A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מודל מעי-על-שבב חיסוני לניתוח תגובות חיסוניות של רירית המעי
* These authors contributed equally
In This Article
Summary
הפרוטוקול המפורט שלנו מתאר את היצירה והשימוש במודל מעי על שבב מתקדם, המדמה רירית מעיים אנושית עם מבנים תלת-ממדיים וסוגי תאים שונים, ומאפשר ניתוח מעמיק של תגובות חיסוניות ותפקודים תאיים בתגובה להתיישבות מיקרוביאלית.
Abstract
פותח מודל מתקדם של מעי על שבב המשחזר מבנים אפיתל-ממדיים דמויי וילוס אורגנוטיפיים ודמויי קריפטה. המודל החיסוני כולל תאי אנדותל של וריד הטבור האנושי (HUVEC), תאי אפיתל מעי Caco-2, מקרופאגים שוכנים ברקמות, ותאים דנדריטיים, המתארגנים בעצמם בתוך הרקמה, ומשקפים מאפיינים של רירית המעי האנושית. היבט ייחודי של פלטפורמה זו הוא יכולתה לשלב תאי חיסון ראשוניים אנושיים במחזור, מה שמשפר את הרלוונטיות הפיזיולוגית. המודל נועד לחקור את תגובת מערכת החיסון של המעי להתיישבות וזיהום חיידקיים ופטרייתיים. בשל גודל החלל המוגדל שלו, המודל מציע קריאות פונקציונליות מגוונות כגון בדיקות חלחול, שחרור ציטוקינים וחדירת תאי מערכת החיסון, והוא תואם למדידת אימונופלואורסנציה של מבנים תלת ממדיים הנוצרים על ידי שכבת תאי האפיתל. הוא מספק בזאת תובנות מקיפות על התמיינות תאים ותפקודם. פלטפורמת מעי-על-שבב הדגימה את הפוטנציאל שלה בהבהרת אינטראקציות מורכבות בין פונדקאיות של מיקרוביוטה חיה לבין רקמה מארחת אנושית בתוך פלטפורמת שבב ביולוגי מיקרופיזיולוגית.
Introduction
מערכות איבר-על-שבב (OoC) מייצגות טכניקה מתפתחת של תרבית תאים תלת-ממדית המסוגלת לגשר על הפער בין תרבית תאים דו-ממדית קונבנציונלית לבין מודלים של בעלי חיים. פלטפורמות OoC מורכבות בדרך כלל מתא אחד או יותר המכילים תאים ספציפיים לרקמות הגדלים על מגוון רחב של פיגומים כגון ממברנות או הידרוג'לים1. המודלים מסוגלים לחקות פונקציה אורגנוטיפית מוגדרת אחת או יותר. משאבות מאפשרות זילוח מיקרופלואידי רציף של מדיום תרביות תאים לסילוק תוצרי פסולת תאית, אספקת גורמי תזונה וגדילה לשיפור התמיינות התא ויצירה מחדש של תנאים חיוניים in vivo. עם שילוב של תאי חיסון, מערכות OoC יכולות לחקות תגובה חיסונית אנושית במבחנה2. עד כה, מגוון רחב של איברים ויחידות פונקציונליות הוצגו1. מערכות אלה כוללות מודלים של כלי הדם3, ריאות4, כבד 2,5 ומעי 6 שניתן להקל עליהם לבדיקות סמים 5,7 ומחקרי זיהום 6,8.
אנו מציגים כאן מודל מעי על שבב אנושי המשלב תאי אפיתל אנושיים היוצרים טופוגרפיה תלת-ממדית אורגנוטיפית של מבנים דמויי וילוס ודמויי קריפטה בשילוב עם רירית אנדותל ומקרופאגים שוכני רקמות. המודל מתורבת בשבב ביולוגי מחורר מיקרופלואידית בפורמט של שקופית מיקרוסקופית. כל ביו-שבב מורכב משני חללים מיקרופלואידים נפרדים. כל חלל מחולק על ידי קרום פוליאתילן טרפתאלט נקבובי (PET) לחדר עליון ותחתון. הממברנה עצמה משמשת גם כפיגום לצמיחת התאים מכל צד. נקבוביות הממברנה מאפשרות הצלבה תאית ונדידת תאים בין שכבות התא. ניתן לגשת לכל תא באמצעות שתי יציאות בגודל מנעול פיתוי. לחלופין, יציאה נוספת בגודל של מנעול מיני-לואר יכולה לספק גישה לתא העליון או התחתון (איור 1).
פלטפורמת OoC מציעה מספר קריאות שניתן לקבל מניסוי יחיד. המעי על שבב מותאם לשילוב תרבית תאים תלת-ממדית מחוררת, ניתוח שפכים ומיקרוסקופ פלואורסצנטי כדי להעריך ביטוי סמן תאים, קצב חילוף חומרים, תגובה חיסונית, נשאות מיקרוביאלית וזיהום, ותפקוד מחסום 3,6,8. המודל כולל תאים חיסוניים שוכנים ברקמה ומגע ישיר של מיקרואורגניזמים חיים עם הרקמה המארחת, דבר המהווה יתרון בהשוואה למודלים אחרים שפורסמו9. יתר על כן, תאי אפיתל מתארגנים בעצמם למבנים תלת-ממדיים המספקים ממשק רלוונטי מבחינה פיזיולוגית להתיישבות עם מיקרוביוטה חיה6.
Access restricted. Please log in or start a trial to view this content.
Protocol
פרוטוקול זה דורש גישה ל~20 מ"ל דם טרי לכל שבב ביולוגי מתורמים בריאים כדי לבודד מונוציטים אנושיים ראשוניים. כל התורמים נתנו הסכמה כתובה ומודעת להשתתף במחקר זה, אשר אושר על ידי ועדת האתיקה של בית החולים האוניברסיטאי יינה (הרשאה מספר 2018-1052-BO). לפרטים על החומרים, עיין בטבלת החומרים. לפרטים על הרכב כל הפתרונות והמדיה, עיין בטבלה 1.
1. הערות כלליות לטיפול בשבבים ביולוגיים
- מפרידים בזהירות רצועת מאגרים ומנתקים את המכסים באמצעות סכין מחוממת לקבלת מאגרים ומכסים בודדים. הרחיבו את חור המכסה כך שצינור הסיליקון יתאים היטב.
- צינור הסיליקון הוא בעל קוטר פנימי של 0.5 מ"מ, הוא א-סימטרי, ומופרד לצדדים ארוכים יותר (20 ס"מ) וקצרים יותר (12 ס"מ) על ידי שני פקקי משאבה פריסטלטיים. הרכיבו שני צינורות מכל סימטריה לכל שבב ביולוגי על ידי חיבור צינור למנעול-מנעול פיתוי זכר והמכסה בצד הנגדי של הצינור. כמו כן להרכיב ארבעה מאגרים לכל שבב.
הערה: הכינו מראש צינורות ומאגרים ועיקרו על ידי אוטוקלאבינג לפני השימוש. מכיוון שלצינורות הסיליקון יש אורך חיים מוגבל, החליפו את הצינור לאחר 3-5 ניסויים. עבור תחומי מחקר מסוימים, כגון בדיקות סמים, מומלץ להכין צינורות חדשים לכל ניסוי. שלבים רבים של פרוטוקול זה פועלים במקביל; עיין באיור הסקירה הכללית, אשר מדגיש את השלבים השונים שבוצעו ביום אחד כפי שמוצג באיור 2.
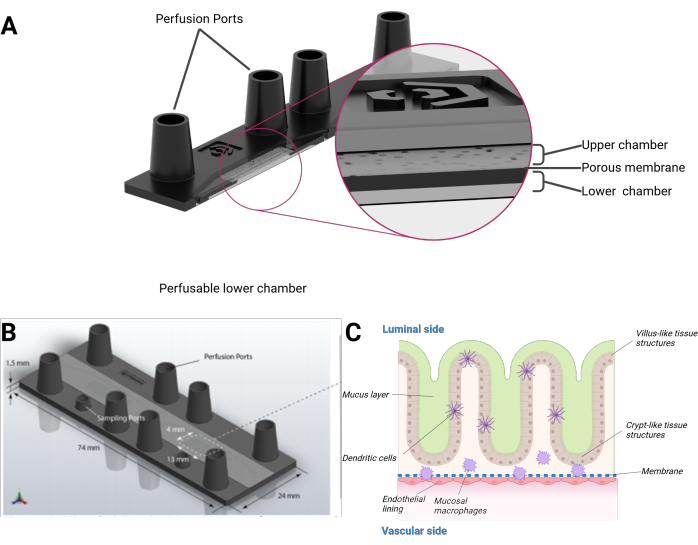
איור 1: ייצוג סכמטי של מודל מעי על שבב. (A) השבב הביולוגי מוצג במבט רוחבי. (B) הממד של השבב הביולוגי כולו, כמו גם של קרום ה-PET השטוח והנשלף גלוי. הנפח הכולל של החדר העליון, כולל היציאות בגודל מנעול הלואר הנשי, הוא 290 μL ו-270 μL עבור התא התחתון בהתאמה. (C) ניתן לראות הרכב סכמטי של השבב הביולוגי של המעי, אפיתל הגידול התלת-ממדי הדומה למבנים דמויי וילוס ודמויי קריפטה, כולל תאי חיסון ממוינים ושכבת ריר. הצד השני של קרום ה-PET מכוסה בחד-שכבה אנדותלית. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
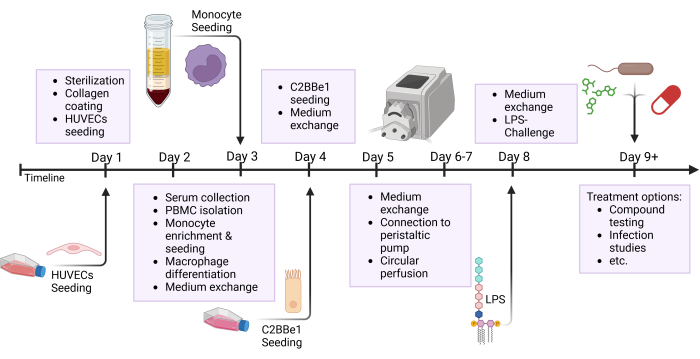
איור 2: סקירה סכמטית של ציר הזמן של בניית המודל והגדרת הניסוי. איור זה מציג את הסקירה הסכמטית של הפרוטוקול המוצג. הליכים חשובים, כגון זריעת תאים ואתגר אפיתל עם LPS מסומנים על ידי חצים. קיצורים: HUVECs = תאי אנדותל ורידיים טבוריים אנושיים; LPS = lipopolysaccharide. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
2. עיקור שבבים ביולוגיים
- ממלאים צלחת פטרי סטרילית מזכוכית, בקוטר של 15 ס"מ, באתנול לא מפורק 70%. הניחו את השבב הביולוגי בתוכו כך שכל יציאות השבב יכוסו לחלוטין על ידי תמיסת האתנול.
- פעמיים בכל יציאה, למשוך 1 מ"ל של אתנול 70% דרך כל התאים של השבב. יש לדגור במשך 45-60 דקות בטמפרטורת החדר (RT).
הערה: ודא שלא נלכד אוויר בתוך השבב הביולוגי. מנקודה זו ואילך, שום אוויר לא צריך להיכנס למערכת השבב, והחללים צריכים להישאר מלאים בנוזל. - מוציאים את האתנול מצלחת הפטרי ומחליפים אותו במים סטריליים בזיקוק כפול (ddH2O) עד שכל היציאות מכוסות במלואן. שוב, פעמיים בכל יציאה, צייר 1 מ"ל של ddH2O דרך חלל השבב הביולוגי. רענן את ddH2O בצלחת פטרי וחזור על ההליך.
- מוציאים את כל הנוזלים מצלחת הפטרי. לאחר מכן, שמרו את השבבים הביולוגיים המעוקרים במלואם בתוך צלחת הפטרי הסגורה בכל פעם שהם נמצאים מחוץ לסביבה סטרילית. הוסף מאגר קטן (למשל, מכסה של צינור 50 מ"ל) של 2-5 מ"ל ddH2O לצלחת פטרי כדי להפחית אידוי של נוזל בתוך השבב הביולוגי.
הערה: ניתן לעקר ביו-שבבים עד 3 ימים מראש אם הם נשמרים בסביבה סטרילית עד לשימוש. זה מאפשר גמישות בעומס העבודה ביום אחד.
3. HUVECs קציר וזריעה
הערה: תאי אנדותל ורידי הטבור האנושי (HUVECs) בודדו מחבל הטבור כפי שפורסם לפני10.
- לפני זריעת HUVECs, לצפות את הממברנה עם קולגן אנושי IV. לשם כך, הכינו דילול בקנ"מ 1:100 של תמיסת מלאי קולגן (טבלה 1) במי מלח חוצצי פוספט של Dulbecco המכילים מגנזיום וסידן (PBS +/+). הוסף 350 μL של תמיסת מלאי מדולל לתא המתאים. לדגור במשך 5 דקות ב RT.
הערה: אם מטפלים בביו-שבב במכסה המנוע הסטרילי, אנו ממליצים להניח מתחתיו רקמה סטרילית כדי לאסוף תווך עודף. - יש לשטוף את כל התאים פעמיים ב-350 μL של PBS +/+ כדי לשטוף את שאריות הקולגן והחומצה האצטית. לאחר מכן, הוסף 350 μL של גידול תאי אנדותל (EC) בינוני לכל חדר.
הערה: מכאן, ביו-שבבים מוכנים לזריעת תאים וניתן לאחסן אותם בטמפרטורה של 37°C עד לשימוש. - השתמש HUVECs במעברים 1-3 ב 80-90% מפגש תאים. טפח HUVECs במדיום EC המכיל תערובת תוספים מוגדרת המסופקת על ידי היצרן. תמונה מייצגת של שדה בהיר של תרבית תאים HUVEC מוצגת באיור 3A.
הערה: בהתאם לתורם, HUVECs של מעברים גבוהים יותר יכולים להתחיל להתמיין ולא יכולים ליצור באופן אמין monolayer צפוף ו confluent בתוך השבב הביולוגי. שימוש באנטיביוטיקה, כלומר 100 U/mL פניצילין ו-100 מיקרוגרם/מ"ל סטרפטומיצין, הוא אופציונלי אך מומלץ כתוסף ל-EC-medium למניעת זיהום מיקרוביאלי. - הסר את מדיום תרבית התאים מבקבוק תרבית תאים T25 ושטוף את התאים בעדינות עם 3-5 מ"ל של מלח חוצץ פוספט של Dulbecco ללא מגנזיום וסידן (PBS -/-). הסר את PBS -/- והוסף 1 מ"ל של מגיב דיסוציאציה טריפסין (טבלה 1). יש לדגור במשך 5 דקות בטמפרטורה של 37°C עד שהתאים מתנתקים מבקבוק תרבית התאים.
- להעביר את התאים מנותקים לתוך צינור באמצעות 9 מ"ל של 5% סרום בקר עוברי (FBS) ב PBS -/-. צנטריפוגה ב 350 × גרם במשך 5 דקות ב RT. הסר את supernatant, resuspend ב 1 מ"ל של EC-medium, ולקבוע את מספר התאים. התאם את ריכוז התא ל- 0.4 × 106 תאים לכל 150 μL (זריעה בתא התחתון) או לכל 250 μL (זריעה בחדר העליון).
- הוסף את נפח התאים המתאים לתא. במקרה של זריעה בתא התחתון, סגרו את כל היציאות ומקמו מיד את השבב הביולוגי הפוך כך שהתאים ייפלו על קרום ה-PET. לדגור את השבבים הביולוגיים באינקובטור לח ב 37 ° C ו 5% CO2.
- בצע חילוף בינוני של התא המכיל HUVEC עם 350 μL של EC-medium לאחר 24 שעות. אין צורך להחליף את המדיום בתא הנגדי.
4. איסוף נסיוב אנושי ובידוד מונוציטים שמקורו בתאי דם חד-גרעיניים היקפיים (PBMC)
הערה: מרכזיות ה-PBMC בודדו כמתואר ב-Mosig et al.11.
- להוציא דם ורידי אנושי מתורמים בריאים. לכל ביו-שבב, רכשו לפחות 10 מ"ל דם שלם בצינורות איסוף דם המכילים סיליקט לאיסוף בסרום. לאחר קרישה מלאה, צנטריפוגו את צינורות איסוף הדם ב 2,500 × גרם למשך 10 דקות ב RT. לאסוף את הסרום, aliquot, ולאחסן ב -20 ° C עד לשימוש חדש.
- לרכוש לפחות 10 מ"ל של דם שלם מאותו תורם בצינורות איסוף דם המכילים EDTA לבידוד PBMC. מערבבים בעדינות את הדם הלא קריש 1:1 עם איזו-חיץ (טבלה 1) על ידי היפוך ולאט שכבה 35 מ"ל של תערובת זו על גבי 15 מ"ל של מדיום שיפוע צפיפות עם צפיפות של 1.077 גרם/מ"ל בצינור של 50 מ"ל.
- צנטריפוגה ב 800 × גרם במשך 20 דקות ללא בלימה ב RT. בזהירות למשוך את שכבת התא החיסונית וכתוצאה מכך, מופיע על גבי מדיום שיפוע הצפיפות, ולהעביר אותו לתוך צינור חדש 50 מ"ל. מלאו עד 50 מ"ל באיזו-באפר קר ושטפו את התאים בהיפוך עדין.
- צנטריפוגה ב 200 × גרם במשך 8 דקות ללא בלימה ב 4 ° C. יש להשליך את הסופרנאטנט ולהשהות מחדש ב-10 מ"ל איזו-חיץ לכל שיפוע צפיפות. אופציונלי: מרכזיות מאגר של תורם אחד אם מספר שיפועים מופעלים במקביל.
- צנטריפוגה ב 150 × גרם במשך 8 דקות ב 4 ° C. השליכו את הסופרנאטנט והשהו מחדש את הגלולה ב-10 מ"ל איזו-חיץ לכל שיפוע צפיפות. חזור על שלב הצנטריפוגה 4.4. לבסוף, השליכו את הסופרנאטנט והשהו מחדש את התאים ב-2 מ"ל של מדיום התמיינות מונוציטים (טבלה 1).
הערה: התוספת של M-CSF ו-GM-CSF אוכפת את ההתמיינות של המונוציטים המבודדים כלפי מקרופאגים שמקורם במונוציטים ותאים דנדריטיים שמקורם במונוציטים (בשילוב עם ליפופוליסכריד [LPS], אשר נוסף בשלב מאוחר יותר של פרוטוקול זה). שימוש באנטיביוטיקה, כלומר 100 U/mL פניצילין ו-100 מיקרוגרם/מ"ל סטרפטומיצין, הוא אופציונלי אך מומלץ כתוסף של המדיום למניעת זיהום מיקרוביאלי. - קבע את מספר התא ואת הזרע ~ 10 ×10 6 תאים לכל באר של צלחת 6 באר ב 2 מ"ל של מדיום התמיינות מונוציטים (טבלה 1). דגירה באינקובטור לח ב 37 ° C במשך 1 שעה כדי לאפשר חיבור של מונוציטים לפלסטיק של צלחת 6 בארות.
- בזהירות להשליך את supernatant ולשטוף 2x עם מחומם מראש 2 מ"ל של תווך תא hematopoietic כדי להסיר את התאים שאינם קשורים. יש לדגור ב-37°C למשך 24 שעות נוספות בתווך התמיינות מונוציטים.
- כדי לקצור את המונוציטים, יש להשליך בזהירות את הסופרנאטנט ולשטוף פעם אחת עם 2 מ"ל של PBS שחומם מראש -/-. ראו איור 3B כדוגמה לתמונת שדה בהיר של תרבית מונוציטים בנקודה זו. לאחר מכן, דגרו על התאים במשך 7 דקות ב-1 מ"ל של מגיב ניתוק מונוציטים שחומם מראש (טבלה 1) ב-37°C כדי לאכוף ניתוק של המונוציטים מהפלסטיק של צלחת 6 הקידוחים.
- מעבירים את המונוציטים המנותקים לצינור בעל קשירה נמוכה. אופציונלי: כדי להשיג תפוקת תאים גבוהה יותר, שטפו בזהירות את צלחת 6 הבארות מספר פעמים עם PBS -/-.
- צנטריפוגה ב-300 × גרם למשך 8 דקות ב-RT. יש להשליך את הסופרנאטנט ולהשהות מחדש בתווך EC-conditioned (טבלה 1). קבע את מספר התא והתאם את ריכוז התא ל 0.1 × 106 תאים לכל 150 μL (זריעה בחלל התחתון) או לכל 250 μL (זריעה בחלל העליון).
הערה: היו עדינים בכל שלבי בידוד תאי מערכת החיסון והפחיתו את כוחות הגזירה כדי למנוע את הפעלת תאי מערכת החיסון. בעת קביעת בידוד זה, בדוק את טוהר המונוציטים שמקורם ב- PBMC (למשל, באמצעות ציטומטריית זרימה). יותר מ -95% מכל התאים צריכים להיות חיוביים לסמנים מונוציטים טיפוסיים כגון CD14.
5. זריעת מונוציטים
- בצע חילוף בינוני בתא המכיל HUVEC עם 350 μL של תווך EC-מותנה שחומם מראש.
- הוסף 150 μL (החדר התחתון) או 250 μL (החדר העליון) של מתלה מונוציטים מוכן (ראה שלב 4.10) לאותו תא. אם הזריעה לתוך החדר התחתון, סגור את כל היציאות ומקם מיד את השבב הביולוגי הפוך כדי שהתאים ייפלו על שכבת HUVEC. לדגור על השבב הביולוגי באינקובטור לח בטמפרטורה של 37°C ו-5% CO2.
- בצע חילוף בינוני בתא המכיל HUVEC + מונוציטים עם 350 μL של מדיום EC-conditioned כל 24 שעות.
6. C2BBe1 קציר וזריעה
הערה: גבול מברשת Caco-2 המבטא תאים 1 (C2BBe1)12 משמשים עד מעבר 35 ונלקחים מצלוחיות של 80-90% מפגש. תמונת שדה בהיר מייצגת של תרבית C2BBe1 מוצגת באיור 3C.
- טפח תאי C2BBe1 ב-C2-medium (טבלה 1).
הערה: שימוש באנטיביוטיקה, כלומר 20 מיקרוגרם/מ"ל גנטמיצין, הוא אופציונלי אך מומלץ כתוסף של C2-medium למניעת זיהום מיקרוביאלי. - הסר את מדיום תרבית התאים של בקבוק תרבית תאים T25 ושטוף את התאים בעדינות עם 3-5 מ"ל של PBS -/-. הסר את PBS -/- והוסף 1 מ"ל של מגיב דיסוציאציה טריפסין (טבלה 1). יש לדגור במשך 5 דקות בטמפרטורה של 37°C עד שהתאים מתנתקים מבקבוק תרבית התאים.
- להעביר את התאים מנותקים לצינור באמצעות 9 מ"ל של 5% סרום בקר עוברי (FBS) ב PBS -/-. צנטריפוגה ב 350 × גרם במשך 5 דקות ב RT. הסר את supernatant, resuspend ב 1 מ"ל של C2-medium, ולקבוע את מספר התאים. התאם את ריכוז התא ל 0.5 × 106 תאים לכל 150 μL (זריעה בחדר התחתון) או לכל 250 μL (זריעה בחדר העליון).
- לפני הזריעה של C2BBe1, לשטוף בעדינות את החדר המתאים עם 350 μL של C2-בינוני.
- הוסף 150 μL (תא תחתון) או 250 μL (תא עליון) של מתלה C2BBe1 מוכן (ראה שלב 6.3) לתא המתאים. במקרה של זריעה לתוך החדר התחתון, סגרו את כל היציאות ומקמו מיד את השבב ההפוך כדי שהתאים ייפלו על קרום ה-PET. לדגור את השבבים הביולוגיים באינקובטור לח ב 37 ° C ו 5% CO2.

איור 3: מורפולוגיה של תאים של HUVECs, מונוציטים ו-C2BBe1 לפני הזריעה בשבב הביולוגי. איור זה מציג תמונות שדה בהיר מייצגות של מקורות התאים השונים המשמשים לאורך הפרוטוקול. התמונות צולמו במיקרוסקופ שדה בהיר הפוך באמצעות הגדלה של פי 10. כל סוגי התאים, (A) HUVECs, (B) מונוציטים ו-(C) C2BBe1 טופחו בתרבית תאים חד-שכבתית דו-ממדית כמתואר בסעיפי הפרוטוקול הספציפיים שלהם. פסי קנה מידה = 200 מיקרומטר. קיצורים: HUVECs = תאי אנדותל ורידיים טבוריים אנושיים; PBMCs = תאי דם חד-גרעיניים היקפיים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
7. חיבור למשאבה פריסטלטית וזילוח מעגלי
- הכינו אינקובטור ריק בתוספת משאבה פריסטלטית. נקו היטב את כל אזורי האינקובטור ומשאבו בחומר חיטוי כדי לספק סביבה מעין סטרילית.
הערה: משאבות פריסטלטיות יכולות לייצר חום רב בזמן העבודה. באינקובטורים מבודדים היטב או במעבדות עם מיזוג אוויר גרוע, מספר המשאבות השמישות לכל אינקובטור עשוי להיות מוגבל מכיוון שהאינקובטורים נוטים להתחמם יתר על המידה. שתי משאבות פריסטלטיות לכל אינקובטור צריכות להיות מספיקות. - לפני חיבור הצינורות המעוקרים לביו-שבב, שטפו כל צינור ב-700 מיקרוליטר של PBS +/+ ואחריו 500 מיקרוליטר של תווך C2-בינוני או EC-מותנה. הכינו צינור אחד מכל סימטריה לכל תווך (ראה שלב 1.2). השתמש בצינורות עם המרחק הקצר ממנעול הפיתוי לפקק המשאבה הפריסטלטי לחלל השמאלי והצינור עם הסימטריה השנייה לחלל הימני.
- אחזר את השבב הביולוגי מהאינקובטור ובצע חילוף בינוני עם 350 μL לכל חדר. הסר את כל התקעים ומלא את כל היציאות עד למעלה.
- החל מהחלל השמאלי, חבר את הצינור הראשון ליציאה הימנית של החדר העליון על ידי הכנסת מתאם נעילת הפיתוי ליציאת השבב הביולוגי. לאחר מכן, חבר את הצינור השני ליציאה השמאלית של החדר התחתון. חזור על הליך זה עבור חלל microfluidic הנכון.
- לוקחים מאגר ומוסיפים טיפה קטנה של מדיום תרבית תאים לתחתית המאגר. לאחר מכן, הכנס את המאגר לצד הנגדי של הצינור הראשון וחזור על הפעולה עבור החדר השני. לאחר שכל היציאות מחוברות לצינורות או למאגר, מלאו את המאגרים ב-3.5 מ"ל של מדיום תרבית תאים.
- הניחו את הצד הרופף של הצינור, שהמכסה מחובר אליו, על גבי המאגר כדי לסגור את המערכת המיקרופלואידית של כל חדר. במצב זה, להעביר את השבב הביולוגי למשאבה פריסטלטית.
הערה: בהתאם למרחק לאינקובטור ולסביבת המעבדה, ניתן להשתמש בקופסה שנוקתה בעבר ועברה אוטוקלאבר כדי להעביר את השבבים לאינקובטור. - השתמש בפקקי המשאבה הפריסטלטיים כדי לחבר את הצינור למשאבה. חברו כל צינור למשאבה הפריסטלטית כך שהתווך יזרום מהמאגר אל החלל, אל תוך הצינור, ודרך המשאבה חזרה אל תוך המאגר (איור 4). המאגר משמש כמלכודת בועות בזילוח המעגלי ומונע מאוויר להילכד במערכת. יש לנקב כל תא בקצב זרימה של 50 μL/min וכתוצאה מכך נוצר לחץ גזירה של 0.013 dyn/cm2 בתא העליון ו-0.006 dyn/cm2 בתא התחתון8.
הערה: אם התווך של החללים התחתונים והעליונים נע בכיוונים מנוגדים, ניתן להשיג צמיחה תלת ממדית גבוהה יותר של רקמת המעי13. לפיכך, המאגרים של החללים העליונים והתחתונים ממוקמים בצדדים מנוגדים (איור 4). הזילוח המעגלי מפחית את כמות תרבית התאים הדרושה, אך עלול לגרום להעשרת ציטוקינים ומטבוליטים. אם תרצה, זילוח ליניארי של השבב הביולוגי אפשרי גם. - יש לנקב את השבב הביולוגי למשך 72 שעות בטמפרטורה של 37°C ו-5% CO2.

איור 4: ביו-שבב מחובר למשאבה פריסטלטית. מוצגת דוגמה לשבב ביולוגי המחובר למשאבה פריסטלטית. תאי אפיתל C2BBe1 מעובדים בתא התחתון (C2-medium אדום נמצא במאגרים שבחזית) ואילו HUVECs מעובדים בחדר העליון (EC-מותאם-בינוני צהבהב נמצא במאגרים מאחור). אמצעי תרביות התאים השונים אינם מתערבבים בשל תפקוד המחסום של הרקמה הגדלה. הביו-שבב מחובר למשאבה הפריסטלטית באופן כזה שהתווך זורם מהמאגר אל החלל. מכאן, התווך זורם חזרה למאגר דרך הצינור באמצעות המשאבה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
8. LPS - התניה של מחסום האפיתל
- לאחר 72 שעות של זילוף, עצור את המשאבה הפריסטלטית והסר את המכסה המחובר לצינור של כל מאגר. הניחו אותו על רקמה סטרילית ליד המשאבה.
- מוציאים את כל המדיום וממלאים את המאגרים ב -2 מ"ל של מדיום טרי. עבור צד האפיתל המכיל את תאי C2BBe1, הוסף 100 ng/mL LPS למדיום.
הערה: ה-LPS מגביר את תפקוד המחסום של הרקמה, מגרה את המקרופאגים שמקורם במונוציטים לנדוד לתוך רקמת האפיתל, ומאפשר התמיינות של תאים דנדריטיים שמקורם במונוציטים. - חברו מחדש את הצנרת והמכסים למאגר והמשיכו את הזילוח המעגלי בקצב זרימה של 50 מיקרוליטר/דקה למשך 24 שעות נוספות.
הערה: מנקודה זו ואילך, מודל השבב יכול לשמש בניסויים - בדיקות מורכבות או מחקרי זיהום. אנו ממליצים על החלפה בינונית של 2 מ"ל למאגר כל 24 שעות.
9. גישה לרקמה לשיטות קריאה שונות
- אספו סופרנאטנטים בינוניים של תרביות תאים מהמאגרים בכל עת של הזלוף. פתח את המאגר ואסוף את הנפח הרצוי (ראה שלבים 8.1-8.3). השתמשו בסופרנאטנטים האלה לזיהוי מטבוליטים, ציטוקינים או מולקולות אחרות.
- כדי לגשת לרקמה, השתמש באזמל כדי לבצע חתך מדויק לאורך החלק החיצוני של החדר העליון והסר את רדיד ההדבקה כדי לפתוח את החלל המיקרופלואידי. הרקמה של מודל הביו-שבב של המעי נגישה כעת. בזהירות לחתוך לאורך החלק החיצוני של החדר microfluidic כדי לנתק את הממברנה מן biochip. אספו את הממברנה המכילה רקמות באמצעות פינצטה.
זהירות: שים לב למיקום האצבעות במהלך שלב זה ועבוד בזהירות כדי למנוע תאונות. מומלץ להשתמש בכפפות עמידות בפני חתכים. - לחלופין, קצרו את התאים משכבות נפרדות בתוך הביו-שבב באמצעות תמיסות אנזימים, כלומר טריפסין או תאים שעברו ליזה באמצעות חוצצים המכילים Triton X-100.
10. הערכת חדירות באמצעות דיפוזיה FITC-dextran
הערה: ניתן לנתח את פונקציית המחסום של הרקמה באמצעות בדיקת חדירות FITC-dextran לאחר ניתוק המשאבה הפריסטלטית. הערכת החדירות של FITC-dextran אומצה על ידי Deinhardt-Emmer et al.4.
- הכינו תמיסת מלאי של איזותיוציאנט פלואורסצאין (FITC)-דקסטרן (משקל מולקולרי של 3-5 kDa, טבלה 1).
- רוקנו את המאגרים ונתק את השבב מהזילוח.
- בצע חילוף בינוני בחדר העליון והתחתון עם מדיום ללא פנול אדום.
הערה: שלב זה אינו הכרחי אם מדיום ללא פנול אדום כבר היה בשימוש במהלך הניסוי. - הוסף 350 μL של 1 מ"ג / מ"ל תמיסת FITC-dextran לתא המכיל את תאי C2BBe1.
- סגור את היציאות ודגר על השבב למשך 60 דקות ב 37 ° C כאשר צד האפיתל פונה כלפי מעלה.
- לאחר זמן הדגירה, לאסוף את המדיום תרבית משני החדרים של השבב בנפרד ולאחסן ב 4 ° C, מוגן מפני האור עד המדידה.
- לצורך המדידה, הכינו עקומה סטנדרטית בתווך C2-medium ובתווך EC-conditioned ללא פנול אדום בטווח של 1,000 מיקרוגרם/מ"ל עד 0 מיקרוגרם/מ"ל FITC-dextran עם 11 דילולים סדרתיים רצופים ביחס של 1:2.
- מעבירים 200 μL מכל דגימה לצלחת שחורה בת 96 בארות עם תחתית שקופה. מדוד את הפלואורסצנטיות באמצעות קורא מיקרו-לוחות באורך גל עירור של 495 ננומטר ובאורך גל פליטה של 517 ננומטר.
- השתמש בעקומה הסטנדרטית כדי לחשב את ריכוז FITC-dextran של הדגימות ובכך את מקדם החדירות.
11. צביעת אימונופלואורסנציה
הערה: ניתן לחקור את הרקמה החיה באופן מיקרוסקופי. לטיפול קל יותר, אנו ממליצים על ניתוק השבב הביולוגי מהמשאבה הפריסטלטית ועל שימוש במטרות למרחקים ארוכים במיקרוסקופ הפוך. כניתוח נקודת קצה, ניתן לקבע את הרקמה בתוך השבב הביולוגי עבור הליכים כמו צביעה אימונופלואורסצנטית.
- עצור את המשאבה הפריסטלטית ופתח את המאגרים של כל החללים. רוקנו את המאגרים ונתק את הצינורות, כמו גם את המאגרים מהשבב.
- פעמיים בכל חדר, לשטוף את החללים microfluidic עם 500 μL של PBS קר +/+. הוסיפו 500 מיקרוליטר מתנול קר כקרח לכל החללים ודגרו במשך 15 דקות בטמפרטורה של -20°C. לאחר מכן, פעמיים בכל חלל, לשטוף את החדר microfluidic עם 500 μL של PBS +/+.
הערה: שיטות קיבוע אחרות, כגון קיבוע עם 4% פרפורמלדהיד או קיבוע של קרנוי, מתאימות גם הן. לאחר הקיבוע, ניתן לאחסן את השבבים ב -4 מעלות צלזיוס או להמשיך ישירות לצביעת פלואורסצנטיות חיסונית. זהירות: קיבוע כימיקלים כגון מתנול או פרפורמלדהיד הם רעילים. בצעו את המשימות המתאימות תחת מכסה אדים ואספו את הפסולת בהתאם. - פתח את השבב כמתואר בשלב 9.2 כדי לגשת לרקמה. חתכו את קרום ה-PET המכיל רקמות לעד שלוש חתיכות כדי להכתים במקביל לאימונופאנלים שונים.
- מעבירים כל אחת מפיסות הממברנה לצלחת נפרדת בת 24 בארות המכילה תמיסה חוסמת וחדירה (טבלה 1) באמצעות פינצטה מדויקת. ודא ששכבת התא המעניינת תמיד פונה כלפי מעלה במהלך כל תהליך הצביעה. לדגור על חתיכות הממברנה במשך 30 דקות ב RT.
הערה: תוצאות הצביעה הטובות ביותר מתקבלות בעת התאמת הסרום לנוגדן המשני. לדוגמה, אם מתקבלים נוגדנים משניים ממיני עזים, אנו ממליצים על שימוש בסרום עיזים רגיל. - מעבירים את חלקי הממברנה למגלשת זכוכית נקייה בתוך תא לח. הכינו את לוח הנוגדנים הראשי בתמיסת הצביעה (טבלה 1) והוסיפו 50 μL לכל חתיכת ממברנה. לדגור לילה ב 4 °C (75 °F).
הערה: ריכוז הנוגדנים האופטימלי ויעילות הצביעה עשויים להשתנות בין יצרנים ושיבוטים. אנו ממליצים לבדוק את לוחות הצביעה מראש בתרבית תאים דו-ממדית. - לאחר הדגירה, העבירו את הדגימות לצלחת בת 24 בארות ושטפו בעדינות את הממברנות במשך 3X5 דקות בתמיסת שטיפה (טבלה 1).
- שוב, העבירו את חתיכות הממברנה למגלשת זכוכית נקייה בתוך תא לח. הכינו את לוח הנוגדנים המשני בתמיסת צביעה (טבלה 1) והוסיפו 50 μL לכל חתיכת ממברנה. במידת הצורך, הוסף כתם נגדי גרעיני כגון 4',6-diamidino-2-phenylindole (DAPI) או Hoechst. דגירה במשך 30 דקות ב- RT.
הערה: בעת עבודה עם פלואורופורים, שמור על הדגימות מוגנות מפני אור כדי למנוע הלבנה כדי לשפר את איכות התמונה. - לאחר הדגירה, העבירו את הדגימות לצלחת בת 24 בארות ושטפו בעדינות את הממברנות 2X5 דקות בתמיסת שטיפה (טבלה 1). לאחר מכן, שטפו פעם אחת עם PBS +/+ במשך 5 דקות.
- הרכיבו את חלקי הממברנה על מגלשת זכוכית נקייה באמצעות אמצעי הרכבה פלואורסצנטי וזכוכית כיסוי. יש לאחסן בטמפרטורה של 4°C עד להדמיה מיקרוסקופית.
Access restricted. Please log in or start a trial to view this content.
תוצאות
תוצאות מייצגות אלה מראות את שכבות הרקמה הנפרדות של מודל המעי על שבב. הם מוכתמים immunofluorescent כמתואר בסעיף פרוטוקול 11. התמונות צולמו במיקרוסקופ אפיפלואורסצנטי או פלואורסצנטי קונפוקלי כערימות z ועובדו להקרנה אורתוגונלית. עיין בטבלת החומרים לקבלת פרטים על ההגדרה והתוכנה המיקרוסקופית...
Access restricted. Please log in or start a trial to view this content.
Discussion
הפרוטוקול המוצג מפרט את הצעדים הדרושים ליצירת מודל מעי על שבב חיסוני. תיארנו טכניקות ספציפיות ושיטות קריאה אפשריות כגון מיקרוסקופ אימונופלואורסצנטי, ניתוח ציטוקינים ומטבוליטים, ציטומטריית זרימה, ניתוח חלבונים וגנטיקה, ומדידת חדירות.
המודל המתואר מורכב מ- HUVECs ראשוניים, מק?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
מ.ר. הוא מנכ"ל Dynamic42 GmbH ומחזיק במניות החברה. א.ס.מ היא יועצת מדעית של Dynamic 42 GmbH ומחזיקה במניות בחברה.
Acknowledgements
העבודה נתמכה כספית על ידי מרכז המחקר השיתופי PolyTarget 1278 (מספר פרויקט 316213987) ל- V.D.W. ו- A.S.M. A.F. ו- A.S.M. כמו כן, מכירים בתמיכה כספית על ידי אשכול המצוינות "איזון המיקרווורס" במסגרת אסטרטגיית המצוינות של גרמניה - EXC 2051 - Project-ID 690 390713860. ברצוננו להודות לאסטריד טנרט ולמעבדת Jena Biophotonic and Imaging Laboratory (JBIL) על שסיפקו לנו גישה למיקרוסקופ סריקת הלייזר הקונפוקלי שלהם ZEISS LSM980. איור 1C ואיור 2 נוצרו עם Biorender.com.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 96-well plate black, clear bottom | Thermo Fisher | 10000631 | Consumables |
| Acetic acid | Roth | 3738.4 | Chemicals |
| Alexa Fluor 488 AffiniPure, donkey, anti-mouse IgG (H+L) | Jackson Immuno Research | 715-545-150 | Secondary Antibody Vascular Staining and Epithelial Staining |
| Alexa Fluor 647 AffiniPure, donkey, anti-rabbit IgG (H+L) | Jackson Immuno Research | 711-605-152 | Secondary Antibody Epithelial Staining |
| Alexa Fluor 647, donkey, anti-rabbit IgG (H+L) | Thermo Fisher Scientific, Invitrogen | A31573 | Secondary Antibody Vascular Staining |
| Axiocam ERc5s camera | Zeiss | 426540-9901-000 | Technical equipment |
| Basal Medium MV, phenol red-free | Promocell | C-22225 | Cell culture consumables |
| Biochip | Dynamic 42 | BC002 | Microfluidic consumables |
| BSA fraction V | Gibco | 15260-037 | Cell culture consumables |
| C2BBe1 (clone of Caco-2) | ATCC | CRL-2102 | Epithelial Cell Source |
| Chloroform | Sigma | C2432 | Chemicals |
| CO2 Incubator | Heracell | 150i | Technical equipment |
| Collagen IV from human placenta | Sigma-Aldrich | C5533 | Cell culture consumables |
| Coverslips (24 x 40 mm; #1.5) | Menzel-Gläser | 15747592 | Consumables |
| Cy3 AffiniPure, donkey, anti-goat IgG (H+L) | Jackson Immuno Research | 705-165-147 | Secondary Antibody Vascular Staining |
| Cy3 AffiniPure, donkey, anti-rat IgG (H+L) | Jackson Immuno Research | 712-165-150 | Secondary Antibody Epithelial Staining |
| Descosept PUR | Dr.Schuhmacher | 00-323-100 | Cell culture consumables |
| DMEM high glucose | Gibco | 41965-062 | Cell culture consumables |
| DMEM high glucose w/o phenol red | Gibco | 31053028 | Cell culture consumables |
| DPBS (-/-) | Gibco | 14190-169 | Cell culture consumables |
| DPBS (+/+) | Gibco | 14040-133 | Cell culture consumables |
| EDTA solution | Invitrogen | 15575-038 | Cell culture consumables |
| Endothelial Cell Growth Medium | Promocell | C-22020 | Cell culture consumables |
| Endothelial Cell Growth Medium supplement mix | Promocell | C-39225 | Cell culture consumables |
| Ethanol 96%, undenatured | Nordbrand-Nordhausen | 410 | Chemicals |
| Fetal bovine Serum | invitrogen | 10270106 | Cell culture consumables |
| Fluorescein isothiocyanate (FITC)-dextran (3-5 kDa) | Sigma Aldrich | FD4-100MG | Chemicals |
| Fluorescent Mounting Medium | Dako | S3023 | Chemicals |
| Gentamycin (10mg/mL) | Sigma Aldrich | G1272 | Cell culture consumables |
| GlutaMAX Supplement (100x) | Gibco | 35050061 | Cell culture consumables |
| Histopaque | Sigma-Aldrich | 10771 | Cell culture consumables |
| Hoechst (bisBenzimid) H33342 | Sigma-Aldrich | 14533 | Epithelial Staining |
| Holotransferrin (5mg/mL) Transferrin, Holo, Human Plasma | Millipore | 616397 | Cell culture consumables |
| Human recombinant GM-CSF | Peprotech | 300-30 | Cell culture consumables |
| Human recombinant M-CSF | Peprotech | 300-25 | Cell culture consumables |
| Illumination device | Zeiss | HXP 120 C | Fluorescence Microscope Setup |
| Laser Scanning Microscope | Zeiss | CLSM980 | Fluorescence Microscope Setup |
| Lidocain hydrochloride | Sigma-Aldrich | L5647 | Cell culture consumables |
| Lipopolysaccharide (LPS) | Sigma | L2630 | Cell culture consumables |
| Loftex Wipes | Loftex | 1250115 | Consumables |
| Low attachment tubes (PS, 5 mL) | Falcon | 352052 | Consumables |
| Luer adapter for the top cap (M) | Mo Bi Tec | M3003 | Microfluidic consumables |
| Male mini luer plugs, row of four,PP, opaque | Microfluidic chipshop | 09-0556-0336-09 | Microfluidic consumables |
| MEM Non-Essential Amino Acids Solution | Gibco | 11140 | Cell culture consumables |
| Methanol | Roth | 8388.2 | Chemicals |
| Microscope | Zeiss | Axio Observer 5 | Fluorescence Microscope Setup |
| Microscope slides | Menzel | MZ-0002 | Consumables |
| Monoclonal, mouse, anti-human CD68 Antibody (KP1) | Thermo Fisher Scientific, Invitrogen | 14-0688-82 | Primary Antibody Vascular Staining |
| Monoclonal, rat, anti-human E-Cadherin antibody (DECMA-1) | Sigma-Aldrich, Millipore | MABT26 | Primary Antibody Epithelial Staining |
| Multiskan Go plate reader | Thermo Fisher | 51119300 | Technical equipment |
| Normal donkey serum | Biozol | LIN-END9010-10 | Chemicals |
| Optical Sectioning | Zeiss | ApoTome | Fluorescence Microscope Setup |
| Penicillin-Streptomycin (10,000 U/mL) | Gibco | 15140-122 | Cell culture consumables |
| Plugs | Cole Parmer | GZ-45555-56 | Microfluidic consumables |
| Polyclonal, goat, anti-human VE-Cadherin Antibody | R&D Systems | AF938 | Primary Antibody Vascular Staining |
| Polyclonal, rabbit, anti-human Von Willebrand Factor Antibody | Dako | A0082 | Primary Antibody Vascular Staining |
| Polyclonal, rabbit, anti-human ZO-1 antibody | Thermo Fisher Scientific, Invitrogen | 61-7300 | Primary Antibody Epithelial Staining |
| Power Supply Microscope | Zeiss | Eplax Vp232 | Fluorescence Microscope Setup |
| Primovert microscope | Zeiss | 415510-1101-000 | Technical equipment |
| Reglo ICC peristaltic pump | Ismatec | ISM4412 | Technical equipment |
| SAHA (Vorinostat) | Sigma Aldrich | SML0061-25MG | Chemicals |
| Saponin | Fluka | 47036 | Chemicals |
| S-Monovette, 7.5 mL Z-Gel | Sarstedt | 01.1602 | Consumables |
| S-Monovette, 9.0 mL K3E | Sarstedt | 02.1066.001 | Consumables |
| Sodium Pyruvate | Gibco | 11360-088 | Cell culture consumables |
| Tank 4.5 mL | ChipShop | 10000079 | Microfluidic consumables |
| Trypane blue stain 0.4% | Invitrogen | T10282 | Cell culture consumables |
| Trypsin | Gibco | 11538876 | Cell culture consumables |
| Tubing | Dynamic 42 | ST001 | Microfluidic consumables |
| Tweezers (Präzisionspinzette DUMONT abgewinkelt Inox08, 5/45, 0,06 mm) | Roth | K343.1 | Consumables |
| Wheat Germ Agglutinin (WGA) | Thermo Fisher Scientific, Invitrogen | W32464 | Epithelial Staining |
| X-VIVO 15 | Lonza | BE02-060F | Cell culture consumables, Hematopoietic cell medium |
| Zellkultur Multiwell Platten, 24 Well, sterile | Greiner Bio-One | 662 160 | Consumables |
| Zellkultur Multiwell Platten, 6 Well, sterile | Greiner Bio-One | 657 160 | Consumables |
| Zen Blue Software | Zeiss | Version 3.7 | Microscopy Software |
References
- Alonso-Roman, R., et al. Organ-on-chip models for infectious disease research. Nat Microbiol. 9 (4), 891-904 (2024).
- Fahrner, R., Groger, M., Settmacher, U., Mosig, A. S. Functional integration of natural killer cells in a microfluidically perfused liver on-a-chip model. BMC Res Notes. 16 (1), 285(2023).
- Raasch, M., et al. Microfluidically supported biochip design for culture of endothelial cell layers with improved perfusion conditions. Biofabrication. 7 (1), 015013(2015).
- Deinhardt-Emmer, S., et al. Co-infection with Staphylococcus aureus after primary influenza virus infection leads to damage of the endothelium in a human alveolus-on-a-chip model. Biofabrication. 12 (2), 025012(2020).
- Kaden, T., et al. Generation & characterization of expandable human liver sinusoidal endothelial cells and their application to assess hepatotoxicity in an advanced in vitro liver model. Toxicology. 483, 153374(2023).
- Maurer, M., et al. A three-dimensional immunocompetent intestine-on-chip model as in vitro platform for functional and microbial interaction studies. Biomaterials. 220, 119396(2019).
- Hoang, T. N. M., et al. Invasive aspergillosis-on-chip: A quantitative treatment study of human aspergillus fumigatus infection. Biomaterials. 283, 121420(2022).
- Kaden, T., et al. Modeling of intravenous caspofungin administration using an intestine-on-chip reveals altered Candida albicans microcolonies and pathogenicity. Biomaterials. 307, 122525(2024).
- Shah, P., et al. A microfluidics-based in vitro model of the gastrointestinal human-microbe interface. Nat Commun. 7, 11535(2016).
- Jaffe, E. A., Nachman, R. L., Becker, C. G., Minick, C. R. Culture of human endothelial cells derived from umbilical veins. Identification by morphologic and immunologic criteria. J Clin Invest. 52 (11), 2745-2756 (1973).
- Mosig, S., et al. Different functions of monocyte subsets in familial hypercholesterolemia: Potential function of cd14+ cd16+ monocytes in detoxification of oxidized ldl. FASEB J. 23 (3), 866-874 (2009).
- Peterson, M., Mooseker, M. Characterization of the enterocyte-like brush border cytoskeieton of the c2bbe clones of the human intestinal cell line, caco-2. J Cell Sci. 102, Pt 3 581-600 (1992).
- Shin, W., Hinojosa, C. D., Ingber, D. E., Kim, H. J. Human intestinal morphogenesis controlled by transepithelial morphogen gradient and flow-dependent physical cues in a microengineered gut-on-a-chip. iScience. 15, 391-406 (2019).
- Kim, H. J., Ingber, D. E. Gut-on-a-chip microenvironment induces human intestinal cells to undergo villus differentiation. Integr Biol (Camb). 5 (9), 1130-1140 (2013).
- Kim, H. J., Huh, D., Hamilton, G., Ingber, D. E. Human gut-on-a-chip inhabited by microbial flora that experiences intestinal peristalsis-like motions and flow. Lab Chip. 12 (12), 2165-2174 (2012).
- Karra, N., Fernandes, J., James, J., Swindle, E. J., Morgan, H. The effect of membrane properties on cell growth in an 'airway barrier on a chip'. Organs-on-a-Chip. 5, 10025(2023).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved