A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
ייצוב אוסטאוטומיה של עצם הירך עם קיבוע פלטה באמביסטומה מקסיקנית
In This Article
Summary
מוצג פרוטוקול לניתוח אוסטאוטומיה של עצם הירך עם שימוש בקיבוע לוחית פנימית באקסולוטלים בוגרים. ההליך יכול לשמש לביצוע מחקרים השוואתיים על התחדשות גפיים וריפוי שברים בדו-חיים ימיים.
Abstract
האקסולוטל (Ambystoma mexicanum) הוא אורגניזם מודל מבטיח לרפואה רגנרטיבית בשל יכולתו יוצאת הדופן לחדש איברים שאבדו או ניזוקו, כולל גפיים, מוח, לב, זנב ועוד. מחקרים על אקסולוטל שופכים אור על מסלולים תאיים ומולקולריים השולטים בהפעלת אבות ושיקום רקמות לאחר פציעה. ידע זה יכול להיות מיושם כדי להקל על ריפוי של פציעות regeneration-incompetent, כגון עצם לא איחוד. בפרוטוקול הנוכחי מתואר ייצוב אוסטאוטומיה של עצם הירך באמצעות מערכת קיבוע לוחית פנימית. ההליך הותאם לשימוש בבעלי חיים ימיים (axolotl, Ambystoma mexicanum). נעשה שימוש באקסולוטלים של ≥20 ס"מ מקצה חוטם לזנב עם עצם הירך המקבילה בגודל עכבר מלא, ותשומת לב מיוחדת הוקדשה למיקום הצלחת וקיבועה, כמו גם לטיפול שלאחר הניתוח. טכניקה כירורגית זו מאפשרת קיבוע עצם סטנדרטי ומיוצב ויכולה להיות שימושית להשוואה ישירה להתחדשות גפיים אקסולוטליות ולמחקרים מקבילים של ריפוי עצם בקרב דו-חיים ויונקים.
Introduction
האקסולוטל (Ambystoma mexicanum) הוא מודל חשוב להתחדשות איברים, כולל הזנב, חוט השדרה, המוח, הלב, הזימים והגפיים 1,2,3,4,5. מחקרים מפורטים של התחדשות גפיים אקסולוטליות חשפו מנגנונים של התמיינות תאים והיווצרות מאגר תאי גזע, בלסטמה, באתר הקטיעה. בשל יכולתם של תאי הבלסטמה לשחזר את כל חלקי הגפיים החסרים, כולל שלד בדוגמת 6,7, האקסולוטל נראה כאורגניזם מודל אטרקטיבי למחקרי ריפוי עצם. לאחרונה, מספר מחקרים התמקדו יותר בביולוגיה של העצם באקסולוטלים, ותיארו מורפולוגיה של השלד, הרכב התא ודינמיקת אוסיפיקציה.
נמצא ביונקים כי תהליך ריפוי העצם בעצמות ארוכות מתרחש באמצעות אוסיפיקציה אנדוכונדרלית ומורכב ממספר שלבים: המטומה, רקמת גרגיר והיווצרות יבלות רכות, אוסיפיקציה של יבלות קשות ועצם ארוגה, ועיצוב מחדש של עצם8. מחקר שנערך לאחרונה הראה כי ניתן לראות שלבים דומים בריפוי עצם אקסולוטלית9.
עד כה, שברים אקסולוטליים נחקרו במערכת לא מיוצבת, שבה עצם פשוט נחתכת עם מספריים iridectomy. השברים הגדולים נוצרו בזאוגופוד, שם מבוצעת אוסטאוטומיה על אחת העצמות, ואילו השנייה משמשת כתמיכה10,11. לעומת זאת, שברים נחקרים באופן שגרתי ביונקים, כולל חולדות ועכברים, באמצעות מערכות קיבוע אמינות, כגון סיכות תוך מדולריות ולוחות יישור עצם, כדי לשלוט בגודל השבר ולהבטיח את יישור העצם.
לפיכך, השיטה נועדה להבטיח קיבוע מיוצב ואחיד של עצם הירך האקסולוטלית לפני אוסטאוטומיה. על מנת להפוך את מחקרי האקסולוטל לדומים יותר ליונקים, כולל עכברים ובני אדם, נלקחו בחשבון פין תוך-מדולרי12, קיבוע לוח חיצוני13,14 וקיבוע לוח יישור עצם פנימי 15,16,17. האחרון הוכח כמבטיח קיבוע עצם תקין ומאפשר יצירת רווח בגודל מסוים באמצעות חתך אחד או שניים עם מסור Gigly בקוטר מסוים. מכיוון שהאקסולוטלים מייצגים את הזחלים הימיים של Ambystoma mexicanum, ייתכן שקיבוע החיצוני גרם לסיבוכים לאחר הניתוח עקב הפצע הפתוח והמגע עם מים. מכיוון שאקסולוטלים אינם מפתחים מרכזי אוסיפיקציה שניוניים אפילו עד שלב מאוחר מאוד בהתפתחותם (גיל20 18), ולכן לא ניתן למנוע מהציפורן התוך-מדולרית הסטנדרטית המשמשת בעכברים לנקב את האפיפיסים, הוחלט ליישם שיטת קיבוע לוחות פנימית על אקסולוטלים גדולים. באקסולוטלים גדולים, גודל עצם הירך ומידת התנודה דומים לאלה של עכבר בוגר, ובכך מאפשרים אוסטאוטומיה דיאפיסיאלית אמצעית עם קיבוע לוחית טיטניום1.
גודל פער השבר קובע במידה רבה את דינמיקת הריפוי ואת תוצאתו. לדוגמה, בעכבר, שברים מיוצבים בקוטר 0.25 מ"מ מתאחים בעיקר באמצעות אוסיפיקציה תוך-ממברנית בשל גודלם הקטן וייצובם הנוקשה; שבר של 0.7 מ"מ מרפא על ידי אוסיפיקציה אנדוכונדרלית, עם היווצרות של יבלת סחוס סביב השבר; פגמים גדולים, כגון פגמים בגודל קריטי של 3.5 מ"מ אינם מחלימים לחלוטין ולכן משמשים למדל שבר עצם ללא איחוד16. במחקר זה, פרוטוקול קיבוע הלוח של עצם הירך האקסולוטלית לפני האוסטאוטומיה באמצעות דוגמה של פער שבר של 0.7 מ"מ נקבע במטרה הסופית להשוות את ריפוי עצם האקסולוטל לזה של עכבר9.
לאחר אוסטאוטומיה עברו השברים תהליך של תנודה אנדוכונדרלית, אם כי איטי יותר מאשר בעכברים, אולי בשל אורח החיים הימי של האקסולוטים וקצב חלוקת התאים האיטי יותר. בשיטה המוצגת כאן, אוסטאוטומיה מרווח 0.7 מ"מ עם קיבוע לוח קשיח מוצג; עם זאת, גדלים מרווחים אחרים וקיבועים גמישים למחצה, כמו גם לוחות מחומרים שונים, אפשריים. בסך הכל, השיטה המוצגת כאן יכולה לשמש לקיבוע עצם סטנדרטי ותהיה מועילה למחקרים המשווים התחדשות גפיים אקסולוטליות לריפוי עצם או לחקר ריפוי עצם באקסולוטלים בתנאים שונים כדי להבטיח קיבוע שבר סטנדרטי.
Protocol
ההליך הבא בוצע באישור שופט השלום בווינה (GZ: MA 58-65248-2021-26). בני 5-8 שנים, ≥ קצה חוטם לזנב בקוטר 20 ס"מ (חוטם עד קצה הזנב) אקסולוטלים ארוכים (Ambystoma mexicanum) שימשו לניתוחי שברים וקטיעות. גברים ונקבות כאחד שימשו לניתוחים. אקסולוטלים גודלו במכון המחקר לפתולוגיה מולקולרית. כאב וסיכון לזיהומים נוהלו באמצעות משככי כאבים ואנטיביוטיקה מתאימים כדי להבטיח תוצאה מוצלחת. הריאגנטים והציוד ששימשו למחקר מפורטים בטבלת החומרים.
1. הכנת בעלי חיים
- רחצו את בעל החיים בתמיסת בנזוקאין 0.03% למשך כ-15-20 דקות עד שמגיעים לטשטוש מלא ואין תנועה רפלקסיבית עם נגיעת הגפיים בפינצטה.
- הניחו את בעל החיים עם הצד הגחוני כלפי מטה על מגבות נייר רטובות ספוגות בתמיסת בנזוקאין 0.03% וכסו אותה במגבות נייר ספוגות בנזוקאין. עורם של בעלי חיים ימיים, כגון אקסולוטלים, רגיש לייבוש, ולכן חיוני לכסות את פני הגוף כדי למנוע התייבשות ולהבטיח נשימה עורית (עור).
- מתחו את הגפה האחורית לניתוח באמצעות מלקחיים טבעתיים. אין להחיל ריאגנטים חיטוי, כגון אתנול, שכן העור axolotl רגיש לכימיקלים בקלות מגורה. במקום זאת, השתמש 0.7x PBS (A-PBS) עם 50 U/mL פניצילין ו 20 מיקרוגרם / מ"ל סטרפטומיצין לניקוי הגפה ולאחר מכן להשקיית עצם לאחר ניסור.
הערה: הזיהום בדרך כלל אינו מדאיג את הניתוחים המבוצעים באקסולוטלים. עם זאת, בשל האופי המימי של בעלי חיים אלה והתפרים המונחים על פני העור, אנו ממליצים על שימוש באנטיביוטיקה כדי למנוע כל זיהום של אתר הניתוח.
2. ניתוח
הערה: יש לעקר את כל כלי הניתוח. שיטות עיקור נפוצות כגון עיקור בחום, אוטוקלאבינג ושטיפה באתנול 70%, ולאחר מכן הסרה יסודית של שאריות האלכוהול, מתאימות למטרה זו. אם אתם מנתחים מספר בעלי חיים, יש לעקר כלים בין לבין באמצעות מעקר חרוזים חם או אתנול 70%.
- בצע חתך אורכי לטרלי (1.5-2 ס"מ) עם אזמל מעל עצם הירך המשתרעת על פני כל הירך בגפה האחורית העליונה. כדי לעשות זאת, למשש את העצם לפני חיתוך העור.
- בזהירות לעקור את השרירים והעצבים מאתר הניתוח מבלי לחתוך. השתמש במלקחיים קמורים כדי לעשות זאת ביעילות.
- הניחו בעדינות מלקחיים מורכנים מתחת לעצם הירך כדי לחשוף אותה לקראת הניתוח.
- הניחו לוחית קיבוע קשיחה בקוטר 7.75 מ"מ בעלת 4 חורים יחד עם דיאפיזה של עצם הירך, הימנעו מנגיעה במפרקים, ואבטחו אותה במצב מיושר עם מלקחיים.
- השתמש בארבעה ברגי טיטניום בקוטר 2 מ"מ כדי לחבר את העצם לצלחת.
הערה: הברגים המשמשים בפרוטוקול זה הם בעלי עיצוב מורכב ומורכבים מ-4 חלקים: החלק העיקרי (יוברג לתוך העצם), ראש בורג (מאפשר הוצאת הברגים והצלחת באמצעות מפתח הקופסה המרובע), צוואר צר יותר (המשמש כנקודת שבירה לאחר הידוק הבורג בעצם) וידית בורג (המשמשת לחיבור למברג ולמכשיר הנחיית המסור). - סדר חיבור הבורג חשוב. התחל תחילה עם הברגים הפנימיים, ולאחר מכן עם שני הברגים החיצוניים כדי לוודא שהצלחת מיושרת עם ציר העצם. השתמש מקדחה ידנית כדי ליצור את החור הראשון בעצם להחדרה קלה של הבורג, ואחריו חריץ בורג1 . יש לקדוח באמצע היקף העצם כדי למנוע עצם דקה יותר בצד אחד, מה שעלול לגרום לשבר עצם ספונטני. השתמש בהשקיה עם PBS 0.7x + 1% Pen/Strep במהלך הקידוח. אין לנתק את הידית של הברג(ים) 1st (אופציונלי: 1st ו-2nd).
- יש למרוח את התקן הנחיית המסור על הברג(ים) 1st (אופציונלי: 1st ו-2 nd ) וליישר אותו עם העצם והצלחת.
הערה: בפרוטוקול זה, לוחית, ברגים, התקן הנחיית מסור ומסור מסופקים על-ידי אותו יצרן וממוטבים כך שיתאימו זה לזה. מכשיר הנחיית המסור יכול להגיע בגדלים שונים כדי להתאים לצלחות וגדלי מסור שונים. - השתמש במכשיר הנחיית המסור כדי לקדוח ולהכניס את שאר הברגים. ודא יישור של הצלחת עם העצם. נתקו את ידיות הברגים.
- מניחים חתיכת סרט פלסטיק (6-7 מ"מ על 4-5 ס"מ), מעוקרים על ידי ניגוב עם 70% אתנול ולאחר מכן autoclaved או מעוקר בחום (140 ° C במשך 4 שעות), מתחת עצם הירך כדי למנוע נזק לרקמות רכות במהלך תהליך אוסטאוטומיה.
הערה: למטרה זו, חתיכת סרט פלסטיק, לחתוך שקית לעיקור בחום ניתן להשתמש. - הניחו מסור תיל בין העצם לסרט הגנה.
- חותכים עצם באמצעות מסור תיל Gigly בקוטר 0.66 מ"מ, ויוצרים חתך יחיד של 0.7 מ"מ בעצם הירך. השתמש בהשקיה קבועה עם PBS 0.7x + 1% Pen/Strep במהלך הניסור כדי למזער נזק וחיכוך לרקמות.
- הסר את המסור ואת מדריך המסור והשתמש במברג כדי לנתק את ידיות הבורג מהברגים.
- הסר את סרט ההגנה והשקה את אזור הניתוח עם PBS 0.7x + 1% Pen/Strep.
- כסו את החלק העליון של הצלחת ואת הברגים בשעוות דבורים סטרילית כדי להגן על העור והשרירים מפני גירוי בשולי הברגים.
- הניחו את השרירים והעור על גבי שעוות דבורת העצם.
- סגור את אתר החתך בתפר סינתטי 7.0 (פוליפרופילן/פוליאתילן) באמצעות תפרים פשוטים קטועים. תפר סינתטי משמש כדי למזער זיהום עם חיידקים ופטריות שנולדו במים.
3. ניהול לאחר הניתוח
- כדי לעורר מחדש את החיה, הניחו אותה במיכל עם מי בריכה מלאכותיים טריים, בתוספת 50 U/mL פניצילין, 20 מיקרוגרם / מ"ל סטרפטומיצין, ו Butorphanol analgetic (0.5 מ"ג / ליטר מים).
- התבונן בחיה כדי להתחיל להזיז זימים, לעשות צעדים, ולשחות - בדרך כלל בתוך 1 שעה לאחר הניתוח.
- שמור את בעל החיים במשך 3 ימים במי בריכה מלאכותיים עם 50 U/mL פניצילין ו 20 מיקרוגרם / מ"ל סטרפטומיצין לפני החזרתו למיכל ההחזקה. כדי להבטיח שיכוך כאבים, להוסיף Butorphanol (0.5 מ"ג / ליטר מים).
- יש לוודא שהתפרים נשארים במקומם ומתרחש ריפוי פצעים תקין.
תוצאות
ההליך הכירורגי המתואר כאן (איור 1) נמשך בין 20 דקות ל-30 דקות ודורש מנתח ועוזר. לחלופין, השתמש במיקרוסקופ דיסקציה דו-עינית או במערכת זכוכית מגדלת.
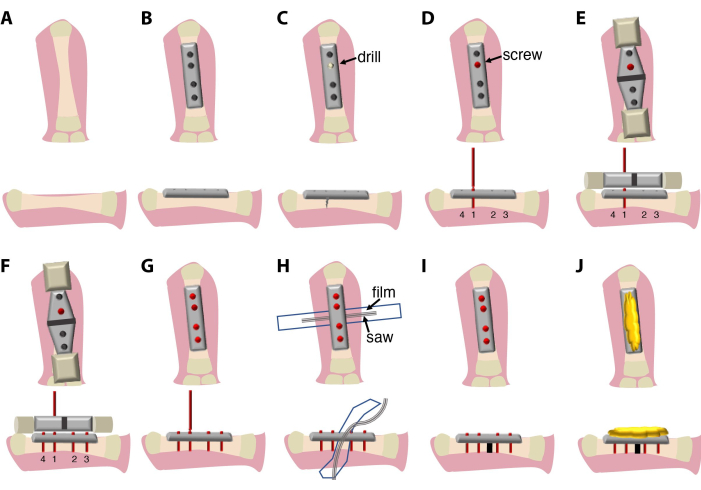
איור 1...
Discussion
השיטה המתוארת כיום של קיבוע לוחית הירך ואוסטאוטומיה מאפשרת את יישומה בבעלי חיים ימיים, כגון Ambystoma mexicanum (axolotl). שיטה כירורגית זו שימשה לאחרונה להשוואת ריפוי שברים והתחדשות גפיים באקסולוטלים לריפוי שברים בעכברים9. כמו בעכברים, ניתן לחבר לוחית קיבוע בעלת 4 ...
Disclosures
המחברים מצהירים כי אין אינטרסים מתחרים.
Acknowledgements
המחברים רוצים להודות לסבין סטומפ על התמיכה הטכנית המצוינת וללידיה גרוסר על הסיוע בניתוחים. מחקר זה מומן על ידי הקרן האוסטרית למדע [מלגת הרטה פירנברג מספר T-1219], ERC [מענק מתקדם, 742046 RegGeneMems], DFG [CRC 1444].
Materials
| Name | Company | Catalog Number | Comments |
| 0.66 mm Gigly wire saw | RISystem | RIS.590.120 | |
| 7.0 Optilene suture | Braun | C3090538 | |
| Benzocaine | Sigma-Aldrich | E1501 | dilute to 0.03% prior to using |
| Butorphanol (Butomidor 10 mg/mL) | Richter Pharma AG | - | dilute to 0.5 mg/L prior to using |
| Drill bit 0.30 mm | RISystem | RIS.590.200 | |
| Dumont #5 Forceps - Standard/Inox | Fine Science Tools | 11251-20 | |
| Hand drill | RISystem | RIS.390.130 | better to have at least 3 pieces |
| Micro CT data analyzer | Bruker, Billerica, MA, USA | SkyScan NRecon software | |
| Micro CT specimen scanner | Bruker, Billerica, MA, USA | SkyScan 1172 | |
| Moria MC31b Iris forceps - smooth, curved, 10 cm | Fine Science Tools | 11373-12FST | 2 pieces |
| MouseFix Drill-&Saw guide 1.75 mm, rigid | RISystem | RIS.301.102 | |
| MouseFix plate 4 hole, rigid | RISystem | RIS.401.110 | |
| MouseFix screw, L =2.00 mm | RISystem | RIS.401.100 | need 4 per bone |
| Narrow Pattern Forceps | VWR | FSCI11002-12 | |
| penicillin/streptomycin | Gibco | 15140-122 | |
| Ring forceps | Fine Science Tools | 11103-09 | |
| scalpel #15 | B Braun, Thermo Fischer Scientific | 5518032 | |
| Square box wrench 0.50 mm | RISystem | RIS.590.111 | |
| Sterile bone wax, 2.5 g | Ethicon, Johnson & Johnson | W810 | |
| Student Fine Scissors - Straight/11.5cm | Fine Science Tools | 91460-11 |
References
- Amamoto, R., et al. Adult axolotls can regenerate original neuronal diversity in response to brain injury. Elife. 5, 13998 (2016).
- Butler, E. G., Ward, M. B. Reconstitution of the spinal cord following ablation in urodele larvae. J Exp Zool. 160 (1), 47-65 (1965).
- Echeverri, K., Tanaka, E. M. Ectoderm to mesoderm lineage switching during axolotl tail regeneration. Science. 298 (5600), 1993-1996 (2002).
- Vargas-Gonzalez, A., Prado-Zayago, E., Leon-Olea, M., Guarner-Lans, V., Cano-Martinez, A. Myocardial regeneration in Ambystoma mexicanum after surgical injury. Arch Cardiol Mex. 75 (3), S321-S329 (2005).
- Vieira, W. A., Wells, K. M., McCusker, C. D. Advancements to the axolotl model for regeneration and aging. Gerontology. 66 (3), 212-222 (2020).
- Song, F., Li, B., Stocum, D. L. Amphibians as research models for regenerative medicine. Organogenesis. 6 (3), 141-150 (2010).
- McCusker, C., Bryant, S. V., Gardiner, D. M. The axolotl limb blastema: Cellular and molecular mechanisms driving blastema formation and limb regeneration in tetrapods. Regeneration (Oxf). 2 (2), 54-71 (2015).
- Einhorn, T. A., Gerstenfeld, L. C. Fracture healing: Mechanisms and interventions). Nat Rev Rheumatol. 11 (1), 45-54 (2015).
- Polikarpova, A., et al. The specialist in regeneration-the Axolotl-a suitable model to study bone healing. NPJ Regen Med. 7 (1), 35 (2022).
- Chen, X., et al. The axolotl fibula as a model for the induction of regeneration across large segment defects in long bones of the extremities. PLoS One. 10 (6), e0130819 (2015).
- Cosden-Decker, R. S., Bickett, M. M., Lattermann, C., MacLeod, J. N. Structural and functional analysis of intra-articular interzone tissue in axolotl salamanders. Osteoarthritis Cartilage. 20 (11), 1347-1356 (2012).
- Williams, J. N., Li, Y., Valiya Kambrath, A., Sankar, U. The generation of closed femoral fractures in mice: A model to study bone healing. J Vis Exp. (138), e58122 (2018).
- Cheung, K. M., et al. An externally fixed femoral fracture model for mice. J Orthop Res. 21 (4), 685-690 (2003).
- Jiang, S., Knapstein, P., Donat, A., Tsitsilonis, S., Keller, J. An optimized protocol for a standardized, femoral osteotomy model to study fracture healing in mice. STAR Protoc. 2 (3), 100798 (2021).
- Matthys, R., Perren, S. M. Internal fixator for use in the mouse. Injury. 40, S103-S109 (2009).
- Manassero, M., et al. Establishment of a segmental femoral critical-size defect model in mice stabilized by plate osteosynthesis. J Vis Exp. (116), e52940 (2016).
- Gunderson, Z. J., Campbell, Z. R., McKinley, T. O., Natoli, R. M., Kacena, M. A. A comprehensive review of mouse diaphyseal femur fracture models. Injury. 51 (7), 1439-1447 (2020).
- Riquelme-Guzman, C., et al. Postembryonic development and aging of the appendicular skeleton in Ambystoma mexicanum. Dev Dyn. 251 (6), 1015-1034 (2022).
- Gentz, E. J., et al. Medicine and surgery of amphibians. ILAR J. 48 (3), 255-259 (2007).
- Lang, A., et al. Collagen I-based scaffolds negatively impact fracture healing in a mouse-osteotomy-model although used routinely in research and clinical application. Acta Biomater. 86, 171-184 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved