בידוד, התרחבות ונוקלאופקציה של תאי גזע עצביים מאזור תת-חדרי מורין בוגרים
In This Article
Summary
במאמר זה אנו מתארים מערכת נוקלאופקציה שנועדה לשפר את יעילות העברת הגנים בתאי גזע עצביים מורחבים (NSCs) שבודדו מהאזור התת-חדרי של המורין הבוגר. הממצאים מראים כי שיטה זו משפרת באופן משמעותי את ההפרעה הגנטית בתאי גזע גזעיים, עולה על היעילות של פרוטוקולי טרנספקציה מסורתיים ומשפרת את שיעור הישרדות התאים.
Abstract
בידוד והתרחבות של תאי גזע עצביים (NSCs) מהאזור התת-חדרי (SVZ) של מוח העכבר הבוגר יכולים להיות מושגים בתווך בתוספת גורם גדילה פיברובלסטים בסיסי (bFGF) וגורם גדילה אפידרמלי (EGF) כמיטוגנים, המייצרים אגרגטים שבטיים הידועים בשם נוירוספרות. מערכת חוץ גופית זו היא כלי רב ערך לחקר פוטנציאל המל"ל. טרנספקציה של siRNAs או גנים הנישאים בפלסמידים יכולה לשמש כדי לגרום להפרעות לביטוי גנים ולחקור ביולוגיה של NSC. עם זאת, העברת חומצות גרעין אקסוגניות לתרביות NSC מאתגרת בשל היעילות הנמוכה של העברת תאי מערכת העצבים המרכזית (CNS). כאן, אנו מציגים מערכת נוקלאופקציה משופרת המשיגה יעילות גבוהה של העברת גנים ב- NSCs מורחבים מ- SVZ מורין בוגר. אנו מראים כי שיטה פשוטה יחסית זו משפרת הפרעות גנים בתאי גזע גזעיים בוגרים, ועולה על פרוטוקולי טרנספקציה מסורתיים עם שיעורי הישרדות העולים על 80%. יתר על כן, שיטה זו יכולה להיות מיושמת גם ב- NSCs מבודדים ראשוניים, ומספקת התקדמות מכרעת במחקרי תפקוד גנים באמצעות מניפולציה של ביטוי גנים באמצעות הפלה או ביטוי יתר בתרבויות נוירוספרה.
Introduction
תאי גזע עצביים (NSCs) הם תאי גזע רב-פוטנטיים השוכנים במוח. תאים אלה הם בעלי יכולת התחדשות עצמית והתמיינות לשלוש השושלות העצביות: אסטרוציטים, אוליגודנדרוציטים ונוירונים1. כתוצאה מכך, תאי עצב עצביים ממלאים תפקיד מכריע בנוירוגנזה בוגרת אצל יונקים, תהליך שבו נוירונים חדשים נוצרים במוח2. NSCs שוכנים בעיקר בשני אזורים במוח הבוגר המכונים נישות נוירוגניות: האזור התת-חדרי (SVZ) לאורך דפנות החדרים הצדיים והאזור התת-גרגירי (SGZ) בתוך הבליטה המשוננת של ההיפוקמפוס 3,4. תאי גזע עצביים (הידועים גם בשם תאי B) ב-SVZ, הנישה הנוירוגנית הפעילה ביותר בעכבר הבוגר, מתחדשים מעצמם ומייצרים אבות מגבירי מעבר (TAPs או C cells) שמתמיינים לאחר מכן לנוירובלסטים (תאי A). נוירובלסטים אלה נודדים דרך זרם הנדידה הרוסטרלי (RMS) אל פקעות הריח (OB), שם הם עוברים התמיינות מלאה לנוירונים בין-עצביים, ומשתלבים במעגלים הקיימים 3,4,5,6.
הבנת יחסי הגומלין המורכבים של רמזים מולקולריים ואותות המווסתים תאי גזע עצביים בתוך נישות אלה חשובה כדי לרתום את הפוטנציאל שלהם ליישומים טיפוליים. לשם כך פותחו שיטות שונות לחקר אוכלוסיית תאים זו, החל מתרבית ראשונית סלקטיבית של תאי גזע גזעיים ועד לבחירת תאים באמצעות סמני שטח 7,8,9,10. כתב היד הנוכחי מפרט את הבידוד והטיפוח של SVZ NSCs במבחנה באמצעות מדיום סלקטיבי ללא נסיוב המכיל את שני המיטוגנים: גורם גדילה פיברובלסט בסיסי (bFGF) וגורם גדילה אפידרמלי (EGF). תווך זה מאפשר התפשטות תאים ושומר על הגבעול של תאי גזע עצביים המתקבלים מ- SVZ של מוחות עכברים בוגרים היוצרים צברים שבטיים חוץ גופיים, תלת ממדיים ולא דבקים הידועים כנוירוספרות9. תרביות נוירוספריות משמשות פלטפורמה מבוקרת למניפולציה וללימוד של המנגנונים והגורמים המולקולריים המשפיעים על התפשטות המל"ל, התחדשות עצמית, התמיינות והישרדות11. יש לציין כי מספר הנוירוספרות הראשוניות הנוצרות בתרבית מאפשר להעריך את מספר הנוירוספרות המלכליות הקיימות ב-SVZ in vivo, מה שהופך אותו לכלי רב עוצמה לחקר ההשפעות של תנאים שונים על מאגר NSC הבוגר12,13. יתר על כן, ברגע שהתרבות הראשונית מבוססת, NSCs יכולים ליצור אגרגטים חדשים (נוירוספרות משניות) כאשר הם עוברים דרך חלוקות סימטריות בתנאי התפשטות14. לפיכך, זריעה בצפיפות נמוכה של תאים נוירוספריים משניים (בדיקת שבטים) יכולה לשמש להערכת קצב ההתחדשות העצמית של תרביות אלה 4,15,16,17.
למרות הפוטנציאל של נוירוספרות בחשיפת המנגנונים השולטים ברגולציה של NSC, יש חוקרים המפקפקים בתוקפם של ממצאי מבחנה, וטוענים כי התנאים המלאכותיים שבהם תאים גדלים עשויים שלא לשכפל נאמנה את המיקרו-סביבה המורכבת in vivo של נישות נוירוגניות 18,19,20,21,22. נקודה שנויה במחלוקת נוספת סובבת סביב ההטרוגניות הנצפית בנוירוספרות. עם זאת, מאמינים כי שונות זו משקפת את החלוקות הסימטריות והא-סימטריות של המל"ל המתרחשות באופן טבעי ב-vivo23,24. יתר על כן, אימות שנערך לאחרונה תמך בשימוש בתרביות NSC לחיזוי מנגנונים הפועלים בתוך הנישה הנוירוגנית SVZ in vivo, ומספר מחקרים הוכיחו כי NSCs בתרבית במבחנה שומרים במדויק על הפרופיל הטרנסקריפטומי שנצפה in vivo11,25.
לכן, תרבויות נוירוספריות לא רק משמשות כשיטה לחקור את יכולות ההתפשטות וההתמיינות של NSC, אלא גם מציעות מערכת לחקר ההשפעה של גנים השולטים בביולוגיה של NSC. טכניקה מרכזית לחקר תפקוד גנים ב- NSCs היא הפרעה בביטוי גנים. siRNAs או גנים המועברים דרך פלסמידים יכולים להיות מועתקים לתרביות תאים, וכתוצאה מכך להפיל או להגביר את הרגולציה של גן המטרה. גישה רב-תכליתית זו מפחיתה באופן משמעותי את הזמן והעלות בהשוואה לביסוס תרביות באמצעות עכברי נוקאאוט מותנים, ומציגה אפיק מבטיח לפענוח הבסיס הגנטי של נוירוגנזה ובחינת סיכויים טיפוליים. שינוי הביטוי של גנים ספציפיים בתאי גזע מל"ל מאפשר לווסת את התנהגותם, ולהשפיע על תהליכים ביולוגיים חיוניים כגון התפשטות, התמיינות והגירה. עם זאת, האפשרות של הדבקת NSCs, במיוחד בתוך נוירוספרות עכבר, מציבה אתגרים בולטים. המבנה התלת-ממדי של נוירוספרות פוגע ביעילות הטרנספקציה, ולעתים קרובות התוצאה היא שיעורים נמוכים של העברת חומצות גרעין אקסוגניות מוצלחות, המגבילות את היקף המניפולציה הגנטית26,27. בנוסף, הליכי טרנספקציה יכולים להשפיע לרעה על יכולת הקיום והפונקציונליות של התא27. בהקשר זה, אנו מציגים את מערכת הנוקלאופקציה כשיטה להפחתת נזק לתאים, השגת שיעור הישרדות גבוה והבטחת יעילות גבוהה יותר במבחני העברת גנים המשמשים להפרעה לתרביות NSC.
כתב יד זה נועד להמחיש את ההליך לבידוד, הרחבה וגרעין של תאי גזע עצביים מהנישה הנוירוגנית SVZ הבוגרת כדי להפריע לגנים באמצעות מערכת התרבית הנוירוספרית. שיטה זו עולה על יעילותם של פרוטוקולי הטרנספקציה המסורתיים, ומציגה שיעורי הישרדות גבוהים משמעותית ויעילות משופרת של העברת גנים בין תאי היעד.
Protocol
כל הניסויים שבוצעו עם בעלי חיים אושרו בעבר על ידי הוועדה האתית של אוניברסיטת ולנסיה ואושרו על ידי Conselleria de Agricultura, Ganadería y Pesca, Generalitat Valenciana (ספרד).
1. תרבות ראשונית של נוירוספרות
- הכנת ריאגנטים
- הכינו תמיסת חיץ של חיץ מלח פוספט של דולבקו (DPBS) במים שעברו דה-יוניזציה ועיקרו על ידי אוטוקלאבינג. לחלופין, הכינו תמיסת PBS pH 7.4 של 0.1 מ"מ על ידי הוספת 137 mM NaCl, 2.7 mM KCl, 10 mM Na2HPO4 ותמיסת KH2PO4 של 1.8 mM במים נטולי יונים.
- מלאו שתי צלחות בנות 12 בארות ב-DPBS מקורר בעבר ושמרו אותן על קרח: אחת תשמש לשימור המוח כולו לפני נתיחה, והשנייה תשמור SVZ מנותחות עד לעיבוד רקמות.
- הכינו תערובת אנזימטית המכילה פפאין כמתואר להלן.
- הכינו תמיסת דיסוציאציה של EDTA/L-ציסטאין בתמיסת מלח מאוזנת של ארל (EBSS) לריכוז סופי של 0.2 מ"ג/מ"ל כל אחת. כדי להשיג המסה מלאה, לדגור את הצינור באמבט מים ב 37 °C (77 °F).
- להמיס 12 U/mL של פפאין בתמיסת EDTA/L-ציסטאין. קחו בחשבון כי 500 μL של פתרון אנזימטי ישמש לכל מוח.
- הציגו תמיסת פפאין באמבט מים 37 מעלות צלזיוס למשך כ-20 דקות עד שהאנזים מתמוסס במלואו.
- סננו ועיקרו את התערובת האנזימטית בעזרת מזרק ומסנן נקבוביות בגודל 0.22 מיקרומטר ושמרו אותה בטמפרטורה של 4°C עד לשימוש.
הערה: פפאין מופעל לאחר 30 דקות ב 37 ° C, וזה יכול להיות מאוחסן במשך 12 שעות ב 4 ° C.
- הכינו את מדיום תרבית הבקרה על ידי הוספת תמיסת תערובת ההורמונים בהתאם לטבלה 1 וסיננו לעקר אותה באמצעות מסנני ניטרוצלולוז 0.22 מיקרומטר נקבוביות. יש לשמור את המדיום על 4°C לחמם אותו באמבט מים ב 37°C לפני השימוש.
- הכן את המדיום המלא על-ידי השלמת אמצעי הבקרה עם EGF ו-bFGF ממש לפני השימוש לפי טבלה 1. אין לסנן את המדיום המלא, מכיוון שמיטוגנים עלולים ללכת לאיבוד עם סינון.
- מיצוי מוח ודיסקציה SVZ
הערה: לעכברים מותרת גישה חופשית למזון ומים לפני המתת חסד. C57BL/6 עכברים בני 8 עד 16 שבועות משמשים. שני המינים משמשים ללא הבדלים ניכרים בהכנה.- לעקר את כלי הדיסקציה על ידי autoclaving לפני הניתוח. לאחר מכן, טבלו אזמלים, פינצטה, מספריים ומרית בכד מלא באתנול 70%. נקו ביסודיות כל משטח עבודה עם 70% אתנול.
- להקריב את העכבר על ידי מנת יתר CO2 ולאשר על ידי נקע צוואר הרחם. רססו את הראש באתנול 70% כדי למזער את האפשרות לזיהום ברקמת המוח.
- להפריד את ראש העכבר משאר הגוף באמצעות מספריים. חותכים את העור מעל הגולגולת עם מספריים קטנים לאורך ציר rostro-caudal עד הגולגולת הוא חשוף לחלוטין.
- לחשוף את המוח על ידי חיתוך הגולגולת בתחילה לאורך תפר הקשת עם מספריים קטנים ולאחר מכן, להסיר את העצמות באמצעות פינצטה עדינה. היזהר לא לגרום נזק לרקמת המוח מתחת לגולגולת במהלך שלב זה.
- בזהירות לחלץ את המוח מן הגולגולת באמצעות מרית ומניחים אותו לתוך צלחת 12 בארות המכילה DPBS קר. שומרים את הצלחת על קרח עד להשלמת הנתיחה.
- העבירו את המוח כולו אל משטח הסיליקון שבו תתרחש הדיסקציה, ומרחו כמה טיפות של DPBS קר על המוח (איור 1A).
- השתמשו באזמל כדי להסיר את ה-OB הממוקם בקצה הרוסטרלי של המוח ואת המוח הקטן הממוקם בחלק הקאודלי, תוך שמירה על החלק המרכזי של המוח המכיל את שני החדרים הצדיים (איור 1B).
- חלקו את המוח לאורך הסדק האורכי לשתי המיספרות, ואז המשיכו בדיסקציה של שתי ההמיספרות בנפרד (איור 1C).
- עבודה עם חצי כדור אחד, לכוון אותו מחדש כך האזור המדיאלי פונה כלפי מעלה. פתחו את המוח לאורך הקו של כפיס המוח, הפרידו את קליפת המוח והסטריאטום מההיפוקמפוס, המחיצה והדיאנצפלון, וכך חשפו את החדרים הצדיים (איור 1D).
הערה: ה-SVZ ממוקם בין חלל החדר לבין הסטריאטום, ולכן השלבים הבאים שואפים לבודד את ה-SVZ בצורה מדויקת ככל האפשר מהרקמה שמסביב. - הסירו את ההיפוקמפוס, המחיצה והמוח בעקבות הגבול הגחוני של החדרים (איור 1E,F), הרקמה שמעבר לקצוות הרוסטרליים והקאודליים של SVZ (איור 1G), ואת קליפת המוח שעוקבת אחרי כפיס המוח (איור 1H,I).
- הטו את הרקמה כך שה-SVZ יפנה הצידה (איור 1J), ואפשרו להסיר את הרקמה הסטריאטלית מתחת ל-SVZ (איור 1K) כדי לקבל פיסת רקמה דקה שמכילה את ה-NSCs (איור 1L).
- אחסן את שני SVZ מנותחים מאותו עכבר בצלחת בת 12 בארות המכילה DPBS קר וסטרילי עד לתחילת עיבוד הרקמות.
הערה: הדיסקציה של שני SVZ ממוח אחד אמורה להימשך 10 דקות. זמן ארוך יותר עלול להשפיע על יכולת הקיום של התא. אם יש צורך בתפוקה מוגברת של התרביות, ניתן לאסוף SVZ מעכברים מרובים באותו גיל, מין, רקע גנטי וגנוטיפ.
- בידוד וזריעה של מל"לים
- חותכים כל SVZ ל 4-5 חתיכות קטנות כדי להקל על פירוק הרקמה.
הערה: משלב זה ואילך, יש לבצע את כל ההליך בתנאים סטריליים במכסה מנוע זרימה למינרית. - מעבירים את ה-SVZ הקצוצים לצינור צנטריפוגה בנפח 15 מ"ל באמצעות פיפטת פסטר סטרילית מפלסטיק. ודא שלא נותרו שברים בצלחת.
- תן את משקעי הרקמה בתחתית הצינור ולהסיר את DPBS הנותרים.
- הוסף 500 μL של תערובת אנזימטית מסוננת המכילה פפאין לכל מוח (2 SVZs) ודגר על הצינורות באמבט מים ב 37 ° C במשך 30 דקות.
- לאחר הדגירה, להוסיף 5 מ"ל של אמצעי בקרה שחומם מראש ב 37 ° C לכל דגימה.
- צנטריפוגה את הדגימות ב 300 x גרם במשך 5 דקות. לאחר מכן, בזהירות להסיר את supernatant באמצעות micropipette או משאבת ואקום.
- מוסיפים 1 מ"ל של אמצעי בקרה ומפרקים בזהירות מכנית את הכדורית, תוך שהם מעלים ויורדים פי 10 עד פי 20, באמצעות פיפטה מזכוכית פסטר מלוטשת באש עד לקבלת תרחיף תאים הומוגני.
זהירות: זהו אחד השלבים הקריטיים ביותר בפרוטוקול, שכן פירוק מוגזם או לא מספיק ישפיע לרעה על התשואה של התרביות. - מוסיפים 4 מ"ל של אמצעי בקרה ומערבבים בהיפוך כדי לשטוף את התאים. צנטריפוגה ב 300 x גרם במשך 5 דקות. לאחר מכן, הסר את supernatant.
- הוסף 1 מ"ל של מדיום מלא והשהה מחדש את הגלולה על ידי פיפטציה למעלה ולמטה פי 10 כדי ליצור הומוגניות של תרחיף התא.
- ספרו את תרחיף התא באמצעות תא נויבאואר מתחת למיקרוסקופ לאחר דילול 1/2 אליקוט של תרחיף התא עם טריפאן כחול או השתמשו במונה תאים אוטומטי. ודא כי תרביות מפורקות ברמת תא בודד.
- לאחר הכנת תרחיף התא, זרעו את התאים המתקבלים באופן שווה ב -8 בארות של צלחת 48 בארות בנפח סופי של 500 מיקרוליטר של תווך שלם.
הערה: בדרך כלל אנו מקבלים 20,000 תאים משני SVZs, וכתוצאה מכך צפיפות הזריעה הסופית היא כ-2,500 תאים/מ"ל כדי להשיג את התפוקה המרבית בתרביות.
- חותכים כל SVZ ל 4-5 חתיכות קטנות כדי להקל על פירוק הרקמה.
- היווצרות נוירוספרות
- לדגור על תאים במשך 5 עד 7 ימים במבחנה (DIV) באינקובטור לח ב 37 ° C ו 5% CO2. בתנאים אלה, תאים ממוינים מתים בעוד NSCs ואבות מתרבים בתגובה לגירוי מיטוגני, ויוצרים אגרגטים שבטיים המוכרים כנוירוספרות ראשוניות.
הערה: ניתן להשתמש ב-EGF או ב-bFGF כדי לגרום להיווצרות נוירוספרה. עם זאת, שני גורמי גדילה אלה אינם ניתנים להחלפה מלאה. - בדקו את גודל הנוירוספרות באמצעות מצלמה מצומדת למיקרוסקופ הפוך, וברגע שהנוירוספרות מגיעות לטווח גודל של 50 עד 100 מיקרומטר, ספרו את כל הנוירוספרות הראשוניות שנוצרו בבאר בהגדלה של פי 10. המספר הכולל של נוירוספרות ראשוניות שנוצרו משמש כהערכה של מספר NSCs הנוכחים בנישת SVZ.
- לאחר תקופה של 10 ימים, אספו את מדיום התרבית מכל באר כדי להתחיל לעבור. בצע מעבר לאחר מכן לאחר 5 עד 7 DIV, אם כי ראוי לציין כי כדורים ראשוניים עשויים לדרוש משך זמן מעט ארוך יותר כדי להגיע לגודל האידיאלי עבור subculturing (סביב 100 מיקרומטר).
- לדגור על תאים במשך 5 עד 7 ימים במבחנה (DIV) באינקובטור לח ב 37 ° C ו 5% CO2. בתנאים אלה, תאים ממוינים מתים בעוד NSCs ואבות מתרבים בתגובה לגירוי מיטוגני, ויוצרים אגרגטים שבטיים המוכרים כנוירוספרות ראשוניות.
טבלה 1: פתרונות מדיה תרבותית. המתכון של מדיום הבקרה מתואר. תמיסת תערובת הורמונים מעורבבת מראש נעשתה. מלאי פתרונות הורמונליים ניתן להכין מראש כפי שצוין ומאוחסן ב -20 ° C. לפני תרבית תאים, להשלים את מדיום הבקרה עם EGF ו bFGF כדי להכין מדיום שלם. מפרטי אחסון, מלאי וריכוזי עבודה מסופקים עבור כל רכיב. אנא לחץ כאן כדי להוריד טבלה זו.
2. הרחבת תרבויות נוירוספריות
- מעבר של נוירוספרות
- לאסוף את המדיום המכיל את הנוירוספרות מן לוחות multiwell ולהעביר אותם צינור צנטריפוגה 15 מ"ל. להבטיח את ההתאוששות של תאים רבים ככל האפשר על ידי שטיפת הבארות עם כמה מיליליטר של DPBS.
- נוירוספרות צנטריפוגות במשך 5 דקות ב 300 x גרם. לאחר מכן, הסר את supernatant.
- הוסף 200 μL של תמיסה אנזימטית (ראה רשימת חומרים) לגלולה והקש בעדינות על תחתית הצינור כדי לעקור אותו. יש לדגור במשך 10 דקות בטמפרטורת החדר כדי להקל על הדיסוציאציה של הנוירוספרות.
- הוסף 1 מ"ל של אמצעי בקרה כדי לעצור את התגובה האנזימטית ולנתק באופן מכני נוירוספרות עם מיקרופיפטה P1000 על ידי פיפטציה למעלה ולמטה 10x עד 20x.
- מוסיפים נפח נוסף של 4 מ"ל של אמצעי הבקרה ומערבבים בהיפוך כדי לשטוף את התאים.
- צנטריפוגה את התאים במשך 5 דקות ב 300 x גרם. לאחר מכן, הסר את supernatant.
- הוסף 1 מ"ל של מדיום מלא והשהה מחדש את הגלולה כדי ליצור הומוגניות של התרחיף התאי על ידי פיפטציה למעלה ולמטה פי 10.
הערה: אם המספר והגודל המקוריים של נוירוספרות גבוהים מדי, הוסף מדיום שלם יותר כדי לדלל את תרחיף התא ולהבטיח ספירת תאים אמינה. - ספור את מתלה התא באמצעות תא נויבאואר לאחר דילול 1/2 aliquot של מתלה התא עם כחול טריפאן או להשתמש מונה תאים אוטומטי.
- כדי להרחיב את תרבית התאים, זרעו תאים בצפיפות של 10,000 תאים לסמ"ק2 באמצעות תווך שלם בצלחת תרבית מתאימה או בבקבוק (ראה טבלה 2).
- תאי דגירה עבור 5 עד 7 DIV באינקובטור לח ב 37 ° C ו 5% CO2 עבור כל מעבר.
הערה: ניתן להרחיב ולהפיץ תרביות נוירוספריות באופן עקבי באמצעות תת-תרבית חוזרת, שלא תעלה על 10 מעברים, מבלי לשנות את יכולות ההתפשטות שלהן. ניתן להשתמש ב-EGF או ב-bFGF לגידול; עם זאת, התרחבות ארוכת טווח של התרבויות יכולה להיות מושגת רק בנוכחות EGF.
- בדיקת התחדשות עצמית
- לאחר מעבר תרביות נוירוספרה, לוחית 1,000 תאים בודדים בצלחת של 96 בארות, ומשלימה עד נפח סופי של 200 μL עם תווך שלם, וכתוצאה מכך צפיפות התאים הסופית של תרביות של 5 תאים/μL.
הערה: מספר התאים שנזרעו חייב להיות מדויק ככל האפשר. במידת הצורך, הכינו דילולי ביניים כדי להבטיח נפח תרחיף תאים אמין לפני הציפוי. יתר על כן, מומלץ צלחת 4 עד 5 משכפלים לכל תנאי כדי להפחית את השונות הטכנית. - לדגור על תאים ב 37 ° C ו 5% CO2 באינקובטור לח במשך 5 ימים או עד נוירוספרות להגיע לגודל מתאים (60 עד 100 מיקרומטר). הימנע להזיז או לנער את הצלחת multiwell כדי למנוע הצטברות נוירוספרה.
- לאחר היווצרות נוירוספרה, ספור את מספר הנוירוספרות הנוצרות בכל באר באמצעות מיקרוסקופ ניגודיות פאזה הפוכה המצויד במצלמה מחוברת. בדיקת החידוש העצמי יכולה להתבצע באמצעות EGF או bFGF בנפרד.
- לאחר מעבר תרביות נוירוספרה, לוחית 1,000 תאים בודדים בצלחת של 96 בארות, ומשלימה עד נפח סופי של 200 μL עם תווך שלם, וכתוצאה מכך צפיפות התאים הסופית של תרביות של 5 תאים/μL.
- שימור בהקפאה של תרביות המל"ל
הערה: תרביות נוירוספריות יכולות להישמר בהקפאה לשימוש עתידי, תוך מזעור מספר העכברים הדרוש. מומלץ לשמר תאים עד מעבר 10.- כדי לשמר תאים בהקפאה, העבר 1 מ"ל של תרחיף התא בתווך מלא לצינור קריו-צינור מסומן כראוי.
- הוסף דימתיל סולפוקסיד (DMSO) לריכוז סופי של 10% לתרחיף התא וערבב בעדינות על ידי היפוך הצינורות.
הערה: DMSO משמש כמגן קריוגני אך עלול להיות רעיל לתאים, ולכן יש לבצע שלב זה במהירות. - הכניסו את הצינורות למקפיא בטמפרטורה של -80°C באמצעות מיכל הקפאה המאפשר ירידה הדרגתית בטמפרטורה של 1°C/min. תהליך הקפאה הדרגתי זה מונע נזק לתאים הנגרם על ידי היווצרות גבישי קרח במהלך שימור בהקפאה. לאחסון לטווח ארוך, שמור על הצינורות במיכל חנקן נוזלי ב -196 ° C.
- הפשרת תרביות המל"ל
הערה: בעת הצורך, ניתן להפשיר תאים, ולהרחיב תרביות מחדש לניסויים.- הסר את צינורות ההקפאה המכילים NSCs קפואים ממיכל אחסון החנקן הנוזלי והניחו אותם מיד באמבט מים של 37 מעלות צלזיוס עד להפשרה מלאה, כ -5 דקות.
זהירות: חיוני למזער את זמן האמבטיה מכיוון ש- DMSO רעיל ויכול להשפיע על יכולת הקיום של התא. - העבר במהירות תאים מופשרים לתוך צינור צנטריפוגה 15 מ"ל המכיל 5 מ"ל של אמצעי בקרה שחומם מראש.
- תאי צנטריפוגה ב 300 x גרם במשך 5 דקות ולהסיר את supernatant. הוסף 1 מ"ל של מדיום מלא והשהה מחדש את הגלולה על ידי זינוק עדין למעלה ולמטה פי 10 כדי ליצור הומוגניות של התרחיף התאי לפני הזריעה.
הערה: הפשרה עלולה להשפיע על כדאיות התא; לכן, מומלץ לעבור תאים לפחות פעם אחת לפני הזריעה לניסויים חדשים.
- הסר את צינורות ההקפאה המכילים NSCs קפואים ממיכל אחסון החנקן הנוזלי והניחו אותם מיד באמבט מים של 37 מעלות צלזיוס עד להפשרה מלאה, כ -5 דקות.
- בדיקת מיקופלסמה
הערה: זיהום מיקופלסמה עלול לפגוע בבריאות התא, ולהשפיע על קצב הגדילה. לכן, בדיקות מיקופלסמה חיוניות כדי להבטיח את שלמות ואמינות הניסויים.- מיצוי DNA
- לאסוף מינימום של 100 μL של תרבית התא עבור מיצוי DNA. גם סופרנאטנט וגם גלולת תא יכולים לשמש למיצוי DNA. יש לאחסן aliquot זה בטמפרטורה של -20°C עד לחילוץ.
- ניקב את מכסה הצינור והרתיח את aliquot ב 99 ° C במשך 15 דקות באמצעות thermoblock.
הערה: פירסינג של מכסי צינור מונע פתיחת צינורות במהלך הרתחה בטמפרטורות גבוהות. - צנטריפוגה למשך 5 דקות ב 16,900 x גרם. מעבירים את הסופרנאטנט המכיל את הדנ"א לצינור חדש. אחסן את הצינור עם ה- DNA ב -20 ° C עד בדיקת PCR.
- PCR לזיהוי מיקופלסמה
- הכן את תערובת ה- PCR באמצעות הרכיבים הבאים: 8.9 μL של מים ללא נוקלאז, 3 μL של 5x מאגר תגובה, 1.2 μL של 25 mM MgCl2, 0.25 μL של 2.5 mM dNTPs, 0.15 μL של Taq פולימראז ו- 0.25 μL של כל פריימר ספציפי למיקופלסמה בריכוז של 10 μM (קדימה, Fw: 5'GATGTTTAGCCGGGTCGAGAG3' והפוך, Rv: 5'GATGTCAAGAGTGGGTAAGGTT3").
- הוסף 1 μL של DNA גנומי שחולץ. הכן את תערובת ה- PCR במכסה מנוע זרימה למינרית כדי למנוע זיהום DNA.
- לדגור את התגובה במחזור תרמי כדלקמן: דנטורציה ראשונית ב 95 ° C במשך 5 דקות ואחריה 35 מחזורים של denaturation ב 95 ° C במשך 30 שניות, חישול ב 53 ° C במשך 1 דקה, הארכה ב 72 ° C במשך 30 שניות, והארכה סופית ב 72 ° C במשך 5 דקות.
- כדי לזהות את גודל הרצועה המתקבלת (סביב 500 bp), לטעון 15 μL של מוצר PCR DNA מעורבב עם 3 μL של 6x טעינת תמיסת צבע על ג'ל agarose 2% ולהפעיל את האלקטרופורזה במשך 40 עד 50 דקות ב 100 V.
- מיצוי DNA
טבלה 2: צלחות וצלוחיות המשמשות לגידול. הממדים והנפחים של לוחות הזריעה והצלוחיות הנפוצים ביותר מסופקים. הטבלה כוללת את הקוטר, שטח הגידול והנפח הבינוני המשמש לכל כלי שיט, יחד עם דוגמה למספר ה-NSCs שיש לזרוע בתנאי התפשטות (10,000 תאים לסמ"ק2). אנא לחץ כאן כדי להוריד טבלה זו.
3. נוקלאופקציה של תרבויות נוירוספריות
- הכנת ריאגנטים
- הכנת DNA
- הכן 25 μL של תאי E. coli DH5α מוכשרים בצינור 1.5 מ"ל לטרנספורמציה.
- הוסף 1 μL של פלסמיד עניין (ב 100 עד 200 ng / μL) לתאים ולחשוף אותם להלם תרמי ב 42 ° C במשך 45 שניות. כאן משתמשים בפלסמיד המכיל סיכת ראש קצרה (sh)RNA להשתקת ביטוי Snrpn ובפלסמיד בקרה shScramble.
הערה: שמור תאים מתאימים על קרח לאורך כל ההליך כדי לשמור על יעילות הטרנספורמציה. - צלחת את התאים מותמרים על לוחות אגר LB עם אנטיביוטיקה מתאימה לדגור אותם ב 37 ° C במשך 18 שעות. שמרו על צלחות פטרי הפוכות כדי למנוע היווצרות טיפות כתוצאה מעיבוי, שעלול להפריע למושבות חיידקים.
הערה: הוסף אנטיביוטיקה מתאימה למדיום תרבית LB כדי לאפשר באופן בלעדי צמיחה של חיידקים מותמרים. - בעזרת קצה פיפטה סטרילי, בחרו מושבות חיידקים בודדות והעבירו אותן לבקבוק ארלנמאייר שהיה מלא בעבר ב-250 מ"ל LB כדי להתחיל תרבית נוזלית. הימנעו מבחירת מושבות לוויין קטנות הממוקמות סביב מושבות המטרה הגדולות יותר, מכיוון שייתכן שהן לא שילבו את הפלסמיד הרצוי.
- יש לדגור על הבקבוק תוך כדי ניעור נמרץ על שייקר אורביטלי בטמפרטורה של 37 מעלות צלזיוס למשך הלילה.
- השתמשו בערכת maxiprep נטולת אנדוטוקסין והפיקו DNA פלסמיד טהור מתרביות החיידקים בהתאם להוראות היצרן. הרכיבו מחדש את הדנ"א בנפח המתאים של מים נטולי אנדוטוקסין כדי לקבל ריכוז פלסמיד של 1 עד 2 מק"ג/מיקרוליטר.
הערה: תשואת maxiprep תלויה בצמיחת התרבית. בדרך כלל, השעיה מחדש של כדורית הדנ"א פלסמיד בנפח של 200 μL תגרום לריכוז ה- DNA הרצוי. - יש לאחסן את הצינור עם ה-DNA של הפלסמיד בטמפרטורה של -20°C עד לשימוש. הכן צינור 1.5 מ"ל עם נפח סופי של 5 μL המכיל 2 עד 6 מיקרוגרם של DNA פלסמיד המיועד nucleofection.
- הכנת חומרים
- הכן את תמיסת הנוקלאופקציה. אם אתם משתמשים בערכה המומלצת (ראו טבלת חומרים), הכינו 95 מיקרוליטר של תמיסת הנוקלאופקציה בצינור של 1.5 מ"ל עבור כל נוקלאופקציה רצויה. פיפטות וקוביטות כלולות בדרך כלל בערכה. הכינו אחד מכל אחד לכל תנאי נוקלאופקטציה.
- הכינו בקבוק T25 מלא ב-4 מ"ל של מדיום מלא שחומם מראש לכל מצב ושמרו אותו באינקובטור עד לשימוש.
- הכנת DNA
- נוקלאופקציה של NSCs
- השתמש 1 עד 2 x 106 תאים נפרדים לכל תנאי לצורך הערכה. צנטריפוגו את התאים במשך 5 דקות ב 300 x גרם, ולאחר מכן להסיר את supernatant.
- הוסף 1 מ"ל של DPBS והשהה מחדש את הגלולה על ידי צנרת למעלה ולמטה פי 10 כדי להבטיח השעיה תאית הומוגנית.
- חזור על הצנטריפוגה (שלב 2.1.6) לשטיפה שנייה ולבסוף תשעה מחדש את הגלולה בתמיסת נוקלאופקציה של 95 מיקרוליטר.
הערה: שלבי שטיפה חיוניים להסרת אנטיביוטיקה ממדיום הבקרה ולהבטחת גרעין יעיל. - שלב את 95 μL של תאים עם תמיסה מעורבבת מראש המכילה 5 μL של כל פלסמיד (2 מיקרוגרם בסך הכל) שנבחר עבור nucleofection.
- באמצעות מיקרופיפטה P200, להעביר פתרון זה cuvette ומניחים אותו במכשיר נוקלאופקטור.
- Nucleofect התאים עם פלסמידים הרצויים באמצעות תוכנית NSC אופטימלית של מערכת nucleofector.
- לאחר השלמת האלקטרופורציה, הציגו בזהירות מדיום שלם וחם לקובט באמצעות פיפטות פסטר המסופקות בערכה. לאחר מכן, מעבירים את תכולת הקובט לבקבוק T25 שהוכן בעבר המכיל מדיום שלם שחומם מראש. לאחר התחשמלות, ייתכן מוות תאי, משקעים DNA, והיווצרות של צבר צמיג. הימנע מלהעביר את זה לצלוחית T25, מכיוון שזה עלול להפחית את הישרדות התא.
הערה: שלב זה הוא חיוני ויש לבצע אותו מהר ככל האפשר כדי להבטיח תשואה גבוהה של נוקלאופקציה והישרדות תרבית לאחר מכן. - לדגור על תאים גרעיניים ב 37 ° C ו 5% CO2 באינקובטור לח במשך 3 עד 5 ימים.
- בחירת תאים בעלי גרעין
- אסטרטגיה א': בחירת ציטומטריית זרימה באמצעות מיון תאים המופעלים על ידי פלואורסצנטיות (FACS)
- לאחר 3 עד 5 ימים של נוקלאופקטציה, עברו את התרביות הגרעיניות לאחר שלב 2.1 ואספו את כל התאים הבודדים שהתקבלו.
- סנן דגימות דרך מסננת תאים של 40 מיקרומטר כדי להסיר צברי תאים ולנתח אותם באמצעות ציטומטר זרימת ממיין התא.
הערה: חיוני למיין את אותו מספר תאים בכל מצב כדי לקבל תוצאות השוואתיות. - באמצעות תוכנת הציטומטר, שער תאים חיים המבוסס על שני מדדים: אור מפוזר קדמי (FSC-A) המתאים לגודל התא ואור מפוזר צדדי (SSC-A) המתאים למורכבות תוך תאית. בחר את אוכלוסיית התאים החיים המאופיינים ב- FSC-A גבוה ו- SSC-A גבוה.
הערה: לחלופין, הוסף 0.1 מיקרוגרם/מ"ל של 4′,6-diamidino-2-phenylindole (DAPI) לתרחיף תאים לפני המיון. זה יאפשר השלכה של תאים מתים וגופים אפופטוטיים מן gating. - מחק כפילים ושלישיות של תאים על-ידי התוויית פרמטרים של FSC-A לעומת FSC-H. בחר את האירועים הכלולים באלכסון של העלילה, המייצג סינגלים.
הערה: כאשר תאים עוברים דרך הלייזר, הציטומטר מזהה שינויי מתח לאורך זמן. FSC-A מייצג את אזור האות, ו- FSC-H מציין את גובה השיא. סינגלים מציגים יחס יחסי בין FSC-A ו- FSC-H (הממוקם באלכסון של העלילה), בעוד שצברי תאים מציגים FSC-A גדול יותר ביחס ל- FSC-H עקב אות ארוך יותר. - בחר תאים נוקלאופקטיים בהתבסס על עוצמת הפלואורסצנטיות של הגן המדווח המקודד על ידי הפלסמיד שבו נעשה שימוש. לדוגמה, בעת שימוש בתאי GFP+ ניתן לבחור בהתבסס על רמות פלואורסצנטיות של FITC-A לעומת התוויית SSC-A.
- בודד את המספר הרצוי של תאי מטרה עבור כל מצב ואסוף אותם ישירות בצינור איסוף מלא בתווך שלם.
- זרעים גרעיניים NSCs בצפיפות של 10,000 תאים לסמ"ק2. לדגור על תרביות תאים ממוינות ב 37 ° C ו 5% CO2 באינקובטור לח.
- אסטרטגיה ב': סלקציה באמצעות עמידות לאנטיביוטיקה המקודדת בפלסמיד
- לאחר 48 שעות של נוקלאופקטציה, הוסף את ריכוז האנטיביוטיקה המתאים לבחירת תאים עמידים.
הערה: לפני שמתחילים, מומלץ לבדוק ריכוזים מרובים של אנטיביוטיקה על תאים שאינם נוקלאופקטים. ריכוז האנטיביוטיקה האופטימלי הוא הכמות הנמוכה ביותר שבה מסולקים כל התאים שאינם עמידים. לדוגמה, קבענו ריכוז אופטימלי של 4 מיקרוגרם/מ"ל אנטיביוטיקה בלסטיצידין עבור תרביות NSC. - לדגור על התאים ב 37 ° C ו 5% CO2 באינקובטור לח במשך 48 שעות.
- לאחר 48 שעות של טיפול אנטיביוטי, תת-תרבית של התאים הנוקלאופקטיים לפי שלב 2.1. אם הנוירוספרות נשארות קטנות, הסר את האנטיביוטיקה ממדיום התרבית על ידי צנטריפוגה ב 300 x גרם למשך 5 דקות. להשהות מחדש את התאים ולתרבית אותם בבקבוק באמצעות מדיום מלא בלבד. יש לדגור על התאים בטמפרטורה של 37°C ו-5%CO2 באינקובטור לח עד שניתן יהיה להרחיבם לאחר שלב 2.1.
- לאחר 48 שעות של נוקלאופקטציה, הוסף את ריכוז האנטיביוטיקה המתאים לבחירת תאים עמידים.
- אסטרטגיה א': בחירת ציטומטריית זרימה באמצעות מיון תאים המופעלים על ידי פלואורסצנטיות (FACS)
תוצאות
תנאי תרבית אופטימליים מאפשרים בידוד והרחבה של NSCs בוגרים שמקורם ב-SVZ במבחנה
תרביות של NSCs שמקורם ב-SVZ הבוגר שימשו כשיטת מבחנה רבת ערך לחקר המנגנונים המולקולריים ואותות הנישה המווסתים את ה-NSCs בתוך המיקרו-סביבות הספציפיות שלהם. הבדיקה הנוירוספרית המתוארת בכתב יד זה שימשה לבחינת ספירת המל"ל בתוך SVZ הבוגר. רקמת SVZ בודדה ממוחם של עכברים בני 3 חודשים, נותקה ותורבתה בתווך NSC מלא בתוספת EGF ו-bFGF או כל אחד בנפרד. לאחר 10 ימים במבחנה (DIV), הספירה הכוללת של הספירות הראשוניות שנוצרו תחת שלושת תנאי התרבית השונים האלה כומתה באמצעות מיקרוסקופ ניגודיות פאזה (איור 2A,B). באופן מדהים, הממצאים שלנו מראים שנוכחות של EGF הובילה להיווצרות מקסימלית של ספירות ראשוניות, וזה ניכר בספירה המופחתת של ספירות ראשוניות שנצפו בתרבויות עם bFGF בלבד (איור 2A,B). כדי להעריך את יכולת ההתחדשות העצמית של תאי גזע עצביים בתנאים בינוניים מגוונים, התאים עברו תת-תרבית וצופו בצפיפות נמוכה (5 תאים/μL) במדיה בתוספת שילובים של מיטוגנים שהוזכרו לעיל. כימות ספירות משניות גילה כי SVZ NSCs זקוקים לפחות ל-EGF כדי לחדש את עצמם ביעילות, וכי השילוב של EGF ו-bFGF משפר את יכולת ההתחדשות העצמית של תאים (איור 2B). יתר על כן, לצורך ניתוח מפורט של דינמיקת גדילה על פני תנאי מדיה מגוונים, נרשם מספר התאים שנזרעו והושגו לאורך 7 מעברים. עקומות גדילה שהתקבלו מתנאי מדיה שונים אישרו כי תרביות שקיבלו תוספת של EGF בלבד או בשילוב עם bFGF הציגו דינמיקת גדילה משופרת בהשוואה לתרבויות שקיבלו תוספת בלעדית של bFGF (איור 2C). יחד, ממצאים אלה מאששים כי שימוש בו זמנית הן ב-EGF והן ב-bFGF משפר את תשואת הטיפוח במבחנה של NSC.
על מנת לחקור את ספירת המל"ל בתוך SVZ בגילאים שונים לאחר הלידה ולהעריך את ההשפעה של הזדקנות עכברים על יעילות תרבית נוירוספרה, נותחה רקמת SVZ מעכברים בני חודש עד 12 חודשים. יש לציין כי הממצאים שלנו חשפו ירידה משמעותית במספר הספירות הראשוניות עם העלייה בגיל, והראו יעילות מרבית בספירת הספירות בסביבות גיל חודשיים עד ארבעה חודשים (איור 2D). בנוסף, כדי להעריך את יכולת ההתחדשות העצמית של NSCs במהלך תת-תרבית, NSCs מעכברים בגילאי 2 עד 4 חודשים עברו תת-תרבית ונזרעו בצפיפות שיבוט (5 תאים/μL) בתווך מלא. כימות מספר הספירות המשניות לאורך הקטעים הבאים הצביע על ירידה ניכרת ביעילות התרבות לאורך המעברים (איור 2E). בהתבסס על כל התצפיות הללו, מומלץ לבצע בדיקות התחדשות עצמית במהלך מעברים מוקדמים כדי לייעל עוד יותר את תנאי התרבית במל"ל.
נוקלאופקציה היא טכניקה יעילה ביותר למניפולציה של ביטוי גנים בתאי גזע עצביים בוגרים
בהתחשב בכך NSCs אינם ניתנים להעברה בקלות, כדי לתפעל ביטוי גנים, כאן אנו מציגים פרוטוקול של נוקלאופקציה עם שיעור גבוה יותר של העברת גנים מוצלחת ללא צורך להשתמש בהתמרה ויראלית. לאחר נתיחה וגידול של SVZ בודדים מעכברים בני 2 עד 4 חודשים, NSCs קיבלו נוקלאופקט עם פלסמיד נושא GFP כמתואר (איור 3A). זיהוי תאים חיוביים ל-GFP יומיים לאחר הנוקלאופקציה גילה יעילות שנעה בין 30% ל-50%, בהתאם לספרות קודמת28. כדי לבודד באופן ספציפי NSCs שעברו בהצלחה גרעינית, התאים מוינו לפי FACS בהתבסס על עוצמת הפלואורסצנטיות של GFP 3 עד 5 ימים לאחר הנוקלאופקציה (איור 3A-C). כ-40% מהתאים שנותחו לפני FACS הציגו רמות פלואורסצנטיות גבוהות של GFP, ולאחר מכן נבחרו על-ידי מיון (איור 3C). זריעה מחדש של GFP+ NSCs ממוינים הראתה שכל התאים היו חיוביים ל-GFP, מה שאימת את שיטת בידוד התאים המבוססת על נוקלאופקציה (איור 3D). יש לציין כי NSCs גרעיניים שמרו על כדאיות באמצעות מעברים עוקבים, ואישרו היתכנות נוקלאופקטיבית עבור NSCs בוגרים. תוצאות אלה מדגישות את היעילות של שילוב נוקלאופקציה ו- FACS כדי לבסס תרבות טהורה של NSCs מותאמים.
כדוגמה למודולציה גנטית בתאי גזע מלשכה בוגרים, נעשה שימוש בהנחתת גנים באמצעות נוקלאופקציה של RNA קצר (sh). באופן ספציפי, shRNA המכוון לגן פוליפפטיד N (Snrpn) גרעיני קטן, הנושא כתב CAG-GFP (shSNRPN) היה nucleofected בתרביות NSC שמקורן בעכברים בני חודשיים. הפחתת רגולציה של Snrpn אושרה על-ידי qPCR ואימונוציטוכימיה בתאים עם פלסמיד shSNRPN, אך לא עבור פלסמיד shSCRAMBLE (איור 3E,F)29. כדי להבהיר את ההשפעות של הפחתת הרגולציה של Snrpn על יכולת ההתחדשות העצמית של NSC, בוצעה בדיקה בצפיפות נמוכה בתאים בעלי גרעין (איור 3F,G). כימות של נוירוספרות משניות בתרביות נוקלאופקטיות חשף יכולת היווצרות נוירוספרה מוגברת עם הפחתת הרגולציה של Snrpn (איור 3G). בדיקה זו מדגישה את יכולת הנוקלאופקציה לתמרן ביטוי גנים בתאי גזע גזעיים בוגרים, ובאופן ספציפי יותר, מזהה את התפקיד של Snrpn בשמירה על גזעיות בתאי גזע בתאי גזע של NSCs בוגרים.
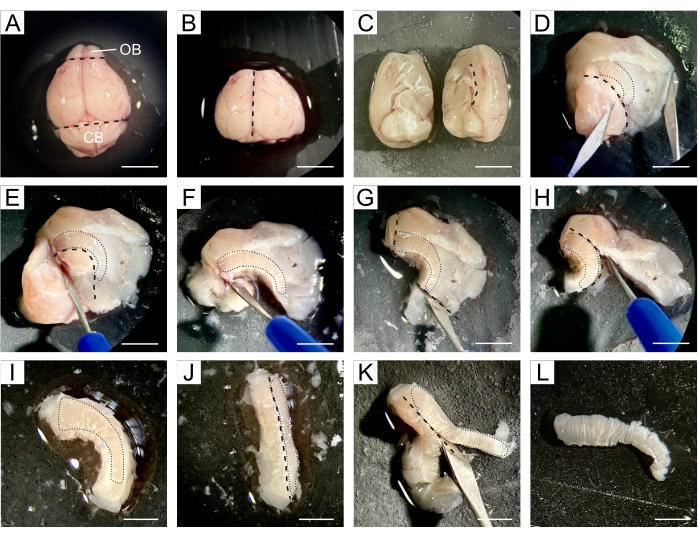
איור 1: תיאור מפורט של דיסקציה SVZ. (A) לאחר הסרת מוח העכבר, המוח כולו מועבר עם DPBS לכרית סיליקון לצורך דיסקציה. (B) OB והמוח הקטן מוסרים מהמוח באמצעות אזמל. (C) המוח מחולק לשתי המיספרות כדי להמשיך בדיסקציה בנפרד. (D) המוח נפתח לאורך הקו של כפיס המוח, מפריד את קליפת המוח והסטריאטום מההיפוקמפוס, המחיצה והדיאנצפלון, ובכך חושף את החדרים הצדיים. (ה-ו) ההיפוקמפוס, המחיצה והדיאנצפלון מוסרים בעקבות הגבול הגחוני של החדרים. (ז-י) הרקמה שמעבר לקצוות הרוסטרליים והקאודליים של SVZ וקליפת המוח מוסרת בעקבות כפיס המוח. (י-ק) הרקמה מוטה כך שה-SVZ פונה הצידה, מה שמאפשר את הסרת הרקמה הסטריאטלית מתחת ל-SVZ. (L) מתקבלת פיסת רקמה דקה המכילה את SVZ. קווים מקווקווים שחורים מציינים את אתר החיתוך. קווים מנוקדים שחורים מציינים את מיקום קובץ SVZ בכל שלב. קיצורים: OB = נורת ריח; CB = המוח הקטן. סרגל קנה מידה ב- A-H: 5 מ"מ; ב- I-L: 3 מ"מ. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
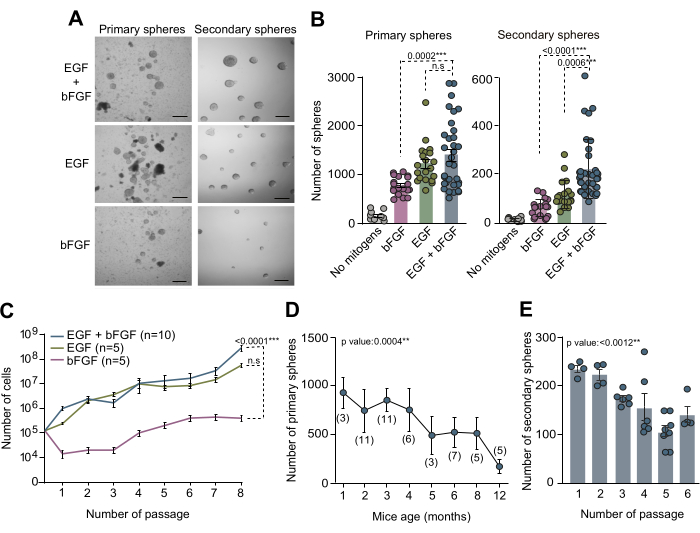
איור 2: גם המיטוגנים EGF וגם bFGF נחוצים לתרבית אופטימלית ולהרחבה של תאי גזע גזעיים גזעיים במבחנה. (A) תמונות מיקרוסקופ עם ניגודיות פאזה של תרביות נוירוספריות ראשוניות ומשניות בתווך NSC בתוספת EGF ו-bFGF או כל מיטוגן בנפרד. (B) מספר הכדורים הראשוניים המתקבלים לכל עכבר ולכל באר בהתבסס על הרכב המיטוגן של מדיום התרבית: ללא מיטוגנים (אפור, n=9), EGF+bFGF (כחול, n=33), רק EGF (ירוק, n=20), או bFGF בלבד (ורוד, n=19; פאנל שמאלי). מספר הנוירוספרות המשניות שנוצרו בצפיפות נמוכה (5 תאים/μL) לכל באר בהתבסס על ההרכב המיטוגני של תווך התרבית): ללא מיטוגנים (אפור, n=11), bFGF (ורוד, n=18), EGF (ירוק, n=18) או EGF+bFGF (כחול, n=37; פאנל ימני). נעשה שימוש במבחן קרוסקל-וואליס עם ניתוח פוסט-הוק של דאן. (C) עקומות גדילה המראות את המספר הכולל של תאים שנוצרו לאחר 8 מעברים בתרביות נוירוספריות נפרדות בהתאם למיטוגנים הקיימים בתווך התרבית: bFGF (ורוד, n=5), EGF (ירוק, n=5) או EGF+bFGF (כחול, n=10). נעשה שימוש בניתוח רגרסיה ליניארית. (D) מספר הנוירוספרות הראשוניות שמקורן בעכברים בודדים שנותחו ופורקו מבעלי חיים בשלבי התפתחות שונים לאחר הלידה. נעשה שימוש בניתוח רגרסיה ליניארית. n מצוין בסוגריים. (E) מספר הנוירוספרות המשניות שנוצרו בצפיפות נמוכה (5 תאים/μL) באמצעות מעברים הבאים במבחנה כדי להעריך את יכולת ההתחדשות העצמית שלהן. נעשה שימוש במבחן קרוסקל-ואליס, וערכי p נכללים: *: p<0.05; **: עמ<0.01; עמ<0.001.: עמ<0.0001.: נ.ס: לא משמעותי. קווי שגיאה מייצגים את SEM. סרגל קנה מידה ב- A הוא 100 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
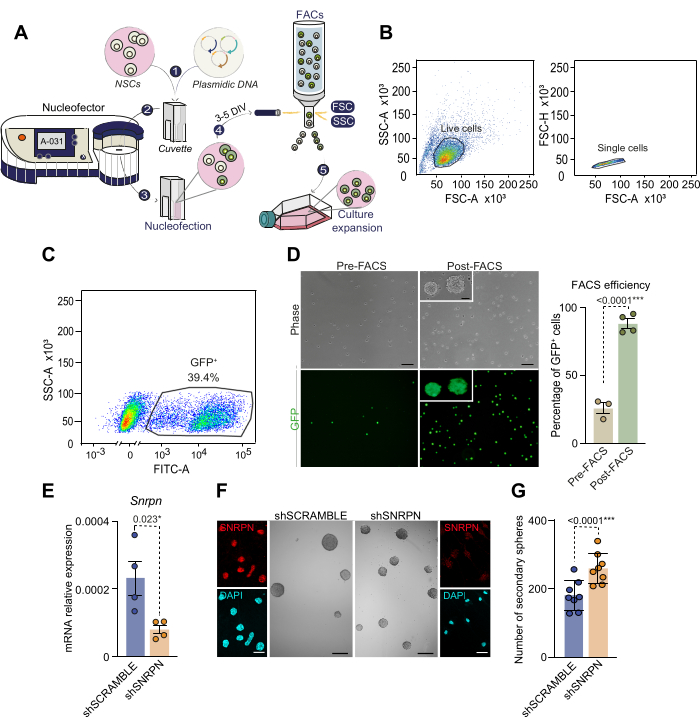
איור 3: סכמה של תהליך הנוקלאופקציה ובחירת תאים מבוססי FACS של תאים בעלי גרעין. (A) סקירה כללית של תהליך הנוקלאופקציה ובחירת תאים מבוססי FACS של תאים בעלי נוקלאופקט. 1) תמיסת DNA פלסמיד משולבת עם תמיסת הנוקלאופקציה ומתווספת לתאים. תערובת זו מועברת לאחר מכן לקובט עבור nucleofection. 2) הקובט המכיל DNA ותאים מוכנס לנוקלאופקטור, שם מופעל שוק חשמלי. עבור תרביות נוירוספריות שבודדו מה-SVZ הבוגר, אנו ממליצים להשתמש בתוכנית A-031 NSC. 3) לאחר נוקלאופקציה, התאים מועברים לבקבוק המכיל תווך שלם בתוספת EGF ו- bFGF. 4) התאים ממוינים על ידי FACS בהתבסס על ביטוי המדווח הכלול בדנ"א הפלסמיד. 5) תאים ממוינים עוברים תרבית נוספת לניסויים הבאים. (B) אסטרטגיית בחירה מבוססת FAC ו-gating עבור NSCs בעלי נוקלאופקט. ראשית, תאים חיים נבחרים בהתבסס על FSC-A גבוה ו- SSC-A גבוה (גרף שמאלי), ולאחר מכן מכפילי תאים ושלישיות מסולקים על ידי ניתוח פרמטרים FSC-A לעומת FSC-H (גרף ימני). (C) FACS gating עבור תאים בעלי נוקלאופקט בהתבסס על ביטוי ה-GFP שלהם (SSC-A לעומת FITC-A fluorescence). (D) מיקרוסקופ ניגודיות פאזה ותמונות פלואורסצנטיות GFP של NSCs בעלי נוקלאופקט לפני (n=3) ואחרי (n=4) בחירת FACS (פאנל שמאלי). אחוז תאי GFP+ בעלי נוקלאופקט מתואר לפני ואחרי בחירת FACS (פאנל ימני). נעשה שימוש במבחן T. (ה) ניתוח PCR כמותי (qPCR) של ביטוי Snrpn בריבוי NSCs עם shRNA ספציפי ל-Snrpn (n=4). נוקלאופקציה באמצעות ערבול shRNA שימשה כבקרה (n=4). נעשה שימוש במבחן T. (F) תמונות אימונוציטוכימיות המציגות SNRPN (באדום) בתאי גזע עצביים (NSC) 7 ימים לאחר נוקלאופקציית shRNA (לוחות חיצוניים). DAPI נוצל כדי להכתים DNA. תמונות מייצגות המתארות נוירוספרות שמקורן בתאי גזע עצביים בתנאי shSNRPN ו-shSCRAMBLE (לוחות אמצעיים). (G) כימות מספר הנוירוספרות שנוצרו בתרביות NSC לאחר נוקלאופקציה עם shSNRPN (n = 8) או shSCRAMBLE (n = 8). נעשה שימוש במבחן T. ערכי p כלולים: *: p<0.05; **: עמ<0.01; עמ<0.001.: עמ<0.0001.: נ.ס: לא משמעותי. קווי שגיאה מייצגים את ה- SEM. סרגל קנה מידה ב- D, 10 מיקרומטר; ב-F, 100 מיקרומטר (תמונות בהגדלה גבוהה ב-F, 7 מיקרומטר). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Discussion
בשל היעדר סמנים מוחלטים לזיהוי אוכלוסיית NSC in vivo, ניתוח NSCs התבסס בעיקר על התבוננות בהתנהגות של תאים שבודדו מנישות נוירוגניות בתנאי ex vivo . עבודתם החלוצית של ריינולדס וייס הניחה את היסודות על ידי קביעת תנאי תרבית מדויקים, המאפשרים בידוד והרחבה של תאים בודדים מרקמת SVZ עכברית צעירה (בת חודשיים) בתנאים שאינם דביקים. תאים אלה מופצים בדרך כלל בתווך נטול סרום המכיל EGF ו- bFGF, תנאים המונעים לחלוטין התמיינות לנוירונים ולגליה תוך קידום התפשטות. ואכן, בתנאי תרבית אלה9, רוב התאים מתים בימים הראשונים בתרבית, אך תת-קבוצה קטנה מתחילה להתחלק ויוצרת בעיקר נוירוספרות צפות9. דיסוציאציה אנזימטית ותת-תרבית של צברי תאים אלה מאפשרים התפשטות תרבית, ומדגימים את יכולת ההתחדשות העצמית של תרביות אלה.
יש לציין כי תרביות נוירוספריות מראות פוטנציאל התפשטות עם תוספת של EGF בלבד, בעוד שתאי גזע עצביים הגדלים בתווך המכיל bFGF בלבד אינם מראים התפשטות תאים לטווח ארוך30. שתי הראיות מצביעות על EGF כמיטוגן העיקרי להתחדשות עצמית של המל"ל. עם זאת, נוכחותם של EGF ו- bFGF במדיום התרבית משפרת את יכולת ההתחדשות העצמית של NSCs31, כמו גם תורמת לאיזון פוטנציאל ההתמיינות לאסטרוציטים, נוירונים ואוליגודנדרוציטים 32,33,34,35. יתר על כן, השימוש בתערובת מוגדרת של הורמונים וגורמים במקום חלופות מסחריות להשלמת המדיום מבטיח את האיכות הגבוהה ואת יכולת השחזור של תרביות המל"ל. בתנאים אלה, תרביות NSC של עכברים יכולות להמשיך כשורות תאים יציבות מבלי לעבור הנצחה. אף על פי כן, דאגה בתרביות נוירוספריות היא הפוטנציאל של אוכלוסיות תאים מתפשטות לעבור טרנספורמציות גנטיות, תוך עקיפת מנגנוני ויסות מחזור התא ולהוביל לפנוטיפ בן אלמוות. לכן, למרות שתרביות נוירוספריות ניתנות להרחבה רבה, תרביות מעבר ל-10 מעברי מבחנה מושלכות בדרך כלל למחקרים, מכיוון שהן עשויות לעבור הזדקנות משוכפלת, ותאים עם תוכן כרומוזומלי חריג או דינמיקת גדילה לא סדירה עשויים להופיע. יתר על כן, השימוש בתרבויות נוירוספריות מבוססות לטווח ארוך חייב להיות מנוטר ברציפות. תרבויות נוירוספריות מציעות גם הזדמנות לבחון את המאפיינים והפוטנציאל שלהן בסביבה מבוקרת, ומספקות סביבה מדויקת ומתכווננת יותר שניתן לווסת ולנטר בצורה מדויקת יותר מאשר in vivo. באמצעות ניתוח קלונוגני או אוכלוסייה במבחנה, ניתן לכמת את יכולות ההתחדשות העצמית וההתרבות של תאים אלה, מה שמקל על זיהוי המנגנונים הבסיסיים השולטים בתכונות אלה.
עם זאת, למרות רשימת היתרונות הגדולה של עבודה עם מל" לים במבחנה, אופיו של פרוטוקול טיפוח זה ועדינותו של המל"ל מהווים אתגר בתחום. לדוגמה, מספר הנוירוספרות הראשוניות הנוצרות במהלך דיסקציה טיפוסית יכול להשתנות באופן משמעותי בהתאם למיומנות ולדיוק של הנסיין. תוצאות הנוירוספרות הראשוניות ממחישות שונות זו במספר הנוירוספרות הראשוניות המתקבלות מה-SVZ של עכברים בני חודשיים, בטווח שבין 500 ל-3000 נוירוספרות. גורמים שונים עשויים לתרום לשונות זו. ראשית, דיוק הדיסקציה ממזער רקמות פרנכימליות לא רצויות, המעכבות היווצרות כדור ראשוני. שנית, יצירת חתיכות קטנות של רקמת SVZ מאפשרת עיכול אנזימטי יעיל וטריטורציה, ובכך מפחיתה את אובדן התאים. זה מדגיש את הצורך בתרגול מוקדם מספיק של פרוטוקול הדיסקציה ופיתוח מכוונן של עיבוד רקמות במהלך הקמת תרביות נוירוספרה.
מגבלה נוספת של תרביות אלה נעוצה בעובדה שנוירוספרות יכולות לכלול גם תאי גזע עצביים וגם תאי אב, מה שמקשה על ההבחנה בין שתי אוכלוסיות אלה בתוך תרבויות ראשוניות. בעוד שסמנים שונים כמו GFAP, Nestin, Musashi ו-SOX2 דווחו כמבוטאים על ידי NSCs8, אף אחד מהם לא היה קשור באופן בלעדי ל-NSCs. טכניקות FACS מתפתחות המבוססות על ביטוי אנטיגן בפני השטח של התא אפשרו בידוד של NSCs וצאצאיהם. מחקרים אלה הוכיחו כי אבות מגבירי מעבר אינם מסוגלים ליצור נוירוספרות במעבר25,36. לכן, בעוד שהקשר בין תאי SVZ לבין תאים יוזמי נוירוספירה דורש עידון נוסף 18,19,20,21,22,23, היכולת של נוירוספרות לעבור באופן סדרתי לאורך תקופה ממושכת עשויה לשקף את נוכחותם של תאי גזע עצביים בתרביות.
מערכת תרבית נוירוספרית זו שימשה מודל חזק לחקר ההשפעה של מסלולי איתות וביטוי גנים בשמירה על יכולת ההתחדשות העצמית של NSC במבחנה15,29. גישה אחת לחקור היבטים אלה כוללת הדבקה של NSCs כדי לבטא יתר על המידה או להפיל גנים ספציפיים. ניתן להשיג זאת באמצעות טכניקות שונות, כולל שיטות ויראליות ולא ויראליות. בעוד שווקטורים נגיפיים משיגים לעתים קרובות יעילות העברת גנים גבוהה, יש להם מגבלות חשובות, כגון דרישות הבטיחות הגבוהות וייצור וקטורים הגוזל זמןרב 26. לעומת זאת, שיטות טרנספקציה קלאסיות כמו ליפופקציה ואלקטרופורציה משיגות שיעורי טרנספקציה נמוכים מאוד, מה שהופך אותן לבלתי ישימות עבור תאים קשים להעברה. טכנולוגיית הנוקלאופקציה מציעה גישה ידידותית למשתמש על ידי שילוב פתרונות נוקלאופקציה ספציפיים לסוג התא עם פרמטרים חשמליים ייחודיים לכל סוג תא37,38. זה מבטיח העברת DNA ישירות לתוך גרעין התא39, ומאפשר את שילוב ה- DNA באופן בלתי תלוי במחזור התא. כתוצאה מכך, נוקלאופקציה מתגלה כטכניקה בת קיימא להעברת תאים קשים להעברה כגון NSCsעכבר 28,40.
מגבלה אחת של שיטה זו היא כי מינימום של 2 x 106 תאים מומלץ והכרחי עבור כל nucleofection, אם כי בתנאים אופטימליים, מספר נמוך יותר של תאים ניתן להשתמש לכל nucleofection יחיד (כלומר, 5 × 105 תאים). חסרון נוסף של השיטה הוא שהאיכות והריכוז של הדנ"א המשמש לנוקלאופקציה משפיעים באופן משמעותי על יעילות העברת הגנים. מומלץ מאוד להשתמש בדנ"א מוכן ללא אנדוטוקסין כדי למנוע תמותת תאים מוגברת כתוצאה מנוכחות אנדוטוקסין. בנוסף, שימוש ביותר מ-6 מיקרוגרם של דנ"א כולל לנוקלאופקציה יכול להפחית באופן משמעותי הן את יעילות העברת הגנים והן את יכולת הקיום של התא. לבסוף, מתן פולס חשמלי הוא גם קריטי להישרדותם של תאים נוקלאופקטים.
בעבודה זו, הדגמנו את המניפולציה של ביטוי הגן Snrpn על ידי שימוש באסטרטגיה הכרוכה בהפחתת הוויסות של ביטויו באמצעות פלסמידים אפיזומליים. פלסמידים אלה אינם משולבים בגנום של התאים, וככל שתאי גזע גזעיים ממשיכים להתרבות במבחנה, הדנ"א שהוחדר ידולל לאחר מכן לאורך חלוקת התא, ובכך יאבד את השפעת המניפולציה הגנטית. לכן, אסטרטגיה זו היא בעלת ערך כדי ללמוד את ההשפעה של שינוי חריף בתקופה קצרה או לתאי תאריך לידה במבחנה. קיימות חלופות מסוימות להערכת השפעה ממושכת יותר של הפרעה גנטית. לדוגמה, מערכת אינטגרטיבית כגון piggyBAC מבוסס טרנספוזון יכול לשמש. מערכת זו מורכבת מהחדרת רצף הקידוד הרצוי הכלול בפלסמיד המוקף ברצפים הניתנים לטרנספוזיה וקו-נוקלאופקט התאים עם פלסמיד המכיל את הרצף עבור האנזים טרנספוזאז41. לחלופין, ניתן להשתמש בטרנספוזונים או במערכות CRISPR/Cas.
פיתוח נוסף של טכנולוגיות הדבקה יהיה צעד חשוב לקראת מבחני תפוקה גבוהה כדי להעריך את תפקידם של גנים שונים על הפיזיולוגיה של תאי גזע עצביים בוגרים. בשילוב עם שיטות טיהור והרחבה מתוחכמות יותר ויותר, מחקרים אלה יאפשרו הבנה של הביולוגיה במבחנה של תאי גזע גזעיים בוגרים והשוואת ההבדלים הביולוגיים בין נוירוספרות צפות לבין NSCs in vivo.
Disclosures
המחברים מצהירים כי אין אינטרסים כלכליים מתחרים.
Acknowledgements
עבודה זו נתמכה על ידי מענקים מ- Ministerio de Ciencia e Innovación ו- Agencia Estatal de Investigación (MCIN/AEI) (PID2019-110045GB-I00; PID2022-142734OB-I00 ו- EUR2023-143479) ל- SRF. EJV (FPU20/00795) ו- DSL (FPU22/03797) ממומנים על ידי תוכנית המלגות הספרדית Formación de Profesorado Universitario (FPU). LLC (PRE2020-094137) ו- JDM (PREP2022-000680) ממומנים על ידי תוכנית המלגות הספרדית Formación de Personal Investigador (FPI). CMM (CIACIF/2022/366) ממומן על ידי Generalitat Valenciana. MIL (CPI-22-481) ממומן על ידי מלגת Programa INVESTIGO (הדור הבא של האיחוד האירופי). מימון בגישה פתוחה מסופק על ידי Ministerio de Ciencia e Innovación.
Materials
| Name | Company | Catalog Number | Comments |
| 0.22 μm pore-filter bottles (250 mL) | VWR | 514-0330P | |
| 0.22 μm pore-filter bottles (500 mL) | VWR | 514-0332P | |
| 12-well plate | LabClinics | PLC30012 | |
| 15 mL tube | Fisher | 10738771 | |
| 24-well plate | LabClinics | PLC30024 | |
| 4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid (HEPES) | BioWest | L0180-100 | |
| 4′,6-diamidino-2-phenylindole (DAPI) | Sigma | D9542 | |
| 48-well plate | ThermoFisher | 150687 | |
| 6-well plate | LabClinics | PLC30006 | |
| 96-well plate | Labclinics | PLC30096 | |
| Accutase solution | Sigma | A6964-100ML | Referred as enzymatic solution |
| Amaxa Mouse Neural Stem Cell Nucleofector Kit | Lonza | VPG-1004 | |
| Amaxa Nucleofector Iib | Lonza | 10700807 | |
| Antibiotic/Antimitotic (A/A) | Sigma | A5955 | |
| Apo-t-Transferrine | Sigma | T2252-1G | |
| Basic Fibroblast Growth Factor (bFGF) | Sigma | F0291 | |
| Blasticidin | Sigma | 203350 | |
| Bovine Serum Albumin (BSA) | Sigma | B4287-25MG | |
| Cell strainer 40 μm | LabClinics | PLC93040 | |
| Deoxynucleotide triphosphate (dNTPs) | NZYTech | MB08701 | |
| Dimethyl sulfoxide (DMSO) | Sigma | D8418 | |
| Dulbecco’s Phosphate Saline Buffer (DPBS) | Gibco | 14080-055 | |
| Dulbecco's Modified Eagle's Medium (DMEM) F12 1:1 | Gibco | 11320-074 | |
| E. coli DH5α Competent Cells | ThermoFisher | EC0112 | |
| Earles's Balanced Salt Solution (EBSS) | Gibco | 24010-043 | |
| Epidermal Growth Factor - Human recombinant (EGF) | Gibco | 53003-018 | |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma | E-6511 | |
| Fine Forceps | Fine Science Tools | 11274-20 | |
| Fine Scissors Sharp | Fine Science Tools | 14060-09 | |
| Glucose | Sigma | G-7021 | |
| GoTaq G2 Flexi DNA Polymerase | Promega | M7805 | Kit includes reagents for PCR |
| Heparin | Sigma | H-3149 | |
| Insuline | Sigma | I6634 | |
| LB agar (Lennox) | LabKem | AGLB-00P-500 | |
| LB broth (Lennox) | LabKem | LBBR-00P-500 | |
| L-Cysteine | Sigma | C-8277 | |
| L-Glutamine | Gibco | 25030-024 | |
| Neubauer chamber | Blaubrand | BR718620 | |
| Nuclease free water | Labbox | WATR-00A-10K | |
| NZYMaxiprep Endotoxin Free Kit | NZYTech | MB39901 | |
| Papain Lyophilized | Worthington | LS003119 | |
| Progesterone | Sigma | P-6149 | |
| Putrescine | Sigma | P-7505 | |
| Scalpel | Fine Science Tools | 10316-14 | |
| shSCRAMBLE | Mission (Sigma) | SHC003 | |
| shSNRPN | Mission (Sigma) | TRCN0000109285 | |
| Sodium Selenite | Sigma | S-9133 | |
| Spatula | Fine Science Tools | 10090-17 | |
| Sterile PES Syringe Filters (0.22 μm pore-filter) | Epica | SFPE-22E-050 | |
| T12.5 cm2 Flask | Biofil | TCF012025 | |
| T25 cm2 Flask | LabClinics | PLC70025 | |
| T75 cm2 Flask | LabClinics | PLC70075 | |
| Tweezers | Fine Science Tools | 91150-20 |
References
- Gage, F. H. Mammalian neural stem cells. Science. 287 (5457), 1433-1438 (2000).
- Ming, G., Song, H. Adult neurogenesis in the mammalian central nervous system. Ann Rev Neurosci. 28 (1), 223-250 (2005).
- Doetsch, F., Caillé, I., Lim, D. A., García-Verdugo, J. M., Alvarez-Buylla, A. Subventricular zone astrocytes are neural stem cells in the adult mammalian brain. Cell. 97 (6), 703-716 (1999).
- Obernier, K., et al. Adult neurogenesis is sustained by symmetric self-renewal and differentiation. Cell Stem Cell. 22 (2), 221-234 (2018).
- Doetsch, F., García-Verdugo, J. M., Alvarez-Buylla, A. Regeneration of a germinal layer in the adult mammalian brain. Proc Natl Acad Sci. 96 (20), 11619-11624 (1999).
- Doetsch, F., García-Verdugo, J. M., Alvarez-Buylla, A. Cellular composition and three-dimensional organization of the subventricular germinal zone in the adult mammalian brain. J Neurosci. 17 (13), 5046-5061 (1997).
- Mamber, C., Kozareva, D. A., Kamphuis, W., Hol, E. M. Shades of gray: The delineation of marker expression within the adult rodent subventricular zone. Prog Neurobiol. 111, 1-16 (2013).
- Cebrian-Silla, A., et al. Single-cell analysis of the ventricular-subventricular zone reveals signatures of dorsal and ventral adult neurogenesis. eLife. 10, e67436 (2021).
- Reynolds, B. A., Weiss, S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science. 255 (5052), 1707-1710 (1992).
- Azari, H., Rahman, M., Sharififar, S., Reynolds, B. A. Isolation and expansion of the adult mouse neural stem cells using the neurosphere assay. J Vis Exp. (45), e2393 (2010).
- Jensen, J. B., Parmar, M. Strengths and limitations of the neurosphere culture system. Mol Neurobiol. 34 (3), 153-161 (2006).
- Ferrón, S. R., et al. Postnatal loss of Dlk1 imprinting in stem cells and niche astrocytes regulates neurogenesis. Nature. 475 (7356), 381-385 (2011).
- Gil-Perotín, S., et al. Adult neural stem cells from the subventricular zone: A review of the neurosphere assay. Anat Record. 296 (9), 1435-1452 (2013).
- Obernier, K., Alvarez-Buylla, A. Neural stem cells: origin, heterogeneity and regulation in the adult mammalian brain. Development. 146 (4), 156059 (2019).
- Ferrón, S. R., et al. A combined ex/in vivo assay to detect effects of exogenously added factors in neural stem cells. Nat Prot. 2 (4), 849-859 (2007).
- Ferron, S., et al. Telomere shortening and chromosomal instability abrogates proliferation of adult but not embryonic neural stem cells. Development. 131 (16), 4059-4070 (2004).
- Singec, I., et al. Defining the actual sensitivity and specificity of the neurosphere assay in stem cell biology. Nat Meth. 3 (10), 801-806 (2006).
- Santa-Olalla, J., Baizabal, J., Fregoso, M., Cárdenas, M. D. C., Covarrubias, L. The in vivo positional identity gene expression code is not preserved in neural stem cells grown in culture. Eur J Neurosci. 18 (5), 1073-1084 (2003).
- Pastrana, E., Silva-Vargas, V., Doetsch, F. Eyes wide open: A critical review of sphere-formation as an assay for stem cells. Cell Stem Cell. 8 (5), 486-498 (2011).
- Wan, F., et al. The utility and limitations of neurosphere assay, CD133 immunophenotyping and side population assay in Glioma stem cell research. Brain Pathol. 20 (5), 877-889 (2010).
- Deleyrolle, L. P., Rietze, R. L., Reynolds, B. A. The neurosphere assay, a method under scrutiny. Acta Neuropsych. 20 (1), 2-8 (2008).
- Campos, L. S. Neurospheres: Insights into neural stem cell biology. Neurosci Res. 78 (6), 761-769 (2004).
- Reynolds, B. A., Rietze, R. L. Neural stem cells and neurospheres—re-evaluating the relationship. Nat Meth. 2 (5), 333-336 (2005).
- Parker, M. A. Expression profile of an operationally-defined neural stem cell clone. Exp Neurol. 194 (2), 320-332 (2005).
- Belenguer, G., et al. Adult neural stem cells are alerted by systemic inflammation through TNF-α receptor signaling. Cell Stem Cell. 28 (2), 285-299 (2021).
- Cruz, M. T. G., Simões, S., Lima, M. C. P. de Improving lipoplex-mediated gene transfer into C6 glioma cells and primary neurons. Exp Neurol. 187 (1), 65-75 (2004).
- Hagemann, C., et al. High efficiency transfection of glioma cell lines and primary cells for overexpression and RNAi experiments. J Neurosci Meth. 156 (12), 194-202 (2006).
- Moritz, S., Lehmann, S., Faissner, A., Holst, A. von An induction gene trap screen in neural stem cells reveals an instructive function of the niche and identifies the splicing regulator Sam68 as a Tenascin-C-regulated target gene. Stem Cells. 26 (9), 2321-2331 (2008).
- Montalbán-Loro, R., et al. TET3 prevents terminal differentiation of adult NSCs by a non-catalytic action at Snrpn. Nat Comm. 10 (1), 1726 (2019).
- Gritti, A., et al. Epidermal and fibroblast growth factors behave as mitogenic regulators for a single multipotent stem cell-like population from the subventricular region of the adult mouse forebrain. J Neurosci. 19 (9), 3287-3297 (1999).
- Nieto-Estévez, V., Pignatelli, J., Araúzo-Bravo, M. J., Hurtado-Chong, A., Vicario-Abejón, C. A global transcriptome analysis reveals molecular hallmarks of neural stem cell death, survival, and differentiation in response to partial FGF-2 and EGF deprivation. PLoS One. 8 (1), 53594 (2013).
- Vergaño-Vera, E., Méndez-Gómez, H. R., Hurtado-Chong, A., Cigudosa, J. C., Vicario-Abejón, C. Fibroblast growth factor-2 increases the expression of neurogenic genes and promotes the migration and differentiation of neurons derived from transplanted neural stem/progenitor cells. Neuroscience. 162 (1), 39-54 (2009).
- Gabay, L., Lowell, S., Rubin, L. L., Anderson, D. J. Deregulation of dorsoventral patterning by FGF confers trilineage differentiation capacity on CNS stem cells in vitro. Neuron. 40 (3), 485-499 (2003).
- Hack, M. A., Sugimori, M., Lundberg, C., Nakafuku, M., Götz, M. Regionalization and fate specification in neurospheres: the role of Olig2 and Pax6. Mol Cell Neurosci. 25 (4), 664-678 (2004).
- Bithell, A., Finch, S. E., Hornby, M. F., Williams, B. P. Fibroblast growth factor 2 maintains the neurogenic capacity of embryonic neural progenitor cells in vitro but changes their neuronal subtype specification. Stem Cells. 26 (6), 1565-1574 (2008).
- Pastrana, E., Cheng, L. C., Doetsch, F. Simultaneous prospective purification of adult subventricular zone neural stem cells and their progeny. Proc Natl Acad Sci. 106 (15), 6387-6392 (2009).
- Kobayashi, N., et al. Gene delivery to embryonic stem cells. Birth Def Res C. 75 (1), 10-18 (2005).
- Gresch, O., Altrogge, L. Transfection of difficult-to-transfect primary mammalian cells. Meth Mol Biol. 801, 65-74 (2011).
- Maasho, K., Marusina, A., Reynolds, N. M., Coligan, J. E., Borrego, F. Efficient gene transfer into the human natural killer cell line, NKL, using the Amaxa nucleofection system. J Immunol Meth. 284 (1-2), 133-140 (2004).
- von Holst, A., Egbers, U., Prochiantz, A., Faissner, A. Neural stem/progenitor cells express 20 tenascin C isoforms that are differentially regulated by Pax6. J Biol Chem. 282 (12), 9172-9181 (2007).
- Woodard, L. E., Wilson, M. H. piggyBac-ing models and new therapeutic strategies. Trend Biotechnol. 33 (9), 525-533 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved