Method Article
מבחן במבחנה לחקר נדידת טסיות הדם באמצעות קשירה של אבידין-ביוטין מתפקדת RGD
In This Article
Summary
מסופק פרוטוקול מפורט להדמיית טסיות נודדות בודדות באמצעות קשירה של אבידין-ביוטין מתפקדת RGD עם צפיפות ניתנת לכוונון, וחושף כי טסיות הדם מייצרות מספיק כוח כדי לקרוע את הקשר אבידין-ביוטין.
Abstract
למרות היותם שברי תאים ללא גרעין, טסיות הדם מוכרות כיום ביכולותיהן הרב-גוניות. לא רק שהם יוצרים קרישי דם כדי למנוע דימום לאחר פציעה, אלא הם גם נלחמים בזיהומים ושומרים על שלמות כלי הדם במהלך מחלות דלקתיות. בעוד שתקעים המוסטטיים דורשים הפעלה וצבירה קולקטיבית של טסיות דם, תפקידם בהגנה על כלי דם מודלקים מבוצע ברמת התא הבודד. בהקשר זה, נתונים עדכניים הראו כי טסיות דם יכולות לנדוד באופן אוטונומי, תהליך התלוי בחישה המכנית של סביבת הדבק שלהן. כאן, מוצג פרוטוקול מפורט להדמיית נדידת טסיות בודדות, תוך שימוש במערכת ציפוי תלת שכבתית המורכבת מפולי-L-ליזין שתל פולי (אתילן גליקול) (PLL-PEG)-עמוד שדרה ביוטין (1), מקשר אבידין פלואורסצנטי (2), וביוטין-מחזורי Arg-Gly-Asp (cRGD) (3) כמוטיב קשירת אינטגרין טסיות הדם. גישה רדוקציוניסטית זו מאפשרת בקרה מדויקת על תכונות הידבקות הסובסטרט ומשמשת כבדיקה פשוטה וסטנדרטית במבחנה לחקר המנגנונים העומדים בבסיס נדידת טסיות הדם. התוצאות מצביעות על כך שטסיות נודדות הנקשרות ל-cRGD מפעילות כוחות המסוגלים לשבש את הקשר אבידין-ביוטין. יתר על כן, צפיפות הביוטין-cRGD משפיעה באופן משמעותי הן על התפשטות טסיות הדם והן על נדידת הטסיות.
Introduction
טסיות הן שברי תאים קטנים ללא גרעין שמקורם במגקריוציטים במח העצם. טסיות דם מופעלות מתאספות לאגרגטים המהווים בסיס לקריש דם כדי לאטום נגעים בכלי הדם בהמוסטזיס פיזיולוגי או לחסום כלי דם חולים בפקקת פתולוגית1. עם זאת, בעשורים האחרונים התברר כי טסיות הדם ממלאות תפקיד מרכזי גם בפתופיזיולוגיה של דלקת, זיהום וממאירות, כאשר אינטראקציות רב-פנים עם תאי חיסון, תאים סרטניים ופתוגנים פולשים הן קריטיות לעיצוב התגובה החיסונית של המארח 2,3. נתונים אחרונים הראו כי לטסיות יש את היכולת לנדוד באופן אוטונומי4. בתגובה לבקטרמיה מערכתית, טסיות הדם מגויסות לסינוסואידים בכבד, שם הן נדבקות ונודדות. הנדידה מאפשרת לטסיות ללכוד ולקשור חיידקים, מה שבתורו תומך בהפעלת לויקוציטים. יש לציין כי טסיות הדם נשארות תוך-וסקולריות במהלך תהליך זה ואינן נודדותלרקמה התת-אנדותלית. בנוסף, טסיות דם הן זקיפים של דלקת בכלי הדם, סורקות כלי דם מודלקים לאיתור פגיעות זעירות הנגרמות על ידי אקסטרווזן של תאי חיסון5 ומשתמשות בנדידה כדי להגן על כלי דם מודלקים 6,7. כאן, טסיות הדם משתמשות באינטגרינים שלהן כדי לקשור פיברינוגן המופקד על האנדותל המודלק. לאחר מכן טסיות הדם יוצרות בליטות למליפודיאליות המאפשרות להן לסרוק את תכונות ההדבקה של סביבתן. לאחר מכן טסיות הדם מקוטבות ונודדות לעבר צפיפות גבוהה יותר של פיברינוגן, תהליך המכונה הפטוטקסיס. נדידת טסיות מכוונת תומכת בסופו של דבר במיקום במיקרו-נגעים אנדותליים המונעים דימום ברקמות דלקתיות, כולל שרירים וריאות.
נדידת טסיות הדם תלויה באופן קריטי בתכונות המכניות של מצע הדבק 4,8. משימת החישה והתמרת התכונות המכניות של הסביבה מתווכת בעיקר על ידי קולטני אינטגרין, שהם חלבונים הטרודימריים טרנסממברניים המורכבים מתת-יחידה α ו-β כאשר התחום החוץ-תאי נקשר לליגנד על המטריצה החוץ-תאית והתחום התוך-תאי נקשר לשלד הציטו של אקטין באמצעות חלבוני מתאם 9,10. אינטגרין הטסיות הנפוץ ביותר הואα IIbβ3, והליגנד העיקרי שלו הוא פיברין (אוגן)11. מעורבות אינטגרין-ליגנד מפעילה אירועי איתות שמגיעים לשיאם ביצירת lamellipodium מונע Arp2/3 המהווה את הקצה המוביל של טסיתדם 7 דביקה. טסיות דבקות בוחנות באופן מיידי את התכונות המכניות של סביבת הדבק שלהן על ידי משיכתה4. כאשר כוחות משיכה תלויי מיוזין IIa מתגברים על היציבות המכנית של המטריצה החוץ-תאית (למשל, פיברין (אוגן)), טסיות הדם קורעות מכנית את הליגנדים המוחלשים ומשתמשות בבליטות הלמליפודיות שלהן כדי לסרוק את המיקרו-סביבה לאיתור ליגנדים דביקים, ליצור קשרי סובסטרט חדשים ולנדוד הרחק מהסביבה המדולדלת ליגנד6. נדידת תאים המונעת על ידי דלדול ליגנד מכני שאינו פרוטאוליטי עשויה לשחק תפקיד מעבר לתפקוד טסיות הדם, שכן נראה שמדובר בתופעה כללית שנצפתה בתאים המסוגלים לעצב מחדש מכנית את מטריצת הדבק שלהם8. קצב דלדול הליגנד קובע את מהירות הנדידה ותלוי הן ביציבות הליגנד והן בצפיפות הליגנד של המצע8. טסיות דם בצפיפות ליגנד נמוכה מסוגלות לשבש מכנית ליגנדים של אינטגרין מהונדסים (Arg-Gly-Asp (cRGD))6,7 הקשורים לכיסויי זכוכית עם קשירה של ביוטין-אבידין בעלת כוח לא מקשר של כ-160 פיקונוטון (pN)12,13,14,15.
כאן, תצפיות אלה מנוצלות לפיתוח פרוטוקול פשוט במבחנה ליצירת משטחי דבק ליגנד-לאביל, המקל על חקר מנגנוני נדידת טסיות הדם. ציפוי הדבק המתואר בפרוטוקול זה מורכב משלושה אלמנטים חיוניים: (1) עמוד שדרה PLL-PEG-ביוטין ו-(2) מקשר נויטרווידין-פלואורסצאין איזותיוציאנט (NA-FITC) המאפשר את הקישור של (3) ביוטין-cRGD (ליגנד דבק) לעמוד השדרה של PLL-PEG-ביוטין (ראה גם איור 1B). היציבות של מבנה זה תלויה בחוזק הקשר ביוטין-אבידין, שיכול להישבר בממשק (A) PLL-PEG-biotin-NA-FITC או (B) FITC-NA-biotin-cRGD. בנוסף, ניתן לכוונן את צפיפות הליגנדים הדביקים על ידי התאמת היחס בין PLL-PEG-ביוטין ל-PLL-PEG בשכבה התחתונה. שיבוש הקשר (A) מביא לשחרור FITC מהציפוי, מה שמוביל לירידה באות הקרינה מתחת לטסיות הנודדות. יחד, הציפוי המתואר בפרוטוקול זה, אם כן, מאפשר כוונון מדויק של תכונות המצע המכני והדבק ומספק קריאה קלה מבוססת פלואורסצנט של נדידת טסיות הדם.
Protocol
ניסויים בבעלי חיים שנערכו במחקר זה בוצעו בהתאם לכל התקנות האתיות הרלוונטיות למחקרים הכוללים עכברים ואושרו על ידי החקיקה המקומית להגנה על בעלי חיים (Regierung von Oberbayern, Munich, 190-15, 2015). במחקר זה נעשה שימוש בעכברים נקבות וזכרים C57BL/6, בני 8-10 שבועות (משקל גוף 20-25 גרם). פרטי הריאגנטים והציוד המשמשים מפורטים בטבלת החומרים.
1. ציפוי cRGD ביוטין-נויטרווידין-ביוטין
- כיסויי זכוכית סוניקטית (24 מ"מ x 24 מ"מ; # 1.5) בתוך 20% HNO3 למשך דקה אחת, ואחריהם סוניקציה בתוך איזופרופנול, אתנול ו-H2O למשך דקה אחת. לאחר כל סוניקציה, שטפו את הכיסויים במים מזוקקים (ddH2O) בהרחבה ולבסוף יבשו אותם בחממה.
- טפל בכיסויים שנוקו מראש עם פלזמה O2 במנקה פלזמה למשך 2 דקות, ולאחר מכן הרכיבו עם שקופיות דביקות כפי שתואר קודם לכן16. שקופיות דביקות וכיסויי זכוכית יהוו ערוץ ביניהם (כפי שמוצג באיור 1A).
הערה: טיפול יעיל בפלזמה חשוב. השתמש ב-O2 כמקור פלזמה. - מלאו את התעלה ב-2.5 מיקרוליטר של PLL-PEG-ביוטין (1 מ"ג/מ"ל) מדולל ב-97.5 מיקרוליטר של PLL-PEG (1 מ"ג/מ"ל) ודגרו במשך 30 דקות בטמפרטורת החדר (RT), ולאחר מכן שטפו שלוש פעמים עם PBS. PLL-PEG-ביוטין קושר נויטרווידין בשלב הבא, בעוד שעמוד השדרה PLL-PEG יוצר מצע אינרטי המונע קשירה לא ספציפית של חלבונים וטסיות דם.
הערה: ריכוז PLL-PEG-ביוטין בתמיסות הציפוי מגדיר את הצפיפות הסופית של ליגנדים cRGD. - הוסף 100 מיקרוליטר של Neutravidin-FITC (25 מיקרוגרם/מ"ל) ודגר במשך 30 דקות בחושך ב-RT, ולאחר מכן שטוף שלוש פעמים עם PBS.
הערה: התאם את ריכוז Neutravidin-FITC לריכוז PLL-PEG-biotin. הגדל את ריכוז Neutravidin-FITC אם מצופים צפיפות גבוהה יותר של PLL-PEG-ביוטין. - יש להוסיף 100 מיקרוליטר של ציקלו [Arg-Gly-Asp-D-Phe-Lys (ביוטין-PEG-PEG)] (cRGD-ביוטין) (0.1-1 מיקרומטר), לדגור למשך 30 דקות ב-RT ולשטוף שלוש פעמים עם PBS. כיסויים מוכנים לשימוש. סכימה של הציפוי מתוארת באיור 1B.
2. בידוד טסיות עכבר מהדם
- הכן את המאגר של Tyrode שונה, המכיל 136.9 מ"מ של NaCl, 12.1 מ"מ של NaHCO3, 2.6 מ"מ של KCl, 5.5 מ"מ של גלוקוז, 10 מ"מ של HEPES, והתאם את ה-pH ל-7.4 ו-6.5.
- להרדים את העכברים (בהתאם לפרוטוקולים שאושרו על ידי המוסד) על ידי הזרקה תוך-צפקית של 0.5 מ"ג/ק"ג פנטניל, 5 מ"ג/ק"ג מידזולם ו-0.05 מ"ג/ק"ג מדטומידין. לאחר אישור עומק ההרדמה באמצעות צביטת הבוהן, הסר את עור בית החזה בעזרת מספריים.
- הכן מזרק של 2 מ"ל (מחט 26 גרם) עם 150 מיקרוליטר חומצה-ציטראט-דקסטרוז (ACD) כנוגד קרישה. הכנס את המחט בין הצלעות השנייה והשלישית בצד שמאל של עצם החזה כדי לשאוב דם מהלב. לאחר מכן, המתת חסד של העכבר על ידי פריקת צוואר הרחם.
הערה: (1) הרכב מאגר ACD: 85 מ"מ של נתרן ציטראט טרי-בייסי מיובש ו-65 מ"מ של חומצת לימון מונוהידרט ב-111 מ"מ של גלוקוז. (2) שאיבת דם צריכה להיעשות בצורה חלקה כדי למנוע היווצרות קרישי דם. ניתן להשיג כ-1 מ"ל דם מעכברים בני 8-10 שבועות. - מערבבים את הדם עם 1 מ"ל של מאגר טירוד (pH 6.5) בצינור FACS של 5 מ"ל (תחתית עגולה מפוליסטירן), וצנטריפוגה ב-70 x גרם למשך 20 דקות ב-RT כשהבלם כבוי.
- לאחר צנטריפוגה, קח את החלק העליון (בסביבות 1 מ"ל) המכיל פלזמה עשירה בטסיות דם (PRP). יש לערבב עם 3 מ"ל של מאגר Tyrode (pH 6.5) ולהוסיף 100 ננוגרם/מ"ל פרוסטציקלין (PGI2) כדי למנוע הפעלת טסיות דם.
- צנטריפוגה ב-1200 x גרם למשך 5 דקות ב-RT, השליכו את הסופרנטנט, השעו מחדש את הגלולה ב-500 מיקרוליטר של מאגר טירוד (pH 6.5), ומדדו את ספירת הטסיות באמצעות המוציטומטר.
3. נדידת טסיות עכבר על ציפוי cRGD ביוטין-נויטרווידין-ביוטין
- השלם את המאגר של Tyrode המותאם (pH 7.4) עם 10 x 103/μL טסיות עכבר, 1 מ"מ של CaCl2, 2 מיקרומטר של U46619 ו-4 מיקרומטר של מלח נתרן אדנוזין 5′-דיפוספט (ADP), ופיפטה בנפח כולל של 240 מיקרוליטר לתעלות שהוכנו בשלב 1.
- הקלט נדידת טסיות חיות באמצעות מיקרוסקופ הפוך המצויד בחממת במה. לחלופין, דגרו את התעלה למשך שעה בטמפרטורה של 37 מעלות צלזיוס בחממה.
- תקן את הדגימה עם 4% פרפורמלדהיד למשך 10 דקות ב-RT ושטוף חמש פעמים עם PBS.
- חלחלו טסיות דם עם Triton-X (0.2% ב-PBS) למשך 5 דקות, ושטפו אותן חמש פעמים עם PBS.
- לדלל 2.5 מיקרוליטר של Alexa Fluor 594 phalloidin (מלאי מתנולי פי 40) ב-100 מיקרוליטר של PBS. דגרו עם טסיות דם למשך 30 דקות בחושך, ואז שטפו חמש פעמים עם PBS.
- דמיינו את השקופיות תחת מיקרוסקופ פלואורסצנטי.
4. כימות
הערה: טסיות הדם היוצרות פילופודיה (בליטות דמויות אצבע) או lamellipodia (בליטות דמויות יריעות) נספרו כטסיות דביקות4. טסיות עם מרחק נדידה של יותר מקוטר אחד הוגדרו כטסיות נודדות.
- חלק מהטסיות הנודדות: ספרו את מספרי ההידבקות או הנדידה של טסיות הדם בעזרת הכלי Multi Point בפיג'י. לחץ לחיצה ימנית על התפריט הנפתח של כלי הנקודה בסרגל הכלים כדי לבחור בכלי מרובה נקודות . חשב את חלק הטסיות הנודדות על ידי חלוקת מספר הטסיות הנודדות במספר טסיות הדם הדביקות.
- מרחק הנדידה הממוצע: חלץ את מרחק הנדידה מדגימות קבועות על ידי מדידת אורך נתיב הנדידה "המוטבע" בציפוי הנויטראווידין-FITC באמצעות הכלי Free Hand Line . לחץ לחיצה ימנית על התפריט הנפתח של קו ישר בסרגל הכלים כדי לבחור את קו יד חופשי כלי.
- מתארי צורת טסיות דם: צור מסכות בינאריות על ידי פילוח טסיות פלואורסצנטיות (Alexa594-Phalloidin) באמצעות פונקציית הסף . בחר Image > Adjust > Threshold בסרגל הכלים.
- ניתן להשיג מתארי צורה כגון שטח, היקף, מעגליות ויחס גובה-רוחב בניתוח חלקיקים. בחרו מתארי צורה ב'נתח > קבעו מידות', ולאחר מכן בחרו ' הצג תוצאות ' ב'נתח > נתח חלקיקים'.
תוצאות
טסיות מופעלות נדבקות ומתפשטות בקלות על שקופיות מצופות PLL-PEG-biotin-neutravidin-FITC-biotin-cRGD (איור 1C ואיור 2A; 0 דקות ו-5 דקות) ולאחר מכן מקוטבות על ידי יצירת lamellipodium בקצה המוביל (איור 2A; 10 דקות). במהלך התהליך הזה, הפסאודו-נוקלאוס (אזור כהה במרכז טסיות הדם) נע ממרכז הטסיות לחלק האחורי של הטסיות (איור 2A). טסיות מקוטבות מתחילות לנדוד ללא כיווניות ברורה (איור 2A; 15 דקות ו-20 דקות ואיור 2B). ראינו כי טסיות דם הנודדות על ציפוי PLL-PEG-biotin-neutravidin-FITC-biotin-cRGD יכולות לשבור את הקשר neutravidin-FITC-biotin-PLL-PEG, כפי שמעידה הירידה בעוצמת הקרינה לאורך נתיב הנדידה (איור 1C ואיור 2A,B). יתר על כן, קומפלקס הנויטרווידין-FITC-ביוטין-cRGD המופרע מצטבר על פני הטסיות (איור 2A,B). תופעה זו דומה לממצאים קודמים שבהם טסיות נודדות הסירו פיברינוגן מהמצע וצברו אותו בתוך מערכת התעלות הפתוחה שלהן (OCS)4.
כדי לחקור כיצד צפיפות הליגנד משפיעה על נדידת טסיות הדם, צפיפות ה-cRGD הותאמה על ידי שינוי היחס בין PLL-PEG-ביוטין ל-PLL-PEG בשכבת הציפוי הראשונה. נתונים אלה מגלים כי טסיות עכבר משיגות נדידה אופטימלית בריכוז של 2.5% של PLL-PEG-ביוטין. הנדידה מופחתת הן בריכוזים נמוכים יותר (1%) והן בריכוזים גבוהים יותר (10%) של PLL-PEG-ביוטין (איור 3A,B). שינויים תלויי סובסטרט אלה בהתנהגות הנדידה מלווים בשינויים במורפולוגיה של טסיות הדם (איור 3C). בצפיפות ליגנד נמוכה (1%), טסיות הדם אינן מתפשטות כראוי, כפי שמעידים שטח והיקף טסיות נמוך (איור 3C). זה מצביע על הפעלת אינטגרין לא מספקת ואיתות מבחוץ פנימה7. כתוצאה מכך, טסיות הדם אינן מסוגלות להפעיל כוחות על ליגנדות ה-cRGD, אינן מצליחות לעצב מחדש את המצע ואינן נודדות (איור 3A,B).
בצפיפות ליגנד בינונית (2.5%), יש עלייה משמעותית בשטח הטסיות ובהיקף (איור 3C). טסיות הדם מתפשטות ביעילות, משבשות מכנית את ליגנדות ה-cRGD הגמישות, ונודדות (איור 3A,B). עם זאת, בצפיפות ליגנד גבוהה (10%), למרות שההתפשטות עולה, טסיות הדם אינן מצליחות לקטב, מה שמסומן על ידי יחס גובה-רוחב מופחת (איור 3C). בתנאים אלה, טסיות הדם נשארות מחוברות למצע הדביק ואינן נודדות מכיוון שהן אינן יכולות לשבור את ליגנדות ה-cRGD הגמישות (איור 3A,B).
ממצאים אלה מדגימים כי נדידת טסיות הדם תלויה באופן קריטי בתכונות ההדבקה של המצע. טסיות דם יכולות לנדוד רק כאשר הן מתחברות מספיק עם ליגנדים דביקים ובמקביל מייצרות כוחות משיכה חזקים מספיק כדי להתגבר על סובלנות המתח של מצע הדבק 4,6,7,8.
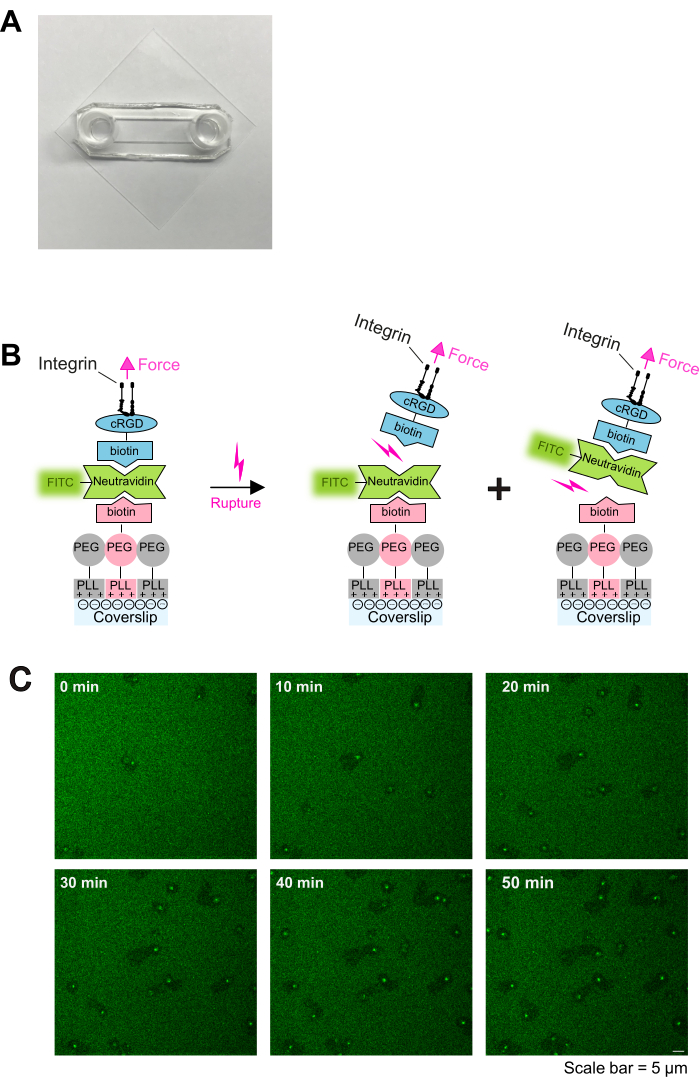
איור 1: הליך ציפוי והדמיה חיה של אינטראקציה בין טסיות למצע. (A) תצלום של התא המורכב. (ב) עקרון הפרוטוקול. משמאל: סכמטי של הציפוי. כיסויי זכוכית שטופלו בפלזמה צופו בשלוש שכבות. השכבה הראשונה היא התערובת של PLL-PEG ו-PLL-PEG-biotin (עמוד השדרה PLL-PEG אינרטי לתאים ומונע קשירה לא ספציפית). השכבה השנייה היא neutravidin-FITC, והשכבה השלישית היא biotin-cRGD. Neutravidin-FITC מגשר בין PLL-PEG-biotin ו-biotin-cRGD. טסיות הדם נקשרות לביוטין-cRGD באמצעות אינטגרינים בקרום הפלזמה. מימין: איור של ביטול קשירת ביוטין-אבידין על ידי אינטגרינים של טסיות דם. טסיות הדם מפעילות כוחות על המצע באמצעות מעורבות אינטגרין-cRGD וקורעות את הקשר העליון cRGD-ביוטין - neutravidin-FITC - או את הקשר התחתון neutravidin-FITC - PLL-PEG-biotin. קרע בקשר התחתון בין neutravidin-FITC לביוטין-PLL-PEG מביא לאות פלואורסצנטי מופחת, בעוד שקרע בקשר העליון בין biotin-cRGD ל-neutravidin-FITC לא. (C) סדרות זמן המציגות נדידת טסיות דם ודלדול של ליגנדים cRGD. אזורים של פלואורסצנטיות מופחתת מצביעים על מסלולי הנדידה של טסיות הדם (ראו גם איור 2A), ואזורים של פלואורסצנטיות מוגברת מצביעים על הצטברות FTIC-neutravidin-biotin-cRGD על טסיות נודדות. סרגל קנה מידה: 5 מיקרומטר. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 2: הדמיה אימונופלואורסצנטית של נדידת טסיות מקודדת על ידי המצע המחודש. (A) רצף סרטים מייצג של נדידת טסיות בודדות. משמאל: תמונות ניגודיות פאזה של טסיות דם נודדות. טסיות הדם מקוטבות על ידי יצירת lamellipodium בקצה המוביל ולאחר מכן נודדות. מימין: Neutravidin-FITC הוסר מהמצע, והשאיר את "טביעת הרגל" של נדידת טסיות הדם. קרע cRGD-ביוטין-neutravidin-FITC מצטבר במרכז טסיות הדם הנודדות. (B) תמונות מייצגות של נדידת טסיות דם על ציפוי cRGD-ביוטין-אבידין של ליגנד. עליון: טסיות דם מוכתמות בפאלואידין (Alexa FluorTM 594) הראו היווצרות למליפודיום גדולה וצורה מקוטבת המזכירה טסיות נודדות. טסיות נודדות קורעות את הקשר cRGD-ביוטין-נויטרווידין-FITC, ויוצרות מסלולי נדידה על המצע המסומנים על ידי אות FITC מופחת. תחתון: תמונה חתוכה עם הגדלה גדולה יותר. (C) מסלולי הנדידה שורטטו ידנית בפיג'י עם קווים צהובים. פסי קנה מידה: 5 מיקרומטר. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 3: היחס בין PLL-PEG-biotin ל-PLL-PEG קובע את נדידת הטסיות ואת צורתן. (A) תמונות מייצגות של טסיות דם על ציפויי PLL-PEG-biotin של 1%, 2.5% ו-10%, סרגל קנה מידה: 5 מיקרומטר. (B) כימות הידבקות טסיות הדם, יעילות הנדידה ומרחק הנדידה, n = 4 ניסויים בלתי תלויים; ממוצע/SD; ANOVA/Tukey חד כיווני; **עמ' < 0.01; עמ' < 0.001; p < 0.0001, ns: לא מובהק (C) כימות של מתארי צורת טסיות (שטח, היקף, מעגליות ויחס גובה-רוחב), n = 4 ניסויים בלתי תלויים; ממוצע/מינימום-מקסימום; ANOVA/Tukey חד כיווני; **עמ' < 0.01; עמ' < 0.001; p < 0.0001, ns: לא משמעותי. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
Discussion
בפרוטוקול זה, מוצג הליך ציפוי תלת שכבתי המורכב מ- (1) עמוד שדרה PLL-PEG-ביוטין ו- (2) מקשר נויטרווידין-FITC המאפשר קשירה של (3) ביוטין-cRGD (ליגנד דבק) לעמוד השדרה של PLL-PEG-ביוטין (ראה גם איור 1B) המאפשר כוונון מדויק של תכונות המצע המכני והדבק על ידי שינוי היחס בין PLL-PEG-ביוטין ל- PLL-PEG ומספק קריאה קלה מבוססת פלואורסצנטיות של נדידת טסיות הדם. בעוד שפרוטוקול זה משתמש בנייטרווידין מצומד FITC ובפלואידין מצומד Alexa Fluor 594 כדי לעקוב אחר נדידת טסיות הדם וצורתן, ניתן להשתמש באבידין ופלואידין מצומדים אחרים עם פלואורופור. מכיוון שכל ריאגנטים לציפוי, כולל PLL-PEG, PLL-PEG-ביוטין, נויטרווידין-פיטק ו-cRGD-ביוטין, כמו גם מפעילי טסיות הדם זמינים מסחרית, ניתן לבצע ניסוי זה ללא מאמץ נוסף רב. השלב הקריטי הוא הטיפול בפלזמה מכיוון שטיפול לא יעיל בפלזמה מוביל לקשירה לא מספקת של ביוטין PLL-PEG/PLL-PEG-למצע, וכתוצאה מכך לכישלון הידבקות טסיות הדם ונדידתם. הביצועים של שואב הפלזמה חשובים. באופן כללי, מנקי פלזמה עם גנרטורים של 13.6 מגה-הרץ מתפקדים טוב יותר מאלה עם 40 קילו-הרץ או 100 קילו-הרץ. בנוסף, מקור פלזמה של חמצן מתאים יותר מאוויר הסביבה. לאחר טיפול מוצלח בפלזמה, שלבי הציפוי כמעט ואינם מועדים לטעויות.
הוכח בעבר כי טסיות דם משתמשות במצב הנדידה המזנכימלי, התלוי מאוד בהידבקויות מצע 4,17. בדומה לפיברובלסטים, צפיפות ליגנד נמוכה מעכבת את הנדידה מכיוון שטסיות הדם מתקשות להיצמד למצע, בעוד שצפיפות ליגנד גבוהה מעכבת את הנדידה על ידי מניעת ניתוק הידבקויות מוצקות18 (איור 3). בצפיפות ביניים, טסיות הדם אכן נדבקות בעוד שכוחות משיכה תלויי מיוזין IIA לכל קשר אינטגרין עדיין מספיקים כדי לשבור הידבקויות. ראוי לציין כי הזיקה הגבוהה בין אינטגריןα IIbβ3 לבין הליגנד פיברין (אוגן) שלו גורמת לפירוק הידבקויות לא באמצעות שחרור הליגנד הדביק, אלא באמצעות קרע או ניתוק שלו מהמצע הבסיסי, כגון תאי אנדותל in vivo או כיסויים במבחנה 4,6. הכוח הבלתי מקשר הנדרש לניתוק פיברינוגן מהמצע הבסיסי מושפע מאוד מתכונות פיזיקליות וכימיות (ביולוגיות) שלעתים קרובות מאתגרות לשליטה, מה שעלול להוביל לשונות משמעותית ביעילות הנדידה. הבדיקה שהוצגה כאן מציעה גישה רדוקציוניסטית לטיפול בסוגיה זו. עם זאת, כוח השבירה של קשר אבידין-ביוטין קבוע בסביבות 160 pN, ולכן יש להשתמש בחיישני מתח מתוחכמים יותר, כגון אלה המבוססים על קשירת DNA דו-גדילית, כדי לחקור הידבקות טסיות במשטרי כוח נמוכים יותר19.
מחקרים קודמים מצאו כי נדידת טסיות דם מעורבת בזיהום חיידקי ודלקת כלי דם in vivo. כתוצאה מכך, טסיות דם עם פגמי נדידה, כגון פגיעה בהתכווצות המיוזין, פילמור אקטין או איתות אינטגרין מבחוץ, מראות פגיעה בפינוי החיידקים ובשלמות כלי הדם 4,6,7. הבדיקה המוצגת כאן היא פשוטה, יציבה, ולכן מתאימה לסינון מעכבים מולקולריים קטנים והשפעותיהם על נדידת טסיות הדם. הוא מספק כלי חדש במבחנה לחקר מטרות טיפוליות בדלקת או פקקת.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי ה-Deutsche Forschungsgemeinschaft (DFG; קרן המחקר הגרמנית) מספרי הפרויקט 514478744 ו-514477451 ל-F.G. הפרויקט ממומן על ידי האיחוד האירופי (ERC, MEKanics, 101078110). ההשקפות והדעות המובעות הן של המחבר בלבד ואינן משקפות בהכרח את אלה של האיחוד האירופי או הסוכנות המבצעת של מועצת המחקר האירופית. לא האיחוד האירופי ולא הרשות המעניקה לא יכולים לשאת באחריות להם.
Materials
| Name | Company | Catalog Number | Comments |
| Adenosine 5′-diphosphate sodium salt (ADP) | Sigma-Aldrich | A2754 | |
| Alexa Fluor 594 phalloidin | Thermofisher | A12381 | |
| Blood counter | Sysmex | XN-1000 | |
| Bottomless 6 channel sticky slide | IBIDI, sticky slides VI0.4 | 80608 | |
| Centrifuge | Eppendorf | 5804 | |
| Confocal microscope | Zeiss | LSM880 | |
| cyclo [Arg-Gly-Asp-D-Phe-Lys(Biotin-PEG-PEG)] | Peptide international | PCI-3697-PI | |
| FACS tubes | Corning Brand | 352052 | |
| FITC conjugate neutravidin | Thermofisher | A2662 | |
| Formaldehyde | Thermofisher | 28908 | |
| HEPES solution | Sigma-Aldrich | H0887 | |
| Phase contrast and epifluorescent microscope | Olympus | IX83 | |
| Plasma cleaner | Diener | 116531 | |
| PLL(20)-g[3.5]-PEG(2)/PEG(3.4)-biotin(50%) | Susos | PLL(20)-g[3.5]-PEG(2)/PEG(3.4)-biotin (50%) | |
| Poly(L-lysine)-graft-poly(ethylene glycol) co-polymer | Susos | PLL(20)-g[3.5]-PEG(2) | |
| Prostaglandin I2 sodium salt (PGI2) | Abcam | ab120912 | |
| Sonicator | BANDELIN | SONNOREX RK514M | |
| Ttriton X-100 20% v/v | Cayman Chemical | 600217 | |
| U46619 | Enzo Life Sciences | BML-PG023-0001) |
References
- Jackson, S. P. Arterial thrombosis--insidious, unpredictable and deadly. Nat Med. 17, 1423-1436 (2011).
- Kaiser, R., Escaig, R., Nicolai, L. Hemostasis without clot formation: how platelets guard the vasculature in inflammation, infection, and malignancy. Blood. 142 (17), 1413-1425 (2023).
- Gaertner, F., Massberg, S. Patrolling the vascular borders: Platelets in immunity to infection and cancer. Nat Rev Immunol. 19 (12), 747-760 (2019).
- Gaertner, F., et al. Migrating platelets are mechano-scavengers that collect and bundle bacteria. Cell. 171 (6), 1368-1382.e23 (2017).
- Gros, A., et al. Single platelets seal neutrophil-induced vascular breaches via GPVI during immune-complex-mediated inflammation in mice. Blood. 126 (8), 1017-1026 (2015).
- Nicolai, L., et al. Vascular surveillance by haptotactic blood platelets in inflammation and infection. Nature Comm. 11, 5778 (2020).
- Kaiser, R., et al. Mechanosensing via a GpIIb/Src/14-3-3zeta axis critically regulates platelet migration in vascular inflammation. Blood. 141 (24), 2973-2992 (2023).
- Sarkar, A., LeVine, D. N., Kuzmina, N., Zhao, Y., Wang, X. Cell migration driven by self-generated integrin ligand gradient on ligand-labile surfaces. Curr Biol. 30 (20), 4022-4032 (2020).
- Hynes, R. O. Integrins: Bidirectional, allosteric signaling machines. Cell. 110 (6), 673-687 (2002).
- Kechagia, J. Z., Ivaska, J., Roca-Cusachs, P. Integrins as biomechanical sensors of the microenvironment. Nat Rev Mol Cell Biol. 20, 457-473 (2019).
- Shattil, S. J., Newman, P. J. Integrins: Dynamic scaffolds for adhesion and signaling in platelets. Blood. 104 (6), 1606-1615 (2004).
- Yuan, C., Chen, A., Kolb, P., Moy, V. T. Energy landscape of streptavidin-biotin complexes measured by atomic force microscopy. Biochemistry. 39 (33), 10219-10223 (2000).
- Florin, E. L., Moy, V. T., Gaub, H. E. Adhesion forces between individual ligand-receptor pairs. Science. 264 (5157), 415-417 (1994).
- Merkel, R., Nassoy, P., Leung, A., Ritchie, K., Evans, E. Energy landscapes of receptor-ligand bonds explored with dynamic force spectroscopy. Nature. 397, 50-53 (1999).
- Jurchenko, C., Chang, Y., Narui, Y., Zhang, Y., Salaita, K. S. Integrin-generated forces lead to streptavidin-biotin unbinding in cellular adhesions. Biophys J. 106 (7), 1436-1446 (2014).
- Fan, S., Lorenz, M., Massberg, S., Gaertner, F. Platelet migration and bacterial trapping assay underflow. Bio-Protocol. 8 (18), e3018 (2018).
- Lauffenburger, D. A., Horwitz, A. F. Cell migration: A physically integrated molecular process. Cell. 84 (3), 359-369 (1996).
- Palecek, S. P., Loftus, J. C., Ginsberg, M. H., Lauffenburger, D. A., Horwitz, A. F. Integrin-ligand binding properties govern cell migration speed through cell-substratum adhesiveness. Nature. 385, 537 (1997).
- Zhao, Y., Wetter, N. M., Wang, X. Imaging integrin tension and cellular force at submicron resolution with an integrative tension sensor. J Vis Exp. (146), e59476 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved