A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
ייצור תחמוצת גרפן אנטיבקטריאלית/ננו-מרוכבים נחושת
In This Article
Summary
כאן, אנו מציגים תחמוצת גרפן/נחושת (GO/Cu) ננו-מרוכבים כננו-חומר אנטיבקטריאלי. היעילות האנטי-בקטריאלית של ננו-מרוכבים GO/Cu הוערכה הן כנגד חיידקים גראם-חיוביים והן נגד חיידקים גראם-שליליים עמידים לאנטיביוטיקה.
Abstract
אנטיביוטיקה היא כיום הטיפול האנטיבקטריאלי הנפוץ ביותר להרג חיידקים. עם זאת, חיידקים מפתחים עמידות כאשר הם נחשפים יתר על המידה לאנטיביוטיקה. פיתוח חומרים אנטי-מיקרוביאליים שיכולים להחליף אנטיביוטיקה קיימת הוא חיוני מכיוון שלחיידקים עמידים לאנטיביוטיקה יש מנגנוני עמידות לכל האנטיביוטיקות הנוכחיות והם יכולים לקדם זיהומים נוסוקומיאליים. כדי להתמודד עם אתגר זה, במחקר זה, אנו מציעים ננו-מרוכבים של תחמוצת גרפן/נחושת (GO/Cu) כחומרים אנטי-בקטריאליים שיכולים להחליף את האנטיביוטיקות הקיימות. ננו-מרוכבים GO/Cu מאופיינים במיקרוסקופ אלקטרונים תמסורת ומיקרוסקופ אלקטרונים סורק. הם מראים כי ננו-חלקיקי נחושת (Cu) גדלים היטב על יריעות תחמוצת הגרפן. בנוסף, שיטת מרק microdilution משמש כדי לאשר את היעילות של החומר האנטי-מיקרוביאלי נגד Staphylococcus aureus עמיד למתיצילין (MRSA) ו Pseudomonas aeruginosa (P. aeruginosa), אשר מעורבים לעתים קרובות זיהומים nosocomial. באופן ספציפי, 99.8% של MRSA ו-84.7% של P. aeruginosa מסולקים על-ידי 500 מיקרוגרם/מ"ל של ננו-מרוכבים GO/Cu. ננו-מרוכבים מתכתיים יכולים לחסל חיידקים עמידים לאנטיביוטיקה על ידי שחרור יונים, יצירת מיני חמצן תגובתיים ופגיעה פיזית בחיידקים. מחקר זה מדגים את הפוטנציאל של ננו-מרוכבים GO/Cu אנטיבקטריאליים בחיסול חיידקים עמידים לאנטיביוטיקה.
Introduction
לזיהומים חיידקיים יש השפעה משמעותית על בריאות הציבור. חיידקים פתוגניים, בפרט, יכולים לחמוק ממנגנוני ההגנה של הגוף ולגרום למחלות1. אנטיביוטיקה נמצאים בשימוש נרחב לטיפול בזיהומים חיידקיים. עם זאת, השימוש הבלתי הולם באנטיביוטיקה זירז את הופעתם של חיידקים עמידים לאנטיביוטיקה. נכון לעכשיו, זיהומים nosocomial המיוחסים חיידקים עמידים לאנטיביוטיקה גרמו סיבוכים בולטים במתקני בריאות2. למרבה הצער, לחיידקים יש מנגנוני עמידות לכל האנטיביוטיקות הנוכחיות3. לכן, פיתוח אנטיביוטיקה חדשה הוא חיוני, אם כי קיימת גם סבירות גבוהה להיווצרות מנגנוני עמידות.
ננו-חלקיקי מתכת התגלו כסוכנים מבטיחים למאבק בחיידקים עמידים לאנטיביוטיקה בגלל התכונות האנטיבקטריאליות היעילות שלהם 4,5,6. קשה לחיידקים לפתח מנגנוני עמידות נגד ננו-חלקיקי מתכת מאחר שהם אינם נקשרים לקולטני חיידקים ספציפיים7. בפרט, חלקיקי כסף, נחושת ותחמוצת אבץ נמצאים במוקד מחקר מקיף בגלל יעילותם האנטיבקטריאלית יוצאת הדופן 8,9,10,11,12,13. הרעילות של ננו-חלקיקי מתכת כלפי חיידקים מיוחסת לשלושה מנגנונים עיקריים: 1) שחרור יוני מתכת, 2) יצירת מיני חמצן תגובתי (ROS), כגון •OH ו-•O2-, ו-3) אינטראקציה פיזית והתקשרות 4,14.
במחקר זה, ננו-מרוכבים של תחמוצת גרפן/נחושת (GO/Cu) פותחו כחומר אנטי-מיקרוביאלי. נחושת (Cu) הורגת ביעילות פתוגנים הפוגשים את פני השטח שלה ומפריעה לשכפול גנים חיידקיים. עם זאת, זהו מיקרואלמנט חיוני בגוף האדם, והוא פחות רעיל לתאי יונקים מכיוון שיש לו מנגנונים הומיאוסטטיים המווסתים את ריכוזי Cu בתוך התאים4. כאשר ננו-חלקיקי Cu מחומצנים, הם מייצרים יוני Cu, שיש להם זיקה גבוהה יחסית לחיידקים בעלי מטען שלילי15,16. יוני Cu נקשרים למבנים התאיים (למשל, חלבונים, ממברנות ודנ"א), ומשבשים את תפקודי התא17. על ידי סינתזה של ננו-חלקיקי Cu על פני השטח של תחמוצת גרפן (GO), ניתן לשלוט בקצב השחרור של יוני מתכת 18,19,20. GO מראה גם השפעה אנטיבקטריאלית על ידי מניעת הידבקות חיידקים עם משטח מחוספס באמצעות עקה חמצונית או על ידי יצירת ROS21,22. יתר על כן, ננו-מרוכבים GO/Cu משחררים יותר ROS מאשר GO באמצעות הפעולה הכימית של Cu2+, אשר פוגעת בחלבונים חיידקיים ובדנ"א, מה שמוביל למוות של חיידקים23,24.
מאמר זה מתאר את הפרוטוקול לסינתזה של ננו-מרוכבים GO/Cu ומציג גישת בדיקה אנטי-מיקרוביאלית נגד חיידקים קליניים MRSA ו-P. aeruginosa, זני החיידקים העמידים הרב-תרופתיים הנפוצים ביותר הגורמים לזיהומים נוסוקומיאליים25. פרוטוקול זה נועד להציג שיטת הפחתה כימית קלה לסינתזה של ננו-מרוכבים GO/Cu שיכולים לעכב את הצמיחה של חיידקים עמידים לאנטיביוטיקה. אנו משתמשים בנחושת (II) כלוריד (CuCl2) ובנתרן בורוהידריד (NaBH4) כקודמן וכחומר מחזרים, בהתאמה. הפרוטוקול מתאר גם את הפרטים של יישום ננו-מרוכבים אלה על חיידקים באמצעות שיטת מרק מיקרודילוטין. כדי למנוע טעויות הנובעות מהפרעות הספיגה של ננו-חלקיקי מתכת ולבצע הערכות מדויקות, היכולת האנטיבקטריאלית מוערכת באמצעות שיטת ספירת המושבות.
Protocol
1. הכנת ננו-מרוכבים GO/Cu
הערה: הגודל והמורפולוגיה של חלקיקי Cu הגדלים על ננו-יריעות GO נקבעים על ידי מידת חמצון GO, ריכוז קודמן Cu וריכוז החומר המחזר26.
- הכינו 10 מ"ל של תרחיף GO 1 מ"ג/מ"ל בבקבוק זכוכית. סוניק את מתלי GO למשך שעה אחת עד ש-GO מתפזר היטב במים מזוקקים (DI).
- הכינו תמיסת CuCl2 20 מ"מ בבקבוקון זכוכית. סוניק את תמיסת CuCl2 עד ש-CuCl2 מתפזר היטב במי DI.
- הוסף 10 מ"ל של תמיסת 20 mM CuCl2 לתמיסת GO והפעל את התערובת ב- 70 ° C למשך שעה אחת.
- הכינו תמיסת NaBH4 של 20 mM.
אזהרה: הליך זה חייב להתבצע במכסה אדים כימי. תגובת חמצון-חיזור מתרחשת ברגע שהחומר המחזר NaBH4 מוכנס למים. הכינו את תמיסת NaBH4 מיד לפני הניסוי. - הכנת תערובת של NaBH4, GO ו-CuCl2
- הוסף 20 מ"ל של תמיסת NaBH4 20 mM לתערובת GO ו- CuCl2 תוך ערבוב עם פס מגנטי ב- 200 סל"ד. לאחר הוספת תמיסת NaBH4 , ערבבו ברציפות במשך 30 דקות.
אזהרה: הליך זה חייב להתבצע במכסה אדים כימי.
- הוסף 20 מ"ל של תמיסת NaBH4 20 mM לתערובת GO ו- CuCl2 תוך ערבוב עם פס מגנטי ב- 200 סל"ד. לאחר הוספת תמיסת NaBH4 , ערבבו ברציפות במשך 30 דקות.
- צנטריפוגה של התערובת
- העבירו את התערובת משלב 1.5.1 לצינור צנטריפוגה. צנטריפוגה את התמיסה ב 23,000 × גרם במשך 10 דקות בטמפרטורת החדר. השליכו את הסופרנטנט.
זהירות: בעת הפעלת הצנטריפוגה, יש לשמור תמיד על איזון על ידי הנחת צינורות בעלי משקל שווה.
- העבירו את התערובת משלב 1.5.1 לצינור צנטריפוגה. צנטריפוגה את התמיסה ב 23,000 × גרם במשך 10 דקות בטמפרטורת החדר. השליכו את הסופרנטנט.
- השהה מחדש את התערובת הננו-מרוכבת GO/Cu עם 10 מ"ל של מי DI וסוניק אותם כדי לאפשר למשקע להתפזר באופן שווה לאורך התמיסה.
- צנטריפוגה התמיסה ב 23,000 × גרם במשך 10 דקות בטמפרטורת החדר; ואז להסיר את supernatant.
- חזור על שלבים 1.7-1.8 פעם נוספת כדי להסיר את הכימיקלים הבלתי מגיבים.
- הוסף 1 מ"ל מים מזוקקים לננו-מרוכבים GO/Cu וסוניק את התערובת כדי לפזר את המשקעים באופן שווה לאורך הפאזה הנוזלית.
הערה: אסוף את כל התמיסות הננו-מרוכבות של GO/Cu בצינור חרוטי אחד. - יבשו בהקפאה את התמיסה בטמפרטורה של -60°C תחת ואקום למשך הלילה עד שהננו-מרוכבים של GO/Cu יתייבשו לחלוטין ויקבלו אבקת GO/Cu nanocomposite.
- אחסנו את האבקה הננו-מרוכבת GO/Cu בטמפרטורה של -20°C עד לשימוש.
2. הכנת חיידקים לבדיקה האנטיבקטריאלית
זהירות: הליך זה חייב להתבצע בארון בטיחות ביולוגי עם מנורת אלכוהול. פסולת חיידקית חייבת להיות autoclaved לפני השלכה. בעת טיפול בחיידקים עמידים לאנטיביוטיקה, יש ללבוש כפפות, חלוקים ומסכות, ולשטוף ידיים באמצעות סבון או חומר לחיטוי ידיים לאחר הניסוי. תמיד לחטא ביסודיות; אם מתרחש זיהום באזור הניסוי, מיד לחטא אותו עם 70% אתנול.
- הכנת מדיה לתרבית חיידקים
- מערבבים 20 גרם של אגר סויה טריפטי ו 500 מ"ל של מים מזוקקים בצלוחית. לעקר את התערובת ב autoclave ב 121 ° C במשך 15 דקות.
- מכינים את צלחת האגר על ידי מזיגת 15 מ"ל מתמיסת האגר לצלחת פטרי לפני שהאגר מתקשה. אחסנו את צלחת האגר בטמפרטורה של 4°C עד לשימוש.
הערה: יש לעשות זאת במהירות לפני שתמיסת האגר מתקשה. כדי למנוע זיהום, לעקר את צלחת אגר עם UV במשך 15 דקות במהלך התקשות. - מערבבים 15 גרם של מרק סויה טריפטי (TSB) ו 500 מ"ל של מים מזוקקים בצלוחית. לעקר את התערובת ב autoclave ב 121 ° C במשך 15 דקות.
- Aliquot 40-50 מ"ל של תמיסת המרק לתוך צינור חרוטי 50 מ"ל. אחסנו את המרק ב-4°C עד לשימוש.
הערה: כדי למנוע זיהום, לעקר את המרק aliquoted עם UV במשך 15 דקות.
- תרבית חיידקים
- חסן את תמיסת מלאי MSRA או P. aeruginosa על צלחת האגר באמצעות לולאה. דוגרים על צלחת האגר ב 37 מעלות צלזיוס באמצעות אינקובטור רועד במשך 24 שעות.
- לחסן מושבה אחת של החיידקים לתוך 10 מ"ל של המרק באמצעות לולאה. לדגור על המרק ב 37 ° C באמצעות אינקובטור רועד ב 200 סל"ד במשך 24 שעות.
- חזור על שלבים 2.2.1-2.2.2 פעם נוספת כדי להשיג חיידקים עם אותם מאפיינים.
- לאחר 24 שעות, מדללים סדרתית את תמיסת החיידקים פי עשרה באמצעות מים מזוקקים סטריליים. חסן 100 μL של תרחיף חיידקי מדולל על צלחת אגר ולהפיץ אותו עם מפזר. דוגרים על צלחת האגר ב 37 מעלות צלזיוס באמצעות אינקובטור רועד במשך 24 שעות.
הערה: רמת הדילול תלויה בחיידק. המטרה היא להכין פחות מ -100 מושבות בצלחת אגר. - ספרו את מושבות החיידקים לאחר הדגירה של 24 שעות כדי לקבוע את היחידה יוצרת-המושבה (CFU) באמצעות משוואה (1).
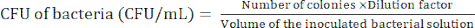 (1)
(1) - חזור על שלבים 2.2.4-2.2.5 לפחות 3x כדי לוודא אם CFU של החיידקים הוא קבוע יחסית.
3. בדיקה אנטיבקטריאלית בשיטת מרק מיקרודילוציה
- יום 1) לחסן מושבה אחת של החיידקים מצלחת האגר לתוך 10 מ"ל של המרק באמצעות לולאה. לדגור על המרק ב 37 ° C באמצעות אינקובטור רועד ב 200 סל"ד במשך 24 שעות.
- יום 2) הכינו את התערובת הננו-מרוכבת GO/Cu בשלושה ריכוזים לפחות באמצעות מלח חוצץ פוספט (DPBS) של Dulbecco. הפעל את המתלים הננו-מרוכבים של GO/Cu עד שהננו-מרוכבים של GO/Cu יתפזרו היטב ב-DPBS.
הערה: בפרוטוקול זה נבדקו 500, 250, 125 ו-62.5 מיקרוגרם/מ"ל של תערובת הננו-מרוכבים GO/Cu. - הכן את פתרונות הבקרה. הבקרה השלילית היא DPBS, והבקרה החיובית היא 1% מתמיסת פניצילין/סטרפטומיצין ב-DPBS שתהרוג את החיידקים.
- הוסף 100 μL של המתלים הננו-מרוכבים GO/Cu ואת פתרונות הבקרה ללוחות בעלי 96 בארות. הוסף את כל הדגימות במשולש.
הערה: יש לעקר דגימות עם UV למשך 15 דקות לפני החלתן על חיידקים. - מבוסס על CFU לאחר 24 שעות של דגירה, לדלל את תרחיף החיידקים באמצעות TSB ל 1 × 106 CFU/mL.
הערה: ריכוזי התרחיף הראשוניים של תרבית MRSA ו-P. aeruginosa במחקר שלנו, לפי שלב 2.2.5, הם 4.5 ×-109 CFU/mL ו-3 × 109 CFU/mL, בהתאמה. ריכוזי חיידקים של 1 × 106 CFU/mL מתקבלים על ידי דילול התרביות 4,500x ו- 3,000x, בהתאמה. - חסן 100 μL של 1 × 106 CFU/mL תרחיף חיידקי מדולל לתוך בארות הדגימה בלוחות 96 בארות. לדגור על לוחות 96 בארות ב 37 ° C באמצעות אינקובטור רועד ב 200 סל"ד במשך 24 שעות.
הערה: הריכוז הסופי של חיידקים הוא 5 × 105 CFU / מ"ל לאחר ערבוב עם 100 μL של דגימה. - יום 3) ערבבו במרץ את הדגימה ואת תרחיף החיידקים עם קצה מיקרופיפטה של 200 מיקרוליטר. מדללים באופן סדרתי את תערובת הדגימה-חיידקים פי עשרה במים מזוקקים סטריליים.
הערה: רמת הדילול תלויה בחיידק. המטרה היא להכין פחות מ -100 מושבות בצלחת אגר. - חסן 100 μL של תרחיף חיידקי מדולל על צלחת אגר ולהפיץ אותו עם מפזר. דוגרים על צלחת האגר ב 37 מעלות צלזיוס באמצעות אינקובטור רועד במשך 24 שעות.
- יום 4) ספור את מושבות החיידקים וקבע את ערכי CFU כדי לאשר את הפעילות האנטיבקטריאלית של ננו-מרוכבים GO/Cu באמצעות משוואה (2).
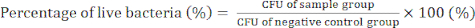 (2)
(2)
תוצאות
מיקרוסקופ אלקטרונים תמסורת (TEM), מיקרוסקופ אלקטרונים סורק (SEM) וספקטרוסקופיית קרני רנטגן מפזרת אנרגיה (EDS) בוצעו כדי לאשר את היווצרותם של ננו-מרוכבים GO/Cu. איור 1A,B מראה שננו-חלקיקי Cu הטרוגניים גדלו על יריעות GO. כפי שניתן לראות באיור 1C...
Discussion
כאן, אנו מדווחים על שיטה זולה ופשוטה להכנת ננו-יריעות GO שהושקעו עם ננו-חלקיקי Cu, אשר תהיה שיטה יעילה פוטנציאלית לחיסול חיידקים עמידים לאנטיביוטיקה. השלב הקריטי בסינתזה של ננו-מרוכבים GO/Cu הוא פיזור יסודי של GO ו-CuCl2 בתמיסה ושמירה על טמפרטורה גבוהה תוך כדי ערבובם. יתר ע?...
Disclosures
ד"ר ג'ונגהון צ'וי הוא המנכ"ל/מייסד, וד"ר יונג-היון צ'וי הוא ה-CTO של מכון פיינמן לטכנולוגיה בתאגיד הננו-רפואה.
Acknowledgements
מחקר זה נתמך על ידי מענק המחקר של אוניברסיטת צ'ונג-אנג בשנת 2022 (במהלך חופשת השבתון של פרופסור ג'ונגהון צ'וי). מחקר זה נתמך גם על ידי תוכנית המחקר המדעי הבסיסי באמצעות קרן המחקר הלאומית של קוריאה (NRF), במימון משרד החינוך (No. RS-2023-00275006), ומענק המכון הקוריאני לסביבה, תעשייה וטכנולוגיה (KEITI) במימון המשרד לאיכות הסביבה של קוריאה (MOE) (מס' 2022002980003). MRSA קליני ו - P. aeruginosa התקבלו מבית החולים האוניברסיטאי Chung-Ang.
Materials
| Name | Company | Catalog Number | Comments |
| Antibiotic-Antimycotic | Gibco | 15240062 | |
| Clinical MDR bacterial strains | Chung-Ang University Hospital (Seoul, South Korea) | ||
| Copper(II) chloride dihydrate | Duksan | 10125-13-0 | |
| Field Emission Scanning Electron Microscope (FE-SEM) | Carl Zeiss | SIGMA | |
| Graphene oxide | Sigma | 796034 | |
| Sodium Borohydride | Sigma | 71320 | |
| Transmission Electron Microscopy (TEM) | JEOL | JEM-2100 | |
| Tryptic Soy Agar | BD difco | 236950 | |
| Tryptic Soy Broth | BD difco | 211825 |
References
- Doron, S., Gorbach, S. L. Bacterial infections: Overview. International Encyclopedia of Public Health. , 273-282 (2008).
- Van Duin, D., Paterson, D. L. Multidrug-resistant bacteria in the community: An update. Infect Dis Clin North Am. 34 (4), 709-722 (2020).
- Blair, J. M. A., Webber, M. A., Baylay, A. J., Ogbolu, D. O., Piddock, L. J. V. Molecular mechanisms of antibiotic resistance. Nat Rev Microbiol. 13 (1), 42-51 (2015).
- Sánchez-López, E., et al. Metal-based nanoparticles as antimicrobial agents: An overview. Nanomaterials (Basel). 10 (2), 292 (2020).
- Makabenta, J. M. V., et al. Nanomaterial-based therapeutics for antibiotic-resistant bacterial infections. Nat Rev Microbiol. 19 (1), 23-36 (2021).
- Liang, X., Govindaraju, S., Yun, K. Dual applicability of polyaniline coated gold nanorods: A study of antibacterial and redox activity. BioChip J. 12 (2), 137-145 (2018).
- Niño-Martínez, N., Salas Orozco, M. F., Martínez-Castañón, G. A., Torres Méndez, F., Ruiz, F. Molecular mechanisms of bacterial resistance to metal and metal oxide nanoparticles. Int J Mol Sci. 20 (11), 2808 (2019).
- Kim, J., Choi, Y., Park, J., Choi, J. Gelatin-gallic acid microcomplexes release go/cu nanomaterials to eradicate antibiotic-resistant microbes and their biofilm. ACS Infect Dis. 9 (2), 296-307 (2023).
- Jang, J., et al. Development of antibiofilm nanocomposites: Ag/cu bimetallic nanoparticles synthesized on the surface of graphene oxide nanosheets. ACS Appl Mater Interfaces. 12 (32), 35826-35834 (2020).
- Jang, J., Choi, Y., Tanaka, M., Choi, J. Development of silver/graphene oxide nanocomposites for antibacterial and antibiofilm applications. J Ind Eng Chem. 83, 46-52 (2020).
- Bankier, C., et al. Synergistic antibacterial effects of metallic nanoparticle combinations. Sci Rep. 9 (1), 16074 (2019).
- Mendes, C. R., et al. Antibacterial action and target mechanisms of zinc oxide nanoparticles against bacterial pathogens. Sci Rep. 12 (1), 2658 (2022).
- Yoon, S., et al. Biologically benign multi-functional mesoporous silica encapsulated gold/silver nanorods for anti-bacterial applications by on-demand release of silver ions. BioChip J. 13 (4), 362-369 (2019).
- Slavin, Y. N., Asnis, J., Häfeli, U. O., Bach, H. Metal nanoparticles: Understanding the mechanisms behind antibacterial activity. J Nanobiotechnology. 15 (1), 65 (2017).
- Ismail, N. A., et al. Sonochemical synthesis of a copper reduced graphene oxide nanocomposite using honey and evaluation of its antibacterial and cytotoxic activities. Front Mol Biosci. 9, 995853 (2022).
- Tu, Y., et al. Remarkable antibacterial activity of reduced graphene oxide functionalized by copper ions. Adv Funct Mater. 31 (13), 2008018 (2021).
- Li, M., et al. Toward a molecular understanding of the antibacterial mechanism of copper-bearing titanium alloys against staphylococcus aureus. Adv Healthc Mater. 5 (5), 557-566 (2016).
- Yang, Z., et al. Long-term antibacterial stable reduced graphene oxide nanocomposites loaded with cuprous oxide nanoparticles. J Colloid Interface Sci. 533, 13-23 (2019).
- Yang, Y., et al. Graphene oxide/copper nanoderivatives-modified chitosan/hyaluronic acid dressings for facilitating wound healing in infected full-thickness skin defects. Int J Nanomedicine. 15, 8231-8247 (2020).
- Mao, M., et al. Graphene oxide-copper nanocomposites suppress cariogenic streptococcus mutans biofilm formation. Int J Nanomedicine. 16, 7727-7739 (2021).
- Ravikumar, V., Mijakovic, I., Pandit, S. Antimicrobial activity of graphene oxide contributes to alteration of key stress-related and membrane bound proteins. Int J Nanomedicine. 17, 6707-6721 (2022).
- Afreen, G., Shoeb, M., Upadhyayula, S. Effectiveness of reactive oxygen species generated from rgo/cds qd heterostructure for photodegradation and disinfection of pollutants in waste water. Mater Sci Eng C. 108, 110372 (2020).
- Yang, F., et al. Fabrication of graphene oxide/copper synergistic antibacterial coating for medical titanium substrate. J Colloid Interface Sci. 638, 1-13 (2023).
- Rajapaksha, P., et al. Antibacterial properties of graphene oxide-copper oxide nanoparticle nanocomposites. ACS Appl Bio Mater. 2 (12), 5687-5696 (2019).
- Sachdeva, C., Satyamoorthy, K., Murali, T. S. Microbial interplay in skin and chronic wounds. Curr Clin Microbiol Rep. 9 (3), 21-31 (2022).
- Ramos, M. K., Zarbin, A. J. G. Graphene/copper oxide nanoparticles thin films as precursor for graphene/copper hexacyanoferrate nanocomposites. Appl Surf Sci. 515, 146000 (2020).
- Fivenson, E. M., et al. A role for the gram-negative outer membrane in bacterial shape determination. PNAS. 120 (35), e2301987120 (2023).
- Wu, C., et al. Copper-containing mesoporous bioactive glass scaffolds with multifunctional properties of angiogenesis capacity, osteostimulation and antibacterial activity. Biomater. 34 (2), 422-433 (2013).
- Zhang, W., et al. Graphene oxide-copper nanocomposite-coated porous cap scaffold for vascularized bone regeneration via activation of hif-1α. Adv Healthc Mater. 5 (11), 1299-1309 (2016).
- Labauve, A. E., Wargo, M. J. Growth and laboratory maintenance of pseudomonas aeruginosa. Curr Protoc Microbiol. 25 (1), 6E.1.1-6E.1.8 (2012).
- Lin, J., et al. The icmf3 locus is involved in multiple adaptation- and virulence-related characteristics in pseudomonas aeruginosa pao1. Front Cell Infect Microbiol. 5, 70 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved