אספקה עקבית של וירוס הקשור לאדנו באמצעות הזרקת וריד זנב לרוחב בעכברים בוגרים
In This Article
Summary
כאן אנו מפרטים פרוטוקול אופטימלי להזרקת וריד זנב רוחבי של עכבר לניהול מערכתי של וירוס הקשור לאדנו (AAV) בעכברים בוגרים. בנוסף, אנו מתארים פרוטוקולים של בדיקות נפוצות להערכת התמרה AAV.
Abstract
הפרעות רבות משפיעות על איברים מרובים או מערבות אזורים שונים בגוף, ולכן קריטי לספק טיפולים באופן מערכתי כדי להתמקד בתאים הפגועים הממוקמים באתרים שונים. הזרקה תוך ורידית היא נתיב אספקה מערכתי נפוץ במחקרים פרה-קליניים המעריכים טיפולים המיועדים למתן בכל הגוף. בעכברים בוגרים, זה כרוך ניהול תוך ורידי של סוכן טיפולי לתוך ורידים זנב לרוחב של העכבר. כאשר שולטים בהן, זריקות ורידים בזנב הן בטוחות ומהירות, ודורשות רק כלים פשוטים וזמינים בדרך כלל. עם זאת, זריקות ורידים זנב הן מאתגרות מבחינה טכנית ודורשות הכשרה מקיפה ותרגול מתמשך כדי להבטיח את המסירה המדויקת של המינון המיועד.
כאן אנו מתארים פרוטוקול הזרקה מפורט, אופטימלי ורוחבי של ורידים בזנב שפיתחנו בהתבסס על הניסיון שלנו ועל המלצות שדווחו בעבר על ידי קבוצות אחרות. מלבד ריסוני עכברים ומזרקי אינסולין, פרוטוקול זה דורש רק ריאגנטים וציוד הזמינים ברוב המעבדות. מצאנו כי ביצוע פרוטוקול זה מביא להעברה מוצלחת באופן עקבי תוך ורידי של וירוס הקשור באדנו (AAV) לתוך ורידי הזנב של עכברים לא מורדמים בני 7-9 שבועות. בנוסף, אנו מתארים את הפרוטוקולים הממוטבים לזיהוי היסטולוגי של חלבוני כתב פלואורסצנטיים וגנום וקטורי לכימות גנום דיפלואידי (vg/dg) המשמשים להערכת התמרה והפצה ביולוגית של AAV. מטרת פרוטוקול זה היא לסייע לנסיינים לבצע בקלות זריקות ורידים בזנב בהצלחה ובעקביות, מה שיכול להפחית את זמן התרגול הדרוש כדי לשלוט בטכניקה.
Introduction
הפרעות מונוגניות מהוות 80% מהמחלות הנדירות, אשר משפיעות באופן קולקטיבי על 300 מיליון אנשים ברחבי העולם 1,2. כיום אין טיפולים מרפאים מאושרים לרוב ההפרעות הנדירות המתישות הללו 1,2,3. עם זאת, הפרעות מונוגניות הן מועמדות אידיאליות לטיפולים גנטיים שיכולים להחליף, להשלים, לתקן או להשתיק גנים לא מתפקדים 4,5. כיום, וקטורים מרובים מפותחים ומשמשים להעברת טיפולים גנטיים לסוגי תאים ספציפיים 4,6. אחד מאותם וקטורים הוא וירוס הקשור לאדנו (AAV). AAV הוא נגיף פרוו לא פתוגני המשמש יותר ויותר כווקטור ריפוי גנטי7. בהשוואה לווקטורים נגיפיים אחרים, ל-AAV יש אימונוגניות נמוכה יותר, פוטנציאל נמוך יותר להשתלב בגנום המארח, ויכולת להתמיר ביעילות תאים מתחלקים ולא מתחלקים ברקמות שונות 7,8. בנוסף, פותחו גישות רבות כדי להנדס ולזהות AAVs עם מאפיינים רצויים כגון טרופיזם רקמות ספציפי או אימונוגניות מופחתת נוספת, אשר משפר מאוד את הרבגוניות של AAV כווקטור ויראלי עבור אינדיקציות שונות9. גורמים אלה הפכו את AAV לווקטור ריפוי גנטי שנחקר באופן נרחב והובילו לפיתוח טיפולים גנטיים מבוססי AAV10 שאושרו על ידי ה- FDA.
מודלים של עכברים משמשים בדרך כלל כדי לבחון טיפולים גנטיים פוטנציאליים in vivo ולהבין טוב יותר את הפתומנגנונים של הפרעות מונוגניות. הסיבה לכך היא שחזור הפתולוגיות של מודלים עכבריים של מצבים שונים, הדמיון של הגנום שלהם לגנום האנושי, והקלות היחסית של טיפול, תחזוקה ודור 11,12,13 של עכברים. בדיקת In vivo חשובה במיוחד כאשר חוקרים הפרעות המשפיעות על מערכות או אזורים מרובים בגוף, כגון ניוון שרירים. עבור הפרעות אלה, בדיקות חוץ גופיות עשויות שלא להספיק כדי להעריך באופן מקיף את הבטיחות, היעילות, הפרמקוקינטיקה והפרמקודינמיקה של טיפולים המיועדים להגיע לאזורי גוף שונים לאחר מתן מערכתי14.
ניתן להשתמש בנתיבי ניהול מערכתיים שונים כדי לספק תרופות. לכל מסלול יש יתרונות, חסרונות ומידת התאמה למודל החייתי ולתרופה הנחקרת15. הזרקה תוך ורידית (IV) לרוחב וריד הזנב היא דרך נפוצה להעברה מערכתית של AAV בעכברים16. הזרקות רוחביות לווריד הזנב מאפשרות ניהול מהיר וישיר של ההזרקה לזרם הדם של העכבר ומבטיחות זמינות ביולוגית גבוהה של התרופה במחזור הדם המערכתי17. הם גם דורשים כלים פשוטים יחסית וזמינים בדרך כלל כדי להתבצע. עם זאת, בעיקר בשל קוטר וריד הזנב הקטן והקושי באיתור הווריד, זריקות רוחביות של וריד הזנב הן מאתגרות מבחינה טכנית ודורשות רמה גבוהה של מיומנות ותרגול מתמיד כדי להימנע מניסיונות הזרקה כושלים או מתן מינון לא שלם 16,17,18,19. אלה יכולים לגרום לאובדן ריאגנטים יקרים או תוצאות לא מדויקות, במיוחד אם הזריקה הלא שלמה אינה מזוהה בעת ביצוע ההזרקה. הניסיון שלנו המסוכם כאן מבוסס על פרוטוקולים שדווחו במאמרים מתועדים היטב שהתאמנו לשימושנו, תוך אופטימיזציה של שלבים שונים של הליך הזרקת וריד הזנב הצידי כדי להבטיח זריקות מוצלחות באופן עקבי20,21,22,23,24,25,26,27.
במאמר זה, אנו מתארים פרוטוקול מפורט זה של הזרקת ורידי זנב לרוחב כדי לספק AAV לעכברים לא מורדמים בני 7-9 שבועות באמצעות כלים פשוטים וזמינים בדרך כלל. בנוסף, אנו מספקים את הפרוטוקולים לשיטות המשמשות להערכת אספקת AAV והפצה ביולוגית. פרוטוקולים אלה מכסים איסוף רקמות לאחר הזרקה, קיבוע רקמות, מיצוי DNA וגנום וקטורי של תגובת שרשרת פולימראז דיגיטלית (dPCR) לכימות גנום דיפלואידי (vg/dg). פרוטוקול הזרקת העירוי והמצביעים המסופקים כאן נועדו לשפר את הקלות של ביצוע מוצלח של הזרקות לרוחב ורידי הזנב. זה עשוי לעזור להפחית את הזמן הדרוש כדי לשלוט במיומנויות ההזרקה ובו זמנית לשפר את הדיוק והעקביות של הזרקות.
Protocol
כל הליכי הטיפול וההזרקה בבעלי חיים אושרו על ידי הוועדה לטיפול בבעלי חיים ב- NINDS. כל ההליכים בבעלי חיים נערכו בהתאם להנחיות NINDS לטיפול ושימוש בבעלי חיים.
1. הכנה לפני הזרקה
- הכנת מינון AAV
- לקבוע את המשקל הממוצע של העכברים שיוזרקו.
- חישוב נפח ההזרקה המרבי המותר בהתאם להנחיות הטיפול בבעלי חיים של המוסד כמוצג במשוואה (1). נפח ההזרקה המרבי הוא בדרך כלל נפח (μL)/משקל עכבר (g) ערך (למשל, 10 μL/g).
נפח הזרקה מרבי (μL)/עכבר= (נפח הזרקה מרבי (μL/g)) × (משקל עכבר ממוצע (גרם)) (1)
הערה: חישוב לדוגמה: נפח הזרקה מרבי/עכבר = 10 μL/g × 20 גרם/עכבר= 200 μL/עכבר - הגדר את מינון הגנום הווקטורי AAV (vg) שיועבר לכל עכבר.
הערה: זה יכול להיות אותו ערך מוחלט בין עכברים שונים (למשל, כל העכברים מקבלים 1.5 × 1012 vg ללא קשר לכמה כל עכבר שוקל). או שהמינון יכול להיות vg/kg, כך שיש לחשב את סך כל VG להזרקה לכל עכבר עבור כל עכבר בהתאם למשקל העכבר ביום ההזרקה.- אם המינון הוא vg / kg, לשקול כל עכבר ביום ההזרקה לפני הכנת המינון.
- חשב את הגנום הווקטורי שיועבר עבור כל עכבר לפי משקלו באמצעות משוואה (2):
גנומים וקטוריים שיועברו בעכבר ספציפי (vg) = ערך vg/kg שצוין מראש (vg/kg) ×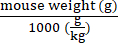 (2)
(2)
הערה: שימוש ב- vg/kg כיחידת מינון במקום vg/mouse עשוי להיות מתאים יותר במחקרים פרה-קליניים מסוימים כדי להבטיח השוואות תקפות בין מינונים מוזרקים. זאת בשל הבדלי המשקל בין עכברים זכרים ונקבות באותו גיל או אולי בין עכברים מאותו מין. - השתמש בנפח ההזרקה המרבי ובמינון AAV (vg) כדי לחשב את נפחי מלאי AAV ותמיסת מלח סטרילית חוצצת פוספט (PBS) הדרושים להכנת המינון הנדרש (ראה משוואות (3-6)). ודא שהנפח שיש להזריק שווה או קטן מנפח ההזרקה המרבי המותר. הכינו תמיד נפח הזרקה הגדול לפחות ב-15 מיקרוליטר מהנפח שיוזרק, כדי להתחשב בטעויות צנרת ובחלל המת של המזרק.
ריכוז ההזרקה (vg/μL) =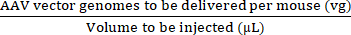 (3)
(3)
סה"כ גנומים וקטוריים AAV שיש להוסיף כדי להכין את ההזרקה (vg) = ריכוז ההזרקה (vg/μL) × נפח שיש להכין (μL) (4)
נפח מלאי AAV שיתווסף להכנת ההזרקה) (μL) =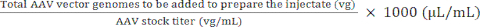 (5)
(5)
נפח PBS שיתווסף להכנת ההזרקה (μL) = נפח שיש להכין (μL) - נפח מלאי AAV שיתווסף להכנת ההזרקה (μL) (6)
הערה: חישוב לדוגמה:
6 × 1013 vg/kg (המינון) יסופק ב-200 μL/עכבר (הנפח שיש להזריק) בעכבר ששוקל 25 גרם. טיטר מלאי AAV הוא 3.0 × 1013 (vg/mL)
גנומים וקטוריים שיועברו בעכבר ספציפי זה (vg) = 6 × 1013 (vg/kg) ×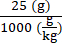 = 1.5 × 1012 vg עבור עכבר זה
= 1.5 × 1012 vg עבור עכבר זה
ריכוז הזרק=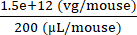 = 7.5 × 109 (vg/μL)
= 7.5 × 109 (vg/μL)
סה"כ גנומים וקטוריים AAV שיתווספו להכנת ההזרקה = 7.5 × 109 (vg/μL) × (200 (μL) + 15 (μL)) = 1.6125 × 1012 (vg)
נפח מלאי AAV שיתווסף להכנת ההזרקה =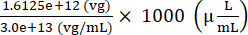 = 53.75 (μL)
= 53.75 (μL)
נפח PBS שיתווסף להכנת ההזרקה = 215 (μL) - 53.75 (μL) = 161.25 (μL)
- הליך הכנת מינון AAV
הערה: בהתאם להנחיות הבטיחות הביולוגית וה- PPE של המוסד לטיפול ב- AAV, בצינור מיקרוצנטריפוגה סטרילי ללא RNase וללא DNase 1.7 מ"ל, יש להכין את הזרקת ה- AAV באמצעות מלאי AAV ו- PBS סטרילי בהתאם לחישובים בשלב 1.1.3.3. תמיד לשמור את המניות AAV ו AAV להזריק על קרח. השתמש micropipettes נקי תיבות קצה micropipette חדש כדי להבטיח סטריליות. השליכו את קצות המיקרופיפטה המזוהמים ב-AAV בהתאם להנחיות ניהול הפסולת של המוסד.- הפשירו את המניה AAV על קרח.
הערה: הימנע מהפשרה והקפאה מחדש של מלאי AAV. או להזמין או להכין את מלאי AAV ב aliquots של 100-200 μL כדי למנוע עודף AAV לאחר הכנת מינון כי יהיה צורך להקפיא מחדש.
- הפשירו את המניה AAV על קרח.
- הכנת תחנת הזרקה
- ניקוי
- נקו את אזור העבודה עם אתנול 70% (EtOH).
- יש לחטא את אזור העבודה באמצעות ריאגנטים קוטלי חיידקים, קוטלי פטריות ווירוסידליים.
- נקו את משנן צינור העכבר במים וסבון.
- הגדרת כלי תחנה
- מניחים צינור חרוטי נקי וריק בנפח 15 מ"ל במחזיק צינורות/מתלה.
- הגדירו פלטפורמה מוגבהת שעליה יוצב מרסן צינור העכבר (איור 1A,B).
- הניחו את משפופרת העכבר הנקייה באזור העבודה.
- אם אתם מזריקים עכברים קטנים בהרבה ממרסנת צינור העכבר הזמינה, השתמשו בקונוס ריסון מכרסמים מפלסטיק כדי ליצור שרוול ריסון. ראה שלבים 2.1.3-4.
- מניחים את המזרקים שישמשו להזרקות באזור העבודה. השתמש מזרקי אינסולין 0.3 מ"ל עם מחטים 29 גרם.
- הניחו את מיכל הפסולת קרוב ככל האפשר לתחנת ההזרקה כדי לאפשר השלכה מיידית של כלים מזוהמים ב-AAV.
- משוך ודחוף את הבוכנה של כל מזרק מספר פעמים כדי לוודא שהבוכנה נעה בצורה חלקה כך שלא תהיה התנגדות הנגרמת על ידי מזרק במהלך ההזרקה. אם הבוכנה אינה זזה בצורה חלקה, השליכו את המזרק הזה והחלף אותו במזרק חדש.
- יש משקל עכבר ומיני צנטריפוגה זמינים ליד אזור ההזרקה.
- הכינו את ה-AAV על הקרח באזור ההזרקה.
- מכינים מים חמים (38-40 מעלות צלזיוס). ודא כי טמפרטורת המים אינה עולה על 40 °C כדי למנוע גרימת כוויות זנב העכבר.
- ניקוי
2. הליך הזרקה
- ריסון עכבר
- שקול כל עכבר כדי לחשב את המינון VG / ק"ג במידת הצורך.
- ודא שהעכבר מרוסן לחלוטין ואינו מסוגל לזוז.
הערה: אם העכבר אינו מרוסן לחלוטין, הוא עלול לזוז במהלך מתן העירוי וכתוצאה מכך להזיז את המחט. זה עלול לגרום למחט לצאת מהווריד ו / או לפצוע את העכבר. - לריסון צינורות:
- שטפו את המשענת במים חמים וסבון בין עכברים כדי לנקות ולחמם את המחזיק.
- החזק את העכבר בזנבו. הכנס את זנב העכבר לפתח העליון של הצינור; לאחר מכן, משוך לאט את העכבר לתוך ריסון הצינור. אם גודל משנן הצינור מתאים לגודל העכבר, מקם את התקע לפני העכבר כדי למנוע מהעכבר לברוח.
הערה: התקע צריך להיות קרוב מספיק לעכבר כדי למנוע מהעכבר לזוז או להסתובב בתוך הצינור, אך התקע לא אמור לחסום את אפו של העכבר כדי לאפשר לעכבר לנשום בחופשיות. אם העכבר קטן מגודל ריסון הצינור, השתמש בקונוס ריסון חד-פעמי גמיש בנוסף לריסון הצינור כמתואר להלן בשלב 2.1.4.
- עבור קונוסים מרסנים חד פעמיים גמישים במידת הצורך (כדי ליצור שרוול ריסון עבור עכברים קטנים יותר):
- בצע חתך בקצה האף של החרוט כדי לוודא שאפו של העכבר אינו חסום ולעכבר יש מספיק מקום לנשום.
- חתכו את גב החרוט כך שאורך החרוט יהיה כמעט זהה לזה של העכבר (כך שהחרוט ייכנס לתוך הצינור) (איור 1A,B).
- הנח את העכבר בריסון הצינור כמתואר לעיל בשלבים 2.1.3. בעת החזקת זנב העכבר, הכנס תחילה את חרוט הרסן עם צד הפתיחה הרחב יותר לתוך הצינור.
- בעודו מחזיק את זנב העכבר, תן לעכבר ללכת לתוך החרוט; לאחר מכן, החלק את שאר החרוט לתוך הצינור. ודא שזנב העכבר נמצא כל הדרך החוצה מהחלק האחורי של הצינור, ולעכבר יש מקום לנשום בתוך החרוט.
- אבטח את תקע הצינור מיד לפני פתח האף של החרוט תוך ודא שהעכבר מרוסן לחלוטין ויש לו מספיק מקום לנשום.
- הזרקת העכבר
- ממלאים את הצינור החרוטי 15 מ"ל במים חמים.
- הניחו את משנן הצינור עם העכבר בתוכו על המשטח המוגבה (איור 1B).
- טבלו כמה שיותר מזנב העכבר המאופק במים החמים למשך דקה אחת לפחות עד שהוורידים הרוחביים מורחבים ונראים בבירור (איור 1B).
- במהלך שלב חימום הזנב, טען את מנת AAV לתוך המזרק.
- הניחו את צינור המיקרוצנטריפוגה בנפח 1.7 מ"ל המכיל AAV במדף צינורות. הכנס את המחט אנכית לתוך הצינור עם היד הדומיננטית. ברגע שהמחט נמצאת בתוך הצינור, החזיקו את הצינור ביד הלא דומיננטית.
הערה: ההחדרה האנכית של המחט מונעת נזק למחט שעלול להיגרם כתוצאה מנגיעה בדופן הצינור. ניתן להשתמש בשיטות חלופיות אחרות לטעינת מזרקים, אך יש להבטיח את בטיחות הנסיין והעכבר המוזרק. החזקת הצינור ביד הלא דומיננטית מגנה מפני פציעות ניקוב מחט בשוגג אם המחט מוחדרת תוך כדי החזקת הצינור. - עם המחט בתוך הצינור, הרימו את הצינור ואת המזרק בו זמנית לגובה העיניים תוך הקפדה שהמחט לא תיגע בדופן הצינור. הניחו את שתי הידיים על השולחן כדי לייצב אותן. לאט למשוך את המינון לתוך מזרק.
הערה: שאיפה איטית מונעת מבועות אוויר עדינות להיצמד לדפנות חבית המזרק. - מוציאים בועות אוויר מהמזרק. אם מזריקים AAV, יש לוודא כי בועות האוויר נפרשות מהמזרק מעל פד סופג חד פעמי שיושלך לקופסת סיכון ביולוגי.
- החזיקו את ההזרקה לפחות 40 שניות כדי לחמם אותה.
הערה: יש לוודא תמיד שההזרקה חמה לפני ההזרקה. אם ניתנת הזרקה קרה, ייתכן שהזריקה לא תזרום דרך הווריד למעט כמה μL ראשונים. - בדוק את ורידי הזנב כל דקה.
הערה: הורידים חייבים להיות גלויים מאוד עד לאתר ההזרקה (יש להוסיף את זמן חימום הזנב ולהחליף במים חמים מתוקים לפי הצורך עד שהוריד נראה בבירור, אך לא לחרוג מזמן הריסון של העכבר המותר על פי פרוטוקול הטיפול בבעלי חיים של המוסד). - לאחר שווידאתם כי הוורידים נראים בבירור, הסירו את ריסון הצינור מראש הפלטפורמה המוגבהת והניחו את ריסון הצינור ישירות על השולחן. מקם את העכבר ברסן כשרגליו כלפי מטה ולא הצידה לטיפול קל בזנב.
הערה: העכבר לא אמור להיות על צדו או על גבו בתוך הרסן. העכבר צריך להיות מרוסן לחלוטין ולא מסוגל לזוז או להסתובב בתוך הרסן או לזוז/למשוך את זנבו. - לנגב במהירות את הזנב עם גזה כדי לייבש את הזנב; לנגב את הזנב עם ספוגית אלכוהול ולאחר מכן, לנגב אותו יבש עם גזה יבש.
הערה: השתמש בגזה יבשה כדי להפוך את הזנב ליבש מספיק כדי לאפשר אחיזה בטוחה של הזנב אך לא יבש לחלוטין. זה יכול להיות קשה יותר לראות את הווריד כאשר הזנב יבש לחלוטין. - סובבו את הזנב כ-90° שמאלה או ימינה כך שאחד משני הוורידים הרוחביים פונה כלפי מעלה. אתר אתר הזרקה מתאים בתוך השליש האמצעי של הזנב. התחל את ההזרקה הראשונית באופן מרוחק (קרוב יותר לקצה הזנב) ונוז בסמיכות אם נדרשות זריקות נוספות עקב ניסיונות כושלים או הנדרשים על ידי תכנון הניסוי.
הערה: אין לנסות להזריק דיסטלי לאתר הזרקה קודם מכיוון שההזרקה עלולה לדלוף מאתר ההזרקה הקודם. אופציונלי: השתמש באגודל ובאצבע המורה של היד הלא דומיננטית כדי להפעיל לחץ פרוקסימלי (במעלה הזרם/קרוב יותר לגוף העכבר) על אתר ההזרקה למשך 10 שניות. האצבעות פועלות כחוסמי עורקים כדי להרחיב עוד יותר את הווריד באתר ההזרקה. מיד לאחר חוסם העורקים של 10 שניות, שחררו את אצבעות חוסם העורקים וודאו שאחד משני הורידים הרוחביים פונה כלפי מעלה ונראה בבירור. - החזיקו את הזנב ביד הלא דומיננטית בעזרת האגודל והאצבע המורה מיד דיסטליים לאזור ההזרקה. קפלו את הזנב מעל האצבע המורה כך שמקום ההזרקה יהיה שטוח על האצבע המורה. משכו לאחור את הזנב כך שהזנב יהיה מתוח ואתר ההזרקה יהיה אופקי לחלוטין (ב-0°) (מקביל לטבלה האופקית) (איור 1C).
- החזיקו את המזרק באמצעות האצבע המורה והאצבע האמצעית של היד הדומיננטית משני צדי אוגן הקנה של המזרק תוך שמירה על האגודל מוכן בבוכנה.
הערה: זה יקל עלינו לא להזיז את האגודל או את המחט ברגע שהמחט נמצאת בתוך הווריד (איור 1C). - הניחו את שתי הידיים על השולחן כדי לייצב אותן והניחו את המחט ישירות על ובמקביל לזנב ולווריד כשהשיפוע פונה כלפי מעלה. שמור את אתר ההזרקה קרוב לאצבע המורה המחזיקה את הזנב כדי לשפר את השליטה והיציבות של אתר ההזרקה.
הערה: ריסון הצינור צריך להיות עמוק מספיק בשולחן כך ששתי הידיים נתמכות על השולחן. - תוך שמירה על המחט מקבילה לווריד הזנב והפעלת לחץ כלפי מטה על המחט, החליקו את המחט קדימה לתוך הווריד.
הערה: הלחץ כלפי מטה אמור להספיק כדי להחדיר את המחט בזווית הנכונה לתוך הווריד. הווריד רדוד מאוד, ולכן המחט צריכה להיות שטוחה ככל האפשר כאשר מנסים להיכנס לווריד. - להזריק לאט את הפתרון לתוך הווריד. לאחר מתן המינון, לאט למשוך את המחט מיד להפעיל לחץ עם גזה באתר ההזרקה לפחות 10 s כדי לעצור דימום.
הערה: יש להפעיל את הלחץ כל עוד יש צורך עד שהדימום ייפסק לחלוטין כדי למנוע אובדן פוטנציאלי של המגיב המוזרק. טיפת דם מופיעה בדרך כלל לאחר משיכת המחט המעידה על כך שהמחט חדרה לווריד. לעיתים, טיפת הדם אינה מופיעה אפילו עם זריקה מוצלחת. טיפת הדם אינה מעידה על הזרקה מוצלחת; זה רק מציין כי המחט חדרה לווריד. אינדיקטור ההזרקה המוצלח האמין הוא היעדר מוחלט של התנגדות הבוכנה במהלך ההזרקה. אם המחט נמצאת בתוך הווריד, לא אמורה להיות התנגדות בבוכנה של המחט במהלך ההזרקה, והווריד הפרוקסימלי למקום ההזרקה ייראה לרגע מעט בהיר יותר בצבע (blanches) (הלבנת הווריד עשויה שלא להיות ברורה מאוד בזני עכברים מסוימים). אם יש התנגדות ו / או בליטה מתחילה להופיע במקום ההזרקה, אז המחט אינה ממוקמת כראוי בתוך הווריד. אם זה קורה, להסיר לחלוטין את המחט מהזנב ולנסות להזריק את הווריד באתר הזרקה חדש פרוקסימלי לאתר ההזרקה הכושל (קרוב יותר לגוף העכבר). - יש להשליך את המזרקים והצינורות המזוהמים ב-AAV בהתאם להנחיות הטיפול בפסולת של המוסד.
- שחררו את העכבר מהרסן והחזירו אותו לכלוב חדש נפרד מעכברים שלא עברו הכלחה. עקוב אחר העכברים במשך 10 דקות כדי להבטיח רמות פעילות תקינות לאחר ההזרקה.
הערה: פעולה זו מונעת העברה פוטנציאלית של חומרים מוזרקים לעכברים unnjected אם חומרים transmissible מנוהלים. - יש לחטא את אזור העבודה באמצעות ריאגנטים קוטלי חיידקים, קוטלי פטריות ווירוסידליים ו-70% EtOH. נקו את משנן צינור העכבר במים וסבון.
- הניחו את צינור המיקרוצנטריפוגה בנפח 1.7 מ"ל המכיל AAV במדף צינורות. הכנס את המחט אנכית לתוך הצינור עם היד הדומיננטית. ברגע שהמחט נמצאת בתוך הצינור, החזיקו את הצינור ביד הלא דומיננטית.
3. דיסקציה ואיסוף רקמות וקיבוע27
- הכנת תחנת איסוף רקמות
- נקה את תחנת העבודה עם מגיב פירוק DNA בהתאם להוראות היצרן כדי לפרק DNA מזהם שעלול להימצא באזור העבודה.
- מניחים מתילבוטאן במיכל מתכת. מניחים את מיכל המתכת מתילבוטאן בתוך קופסת קלקר; לאחר מכן, הקיפו את מיכל המתכת בקרח יבש כך שמפלס הקרח היבש המקיף את המיכל יהיה גבוה יותר מרמת המתילבוטאן בתוך המיכל.
- יש לתייג ולהניח צינורות אחסון ריקים של רקמת מיקרוצנטריפוגה בנפח 2 מ"ל על הקרח היבש. השאירו את צינורות אחסון המתילבוטאן והרקמות להתקרר על קרח יבש למשך 20 דקות לפחות לפני שתתחילו להקפיא את הרקמות. מניחים מלקחיים להעברת רקמות על קרח יבש.
- תייגו ומלאו קבוצה נוספת של צינורות אחסון רקמת מיקרוצנטריפוגה בנפח 2 מ"ל בפרפורמלדהיד טרי של 4% (PFA) ושמרו אותם בטמפרטורת החדר. הוסף מספיק 4% PFA לכל צינור כדי לטבול לחלוטין את הרקמות שיונחו בצינור.
- איסוף רקמות וקיבוע
- יש להרדים את העכבר בהתאם להנחיות הטיפול בבעלי חיים של המוסד.
הערה: כאן, העכברים הומתו באמצעות נקע צוואר הרחם. - רסס את העכבר באופן מלא עם 70% EtOH.
- לאסוף את הרקמות הנדרשות.
הערה: פרוטוקול האיסוף והקיבוע המתואר כאן נבדק על שרירי השלד והכבד. - עבור רקמות שישמשו למיצוי DNA:
- זרקו את הרקמה במתילבוטאן מקורר על קרח יבש והשאירו את הרקמה במתילבוטאן למשך דקה אחת לפחות. השתמש במלקחיים העברה מראש כדי להעביר את הרקמות הקפואות מן methylbutane לתוך precooled ריק 2 מ"ל מיקרוצנטריפוגה רקמות אחסון צינור. אחסן את הרקמה ב -80 ° C.
הערה: אופציונלי: ניתן לחתוך את הרקמה לחתיכות של 20 מ"ג לפני הטמנת מתיל-בוטאן כדי להיות מוכנה לשימוש בשלב 4.1.4.
- זרקו את הרקמה במתילבוטאן מקורר על קרח יבש והשאירו את הרקמה במתילבוטאן למשך דקה אחת לפחות. השתמש במלקחיים העברה מראש כדי להעביר את הרקמות הקפואות מן methylbutane לתוך precooled ריק 2 מ"ל מיקרוצנטריפוגה רקמות אחסון צינור. אחסן את הרקמה ב -80 ° C.
- לרקמות שישמשו לניתוח היסטולוגי ולשימור פלואורסצנטיות של חלבוני כתב:
- באמצעות מלקחיים ייעודיים הנשמרים בטמפרטורת החדר, שחררו את הרקמות בצינור המיקרוצנטריפוגה המתאים להן המכיל 4% PFA (נשמר בטמפרטורת החדר) תוך כדי לוודא שהרקמה שקועה לחלוטין בתמיסת 4% PFA.
הערה: זיהום PFA יכול להשפיע לרעה על בדיקות מולקולריות שונות במורד הזרם. השתמש במלקחיים ייעודיים ל- PFA רק בעת טיפול ב- PFA כדי למנוע זיהום PFA של רקמות או כלים אחרים. - הניחו את צינורות המיקרוצנטריפוגות על מדף וכיסו את המדף בנייר כסף כדי לשמור על הצינורות בחושך. יש לדגור על המדף המכוסה בטמפרטורה של 4°C על שייקר עם ניעור עדין למשך הלילה.
- לאחר דגירה של לילה, הכינו 5% סוכרוז (% w/v) ב-1x PBS על ידי המסת 5.0 גרם סוכרוז ב-70 מ"ל של 1x PBS על ידי ניעור נמרץ. הוסף מספיק PBS 1x לנפח כולל סופי של 100 מ"ל כדי להשיג תמיסת 5% סוכרוז (% w / v).
- יש לעקר את תמיסת הסוכרוז 5% באמצעות מסנן מזרקים בגודל 0.22 מיקרומטר. לתייג ולמלא צינורות מיקרוצנטריפוגות 2.0 מ"ל עם 5% סוכרוז טרי שהוכן.
- העבירו את הרקמות מ-4% PFA לצינור המיקרוצנטריפוגה המתאים להן המכיל 5% סוכרוז (נשמר בטמפרטורת החדר) תוך וידוא שהרקמה שקועה לחלוטין בתמיסת 5% סוכרוז.
- הניחו את צינורות המיקרוצנטריפוגות על מדף וכיסו את המדף בנייר כסף כדי לשמור על הצינורות בחושך. יש לדגור על המדף המכוסה בטמפרטורה של 4°C על שייקר עם ניעור עדין למשך הלילה.
- לאחר דגירה של לילה, הכינו 20% סוכרוז (% w/v) ב-1x PBS על ידי המסת 20.0 גרם סוכרוז ב-70 מ"ל של 1x PBS על ידי טלטול נמרץ. הוסף מספיק PBS 1x לנפח כולל סופי של 100 מ"ל כדי להשיג תמיסת סוכרוז 20% (% w / v).
- יש לעקר את תמיסת הסוכרוז 20% באמצעות מסנן מזרקים בגודל 0.22 מיקרומטר. לתייג ולמלא צינורות מיקרוצנטריפוגה 2.0 מ"ל עם 20% סוכרוז טרי שהוכן.
- העבירו את הרקמות מ-5% סוכרוז לצינור המיקרו-צנטריפוגה המתאים להן המכיל 20% סוכרוז (נשמר בטמפרטורת החדר) תוך וידוא שהרקמה שקועה לחלוטין בתמיסת 20% סוכרוז.
- הניחו את צינורות המיקרוצנטריפוגות על מדף וכיסו את המדף בנייר כסף כדי לשמור על הצינורות בחושך. יש לדגור על המדף המכוסה בטמפרטורה של 4°C על שייקר עם ניעור עדין למשך הלילה.
- לאחר דגירה של לילה, הניחו מתיל-בוטאן במיכל מתכת והניחו את מיכל המתכת מתיל-בוטאן בתוך קופסת קלקר. הקיפו את מיכל המתכת בקרח יבש כך שרמת הקרח היבש המקיף את המיכל גבוהה מרמת המתילבוטאן בתוך המיכל.
- יש לתייג ולהניח צינורות אחסון ריקים של רקמת מיקרוצנטריפוגה בנפח 2 מ"ל על קרח יבש. השאירו את צינורות אחסון המתילבוטאן והרקמות להתקרר על קרח יבש למשך 20 דקות לפחות לפני שתתחילו להקפיא את הרקמות. מניחים את המלקחיים על קרח יבש.
- הכתימו במהירות את הרקמות באמצעות מגבונים מדויקים כדי להסיר עודפי 20% סוכרוז. זרקו את הרקמה במתילבוטאן מקורר מראש על קרח יבש. השאירו את הרקמה במתילבוטאן למשך דקה אחת לפחות.
- השתמש במלקחיים העברה מראש כדי להעביר את הרקמות הקפואות מן methylbutane לתוך precooled ריק 2 מ"ל מיקרוצנטריפוגה רקמות אחסון צינור. אחסן את הרקמה ב -80 ° C.
- באמצעות מלקחיים ייעודיים הנשמרים בטמפרטורת החדר, שחררו את הרקמות בצינור המיקרוצנטריפוגה המתאים להן המכיל 4% PFA (נשמר בטמפרטורת החדר) תוך כדי לוודא שהרקמה שקועה לחלוטין בתמיסת 4% PFA.
- יש להרדים את העכבר בהתאם להנחיות הטיפול בבעלי חיים של המוסד.
4. dPCR לכימות VG/DG
- מיצוי DNA מרקמות ועיכול RNA ראשוני
הערה: המדריך של ערכת מיצוי הדנ"א המופיע בטבלת החומרים שימש לגזירת פרוטוקול מיצוי דנ"א זה. שמור תמיד את הצינורות המכילים את חתיכות הרקמה הקפואה על קרח יבש.- הכינו דלי קרח.
- עבור כל דגימת DNA, יש לסמן צינור חרוז ליזה אחד בנפח 1.5 מ"ל ושתי שפופרות מיקרוצנטריפוגות ריקות ללא RNase ונטולות DNase בנפח 1.7 מ"ל.
- הוסף 180 μL של מאגר ערכת מיצוי ה- DNA הראשון לכל צינור חרוזים. צמצמו את צינור החרוזים הראשון המכיל חיץ.
הערה: אם הרקמות לא נחתכו מראש בשלב 3.2.4.1, השתמש בסכין גילוח המצונן מראש על קרח יבש כדי לחתוך את הרקמה לחתיכות של 20 מ"ג. שלב זה חייב להיעשות בתוך קריוסטט נקי נשמר ב -20 ° C או קר יותר. - הוסף חתיכה אחת של רקמה לתוך הצינור; לשקול ולרשום את משקל הרקמה (להיות ~ 20 מ"ג).
- מיד מניחים את צינור החרוז lysis עם הרקמה בו על קרח. החיץ עלול להתגבש.
- חזור על השלבים הקודמים עבור כל דגימת רקמה.
- מעבירים את הצינורות לבלנדר צינור החרוזים ליזיס ופועלים במשך דקה אחת במהירות מרבית (מהירות 10) ב-4°C.
- מניחים את הדגימות על קרח כדי להעביר אותן לצנטריפוגה. צנטריפוגה למשך דקה אחת ב-20,000 × גרם ב-4°C.
- במהלך שלב הצנטריפוגה, הוסף 20 μL של proteinase K לסדרה הראשונה של צינורות מיקרוצנטריפוגות 1.7 מ"ל. לאחר שלב הצנטריפוגה, מעבירים את הסופרנאטנט של ההומוגנטים לצינורות 1.7 מ"ל המכילים את הפרוטאינאז K ומערבבים היטב. יש לדגור בטמפרטורה של 56°C למשך 15 דקות, עם ערבוב של 500 סל"ד.
- אספו את הטיפות מהקירות והמכסה של הצינור על ידי צנטריפוגה של הצינור למשך 1-2 שניות באמצעות מיני צנטריפוגה. יש לדגור בטמפרטורת החדר למשך 2 דקות.
- מוסיפים 4 μL של RNase A ומערבבים על ידי מערבולת פולסים קצרה. יש לדגור בטמפרטורת החדר למשך 2 דקות. מערבולת דופק למשך 15 שניות.
- אספו את הטיפות מהקירות והמכסה של הצינור על ידי צנטריפוגה של הצינור למשך 1-2 שניות באמצעות מיני צנטריפוגה. הוסף 200 μL של מאגר ערכת מיצוי ה- DNA השני. מערבולת דופק למשך 15 שניות.
- אספו את הטיפות מהקירות והמכסה של הצינור על ידי צנטריפוגה של הצינור למשך 1-2 שניות באמצעות מיני צנטריפוגה. הוסף 200 μL של 100% EtOH. מערבולת דופק למשך 15 שניות.
- אספו את הטיפות מהקירות והמכסה של הצינור על ידי צנטריפוגה של הצינור למשך 1-2 שניות באמצעות מיני צנטריפוגה. העבר את הליזטים לעמודת הספין של מיצוי ה- DNA. יש לסחוט במהירות של 6,000 × גרם למשך דקה.
- הניחו את עמוד הסחרור בצינור איסוף חדש. הוסף 500 μL של מאגר ערכת מיצוי ה- DNA השלישי לעמודת הספין. יש לסחור במהירות של 6,000 × גרם למשך דקה.
- הניחו את עמוד הסחרור בצינור איסוף חדש. הוסף 500 μL של מאגר ערכת מיצוי ה- DNA הרביעית לעמודת הספין. סחרור ב 20,000 × גרם במשך 3 דקות.
- מקם את עמוד הסחרור בצינור מיקרוצנטריפוגה חדש בנפח 1.7 מ"ל. הוסף 100 μL של מים ברמה מולקולרית לעמודת הסחרור. יש לדגור בטמפרטורת החדר למשך דקה. יש לסחור במהירות של 6,000 × גרם למשך דקה אחת בטמפרטורת החדר.
- מדדו את ריכוז הדנ"א במידת הצורך. יש לאחסן ב-4°C לאחסון לטווח קצר או ב-20°C לאחסון לטווח ארוך.
- מיצוי DNA מתאים ממוינים ב-FAC
הערה: המדריך של ערכת מיצוי הדנ"א המופיע בטבלת החומרים שימש לגזירת פרוטוקול מיצוי דנ"א זה.- לאחר מיון התאים, צנטריפוגות את הדגימות ב 300 × גרם במשך 5 שניות לאסוף את כל הטיפות על הצדדים ואת המכסה. ודא שכל הטיפות נאספות.
הערה: אם נפח הדגימה קטן מ- 1.5 מ"ל, המשך ישירות לשלב הבא. אם נפח הדגימה גדול מ -1.5 מ"ל, הסר בזהירות והשלך את החלק העליון של הסופרנאטנט באמצעות מיקרופיפטה ומשאיר 1-1.5 מ"ל של הדגימה. - מערבבים את הדגימה על ידי צנרת למעלה ולמטה מספר פעמים ומעבירים את הדגימה לצינור מיקרוצנטריפוגה בנפח 1.7 מ"ל. צנטריפוגה ב 515 × גרם למשך דקה אחת בטמפרטורת החדר.
- השליכו את הסופרנאטנט למעט 50 μL האחרונים. השהו מחדש את הגלולה ב-50 μL של מאגר ערכת מיצוי הדנ"א הראשונה לקבלת נפח סופי של 100 μL.
- פעל בהתאם לפרוטוקול היצרן לבידוד DNA גנומי מכמויות קטנות של דם (ראה טבלת חומרים).
- הוסף 10 μL של proteinase K ו 100 μL של מאגר ערכת מיצוי DNA שני; מערבבים על ידי מערבולות פולס במשך 15 שניות. דגרו את הדגימות בטמפרטורה של 56°C למשך 10 דקות עם ערבוב של 300 סל"ד. מערבבים את הדגימות פעמיים בהיפוך עדין במהלך תקופת הדגירה.
- אספו את הטיפות מהקירות והמכסה של הצינור על ידי צנטריפוגה של הצינור למשך 1-2 שניות באמצעות מיני צנטריפוגה. מוסיפים 50 μL של 100% EtOH ומערבבים על ידי מערבולות פולס במשך 15 שניות. דוגרים על הדגימות בטמפרטורת החדר למשך 5 דקות.
- אספו את הטיפות מהקירות והמכסה של הצינור על ידי צנטריפוגה של הצינור למשך 1-2 שניות באמצעות מיני צנטריפוגה. מעבירים את הדגימות לעמודת מיצוי הדנ"א (העמודה נמצאת בצינור איסוף של 2 מ"ל) מבלי להרטיב את השפה. צנטריפוגה בעוצמה של 6,000 × גרם למשך דקה.
- לאחר הנחת העמוד בצינור איסוף נקי של 2 מ"ל, יש להשליך את צינור האיסוף המכיל את הזרימה. הוסף 500 μL של מאגר ערכת מיצוי ה- DNA השלישי לעמוד מבלי להרטיב את השפה והצנטריפוגה ב- 6,000 × גרם למשך דקה אחת.
- שוב, לאחר הנחת העמוד בצינור איסוף נקי של 2 מ"ל, יש להשליך את צינור האיסוף המכיל את הזרימה. הוסף 500 μL של מאגר ערכת מיצוי ה- DNA הרביעית לעמוד מבלי להרטיב את השפה והצנטריפוגה ב- 6,000 × גרם למשך דקה אחת.
- מניחים את העמוד בצינור איסוף נקי של 2 מ"ל ומשליכים את צינור האיסוף המכיל זרימה. צנטריפוגה בעוצמה של 20,000 × גרם למשך 3 דקות.
- מניחים את העמוד בצינור מיקרוצנטריפוגה נקי בנפח 1.7 מ"ל ומשליכים את צינור האיסוף המכיל זרימה. הוסף 20 μL של מים כיתה מולקולרית למרכז קרום העמוד עבור elution; סגרו את המכסה ודגרו על הדגימות עם המים המולקולריים בטמפרטורת החדר למשך 5 דקות.
- צנטריפוגה בעוצמה של 20,000 × גרם למשך דקה. אחסן את ה- DNA המדולל ב- 4 ° C לאחסון לטווח קצר או - 20 ° C לאחסון לטווח ארוך.
- לאחר מיון התאים, צנטריפוגות את הדגימות ב 300 × גרם במשך 5 שניות לאסוף את כל הטיפות על הצדדים ואת המכסה. ודא שכל הטיפות נאספות.
- עיכול וניקוי RNA
הערה: המדריך של ערכת מיצוי הדנ"א המופיע בטבלת החומרים שימש להפקת פרוטוקול ניקוי דנ"א זה. בהתאם לתנאי dPCR, ריאגנטים ותכנוני פריימר ובדיקה, ייתכן שיהיה צורך להבטיח היעדר מוחלט של RNA בדגימת ה- DNA לפני שתמשיך לכימות dPCR vg/dg. זיהום RNA עלול לגרום לדרגות שונות של ערכי vg/dg לא מדויקים בתנאי dPCR מסוימים.- בצינור PCR של 0.2 מ"ל או בצינור מיקרוצנטריפוגה של 1.7 מ"ל, הוסף לכל היותר 20 μL של דגימת ה- DNA שחולצה ו- 1.5 μL של RNase ללא DNase לכל דגימת DNA. אם נפח תערובת ה- DNA/RNase קטן מ- 21.5 μL, הוסף מספיק מים ברמה מולקולרית לנפח סופי של 21.5 μL וערבב פי 25 על ידי היפוך הצינורות. יש לדגור בטמפרטורה של 37°C למשך 30 דקות עם ערבוב תקופתי כל 10 דקות על ידי היפוך הצינורות.
הערה: הכמות הכוללת של חומצות גרעין שנוספו לצינור צריכה להיות בין 175 ננוגרם ל-700 ננוגרם. ייתכן שיהיה צורך בשינויים אם דגימות הדנ"א מכילות נפחים או כמויות חומצות גרעין מחוץ לטווח זה או אם דגימות הדנ"א בודדו באופן שונה. - מניחים על קרח למשך 2 דקות. הוסף מספיק מים באיכות מולקולרית לכל תערובת DNA/RNase לנפח סופי של 100 μL.
הערה: ה- RNase המפורט כאן מומלץ מכיוון שהוא מעכל את ה- RNA המזהם מבלי להשפיע לרעה על DNA המטרה או בדיקות PCR במורד הזרם. - פעל בהתאם לפרוטוקול היצרן לניקוי DNA גנומי (ראה טבלת חומרים).
- הוסף 10 μL של מאגר ערכת מיצוי ה- DNA הראשון ו- 250 μL של מאגר ערכת מיצוי ה- DNA השני. מערבבים על ידי מערבולות פולס במשך 10 שניות.
- העבירו את הדגימות לעמודת מיצוי הדנ"א בצינור איסוף של 2 מ"ל מבלי להרטיב את השפה. צנטריפוגה ב-6,000 × גרם למשך דקה.
- לאחר הנחת העמוד בצינור איסוף נקי של 2 מ"ל, יש להשליך את צינור האיסוף המכיל את הזרימה. הוסף 500 μL של מאגר ערכת מיצוי ה- DNA השני לעמוד מבלי להרטיב את השפה. צנטריפוגה ב-6,000 × גרם למשך דקה.
- מניחים את העמוד בצינור איסוף נקי של 2 מ"ל ומשליכים את צינור האיסוף המכיל זרימה. צנטריפוגה בעוצמה של 20,000 × גרם למשך 6 דקות.
- מניחים את העמוד בצינור מיקרוצנטריפוגה נקי של 1.7 מ"ל ומשליכים את צינור האיסוף המכיל את הזרימה. יש להוסיף 20 μL של מים באיכות מולקולרית למרכז קרום העמוד לצורך הדבקה, לסגור את המכסה ולדגור על הדגימות עם המים המולקולריים בטמפרטורת החדר למשך 5 דקות.
- צנטריפוגה בעוצמה של 20,000 × גרם למשך דקה. יש לאחסן ב-4°C לאחסון לטווח קצר או ב-20°C לאחסון לטווח ארוך.
- אשר את היעדר זיהום RNA בדגימה המעוכלת ב- RNase עם PCR או dPCR בנקודת קצה או PCR כמותי (qPCR) באמצעות זוג פריימר PCR שיגביר אזור mRNA המשתרע על פני אקסונים מרובים ולא רק אקסון יחיד.
הערה: מטרת ה-mRNA צריכה להיות של גן המתבטא היטב ברקמת המטרה/סוג התא כדי להבטיח שזיהום ה-mRNA יזוהה כראוי אם קיים. אמפליקונים המשתרעים על פני אקסונים מרובים מבדילים בין פסים הנובעים מזיהום mRNA לעומת DNA גנומי. תמיד יש דגימת DNA מעוכלת שאינה RNase כבקרה חיובית לתגובת PCR כדי להבטיח כי זיהום mRNA יזוהה אם קיים.
- בצינור PCR של 0.2 מ"ל או בצינור מיקרוצנטריפוגה של 1.7 מ"ל, הוסף לכל היותר 20 μL של דגימת ה- DNA שחולצה ו- 1.5 μL של RNase ללא DNase לכל דגימת DNA. אם נפח תערובת ה- DNA/RNase קטן מ- 21.5 μL, הוסף מספיק מים ברמה מולקולרית לנפח סופי של 21.5 μL וערבב פי 25 על ידי היפוך הצינורות. יש לדגור בטמפרטורה של 37°C למשך 30 דקות עם ערבוב תקופתי כל 10 דקות על ידי היפוך הצינורות.
- PCR דיגיטלי (dPCR)
- PCR בנקודת קצה לבדיקת ספציפיות הפריימרים ותנאי PCR אופטימליים (אופציונלי)
- תכנן זוגות פריימר dPCR ובדיקות עבור הגנום הווקטורי וזוגות פריימר dPCR ובדיקות עבור גן הייחוס של העכבר שישמשו לכימות הגנום הדיפלואידי בדגימה.
הערה: יש לשאוף לגודל אמפליקון בין 60 bp ל-150 bp. גן הייחוס של העכבר צריך להיות גן שיש לו מספר העתק גן קבוע לכל גנום דיפלואידי. לצורך החישובים המפורטים כאן, לגן הייחוס (Polr2a) יש שני עותקים לכל גנום דיפלואידי. - עבור תגובת PCR של 10 μL בנקודת הקצה, הכינו את תערובת ה-PCR באמצעות הריאגנטים והריכוזים הסופיים שישמשו מאוחר יותר לתגובת dPCR. הוסף את דגימת ה- DNA של תבנית RNase מעוכלת (טווח כמויות חומצות גרעין 56-223 ננוגרם) לריכוז סופי של תערובת מאסטר 1x dPCR המכילה את ה- DNA פולימראז ו- dNTPs, 0.8 מיקרומטר מכל פריימר קדמי, 0.8 מיקרומטר מכל פריימר הפוך, 0.4 מיקרומטר מכל בדיקה ו- 0.025 U/μL של אנזים הגבלה (הריכוז הסופי של אנזים הגבלה תלוי באנזים ההגבלה ובמותג בו נעשה שימוש). הוסיפו מים ברמה מולקולרית כדי להגיע לנפח סופי של 10 μL.
הערה: צריכים להיות לפחות שני זוגות פריימר ושתי בדיקות בתמהיל ה-PCR: זוג פריימר אחד ובדיקה אחת לגילוי הגנום הווקטורי וזוג פריימר אחד ובדיקה אחת לזיהוי גנום העכבר. - תנאי מחזור תרמי PCR: שלב הפעלת חום ראשוני ב- 95 ° C למשך 2 דקות, ואחריו 35-45 מחזורים של שלב דנטורציה ב- 95 ° C למשך 25 שניות ושלב חישול / הארכה משולב ב- 58-62 ° C למשך דקה אחת.
הערה: יש לקבוע את טמפרטורת החישול האופטימלית עבור כל זוג אמפליקון ופריימר. ניתן להתאים את מספר המחזורים בהתאם לכמות הדנ"א של התבנית בדגימה. - דמיינו את מוצר ה-PCR על ג'ל אגרוז באמצעות אלקטרופורזה בג'ל כדי לקבוע את נוכחותם של רצועות אמפליקון המטרה וכל להקות הגברה לא ספציפיות אפשריות.
- המשך לשלב dPCR הבא לאחר אישור כי זוגות פריימר ותנאי רכיבה על אופניים לגרום הגברה ספציפית של רצפי המטרה.
- תכנן זוגות פריימר dPCR ובדיקות עבור הגנום הווקטורי וזוגות פריימר dPCR ובדיקות עבור גן הייחוס של העכבר שישמשו לכימות הגנום הדיפלואידי בדגימה.
- תגובת dPCR
- עבור תגובת dPCR של 40 μL, הוסף עד 4 μL של דגימת DNA של תבנית RNase מעוכלת (טווח חומצות גרעין 50-330 ng) לריכוז סופי של 1x dPCR Master Mix המכיל את ה- DNA פולימראז ו- dNTPs, 0.8 מיקרומטר מכל פריימר קדמי, 0.8 מיקרומטר מכל פריימר הפוך, 0.4 מיקרומטר מכל בדיקה, ו-0.025 U/μL של אנזים הגבלה (הריכוז הסופי של אנזים ההגבלה תלוי באנזים ההגבלה ובמותג שבו משתמשים). הוסיפו מים ברמה מולקולרית כדי להגיע לנפח סופי של 40 μL.
- תנאי מחזור תרמי dPCR: שלב הפעלת חום ראשוני ב- 95 ° C למשך 2 דקות, ואחריו 40-50 מחזורים של שלב דנטורציה ב- 95 ° C למשך 25 שניות, ושלב חישול / הרחבה משולב ב- 58-62 ° C למשך דקה אחת.
הערה: יש לקבוע את טמפרטורת החישול האופטימלית עבור כל זוג אמפליקון ופריימר. ניתן להתאים את מספר המחזורים בהתאם לכמות הדנ"א של התבנית בדגימה. הנפחים, הריכוזים והתנאים המפורטים כאן ממוטבים עבור לוחות dPCR, ריאגנטים והתקנים המפורטים בטבלת החומרים. תנאים אלה מפחיתים את ההשפעה של מעכבי dPCR פוטנציאליים שעלולים להפחית את דיוק התגובה. - לאחר הרצת תגובת dPCR וקבלת הערכים המוחלטים עבור הגנום הווקטורי וגן הייחוס של העכבר, חשב vg/dg במדגם באמצעות משוואות (7-8).
לגני ייחוס בעלי שני עותקי גנים/גנום דיפלואידי:
ערך מוחלט של גנום דיפלואידי (dg) =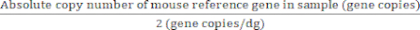 (7)
(7)
VG/DG =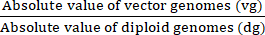 (8)
(8) - בדוק את תרשים הפיזור ה-1D של תגובת dPCR כדי לאשר את תקפות הבדיקה והכימות (איור 3A,C). כדי שהבדיקה תהיה תקפה, ודא כי 1D scatterplot עונה על כל הקריטריונים הבאים: נוכחות של מחיצות חיוביות ושליליות; הפרדה ברורה בין המחיצה החיובית לשלילית כדי לאפשר קביעת סף מדויקת; ונוכחות של טיפות בודדות בין המחיצות החיוביות והשליליות (הידועות גם בשם גשם), מה שיכול להפחית את הדיוק של כימות dPCR.
- PCR בנקודת קצה לבדיקת ספציפיות הפריימרים ותנאי PCR אופטימליים (אופציונלי)
תוצאות
עכברים זכרים בני שבעה עד תשעה שבועות הוזרקו עם AAV באמצעות הזרקה צידית של וריד הזנב ב 1.5 × 1012 vg / עכבר שסופקו בנפח הזרקה של 150-200 μL. ה- ssDNA AAV המשמש כאן סיפק טרנסגן Cre recombinase המונע על ידי מקדם CMV. העכברים שהוזרקו היו הומוזיגוטיים לאלל Ai14 של כתב Cre. כאשר נחשפים ל-Cre recombinase, תאים המכילים אלל Ai14 מבטאים את החלבון הפלואורסצנטי tdTomato. מאחר שביטוי tdTomato נגרם על ידי רקומבינציה גנומית המושרה על ידי Cre, תאים המבטאים tdTomato מצביעים על תאים שהותמרו ישירות על ידי AAV או שהיו תאי צאצא של תאים מותמרים. הנתונים המוצגים כאן הם של עכברים שהוזרקו AAV9-CMV-Cre ב 1.5 × 1012 vg / עכבר נמסר ב 160 μL (5.8-5.9 × 1013 vg / kg). העכברים הוקרבו 28 יום לאחר ההזרקה, והרקמות נאספו כמתואר לעיל. כמה שרירי שלד ואונות כבד עוכלו, והתאים שלהם נאספו באמצעות FACS. כמה אונות כבד הוקפאו מיד באמצעות מתילבוטאן מראש למיצוי חומצות גרעין. כמה שרירי שלד ואונות כבד תוקנו-הוקפאו לצורך הדמיה היסטולוגית של tdTomato פלואורסצנטי. tdTomato התבטא באופן מפוזר ברחבי הכבד (איור 2A) והארבע ראשי (איור 2C), מה שמצביע על כך ש-AAV9 הגיע באופן נרחב לאזורים שונים בשתי הרקמות.
DNA שהופק מכבד קפוא טרי ותאים ממוינים FAC שימש לכימות vg/dg באמצעות dPCR. ניתן להשתמש בכימות Vg/dg כדי להעריך את עקביות ההזרקה ואת יעילות ההמרה של AAV במדגם המנותח. פיזור טיפות 1D מדגימת רקמת כבד טרייה קפואה ותאים ממוינים FAC שימשו כדי להבטיח את תקפות הבדיקה (איור 3A,C). תרשים הפיזור הראה נוכחות של מחיצות חיוביות ושליליות, הפרדה ברורה בין המחיצות החיוביות והשליליות המאפשרת קביעה מדויקת של סף הזיהוי, ונוכחות של טיפות בודדות בין המחיצות החיוביות והשליליות, מה שיכול להפחית את הדיוק של בדיקת dPCR. עמידה בכל הקריטריונים הללו הצביעה על כך שתוצאות בדיקת dPCR היו תקפות. מספר עותקי הגן Polr2a בכל דגימה כומת כדי לקבוע את מספר הגנומים הדיפלואידיים של עכברים (2 עותקי גן Polr2a/גנום דיפלואידי עכבר), ונעשה שימוש בפריימרים/בדיקה כנגד רצף הטרנסגנים Cre recombinase כדי לכמת את הגנום הנגיפי (עותק טרנסגני אחד/גנום נגיפי, טבלה 1). ערך vg/dg כומת עבור דגימת רקמת כבד טרייה קפואה ותאים ממוינים FACS, והראה נוכחות של 187.7 vg/dg ו-4.7 vg/dg בכל דגימה, בהתאמה (איור 3B,D). דגימות מעכברים שהוזרקו באמצעות PBS ובקרות שאינן מכילות חומצות גרעין שימשו כבקרות שליליות.

איור 1: סקירה כללית של תחנת הזרקה תוך ורידית. (A) כלים הדרושים לביצוע הזרקה בעירוי. מוצג כאן הטיימר (1), (2) מרסן צינור עכבר, (3) לא חתוך ו (4) קונוסים מרסנים פלסטיים חתוכים, (5) ספוגית אלכוהול, (6) קופסת טיפים פיפטה ריקה המשמשת כפלטפורמה להרמת ריסון צינור העכבר, (7) רפידות סופגות חד פעמיות, (8) צינור חרוטי 15 מ"ל עם מים חמים, (9) מחזיק צינור 15 מ"ל, (10) גזה, ו (11) מזרק אינסולין. (B) העכבר ממוקם תחילה בתוך משנן הצינור. לאחר מכן, חרוט הריסון החתוך מוכנס כדי ליצור שרוול מרסן סביב העכבר, אם העכבר קטן מכדי להיות מרוסן על ידי משנן הצינור בלבד. ודא כי נשימתו של העכבר אינה מופרעת על ידי מרסנים. משנן הצינור ממוקם על גבי הפלטפורמה המוגבהת כדי לאפשר את מיקום זנב העכבר במים חמים. (C) מיקום זנב העכבר וזווית אחיזת המחט מיד לפני ביצוע ההזרקה. משוך לאחור את הזנב כך שהזנב נמתח, ואתר ההזרקה אופקי לחלוטין. המחט מקבילה לזנב ולווריד, והשיפוע פונה כלפי מעלה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
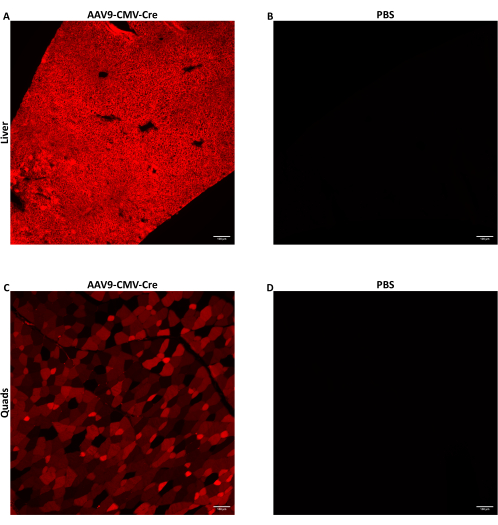
איור 2: זיהוי חלבון פלואורסצנטי לאחר הזרקת IV. עכברים זכרים בני שבעה עד תשעה שבועות המכילים את האלל Ai14 של כתב Cre הוזרקו עם AAV9-CMV-Cre בעוצמה של 1.5 × 10,12 vg/mouse שנמסרו ב-160 μL (5.8-5.9 × 10,13 vg/kg) או PBS. תמונות פלואורסצנטיות מייצגות של עכבר (A) כבד או (C) חלקים ארבע ראשיים לאחר AAV9 מתן הזרקת Cre IV. (B) מקטעי כבד או (D) ארבע ראשי מעכברים שהזריקו PBS צולמו כדי לשמש כבקרות שליליות. הרקמות נאספו והוקפאו 28 יום לאחר הזרקת העירוי. לאחר חשיפה ל-Cre, חלבון tdTomato פלואורסצנטי מתבטא בתאים מותמרים ובתאי צאצאים של תאים מותמרים. חתכים בעובי 10 מיקרומטר צולמו בהגדלה של פי 10. פסי קנה מידה = 100 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
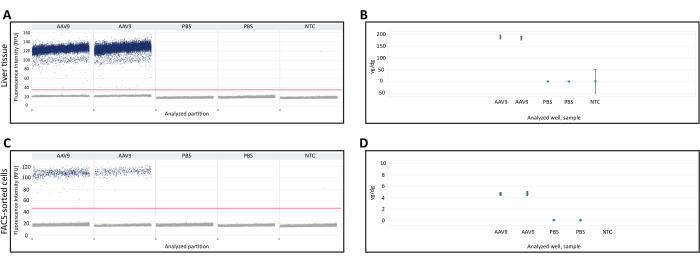
איור 3: כימות גנום וקטורי לכל גנום דיפלואידי (vg/dg). פיזור 1D של כימות גנום וקטורי dPCR ברקמת כבד (A) או (C) תאים ממוינים FACS שנאספו מעכברים שהוזרקו עם AAV9-CMV-Cre או PBS. תרשימי הפיזור מציגים את מחיצות dPCR החיוביות והשליליות, כמו גם את סף הזיהוי המצוין על ידי הקו האופקי על פני הדגימות. (B,D) כימות vg/dg לאחר כימות הגנום הדיפלואידי של העכבר והגנום הווקטורי ברקמת הכבד (B) או (D) דגימות תאים ממוינות FACS. התוצאות המוצגות כאן הן מעכבר מוזרק AAV9 יחיד ועכבר מוזרק PBS יחיד עם שכפול dPCR טכני עבור כל עכבר. קווי שגיאה מציינים רווח בר-סמך של 95% עבור כל דגימה. קיצורים: NTC= פקד שאינו תבנית; dPCR = PCR דיגיטלי; FACS = מיון תאים המופעלים על ידי פלואורסצנטיות. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
| תחל | רצף |
| פריימר Cre קדימה | CTGACGGTGGGAGAATGTTAAT |
| פריימר הפוך Cre | CATCGCTCGACCAGTTTAGTT |
| בדיקת Cre | /56-FAM/CGCAGGTGT/ZEN/AGAGAAGGCACTTAGC/3IABkFQ/ |
| פריימר קדמי Polr2a | GACTCCTTCACTCACTGTCTTC |
| פריימר הפוך Polr2a | TCTTGCTAGGCAGTCCATTATC |
| בדיקת Polr2a | /5HEX/ACGAGATGC/ZEN/TGAAAGAGCCAAGGT/3IABkFQ/ |
טבלה 1: רצפים של פריימרים וגשושיות המשמשים לכימות vg/dg. פריימרים של Cre ובדיקה שימשו לכימות הגנום הווקטורי. פריימרים ובדיקה Polr2a שימשו לכימות הגנום הדיפלואידי של העכבר.
Discussion
טיפולים מבוססי AAV טומנים בחובם פוטנציאל גדול להפרעות מונוגניות בשל הרבגוניות של AAV כווקטור ריפוי גנטי, המאפשר להתאים אישית AAVs כדי לענות על צרכי המסירה השונים של הפרעות שונות 4,5,7,9. AAVs ניתנים בדרך כלל באמצעות הזרקת IV במודלים פרה-קליניים של עכברים כדי לבדוק את הבטיחות והיעילות של טיפולים פוטנציאליים16. מכיוון שמינונים שונים של AAV מוזרקים יכולים לגרום להבדלים ניכרים בתוצאות הניסוי, זה קריטי עבור הנסיינים להיות מסוגלים להזריק באופן עקבי את מינון ה- AAV המיועד כדי להבטיח את התוקף והחוסן של נתוני ה- in vivo שנוצרו28. זריקות IV נמצאות בשימוש נרחב, אך הן מאתגרות מבחינה טכנית ודורשות הכשרה מקיפה ותרגול מתמשך כדי לפתח ולשמור על רמת מיומנות המבטיחה זריקות מוצלחות באופן עקבי 16,17,18,19. בנוסף להזרקה נכונה של AAV, בדרך כלל רצוי להשתמש בבדיקות כדי להעריך את יעילות ההפצה הביולוגית והאספקה של AAV המוזרק לרקמות היעד או לתאים29,30.
פרוטוקול זה נועד לסייע לנסיינים לבצע בקלות זריקות IV בהצלחה ובעקביות על ידי תיאור יסודי של הפרטים של פרוטוקול הזרקת IV אופטימלי למתן AAV בעכברים בני 7-9 שבועות, ללא הרדמה. חשוב לציין כי עכברים קטנים או גדולים משמעותית מעכברי בר בטווח הגילאים המשמש כאן עשויים להוות אתגר גדול יותר בשל ראות מופחתת של הוורידים או חוסר התאמה עם המעצורים המשמשים בשיטה זו. בעבר דווח כי זריקות IV זנב אינן מתאימות למתן ריאגנטים תוך ורידי בעכברים מתחת לגיל 6 שבועות בשל גודל כלי הדם הקטן31. למרות שניתן, ייתכן שיהיה קשה להזריק באופן עקבי עכברים במשקל של פחות מ-22.0 גרם בהצלחה. חוקרים המשתמשים בעכברים בגודל לא טיפוסי עשויים להזדקק לבצע התאמות להליך. פרוטוקול זה גם מתאר מספר בדיקות שניתן להשתמש בהן כדי להעריך את יעילות ההפצה הביולוגית והטרנסדוקציה של AAV.
יש לזכור כמה נקודות קריטיות בעת ביצוע פרוטוקול זה. במהלך ההזרקה, מחטי 29 G מספקות התנגדות גדולה יותר אם המחט אינה בתוך הווריד. פעולה זו מפחיתה את הנפח שאבד מהזרקה פריווסקולרית בשוגג של התמיסה במהלך ניסיונות הזרקה כושלים. מזרקי אינסולין הם בעלי נפחים מתים קטנים יותר מאשר מזרקים רגילים. אם משתמשים במזרק ו/או מחט שונים מאלה המפורטים כאן, ייתכן שיהיה צורך להכין נפח הזרקה נוסף בשלבי פרוטוקול 1.1.3.3 כדי לקחת בחשבון נפח שטח מת גדול יותר (למשל, להוסיף 30 μL למינון המיועד במקום 15 μL).
אם נוצרות בועות אוויר עדינות הנובעות משאיפה בדפנות המזרק תוך כדי שאיפת מנת AAV לתוך המזרק, משכו לאט את ההזרקה הלאה במעלה המזרק. פעולה זו תסיר את רוב בועות האוויר הקטנות. טען לפחות 10-15 μL נוספים של AAV לנפח המיועד להזרקה. נפח נוסף זה אמור לקחת בחשבון כל נפח שעלול ללכת לאיבוד במהלך סילוק בועות אוויר או ניסיונות הזרקה כושלים פוטנציאליים. (למשל, אם נפח היעד להזרקה הוא 150 μL, טען 165 μL לתוך המזרק (באמצע הדרך בין 160 μL ו 170 μL סימנים על סולם מזרק). אם המחט ממוקמת כראוי בתוך הווריד, והנפח במזרק הוא ב 165 μL מיד לפני ניסיון ההזרקה המוצלח, לספק את מגיב עד 15 μL נשארים מזרק (באמצע הדרך בין 10 μL ו 20 μL סימנים), ובכך לספק 150 μL (165 μL - 150 μL = 15 μL)). יישור לומן משופע (משופע הפונה כלפי מעלה) עם סולם המזרק מאפשר מעקב אחר הנפח המועבר במהלך ההזרקה.
חלק מהנסיינים יעדיפו למקם את העכבר על צדו כך שאחד הוורידים שלו יהיה ישר ונגיש בקלות בהשוואה לעכבר על רגליו. עם זאת, זנב העכבר על צדו יהיה משופע בזוויות שונות בהתאם לגודל העכבר הדורש התאמת זווית הזרקה בעת הזרקת עכברים בגדלים שונים. הדבר עלול להשפיע לרעה על עקביות הצלחת ההליך. במהלך ניסיונות תרגול ראשוניים, הנסיינים יכולים לנסות את שני כיווני ריסון העכבר כדי לקבוע את הגישה המועדפת עליהם. עמידת העכבר על רגליו מאפשרת גישה מהירה וקלה לשני ורידי הזנב הרוחביים. זה מקטין את זמן הריסון כאשר יש צורך בגישה לשני הוורידים במקרה של ניסיונות הזרקה כושלים מרובים.
אם מזריקים את הווריד הצידי קרוב לבסיס הזנב (קרוב יותר לגוף העכבר) (במיוחד עבור עכברים במשקל >30 גרם), יש להתאים את זווית ההזרקה מהמקביל לווריד ל-5°-10° לווריד מכיוון שהוריד בבסיס הזנב מעט עמוק יותר מאשר הוא דיסטלי.
פרוטוקולי בדיקת העיכול והזיהום של RNase המפורטים כאן אומתו על דגימות DNA שבודדו מרקמות כבד קפואות טריות המכילות סך של 175-700 ננוגרם של חומצות גרעין ב-20 מיקרוליטר. פרוטוקול העיכול של RNase נבדק גם על דגימות DNA שבודדו מרקמות כבד קפואות טריות ותאים ממוינים ב-FACS כדי לאשר את נוכחות הגנום הווקטורי והגנום של העכבר לאחר עיכול RNase. התוצאות הודגמו באמצעות אלקטרופורזה של ג'ל אגרוז של הגברת PCR בנקודת הקצה של מגברי המטרה.
ביצוע המתודולוגיה המתוארת יכול להפחית את זמן האימון והתרגול הדרוש כדי לשלוט בזריקות IV ולגרום לשיעור הזרקות מוצלח גבוה יותר, אשר יחסוך ריאגנטים. פרוטוקול זה משתמש בכלים פשוטים ונפוצים ללא צורך בציוד מתקדם או הגדרות שייתכן שלא יהיו זמינות. יתר על כן, שלבי ההזרקה בעירוי המפורטים כאן יכולים להיות מיושמים על מגוון רחב של זריקות שיש לתת תוך ורידי, כגון אוליגונוקלאוטידים אנטיסנס (ASOs), עם השינויים המתאימים שבוצעו בשלבי הכנת ההזרקה בהתאם להזרקה.
Disclosures
למחברים אין גילויים רלוונטיים לעבודה שפורסמה במאמר זה.
Acknowledgements
המחברים רוצים להודות לצוות מתקן הטיפול בבעלי חיים NINDS על תמיכתם. עבודה זו נתמכה על ידי האגף למחקר אינטרמורלי של NIH, NINDS (דוח שנתי מספר 1ZIANS003129). התוכן הוא באחריותם הבלעדית של המחברים ואינו מייצג בהכרח את הדעות הרשמיות של המכונים הלאומיים לבריאות.
Materials
| Name | Company | Catalog Number | Comments |
| 0.22 µm syringe filter | Millipore | SLGVM33RS | |
| 0.3 mL insulin syringes with 29G needle | BD Biosciences | 324702 | |
| 1.7 mL microcentrifuge tube | Crystalgen | 23-2051 | |
| 10 mL syringe | BD Biosciences | 302995 | |
| 100% EtOH | The Warner Graham Company | 201096 | |
| 10x phosphate-buffered saline (PBS) | Corning | 46-013-CM | Used to prepare 1x PBS for tissue fixation |
| 15 mL conical tube | Corning | 430766 | |
| 15 mL conical tube holder | Multiple sources | N/A | |
| 190 proof ethyl alcohol | The Warner Graham Company | 6810-01-113-7320 | Used to prepare 70% ethanol |
| 1x sterile PBS | Gibco | 10010023 | |
| 2 mL microcentrifuge tissue storage tubes | Eppendorf | 022363344 | |
| 4% paraformaldehyde (PFA) | Electron Microscopy Sciences | 157-4 | |
| Adeno-associated virus (AAV) | Charles River | N/A | Single-stranded DNA (ssDNA) AAV was packaged to deliver Cre recombinase as the transgene driven by CMV promoter |
| Alcohol swab | BD Biosciences | 326895 | |
| Bead lysis tube | Next Advance | GREENE5 | |
| BsuRI (HaeIII) restriction enzyme | Thermo Fisher Scientific | ER0151 | |
| Bullet blender | Next Advance | BBX24B | |
| Ai14-derived mice from JAX 007914 strain (genetic background: C57BL/6J) | N/A | N/A | Mice containing Ai14 Cre-reporter allele were purchased from JAX (catalog number: 007914) |
| Disposable absorbent pads | Fisherbrand | 1420662 | |
| Dissection forceps | Fine Science Tools (F.S.T) | 11251-35 | |
| Dissection scissors | Fine Science Tools (F.S.T) | 14085-08 | |
| DNA degradation reagent (DNAZap) | Invitrogen | AM9890 | |
| DNA-Extraction RNase A | Qiagen | 19101 | For RNA digestion during nucleic acid extraction |
| DNase-free RNase for DNA cleanup | F. Hoffmann-La Roche | 11119915001 | For RNA digestion after nucleic acid extraction |
| dPCR Probe PCR Kit | Qiagen | 250102 | |
| dPCR software | Qiagen | N/A | QIAcuity Software Suite |
| Elevated platform | Multiple sources | N/A | An empty pipette tips box was used to elevate the mouse restrainer during tail warming up |
| Fluorescence microscope | Multiple sources | N/A | Model used here: Nikon Eclipse Ti |
| Fluorescence microscope software | Multiple sources | N/A | Software used here: NIS-Elements |
| Gauze | Covidien | 9022 | |
| Heat block | Eppendorf | Thermomixer 5350 | |
| High-speed centrifuge | Eppendorf | 22620689 | |
| Metal container | Vollrath | 80125 | |
| Methylbutane | J.T. Baker | Q223-08 | |
| Molecular grade water | Quality Biological | 351-029-131 | |
| Mouse tube restrainer | Braintree Scientific | TV-RED-150-STD | |
| Myfuge mini centrifuge | Benchmark Scientific | C1012 | |
| Polymerase chain reaction thermal cycler | Bio-Rad Laboratories | 1851148 | Model: C1000 Touch |
| Precision wipes | Kimberly-Clark Professional | 7552 | |
| Proteinase K | Qiagen | 19131 | |
| QIAcuity dPCR Nanoplate 26k 24-well | Qiagen | 250001 | |
| QIAcuity One dPCR system | Qiagen | 911020 | |
| Qiagen DNeasy Blood & Tissue Kit | Qiagen | 69504 | Used for DNA extraction from tissues |
| Qiagen QIAamp DNA Micro Kit | Qiagen | 56304 | Used for cleanup of genomic DNA, and the isolation of DNA from small volumes of blood prtocotol was used for DNA extraction from FACS-sorted cells |
| Rodent restrainer cone | Braintree Scientific | MDC-200 | |
| Scale | Ohaus | 72212663 | |
| Styrofoam box | Multiple sources | N/A | |
| Sucrose | Sigma-Aldrich | S9378-1kg | |
| Surface cleaner and disinfectant | Peroxigard | 29101 | |
| Timer | Multiple sources | N/A | |
| Transfer forceps | Fine Science Tools (F.S.T) | 91113-10 | |
| Vortex | Daigger & Company | 22220A | Model: Daigger Vortex Genie 2 |
References
- Tisdale, A., et al. The ideas initiative: Pilot study to assess the impact of rare diseases on patients and healthcare systems. Orphanet J Rare Dis. 16 (1), 429 (2021).
- Condo, I. Rare monogenic diseases: Molecular pathophysiology and novel therapies. Int J Mol Sci. 23 (12), 6525 (2022).
- Vaisitti, T., et al. The frequency of rare and monogenic diseases in pediatric organ transplant recipients in italy. Orphanet J Rare Dis. 16 (1), 374 (2021).
- Bulcha, J. T., Wang, Y., Ma, H., Tai, P. W. L., Gao, G. Viral vector platforms within the gene therapy landscape. Signal Transduct Target Ther. 6 (1), 53 (2021).
- Lundstrom, K. Viral vectors in gene therapy: Where do we stand in 2023. Viruses. 15 (3), 698 (2023).
- Wang, C., et al. Emerging non-viral vectors for gene delivery. J Nanobiotechnology. 21 (1), 272 (2023).
- Naso, M. F., Tomkowicz, B., Perry, W. L., Strohl, W. R. Adeno-associated virus (aav) as a vector for gene therapy. BioDrugs. 31 (4), 317-334 (2017).
- Ghosh, S., Brown, A. M., Jenkins, C., Campbell, K. Viral vector systems for gene therapy: A comprehensive literature review of progress and biosafety challenges. Appl Biosaf. 25 (1), 7-18 (2020).
- Wang, D., Tai, P. W. L., Gao, G. Adeno-associated virus vector as a platform for gene therapy delivery. Nat Rev Drug Discov. 18 (5), 358-378 (2019).
- Srivastava, A. Rationale and strategies for the development of safe and effective optimized aav vectors for human gene therapy. Mol Ther Nucleic Acids. 32, 949-959 (2023).
- Mukherjee, P., Roy, S., Ghosh, D., Nandi, S. K. Role of animal models in biomedical research: A review. Lab Anim Res. 38 (1), 18 (2022).
- Jucker, M. The benefits and limitations of animal models for translational research in neurodegenerative diseases. Nat Med. 16 (11), 1210-1214 (2010).
- Vandamme, T. F. Use of rodents as models of human diseases. J Pharm Bioallied Sci. 6 (1), 2-9 (2014).
- Anders, H. J., Vielhauer, V. Identifying and validating novel targets with in vivo disease models: Guidelines for study design. Drug Discov Today. 12 (11-12), 446-451 (2007).
- Turner, P. V., Brabb, T., Pekow, C., Vasbinder, M. A. Administration of substances to laboratory animals: Routes of administration and factors to consider. J Am Assoc Lab Anim Sci. 50 (5), 600-613 (2011).
- Prabhakar, S., Lule, S., Da Hora, C. C., Breakefield, X. O., Cheah, P. S. Aav9 transduction mediated by systemic delivery of vector via retro-orbital injection in newborn, neonatal and juvenile mice. Exp Anim. 70 (4), 450-458 (2021).
- Hauff, P., Nebendahl, K., Kiessling, F., Pichler, B. J., Hauff, P. Drug administration. Small Animal Imaging: Basics and Practical. , 127-152 (2017).
- Saleem, M., et al. A new best practice for validating tail vein injections in rat with near-infrared-labeled agents. J Vis Exp. (146), (2019).
- Resch, M., Neels, T., Tichy, A., Palme, R., Rulicke, T. Impact assessment of tail-vein injection in mice using a modified anaesthesia induction chamber versus a common restrainer without anaesthesia. Lab Anim. 53 (2), 190-201 (2019).
- Glascock, J. J., et al. Delivery of therapeutic agents through intracerebroventricular (icv) and intravenous (iv) injection in mice. J Vis Exp. (56), 2968 (2011).
- Grames, M. S., Jackson, K. L., Dayton, R. D., Stanford, J. A., Klein, R. L. Methods and tips for intravenous administration of adeno-associated virus to rats and evaluation of central nervous system transduction. J Vis Exp. (126), 55994 (2017).
- Yano, J., Lilly, E. A., Noverr, M. C., Fidel, P. L. A contemporary warming/restraining device for efficient tail vein injections in a murine fungal sepsis model. J Vis Exp. (165), 61961 (2020).
- Warren, J. S. A., Feustel, P. J., Lamar, J. M. Combined use of tail vein metastasis assays and real-time in vivo imaging to quantify breast cancer metastatic colonization and burden in the lungs. J Vis Exp. (154), 60687 (2019).
- JoVE Science Education Database. . Lab Animal Research. Compound administration I. , (2023).
- UCSF Office of Research, Institutional Animal Care and Use Program. Lateral tail vein injection in mice and rats (preferred technique for vascular access in mice Available from: https://iacuc.ucsf.edu/sites/g/files/tkssra751/f/wysiwyg/STD%20PROCEDURE%20-%20Misc%20Rodent%20Procedures%20-%20Lateral%20Tail%20Vein%20Injection%20in%20Mice%20and%20Rats.pdf (2023)
- Jones, K. Tail vein injections in the mouse and rat sop. UBC Animal Care Guidelines SOP: ACC-2012-Tech03. , (2012).
- Liadaki, K., Luth, E. S., Kunkell, L. M. Co-detection of gfp and dystrophin in skeletal muscle tissue sections. Biotechniques. 42 (6), 699-700 (2007).
- Burr, A., et al. Allometric-like scaling of aav gene therapy for systemic protein delivery. Mol Ther Methods Clin Dev. 27, 368-379 (2022).
- Lang, J. F., Toulmin, S. A., Brida, K. L., Eisenlohr, L. C., Davidson, B. L. Standard screening methods underreport aav-mediated transduction and gene editing. Nat Commun. 10 (1), 3415 (2019).
- Rodriguez-Estevez, L., Asokan, P., Borras, T. Transduction optimization of aav vectors for human gene therapy of glaucoma and their reversed cell entry characteristics. Gene Ther. 27 (3-4), 127-142 (2020).
- Hatakeyama, S., Yamamoto, H., Ohyama, C. Tumor formation assays. Methods Enzymol. 479, 397-411 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved