התקדמות בטכנולוגיית אורגנואיד בקר באמצעות ממשקים חד-שכבתיים של מעי קטן וגדול
In This Article
Summary
מחקר זה מציג פרוטוקול ליצירת חד-שכבות דו-ממדיות של מעי בקר מאורגנואידים, ומציע גישה משופרת לחקר אינטראקציות בין פונדקאי לפתוגן. הוא כולל שיטות להערכת שלמות ותפקוד הממברנה, קידום מודלים במבחנה המחקים את הפיזיולוגיה של מערכת העיכול של הבקר. גישה זו מבטיחה יתרונות ביו-רפואיים וחקלאיים משמעותיים, כולל אסטרטגיות טיפול משופרות.
Abstract
קידום הידע בפיזיולוגיה של מערכת העיכול ומחלותיה תלוי באופן קריטי בפיתוח מודלים מדויקים וספציפיים למין במבחנה , המחקים נאמנה את רקמות המעי in vivo . זה חיוני במיוחד לחקר אינטראקציות פונדקאי-פתוגן בבקר, שהם מאגרים משמעותיים לפתוגנים המהווים סיכונים חמורים לבריאות הציבור. אורגנואידים תלת-ממדיים מסורתיים מציעים גישה מוגבלת למשטח האפי של אפיתל המעי, מכשול שהתגברו עליו עם הופעתן של תרביות חד-שכבתיות דו-ממדיות. תרביות אלה, שמקורן בתאים אורגנואידים, מספקות משטח לומינלי חשוף למחקר נגיש יותר. במחקר זה, פרוטוקול מפורט מוצג ליצירה ותחזוקה של תרביות חד-שכבתיות דו-ממדיות מתאים של אורגנואידים במעיים קטנים וגדולים של בקר. שיטה זו כוללת פרוטוקולים להערכת שלמות הממברנה באמצעות התנגדות חשמלית טרנסאפיתל וחדירות פארא-תאית לצד טכניקות צביעה אימונוציטוכימיות. פרוטוקולים אלה מניחים את היסודות להקמה ולאפיון של מערכת תרבית חד-שכבתית דו-ממדית של בקר, ודוחפים את הגבולות של יישומי שיטות אלה במחקר ביו-רפואי ותרגומי בעל חשיבות לבריאות הציבור. שימוש בגישה חדשנית זו מאפשר פיתוח מודלים פיזיולוגיים רלוונטיים במבחנה לחקר מצבים נורמליים וחולים כאחד של פיזיולוגיה של מעי בקר. ההשלכות על ההתקדמות הביו-רפואית והחקלאית הן עמוקות, וסוללות את הדרך לטיפולים יעילים יותר במחלות מעיים בבקר, ובכך משפרים הן את רווחת בעלי החיים והן את בטיחות המזון.
Introduction
תרבית תאי גזע אפיתליאליים במעי בתרביות תלת ממדיות (3D), הידועות כאורגנואידי מעיים, מסמנת התקדמות משמעותית בטכנולוגיית המבחנה לחקר תפקודי מעיים, תזונה ואינטראקציות עם פתוגנים 1,2. אורגנואידים אלה מחקים את המבנה המורכב של אפיתל המעי in vivo על ידי שכפול עצמי וארגון לתצורות תלת-ממדיות המקיפות שושלות תאי מעיים שונות3. תכונה זו מדגישה את הפוטנציאל הרב שלהם להניע את ההבנה של הביולוגיה של המעי קדימה.
העניין הגובר ביישום טכנולוגיית אורגנואיד מעיים על חיות משק מחייב שכלול של טכניקות תרבות ותחזוקה 4,5. הרלוונטיות של טכנולוגיה זו מודגשת על ידי ההשפעה הפוטנציאלית שלה על חקר בריאות המעיים של חיות משק, אשר ממלאת תפקיד קריטי בפריון שלהם, וכתוצאה מכך, הכלכלה של תעשיית המזון לחיות על ידי השפעה על רווחת בעלי חיים ועלויות תפעול 6,7. באופן ספציפי, שימוש בתרביות אורגנואידים במעיים כדי לחקור את תפקוד המעיים של בקר הוא בעל חשיבות עליונה, בהתחשב בתפקידם כמאגרים לפתוגנים אנטריים זואונוטיים, כגון Salmonella spp. ו- Escherichia coli (E. coli) O157:H78. פתוגנים אלה ממוקמים במקטעים מסוימים של המעי, ולכן חיוני להבדיל בין שיטות תרבית אורגנואידים במעי לפי מקטע מעיים כדי לשפר את הדיוק במחקרים9.
מכשול משמעותי בחקר אורגנואידי מעיים הוא הגישה המוגבלת למשטח האפי של תא האפיתל10. בתרבית בתוך מטריצה חוץ-תאית (ECM), התאים מכוונים את עצמם באופן טבעי כך שפני השטח הבסיסיים פונים החוצה, והמשטח האפי מופנה פנימה10. כדי להתמודד עם אתגר זה, מוצגות שיטות הכוללות ניתוק אורגנואידים תלת-ממדיים לתאים בודדים וזריעתם לתוספות תרבית תאים חדירים למחצה. מערך זה יוצר ממשק בין המשטח האפי לתא בזולטרלי. פרוטוקול זה מדגים כי תאים שמקורם באורגנואידים של מעי בקר יכולים ליצור חד-שכבה דו-ממדית קוהרנטית, כפי שמעידות מדידות התנגדות חשמלית טרנסאפיתל (TEER) ומבחני חדירות פארא-תאיים. בנוסף, התפתחות הקוטביות התאית עם גבולות מברשת וצמתים הדוקים בתאים חד-שכבתיים דו-ממדיים שמקורם באורגנואידים מאושרת באמצעות אימונופלואורסנציה ומיקרוסקופ אלקטרונים, המשקף את תכונות אפיתל המעי in vivo .
במחקר זה, האילאום מייצג את מערכת המעי הדק, ופי הטבעת מסמל את מערכת העיכול הגדולה. ברירות אלה מבוססות על פתוגנים אנטריים רלוונטיים כגון סלמונלה spp., אשר יכול לשנות את אילאום11, ו E. coli O157:H7 הידוע בעיקר ליישב את פי הטבעת9 בבקר. הבחירה של מקטעי מעיים ספציפיים אלה מדגישה את הצורך בהתאמת שיטות תרבית אורגנואידים במעי לאזור המעי לצורך דיוק במחקר. שיטות אלה מפרטות את ההליך לטיפוח יעיל של ממשק חד-שכבתי דו-ממדי שמקורו באורגנואידים ממקטעי מעיים אלה, ומספקות מודל חזק לחקר בריאות מעי בקר, זיהומים פתוגניים ואינטראקציות בין מיקרוביום המעי לפונדקאי.
Protocol
קריפטים של מעיים נרכשו מעודפי דגימות מעיים שמקורם בבית מטבחיים מקומי, ואיתות של תורמים מסופק בטבלה משלימה 1. אורגנואידים נוצרו באמצעות רקמות שמקורן בבעלי חיים שעברו המתת חסד הומנית בבית מטבחיים, ובעלי חיים לא נרכשו רק למחקר זה; לפיכך, מחקר זה פטור מביקורת IACUC, והצהרת אתיקה אינה ישימה.
1. ציפוי ECM על תוספות תרבית תאים לתרבית חד-שכבתית דו-ממדית שמקורה באורגנואידים
הערה: כל ההליכים מתבצעים באמצעות חומרים מעוקרים וטכניקות אספטיות בארון בטיחות ביולוגית. כל הריאגנטים נשמרים על קרח לאורך כל ההליך, אלא אם כן צוין אחרת.
- הכן 100 μL של ECM לציפוי כל 0.33ס" מ 2 תרבית תאים להוסיף על ידי ערבוב מדיום בסיסי עם 2% (v/v) הידרוג'ל מבוסס ECM במיקרו צינור.
- יש להסיר את תרבית התאים הבודדת מהאריזה עם מלקחיים מעוקרים ולהניח בנפרד בבארות של צלחת תרבית תאים שטוחה ושטוחה בעלת 24 בארות.
- החל 100 μL של ציפוי ECM שהוכן בשלב 1.1 על התא האפי של כל תוספת תרבית תאים שהוכנה בשלב 1.2.
- יש להחליף את המכסה ולדגור על צלחת תרבית התאים המכילה תוספות תרבית תאים מצופות באינקובטור לח בטמפרטורה של 37°C ו-5% CO2 למשך שעה אחת.
- עבור תאי אורגנואיד איליאליים, העלון מוכן לשימוש לאחר דגירה של שעה אחת. עבור תאי אורגנואיד רקטליים, לאחר דגירה של שעה אחת, יש להחליף את ציפוי ECM בתווך תרבית חד-שכבתית רקטלית ולדגור למשך הלילה (טבלה 1). הכן תוספות נוספות של תרביות תאים עבור פקדים ריקים אם מיועד לבצע מדידות TEER.
| אילאום | פי הטבעת | |
| זמן הדגירה של ציפוי ECM | 1 שעות | שעה ואחריה לילה במדיה התרבותית של מונולייר |
| תוספים ל מדיום תרבית אורגנואידים | ||
| CHIR99021 | ||
| LY2157299 | LY2157299 | |
| Y-27632 | Y-27632 | |
| סרום בקר עוברי | סרום בקר עוברי | |
| צפיפות זריעת תאים (תאים/באר) | 5 x 105 | 3 x 105 |
טבלה 1: סיכום הפרוטוקול הממוטב ליצירת חד-שכבות דו-ממדיות הנגזרות מאורגנואידים רקטליים ורקטיליים של בקר בוגר.
2. זריעת תאי אורגנואיד רקטליים ו/או רקטליים ותרבית חד-שכבתית דו-ממדית
הערה: הפרוטוקול המתואר בסעיף זה משתמש באורגנואידים איליאליים ורקטליים של בקר, אשר תורבתו ותוחזקו על לוחות של 48 בארות תוך שימוש בטכניקות המתוארות5. לקבלת תוצאות מיטביות, מומלץ להשתמש באורגנואידים מתוחזקים היטב שעברו יותר מ -3 פעמים לאחר ההקמה הראשונית וגודלו בתרבית במשך יותר מ -3 ימים לאחר המעבר האחרון.
- מבלי להפריע לכיפת הידרוג'ל מבוססת ECM המכילה אורגנואידים בוגרים, הסר את מדיית תרבית האורגנואידים באמצעות פיפט פסטר חד פעמי מזכוכית המחובר למערכת ואקום והוסף 300 מיקרוליטר של תמיסת דה-פולימריזציה ECM קרה כקרח לכל באר. לדגור לפחות 1 שעה ב 4 °C (75 °F).
הערה: לחלופין, יש לשבש מכנית את האורגנואיד המכיל כיפת הידרוג'ל מבוססת ECM לאחר הוספת תמיסת דה-פולימריזציה של ECM ולאסוף תרחיף בצינור חרוטי של 15 מ"ל לפני הדגירה ב-4°C. שיטה זו מומלצת כאשר אורגנואידים שאינם מיועדים לשמש לתרבית חד-שכבתית דו-ממדית מתורבתים בו זמנית על אותה צלחת. צפיפות התרביות האורגנואידיות משפיעה באופן משמעותי על מספר הבארות הדרושות לזריעה אופטימלית לתוספות תרביות תאים.- עבור תרביות אורגנואידים בצפיפות גבוהה (איור משלים 1A), תוספות תרבית תאים רקטליות משתמשות ביחס זריעה בטווח של 1:1 עד 1:2, כלומר באר תרבית אחת יכולה לזרוע באר אחת עד שתיים. עבור איליאום, שמור על יחס של 1:1. לעומת זאת, תרביות בצפיפות נמוכה יותר (איור משלים 1B) זקוקות ליותר בארות תרבות; השתמש ב-3-4 בארות תרבית אורגנואידים רקטליות עבור תוספת אחת של תרבית תאים רקטלית (יחס של 3-4:1), ובבארות תרבית אורגנואידים איליאליות עבור תוספת תרבית תאים איליאלית אחת (יחס של 4-5:1).
- בדוק חזותית המסת הידרוג'ל מלאה מבוססת ECM ואסוף תרחיף אורגנואיד לצינור חרוטי של 15 מ"ל.
- אורגנואידים גלולתיים על ידי צנטריפוגה ב 200 x גרם ו 4 ° C במשך 5 דקות. להשליך supernatant. גלולת השעיה ב-1 מ"ל של תמיסת אנזים דיסוציאציה של תאים רקומביננטיים בתוספת 10 מיקרומטר Y-27632.
- יש לדגור על תרחיף אורגנואידים באמבט מים של 37 מעלות צלזיוס למשך 10 דקות עם טלטול לסירוגין של 3-5 שניות עם מערבולת כל 2-3 דקות כדי להקל על דיסוציאציה אורגנואידית יעילה.
- לאחר עיכול אנזימטי, הוסף 5 מ"ל של מדיום בסיסי ופיפטה באגרסיביות עם מיקרופיפטה P1000 כדי לשבש עוד יותר אורגנואידים לתאים בודדים. בדוק את המתלה עבור גושים אורגנואידים, ואם עדיין ניתן להבחין חזותית, חזור על פיפטינג כדי לשפר את הדיסוציאציה של תא יחיד.
- הכינו צינור חרוטי 50 מ"ל עם מסננת תאים 70 מיקרומטר. הרטיבו מראש את המסננת על ידי מריחת 1-2 מ"ל של מדיום בסיסי.
- סנן את תרחיף התאים דרך המסננת כדי להסיר שאריות של פסולת הידרוג'ל מבוססת ECM וגושי תאים גדולים. שטפו את הצינור המקורי של 15 מ"ל ואת מסננת התאים של 70 מיקרומטר בתוספת של 10 מ"ל של מדיום בסיסי.
הערה: אם תרחיף התא אינו עובר בקלות דרך מסננת, זה עשוי להיות אינדיקציה לדיסוציאציה אורגנואידית חלקית. ניתן לנסות להעביר מחדש את תרחיף התאים שנאסף דרך אותה מסננת תאים של 70 מיקרומטר. ייתכן שיהיה צורך בהפרעה אנזימטית או מכנית נוספת. - תרחיף חד-תאי גלולה על ידי צנטריפוגה ב 200 x גרם ו 4 ° C במשך 5 דקות. הסר supernatant ו resuspend תאים עם נפח מתאים של מדיום בסיסי כדי לבצע ספירת תאים.
- ספור תאים קיימא עם המוציטומטר לאחר צביעה כחולה טריפאן כדי לחשב את המספר הכולל של תאים שנאספו.
- תרחיף חד-תאי גלולה על ידי צנטריפוגה ב 200 x גרם ו 4 ° C במשך 5 דקות. הסר תאים סופרנאטנטיים והשהה מחדש לצפיפות זריעה מתאימה בתווך תרבית חד-שכבתי מתאים (טבלה 1).
- עבור תאי אורגנואיד איליאליים, יש להשהות מחדש תאים לריכוז של 2.5 x 106 תאים/מ"ל כדי להשיג צפיפות זריעה של 5 x 105 תאים לכל תרבית תאים ב-200 מיקרוליטר של מדיום תרבית חד-שכבתי איליאלי, שהוא מצע תרבית האורגנואידים בתוספת LY2157299 500 ננומטר, 10 מיקרומטר Y-27632 וסרום בקר עוברי (FBS) 20%.
- עבור תאי אורגנואידים רקטליים, תאי השעיה מחדש לריכוז של 1.5 x 106 תאים / מ"ל כדי להשיג צפיפות זריעה של 3 x 105 תאים לכל תרבית תאים להכניס 200 μL של מדיום תרבית חד שכבתית רקטלית, שהוא מדיה תרבית אורגנואידים בתוספת 100 ננומטר CHIR99021, 500 ננומטר LY2157299, 10 מיקרומטר Y-27632, ו-20% FBS.
- יש לאחזר את צלחת תרבית התאים בעלת 24 הקידוחים עם תוספות תרבית תאים מצופות ECM ולרוקן את התא האפי של תרבית התא בשאיבת ואקום זהירה כדי לא להפריע לציפוי.
- יש למרוח בעדינות 200 μL של תרחיף חד-תאי שהוכן בשלב 2.10 על התא האפי של תוספת תרבית התא. עבור הבקרה הריקה, הוסף 200 μL של מדיה תרבית ללא תאים בתא האפיקאלי. עבור הבקרה הריקה, הוסף 200 μL של מדיה תרבית ללא תאים בתא האפיקאלי.
- יש למרוח 500 μL של מדיום תרבית חד-שכבתי בתוספת מתאימה (תלוי בתאים איליאליים לעומת רקטליים) על החדר הבזולטרלי של כל באר.
- יש לדגור באינקובטור לח בטמפרטורה של 37°C ו-5%CO2 כדי להקל על הידבקות התא וצמיחתו ליצירת חד-שכבה דו-ממדית על תוספת תרבית התא.
- החליפו את אמצעי התרבית הן בחדרים אפיים והן בתאים בזולטרליים אחת ליומיים החל מ-48 שעות לאחר זריעת תאים. ודא זמן דגירה שווה עבור הפקד הריק וההוספה המכילה תא.
3. מדידת TEER
הערה: השיטה המתוארת כאן משתמשת במערכת מדידה ידנית של TEER הזמינה מסחרית בשם מד מתח אפיתל עם זוג אלקטרודות Ag/AgCl (איור 1A). קביעת TEER על פני חד-שכבה דו-ממדית דורשת מדידה של בארות ריקות. ודא שהקריאה הריקה נלקחת באותו אופן כמו הדגימה.
- אחזר צלחת המכילה תוספות תרבית תאים עם חד-שכבות דו-ממדיות שמקורן באורגנואידים וריק מהאינקובטור. מניחים לצלחת להגיע לטמפרטורת החדר למשך כ-10 דקות.
- לחטא את האלקטרודות עם 70% אתנול ולאפשר להם להתייבש לחלוטין.
- הציגו בזהירות את האלקטרודות עם הקצה הקצר בתא האפי והקצה הארוך בתא הבזולטרלי (איור 1A).
הערה: נדרשת זהירות יתרה כדי לא להפריע לחד-שכבה של התא. - אפשר לקריאה להתאזן ורשום את הערך באוהם כאשר הוא מתייצב.
הערה: הרגישות של מד המתח היא כזו שתנודות בערך האוהם יתרחשו בעת לקיחת מדידת ההתנגדות החשמלית. קריאה אמינה מתקבלת כאשר המדידות מתייצבות ומרחפות באופן עקבי סביב ערך מישורי. - קבע TEER של monolayer דו-ממדי באמצעות הנוסחה הבאה:
TEER (Ω x ס"מ 2) = שטח הפנים של תוספות תרבית תאים (ס"מ 2) x התנגדות חשמלית נטו
כאשר ההתנגדות החשמלית נטו שווה להתנגדות הנמדדת של הכנס החד-שכבתי של התא פחות ההתנגדות הנמדדת של התוספת הריקה. תוספות תרבית תאים עבור לוחות 24 בארות יש שטח פנים של 0.33 ס"מ2.
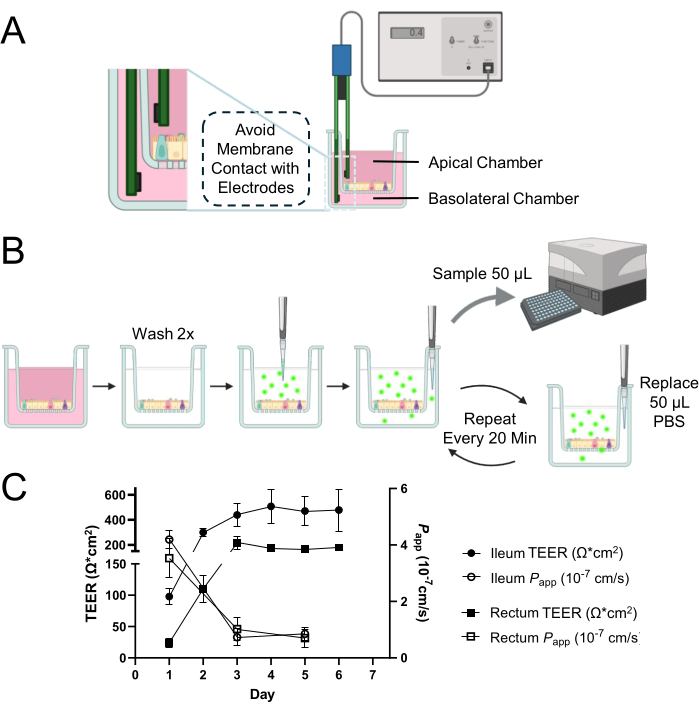
איור 1: הערכת שלמות מחסום אפיתל של חד-שכבה דו-ממדית שמקורה באורגנואידים במעי בקר. (A) סכמטי של מיקום מתאים של אלקטרודות בתוך החדרים האפיקליים והבזולטרליים של תוספת תרבית תאים למדידות TEER. האלקטרודה הקצרה מוחדרת לתא האפיקאלי, והאלקטרודה הארוכה ממוקמת בתא הבזולטרלי בזהירות כדי למנוע מגע עם הממברנה. (B) סכמה של תהליך בדיקת החדירות. תאי תרבית תאים נשטפים 2x עם PBS מחומם, ו 0.5 מ"ג / מ"ל 4 kDa FITC-dextran tracer מומס PBS מוחל על תא apical . אליציטוטים חוזרים של 50 μL מהחדר הבזולטרלי נדגמים עם החלפת נפח שווה של PBS כדי לשמור על הנפח הכולל בחדר הבזולטרלי לאורך כל תקופת הדגירה. עוצמת הפלואורסצנטיות של aliquot נמדדת באמצעות קורא microplate כדי לכמת את הדיפוזיה של נותב 4 kDa FITC-dextran על פני monolayer התא. (C) ההתפתחות הדינמית של שלמות המחסום בתוך חד-שכבות איליאליות ורקטליות לאורך זמן הוערכה באמצעות מדידות TEER (המיוצגות על ידי עיגולים סגורים עבור האילאום וריבועים סגורים עבור פי הטבעת) ומבחני חדירות (המסומנים על ידי עיגולים פתוחים עבור האילאום וריבועים פתוחים עבור פי הטבעת) עם נותב 4 kDa FITC-dextern. ביום השלישי של התרבות, שני סוגי החד-שכבות הציגו את הקמתם של מחסומי אפיתל יציבים ופונקציונליים, כפי שמעידים פרופילי TEER וחדירות בהתאמה. התוצאות הן ממוצע של לפחות שני ניסויים עצמאיים עם שני שכפולים טכניים. קווי שגיאה מייצגים את ה- SEM של המדידות. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
4. בדיקת חדירות פארא-תאית
הערה: בדיקה זו כוללת את קביעת עוצמת הפלואורסצנטיות הנובעת מדיפוזיה של איזותיוציאנט פלואורסצאין (FITC)-דקסטרן מהחדר האפי לחדר הבזולטרלי על פני חד-שכבות דו-ממדיות במשך 120 דקות (איור 1B). לקבלת תוצאות מיטביות, מומלץ למזער את החשיפה לאור במהלך הבדיקה ולבצע מדידות בקורא microplate מיד לאחר כל דגימה כדי למנוע כל ירידה או מרווה של פלואורסצנטיות. ניתן להשתמש בכל באר פעם אחת בלבד ולא ניתן לעשות בה שימוש חוזר בבדיקות הבאות. הכינו לפחות 2 בארות שישמשו כשכפולים טכניים לכל בדיקה. לדוגמה, נדרשות בסך הכל 6 בארות כדי לקבל את התוצאות המוצגות באיור 1C, שבו הבדיקות בוצעו בשכפול ב-3 נקודות זמן שונות (ימים 1, 3 ו-5 של תרבית).
- הכן סדרת דילול עקומה סטנדרטית עם 4 kDa FITC-dextran במי מלח חוצצי פוספט (PBS). עבור כל דילול, פיפטה 50 μL לצלחת 96 באר משולש.
הערה: מומלץ ליצור סדרה של 5-7 דילולים בטווח של 0 עד 0.5 מ"ג/מ"ל. - קבע את עוצמת הפלואורסצנטיות של התקנים בקורא מיקרו-לוחות מכויל מראש באורך גל עירור של 495 ננומטר ובאורך גל פליטה של 535 ננומטר.
- חשב את הרגרסיה הליניארית עם תוצאות עוצמת פלואורסצנטיות ליצירת עקומה סטנדרטית.
- אחזור צלחת המכילה תוספות תרבית תאים עם חד-שכבות דו-ממדיות שמקורן באורגנואידים מהאינקובטור. הסר את אמצעי התרבית החד-שכבתיים מהחדר האפי והבזולטרלי של עלון תרבית התא המכיל את החד-שכבה הדו-ממדית שמקורה באורגנואידים להערכה.
- שטפו בעדינות כל תא 2x עם 200 μL (תא אפיקלי) ו-500 μL (תא בזולטרלי) של PBS שחומם מראש, בהתאמה.
- הסר את תמיסת השטיפה מתא האפיקלי והחל 200 μL של 0.5 מ"ג / מ"ל 4 kDa FITC-dextran tracer ב- PBS על התא האפי של תוספת תרבית התא.
- יש לדגור באינקובטור לח בטמפרטורה של 37°C ו-5%CO2 למשך 20 דקות.
- דגימה של 50 μL מהחדר הבזולטרלי של הצלחת המודגרת בת 24 הקידוחים והעברה לצלחת תואמת 96 בארות לקורא מיקרו-צלחות.
- החלף 50 μL של PBS טרי בתא basolateral של הבאר שנדגמה.
- בצע מיד מדידת עוצמת פלואורסצנטיות בקורא מיקרו-לוחות מכויל מראש באורך גל עירור של 495 ננומטר ובאורך גל פליטה של 535 ננומטר.
- חזור על שלבים 4.6-4.10 כל 20 דקות עד 120 דקות. בסוף הבדיקה, אם רוצים לשמר את החד-שכבה הדו-ממדית, שוטפים הן את החדר האפי והן את החדר הבזולטרלי ב-PBS 2x טרי, מחליפים במדיום תרבית חד-שכבתי טרי ודוגרים.
הערה: ניתן לבצע הערכה נוספת של חד-שכבות דו-ממדיות, כלומר, מדידות TEER, צביעה אימונופלואורסצנטית וכו '; עם זאת, זה לא מומלץ כמו נותב פלואורסצנטי שיורי סביר ועשוי להשפיע על הניתוח. - קבע את מקדם החדירות הנראה (Papp) באמצעות הנוסחה הבאה:
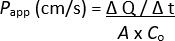
ΔQ / Δt = ריכוז נותב פלואורסצנטי שהעביר את החד-שכבה לתא הבזולטרלי של תרבית התא שהוכנס במשך הזמן הספציפי, נמדד על ידי עוצמת הפלואורסצנטיות ואקסטרפולציה למק"ג/מ"ל דרך העקומה הסטנדרטית
A = שטח הפנים של תרבית התא מוסיף
Co = ריכוז של נותב פלואורסצנטי שנוסף לתא האפי של תרבית התא בהכנסה של מיקרוגרם/מ"ל
5. צביעה אימונופלואורסצנטית של חד-שכבה דו-ממדית שמקורה באורגנואידים
- הסר מדיית תרבית חד-שכבתית מתרבית תאים, הכנס עם שאיבת ואקום והוסף 200 μL של 4% paraformaldehyde (PFA). יש לדגור בטמפרטורת החדר למשך 15-30 דקות לצורך קיבוע תאים.
- יש להסיר את PFA עם שאיבת ואקום ולשטוף עם 100 μL של PBS 2x.
- חדיר תאים עם 100 μL של 0.3% Triton X-100 באלבומין 2% בסרום בקר (BSA) ב- PBS על ידי דגירה בטמפרטורת החדר למשך 10 דקות.
- יש להסיר את הסופרנאטנט עם שאיבת ואקום ולשטוף עם 100 μL של PBS 2x.
- מוציאים סופרנאטנט ומחליפים ב-2% BSA ב-PBS ודגרים בטמפרטורת החדר למשך שעה לחסימה.
- יש לסלק סופרנטנט, למרוח 100 μL של נוגדן ראשוני מדולל ב-2% BSA ב-PBS ולדגור בטמפרטורת החדר למשך שעה אחת, או למשך הלילה ב-4°C.
הערה: ריכוזי הנוגדנים הראשוניים המשמשים נמצאים בטבלת החומרים. אלא אם צוין אחרת, המלצות היצרן מתבצעות. - יש להסיר סופרנאטנט ולשטוף עם 100 μL של PBS 3x.
- יש למרוח 100 μL של נוגדן משני מדולל ב-2% BSA ב-PBS ולדגור בטמפרטורת החדר למשך שעה אחת, או למשך הלילה ב-4°C.
הערה: ניתן לדלג על שלב זה אם הנוגדן העיקרי המשמש מצומד עם בדיקה פלואורסצנטית. ריכוזי נוגדנים משניים בשימוש נמצאים בטבלת החומרים. אלא אם צוין אחרת, המלצות היצרן מתבצעות. - יש להסיר סופרנאטנט ולשטוף עם 100 μL של PBS 3x.
- אופציונלי: לצביעה נגדית של F-אקטין וגרעינים (DAPI), יש להכין על ידי ערבוב שתי הגשושיות בדילול מתאים (לפי המלצת היצרן) ב-PBS, למרוח 100 μL ולדגור בטמפרטורת החדר למשך 30 דקות. יש להסיר סופרנאטנט ולשטוף עם 100 μL של PBS 3x.
- גזור בזהירות את תרבית התא, הכנס קרום עם להב אזמל, והרכבה על מגלשת זכוכית עם פתרון הרכבה. מניחים פתק כיסוי ומתבוננים.
תוצאות
פרוטוקול זה מייצר באופן אמין חד-שכבות דו-ממדיות חזקות של אורגנואידים ממערכת העיכול הקטנה והגדולה, המחקות את המורכבות של אפיתל המעי in vivo . שיטה זו משתמשת באורגנואידים בוגרים שפותחו מדגימות קריפטה של מעיים של בקר בריא שתורבת בתנאים אופטימליים. באופן מעניין, התנאים המוצלחים והחוזרים על עצמם עבור חד-שכבות דו-ממדיות שמקורן באורגנואידים הם ייחודיים למקטע המעי (טבלה 1). זה מחזק את החשיבות של טכניקות תרבות אופטימליות עבור מגזר המעיים של עניין.
יום אחד לאחר זריעת אורגנואידים בוגרים מנותקים על גבי תרבית תאים, נראתה חד-שכבה דו-ממדית שנוצרה (איור 2A). אולם למרות הופעה ראשונית זו, מדידות TEER עבור חד-שכבות איליאליות ורקטליות נותרו נמוכות בשלב זה (איור 1C). יתר על כן, בדיקת חדירות פארא-תאית גילתה שהחד-שכבתית, לאחר יום אחד בלבד של תרבית, אפשרה מעבר של נותב FITC-dextran 4 kDa על פני שכבת התא (איור 1C). עדהיום השלישי לתרבית, שני הסוגים של חד-שכבות דו-ממדיות שמקורן באורגנואידים הראו התבגרות משמעותית, עדות לכך היא עלייה בערכי TEER ועמידות לנותב 4 kDa FITC-dextern, מגמה שנמשכה עד היום החמישי של התרבות.
בולטת במיוחד השונות בין המינים, שבה למרות ערכי TEER נמוכים יותר של תרביות חד-שכבתיות דו-ממדיות שמקורן באורגנואידים בקר, ביחס לעמיתיהם האנושיים והכלבים בתנאים דומים 12,13,14,15, שלמות הממברנה נותרה שלמה. מסקנה זו נגזרת מהתגובה המתאימה של החד-שכבות במבחני חדירות, דבר המצביע על כך שערכי TEER נמוכים בדגימות בקר אינם משקפים בהכרח חוסר תפקוד מחסום. שלמות זו חיונית למחסום אפיתל פונקציונלי ומודגמת ביעילות באמצעות פרשנות זהירה של תוצאות בדיקת חדירות לצד מדידות TEER.
הדמיה של תיחום תאי ומיקרוווילי מפותח היטב על פני השטח האפי של המונושכבות הדו-ממדיות באמצעות מיקרוסקופ אלקטרונים סורק, המציג מבנים מיקרואנטומיים מיוחדים, חיזוק נוסף להבשלה של חד-שכבות דו-ממדיות שמקורן באורגנואידים איליאליים ורקטליים (איור 2B). נוסף על כך, צביעה אימונופלואורסצנטית של החד-שכבות הדו-ממדיות אישרה את נוכחותם של גבול מברשת אפיקלית, צמתי היצמדות בזולטרליים ותאי גביע מייצרי ריר הן בשכבות החד-ממדיות האילאליות (איור 3A) והן ברקטליות (איור 3B) שמקורן באורגנואידים. תוצאות אלה מחזקות את העובדה שהחד-שכבה הדו-ממדית המפותחת מורכבת בהרכבה ובהיווצרותה, ולא רק מבטאת תכונות מפתח של אפיתל מעיים שלם, אלא גם מורכבת מאוכלוסיית תאים רב-שושלת.
פיתוח חד-שכבתי דו-ממדי מוצלח מסתמך על היצמדות התאים ל-ECM וצמיחה למפגש ליצירת שכבת אפיתל שלמה. יש לציין שפיזור ECM לא אחיד או תנאים תת-אופטימליים במהלך הדגירה על תוספת תרבית התא יכולים לגרום לניתוק חלקי של שכבת התא, בולט במיוחד לאורך הקצוות שלה (איור 4Ai). בעיה זו מורכבת עוד יותר אם התאים נזרעים בצפיפות גבוהה מהאופטימלית או שתאי הזריעה אינם מפוזרים באופן שווה על פני השטח של התרבית, תרחיש הנובע לעתים קרובות מדיסוציאציה חלקית של אורגנואידים לתרחיף של תא יחיד. פיזור לא אחיד כזה יכול להוביל להיווצרות רווחים בתוך המונו-שכבה ו/או מורפוגנזה תלת-ממדית על גבי תוספת של תרבית תאים (איור 4Aii). לעומת זאת, זריעה חסרה של התאים יכולה גם לגרום להתפתחות חד-שכבתית לא מוצלחת או מאוחרת במהלך תקופת התרבית הצפויה, מה שמשפיע שלא במתכוון על היעילות של מחקרים מאוחרים יותר המשתמשים במערכת חד-שכבתית דו-ממדית (איור 4Aiii). יתר על כן, זיהום של מערכת התרביות יכול גם להוביל להיווצרות פערים בתוך החד-שכבתי, ולשבש את החד-שכבה החד-שכבתית שנוצרה בשלב מאוחר יותר של התרבית (איור 4Aiv). ערכי TEER מתמשכים ותגובת חדירות פארא-תאית יכולים להיות מושפעים מהפרעות בשכבת התא כתוצאה מטכניקות שטיפה או טיפול אגרסיביות, אפילו כאשר הגורמים הפוטנציאליים שהוזכרו לעיל לכשל לא נתקלו לפני הבדיקות האלה (איור 4B). לפיכך, טיפול זהיר בתאים והערכה של היווצרות חד-שכבתיים או שיבושים הם בעלי חשיבות עליונה לפיתוח מוצלח של חד-שכבות דו-ממדיות שמקורן באורגנואידים באמצעות יישום יעיל של אסטרטגיות לפתרון בעיות.
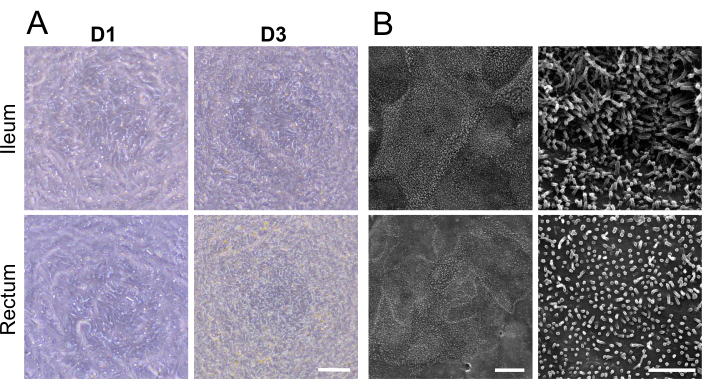
איור 2: אפיון מיקרוסקופי של חד-שכבות דו-ממדיות שמקורן באורגנואידים בקר. (A) תמונות במיקרוסקופ ניגודיות פאזה מייצג של חד-שכבות דו-ממדיות ביום 1 וביום 3 (D1 ו-D3) של תרבית על גבי עלון תרבית תאים. סרגל קנה מידה = 100 מיקרומטר. (B) תמונות מייצגות של מיקרוסקופ אלקטרונים סורק של חד-שכבות דו-ממדיות עם הגדלות נמוכות יותר (משמאל) וגבוהות יותר (מימין). ניתן להעריך מבנה מפורט של פני השטח של התא, כולל מיקרוווילי, הן בשכבות החד-שכבתיות האיליות (למעלה) והן ברקטליות (התחתונות). סרגל קנה מידה שמאלי = 10 מיקרומטר, סרגל קנה מידה ימני = 2 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
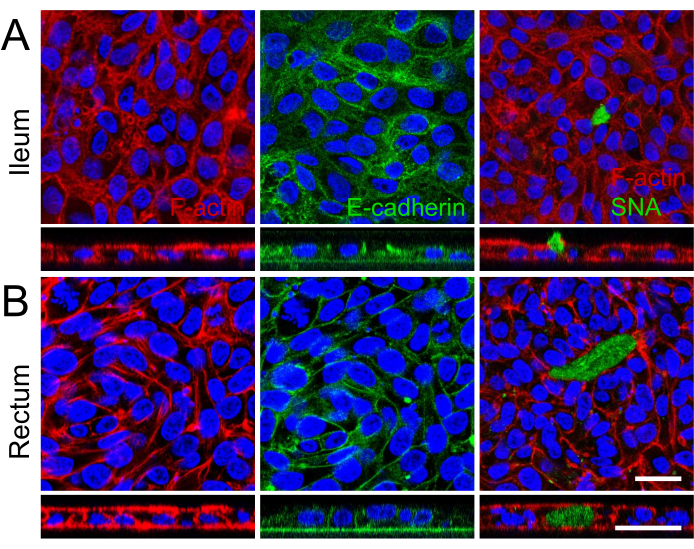
איור 3: אפיון אימונופלואורסנציה של חד-שכבות דו-ממדיות שמקורן באורגנואידים איליאליים ורקטליים. (א, ב) הלוח (A) מראה איליאלי, והלוח (B) מראה אורגנואידים רקטליים. משמאל, סיבי F-actin מודגשים בפלואידין (אדום), הממחישים את ארכיטקטורת השלד הציטו-שלד ואת היווצרות גבולות המברשת האפיקאלית. התמונה האמצעית לוכדת את הלוקליזציה הבזולטרלית של צמתים נצמדים, המסומנת על ידי E-cadherin (ירוק), דבר המעיד על הידבקות תאים-תאים ושלמות חד-שכבתית. מימין, נוכחותם של תאי גביע המייצרים מוצין מזוהה על ידי SNA (ירוק), עם תמונת מחסנית z המתארת את הפרשת המוצין האפי בחד-שכבה האיליאלית. גרעינים בכל התמונות היו מוכתמים ב-DAPI (כחול). בנוסף, הדמיה של מחסנית z בכל התמונות מדגימה עוד יותר את היווצרותה של שכבת תא בודדת בתוך תוספת התרבית. סרגל קנה מידה = 25 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
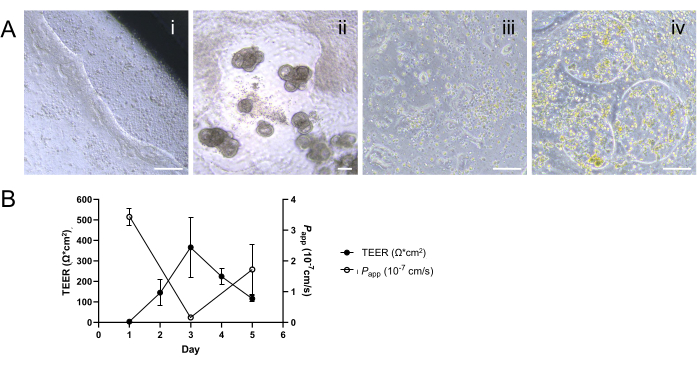
איור 4: אפיון היווצרות חד-שכבתית דו-ממדית תת-אופטימלית. (A) תמונות ניגודיות פאזה מייצגות המדגימות (i) ניתוק חלקי של השכבה החד-שכבתית לאורך קצה תוספת תרבית התא; (2) התפתחות של צמיחה תלת-ממדית והיווצרות פערים בתוך החד-שכבתי; (iii) היווצרות חד-שכבתית חלקית או מאוחרת עקב צפיפות זריעה נמוכה מהאופטימלית שצוינה כהיצמדות טלאים של תאים; ו-(iv) היווצרות רווחים בתוך החד-שכבה הדו-ממדית שנוצרה בשלב מאוחר יותר, ככל הנראה כתוצאה מחשד לזיהום. פסי קנה מידה = 100 מיקרומטר. (B) ירידה במדידות TEER יחד עם עלייה בפרופילי החדירות לאחר היום השלישי מצביעים על כישלון ביצירת מחסומי אפיתל יציבים ופונקציונליים. התוצאות מוצגות כממוצע ± שגיאת תקן של הממוצע (SEM) מניסוי יחיד עם שני עותקים טכניים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
איור משלים 1: שינויים בצפיפות בתרביות אורגנואידים של מעי בקר בהידרוג'ל מבוסס ECM. אורגנואידים של מעי בקר בתרבית הידרוג'ל מבוסס ECM; (A) צפיפות גבוהה ו-(B) צפיפות נמוכה. סרגל קנה מידה = 100 מיקרומטר. אנא לחץ כאן להורדת קובץ זה.
טבלה משלימה 1: איתותי תורם רקמות מסוכמים. אנא לחץ כאן כדי להוריד קובץ זה.
Discussion
בריאות מערכת העיכול היא בעלת חשיבות עליונה הן לפרודוקטיביות והן לרווחה הכללית של בקר16. באמצעות מינוף טכנולוגיה חד-שכבתית דו-ממדית שמקורה באורגנואידים, מדענים יכולים כעת לחקות בצורה מדויקת יותר את המבנה המורכב של אפיתל מעי בקר בתוך הגדרה חוץ גופית 5. גישה חדשנית זו לא רק משחזרת את ההרכב התאי המגוון של רירית המעי, כולל השושלות הרב-תאיות שלה, אלא גם לוכדת מאפיינים תפקודיים מרכזיים, כגון הפרשת ריר ונוכחות מיקרוווילי, החיוניים להבנת הפיזיולוגיה והפתולוגיה של המעי3. הפיתוח של פרוטוקולי תרבית מותאמים אישית למקטעים של האילאום ופי הטבעת הוליד פלטפורמה מתקדמת המשפרת באופן משמעותי את היכולת לחקור את בריאות מעי בקר. גישה מתוחכמת זו מאפשרת חקירה מפורטת של יחסי הגומלין בין פתוגנים זואונוטיים לבין סביבת מעי בקר. היכולת לשכפל ולחקור מקרוב את ההיבטים הייחודיים של המערכת האקולוגית של מעי בקר במבחנה היא צעד משמעותי לקראת פיתוח אסטרטגיות ממוקדות לשיפור בריאות בעלי החיים ולמיתון התפשטות מחלות זואונוטיות.
עם זאת, כדי להבטיח פיתוח חד-שכבתי דו-ממדי מוצלח באמצעות אורגנואידים של מעי בקר, חיוני לשמור על הבריאות והחיוניות הן של האורגנואידים והן של התאים הבודדים המנותקים שלהם. טיפול זהיר ומזעור הלחץ הם בעלי חשיבות עליונה בשמירה על שלמות התא ותפקודו, החיוניים לצמיחה יעילה של אורגנואידים וליצירת מונושכבה מתפקדת לאחר מכן. יתר על כן, השגת מונושכבה אחידה מסתמכת על דיסוציאציה מוצלחת של אורגנואידים לתאים בודדים מבלי ליצור גושים גדולים. גושים כאלה יכולים לשבש את התפלגות התאים ולפגוע במבנה החד-שכבתי. לכן, שימוש בטכניקות מדויקות לדיסוציאציה חלקה הוא חיוני, וכתוצאה מכך מתלה חד-תאי עקבי. נוסף על כך, מזעור ההפרעות במהלך הידבקות התאים ובעת שטיפת עודפי תאים שאינם נצמדים הופך למועיל. גישה זו חשובה במיוחד לטיפול בבעיות פוטנציאליות במורפוגנזה תלת-ממדית, ובכך משפרת את האיכות הכוללת של החד-שכבתי.
אתגר בולט עם הידרוג'לים מבוססי ECM שמקורם ביולוגי הוא וריאציה מאצווה לאצווה בהרכב17. אמנם זה לא נצפה באמצעות הפרוטוקולים והחומרים המתוארים, וריאציות מאצווה לאצווה בהרכב ECM עלולות להציב אתגרים לפיתוח חד-שכבתי מוצלח. אם היווצרות חד-שכבתית נפגעת כאשר מוצרים, מותגים או מספרי לוט של ECM משתנים, ייתכן שיהיה צורך בשלבי מיטוב כדי לקבוע את ריכוז ECM המתאים הדרוש לציפוי תוספות תרבית התא.
יתר על כן, התאמת מדיום התרבית לטמפרטורת החדר לפני ביצוע שינויים כלשהם היא צעד קריטי המסייע להפחית הלם תרמי, להגן על בריאות התא ולשמור על האיכות הן של תרבית אורגנואיד והן של תרבית חד-שכבתית. שיטות כביסה עדינות הן גם בעלות חשיבות עליונה בשמירה על שלמות המונושכבה במהלך היווצרותה והבדיקות שלאחר מכן, והימנעות משיבושים יכולה למנוע אי דיוקים בתוצאות. החלפת PBS בתמיסת מלח מאוזנת של האנק (HBSS) נראתה מועילה במזעור ניתוק חד-שכבתי כאשר היא הפכה לבעיה במהלך שטיפה חוזרת או חשיפה ממושכת ל-PBS, כמו במבחני החדירות הפארא-תאיים. לבסוף, התאמת מדיום התרבית כדי לענות על הצרכים הספציפיים של תאים ממקטעים שונים של מערכת העיכול, כגון אילאום ופי הטבעת, חיונית לשכפול מדויק בתנאי vivo . ספציפיות זו מבטיחה בריאות ופונקציונליות אופטימליות של התא, ומאפשרת מידול מדויק של הפיזיולוגיה של מעי הבקר ואינטראקציות עם פתוגנים, ובכך מדגישה את השלבים הקריטיים הללו במחקר אורגנואידים.
מלבד שימוש בתרגול עדין של טיפול בתאים, בניית יכולת טכנית טובה הקשורה לספירת תאים ומדידות TEER היא חיונית לפיתוח מוצלח של חד-שכבה דו-ממדית מתפקדת. מכיוון שגם צפיפות זריעה נמוכה מדי וגם גבוהה מדי כתוצאה מספירה מוגזמת או חסרה של התאים, בהתאמה, עלולה להוביל לפגיעה בצמיחה חד-שכבתית. מומלץ לבדוק בקפידה את ספירת התאים ולהבטיח צפיפות זריעה מתאימה במקרים בהם יש חשד לצפיפויות זריעה לא מדויקות. בנוסף, טכניקות מדידה לא מספקות של TEER יכולות לגרום לשיבוש של monolayer על ידי שריטות בשוגג עם האלקטרודות. החדרה זהירה של האלקטרודות לתא האפי ותשומת לב מיוחדת לשמירה על הכיוון האנכי שלהן ביחס לפני השטח של הממברנה יכולה לסייע בהפחתת הסיכון לנזק מקרי לחד-שכבות.
שיטות בדיקת החדירות הפארא-תאית המתוארות כאן הותאמו מפרוטוקול18 קודם. שינויים בפרוטוקול המדווח, הכוללים דגימות מרובות במשך 120 דקות והחלפת האליציטוט שנדגם בכמויות שוות של PBS, נעשים כדי לשפר את הדיוק והאמינות של התוצאות. שמירה על הנפח הכולל בתוך התא היא קריטית מכמה סיבות: היא שומרת על איזון אוסמוטי, מבטיחה את שלמות התא, שומרת על שיפוע הריכוז החיוני להערכת חדירות מדויקת, ומונעת שינויים בלחץ הידרוסטטי שעלולים להשפיע על קצבי ההובלה. פרקטיקה זו של חידוש התא הבזולטרלי ב-PBS טרי שווה ערך לנפח ה-PBS המכיל נותב פלואורסצנטי שנדגם היא חיונית לשימור תנאים אלה, ומאפשרת הערכות מדויקות ומשמעותיות של חדירות חד-שכבתית. בדיקת החדירות הפארא-תאית משמשת כהשלמה למדידת TEER על ידי הערכת התנועה של מולקולות נותבות דרך החד-שכבה ישירות. יתר על כן, השוואת ערכי TEER במעבדות שונות עשויה שלא להניב תובנות רלוונטיות, שכן ערכים אלה יכולים להיות מושפעים ממשתנים רבים, כגון טמפרטורה והתנאים הספציפיים שבהם תאים מתורבתים, כולל סוגי תאים, מספרי מעבר, והרכב מדיום התרבית19. בדיקת החדירות הפארא-תאית מספקת הערכה פונקציונלית במבחנה של הביטוי היעיל של דבקים וצמתים הדוקים בתוך מחסום אפיתל20.
בעוד שהפיתוח של חד-שכבות דו-ממדיות מאורגנואידים תלת-ממדיים מייצג התקדמות משמעותית בטכנולוגיית התרבית, חשוב להכיר במגבלות הקשורות לחד-שכבות דו-ממדיות. חסרון עיקרי אחד הוא שזו נשארת מערכת תרבות סטטית, חסרה את הגירוי הדינמי שנמצא בסביבת in vivo . בנוסף, שינוי תכולת החמצן במערכת התרבית מציב אתגרים בשל המערך הפתוח שלה הכולל לוחות תרבית עם מכסים, מה שהופך אותה לפחות מתאימה לתרבית משותפת ארוכת טווח עם חיידקים אנאירוביים. ניתן לטפל במגבלות אלה על ידי אימוץ פלטפורמות תרבית דינמיות יותר, כגון מערכות מיקרופלואידיות21, המציעות סביבה מבוקרת יותר ורלוונטית יותר מבחינה פיזיולוגית. יתר על כן, חשוב להכיר בכך שבעוד שתנאי התרבית הנוכחיים עשירים בחומרים מזינים המועילים לשמירה על גדילת תאי גזע, הם עשויים שלא להיות אופטימליים לגרימת התמיינות פיזיולוגית של תאי האפיתל. פער זה מדגיש את הצורך באופטימיזציה במחקר עתידי כדי לחקות באופן הדוק את תנאי in vivo ולתמוך בתהליך הבידול. על ידי התמודדות עם מגבלות אלה ושכלול גישות אלה, התועלת והישימות של טכנולוגיות תרבית אורגנואידים משופרות, ומתקרבות לשכפול הדינמיקה והאינטראקציות המורכבות של מערכת העיכול במבחנה.
הפרוטוקול ליצירת חד-שכבות דו-ממדיות מרקמות איליאליות ורקטליות של בקר מציע לחוקרים מודל מבחנה רב ערך של הממשק הלומינלי של אפיתל מעיים קטן וגדול כאחד. מודל זה פותח אפשרויות נרחבות ליישום במחקרי תזונה בסיסיים של בעלי חיים, במיוחד בבחינת האופן שבו חומרים מזינים נספגים בתנאים שונים. תחום עניין בולט הוא חקירת תסמונת המעי הדולף, המאופיינת בעלייה חריגה בחדירות מערכת העיכול, המופעלת לעתים קרובות על ידי שינויים תזונתיים וטמפרטורות סביבתיות קיצוניות22,23. יתר על כן, מודל זה משמש ככלי חיוני לחקר יחסי הגומלין המורכבים בין מיקרוביום המעי לבין המאכסן שלו. הוא מאפשר לחקור כיצד מיקרואורגניזמים קומנסליים עשויים להשפיע על בריאותו של האורגניזם המארח, תוך התייחסות להיבט מכריע של מדע הווטרינריה והרפואה 1,24. בנוסף, פתוגנים הנישאים במזון אנושי נמצאים לעתים קרובות כקומנסלים במקטעים שונים של מעי בקר 8,9,25, פרוטוקול זה מאפשר מחקרים מפורטים של התנאים הספציפיים המאפשרים לסוכנים זואונוטיים אלה לשגשג בנישות שלהם.
במהלך מחקר זה, נצפה כי monolayers רקטלי ו ileal organoid שמקורו דורשים תנאים שונים להתפתחות מוצלחת. באופן ספציפי, כאשר מונושכבות שמקורן באורגנואידים רקטליים נזרעו בתחילה על תוספות תרבית תאים שהוכנו עם הידרוג'ל מבוסס ECM 2% במדיה בסיסית במשך שעה אחת, חורים גדולים וחריקת תאים צוינו. בעיה זו נפתרה על ידי מעבר למדיה מיוחדת של תרבית חד-שכבתית רקטלית והארכת תקופת הדגירה ללילה לפני הזריעה, בעוד שחד-שכבות שמקורן באורגנואידים איליאליים פותחו בהצלחה באמצעות פרוטוקול הכנה קצר יותר. יתר על כן, הוספת CHIR99021 למדיום התרבית שיפרה באופן עקבי את הקמתן של חד-שכבות רקטליות26 אך לא הייתה הכרחית עבור חד-שכבות איליאליות27. בנוסף, מונושכבות איליאליות דרשו צפיפות תאים גבוהה יותר להתפתחות מוצלחת בהשוואה לאורגנואידים רקטליים27. תנאים אופטימליים אלה (טבלה 1) פיתחו שוב ושוב חד-שכבות השומרות על שלמות מחסום עמיד, מה שמדגיש את החשיבות של התאמת תנאי התרבית למקטע המעיים הספציפי.
גישה למודל המשקף במדויק את מורכבות השושלת הרב-תאית של המעי in vivo היא קריטית לחקירות אלה. הוא מאפשר לחוקרים לחקות מקרוב את התנאים הטבעיים של סביבת המעיים, ומספק בסיס אמין יותר לניסויים. באמצעות פרוטוקול זה, החוקרים מצוידים במודל חזק המשפר את יכולות המחקר שלהם, ועשוי להוביל לתגליות פורצות דרך בתחומי המחקר שלהם. גישה זו לא רק תורמת להבנת בריאות המעי ומחלותיו, אלא גם מסייעת בפיתוח אסטרטגיות לשיפור ניהול משק החי ובטיחות המזון.
Disclosures
למחברים אין ניגודי עניינים להצהיר.
Acknowledgements
מחקר זה נתמך בחלקו על ידי משרד מנהל המכונים הלאומיים לבריאות (K01OD030515 ו- R21OD031903 ל- YMA) ומענק מחקר לסטודנטים לתארים מתקדמים של WSU VCS (ל- GDD). המחברים מבקשים להודות למשחטה המשתתפת על אספקת בקר תורם.
Materials
| Name | Company | Catalog Number | Comments |
| Basal Medium | |||
| Advanced DMEM/F12 (1X) | Gibco | 12634-010 | n/a |
| GlutaMAX-I (100X) | Gibco | 35050-061 | 2 mM |
| HEPES (1M) | Gibco | 15630-080 | 10 mM |
| Pen Strep Glutamine (100X) | Gibco | 10378-016 | 1X |
| Organoid Culture Medium (Supplements to Basal Medium) | |||
| A-83-01 | Sigma-Aldrich | SML0788-5MG | 500 nM |
| B27 Supplement (50X) | Gibco | 17504-001 | 1X |
| [Leu15]-Gastrin I human | Sigma-Aldrich | G9145-.5MG | 10 nM |
| Murine EGF | PeproTech | 315-09-500UG | 50 ng/mL |
| Murine Wnt-3a | PeproTech | 315-20-10UG | 100 ng/mL |
| N-Acetyl-L-cysteine | MP Biomedicals | 194603 | 1 mM |
| N-2 MAX Media Supplement (100X) | R&D Systems | AR009 | 1X |
| Nicotinamide | Sigma-Aldrich | N0636-100G | 10 mM |
| Noggin Conditioned Medium | n/a | n/a | 10 vol/vol % |
| Primocin | InvivoGen | ant-pm-2 | 100 µg/mL |
| R-Spondin-1 Conditioned Medium | n/a | n/a | 20 vol/vol % |
| SB202190 | Sigma-Aldrich | S7067-25MG | 10 µM |
| Monolayer Culture Medium (Supplements to Organoid Culture Medium) | |||
| CHIR99021 | Sigma-Aldrich | SML1046-5MG | 2.5 µM |
| HI FBS | Gibco | 10438-034 | 20 vol/vol % |
| LY2157299 | Sigma-Aldrich | SML2851-5MG | 500 nM |
| Y-27632 | StemCellTechnologies | 72308 | 10 µM |
| Reagents | |||
| Alexa Fluor 488 Mouse anti-E-cadherin | BD Biosciences | 560061 | 1:200 dilution |
| Alexa Fluor 647 Phalloidin | Invitrogen | A22287 | 1:400 dilution |
| BSA | Cytiva | SH30574.02 | 2 w/vol % |
| Cell Recovery Solution | Corning | 354253 | n/a |
| DAPI Solution (1 mg/mL) | Thermo Scientific | 62248 | 1:1000 dilution |
| DPBS (1X) | Gibco | 14190-144 | n/a |
| Fluorescein Isothiocyanate–Dextran | Sigma-Aldrich | FD4-100MG | 0.5 mg/mL |
| Matrigel Matrix | Corning | 354234 | n/a |
| Paraformaldehyde Solution (4%) | Thermo Scientific | J19943K2 | n/a |
| ProLong Gold antifade reagent | Invitrogen | P36930 | n/a |
| SNA, EBL, Fluorescein | Vector Laboratories | FL-1301 | 1:100 dilution |
| Triton X-100 | Thermo Scientific | A16046.AE | 0.3 vol/vol % |
| TrypLE Express | Gibco | 12605-028 | n/a |
| Trypan Blue Solution, 0.4% | VWR Life Science | K940-100ML | n/a |
| Materials and Equipment | |||
| 0.4 µm Cell Culture Insert | Falcon | 353095 | |
| 24-well Cell Culture Plate | Corning | 3524 | |
| 48-well Cell Culture Plate | Thermo Scientific | 150687 | |
| 70 µm Sterile Cell Strainer | Fisher Scientific | 22-363-548 | |
| 96-well Cell Culture Plate | Greiner Bio-One | 655086 | |
| Centrifuge | Eppendorf | 5910Ri | |
| CO2 Incubator | Thermo Scientific | 370 | |
| Epithelial Volt-Ohm Meter | Millipore | Millicell ERS-2 | |
| Hemocytometer | LW Scientific | CTL-HEMM-GLDR | |
| Inverted Confocal Microscope | Leica Microsystems | SP8-X | |
| Inverted Phase-Contrast Microscope | Leica Microsystems | DMi1 | |
| Microscope Cover Glass | Fisher Scientific | 12-540-B | |
| Microplate Reader | Molecular Devices | SpecrtraMax i3x | |
| Microscope Slides | Fisher Scientific | 22-034-486 | |
| Pasteur Pipets | Fisher Scientific | 13-678-20C | |
| Scalpel Blade | iMed Scientific | - | #11 carbon steel |
| Vortex Mixer | Scientific Industries | SI-0236 | |
| Software | |||
| LAS X imaging software | Leica Microsystems | LAS X 3.7.6.25997 | |
| Microplate Reader software | Molecular Devces | SoftMax Pro 7.1.2 |
References
- Min, S., Kim, S., Cho, S. W. Gastrointestinal tract modeling using organoids engineered with cellular and microbiota niches. Exp Mol Med. 52 (2), 227-237 (2020).
- Fitzgerald, S. F., et al. Shiga toxin sub-type 2a increases the efficiency of Escherichia coli O157 transmission between animals and restricts epithelial regeneration in bovine enteroids. PLoS Pathogens. 15 (10), e1008003 (2019).
- Dutta, D., Heo, I., Clevers, H. Disease modeling in stem cell-derived 3D organoid systems. Trend Mol Med. 23 (5), 393-410 (2017).
- Beaumont, M., et al. Intestinal organoids in farm animals. Vet Res. 52 (1), 33 (2021).
- Kawasaki, M., Dykstra, G. D., McConnel, C. S., Burbick, C. R., Ambrosini, Y. M. Adult bovine-derived small and large intestinal organoids: In vitro development and maintenance. J Tissue Eng Regene Med. 2023, e3095002 (2023).
- Kvidera, S. K., et al. Intentionally induced intestinal barrier dysfunction causes inflammation, affects metabolism, and reduces productivity in lactating Holstein cows. J Dairy Sci. 100 (5), 4113-4127 (2017).
- Crawford, C. K., et al. Inflammatory cytokines directly disrupt the bovine intestinal epithelial barrier. Sci Rep. 12 (1), 14578 (2022).
- Heredia, N., García, S. Animals as sources of food-borne pathogens: A review. Animal Nutri. 4 (3), 250-255 (2018).
- Naylor, S. W., et al. Lymphoid follicle-dense mucosa at the terminal rectum is the principal site of colonization of enterohemorrhagic Escherichia coli O157:H7 in the bovine host. Infect Immun. 71 (3), 1505-1512 (2003).
- Co, J. Y., et al. Controlling epithelial polarity: A human enteroid model for host-pathogen interactions. Cell Rep. 26 (9), 2509-2520.e4 (2019).
- Pullinger, G. D., et al. Systemic translocation of Salmonella enterica Serovar Dublin in cattle occurs predominantly via efferent lymphatics in a cell-free niche and requires type III secretion system 1 (T3SS-1) but not T3SS-2. Infect Immun. 75 (11), 5191-5199 (2007).
- Nickerson, K. P., et al. A versatile human intestinal organoid-derived epithelial monolayer model for the study of enteric pathogens. Microbiol Spectr. 9 (1), e0000321 (2021).
- Varani, J., McClintock, S. D., Aslam, M. N. Cell-matrix interactions contribute to barrier function in human colon organoids. Front Med. 9, 838975 (2022).
- Freire, R., et al. Human gut derived-organoids provide model to study gluten response and effects of microbiota-derived molecules in celiac disease. Sci Rep. 9, 7029 (2019).
- Ambrosini, Y. M., et al. Recapitulation of the accessible interface of biopsy-derived canine intestinal organoids to study epithelial-luminal interactions. PLoS ONE. 15 (4), e0231423 (2020).
- Kogut, M. H., Arsenault, R. J. Editorial: Gut health: The new paradigm in food animal production. Front Vet Sci. 3, 71 (2016).
- Lingard, E., et al. Optimising a self-assembling peptide hydrogel as a Matrigel alternative for 3-dimensional mammary epithelial cell culture. Biomater Adv. 160, 213847 (2024).
- Turksen, K. . Permeability Barrier: Methods and Protocols. , (2011).
- Srinivasan, B., et al. TEER measurement techniques for in vitro barrier model systems. J Lab Autom. 20 (2), 107-126 (2015).
- Frost, T. S., Jiang, L., Lynch, R. M., Zohar, Y. Permeability of epithelial/endothelial barriers in Transwells and microfluidic bilayer devices. Micromachines. 10 (8), 533 (2019).
- Bein, A., et al. Microfluidic organ-on-a-chip models of human intestine. Cell Mol Gastroenterol Hepatol. 5 (4), 659 (2018).
- Sanz-Fernandez, M. V., et al. Targeting the hindgut to improve health and performance in cattle. Animals. 10 (10), 1817 (2020).
- Gressley, T. F., Hall, M. B., Armentano, L. E. Ruminant nutrition symposium: Productivity, digestion, and health responses to hindgut acidosis in ruminants. J Anim Sci. 89 (4), 1120-1130 (2011).
- O'Hara, E., Neves, A. L. A., Song, Y., Guan, L. L. The role of the gut microbiome in cattle production and health: Driver or passenger. Ann Rev Animal Biosci. 8 (2020), 199-220 (2020).
- Beach, J. C., Murano, E. A., Acuff, G. R. Prevalence of Salmonella and Campylobacter in beef cattle from transport to slaughter. J Food Protect. 65 (11), 1687-1693 (2002).
- Kawasaki, M., Ambrosini, Y. M. Accessible luminal interface of bovine rectal organoids generated from cryopreserved biopsy tissues. PLoS One. 19 (3), e0301079 (2024).
- Kawasaki, M., McConnel, C. S., Burbick, C. R., Ambrosini, Y. M. Pathogen-epithelium interactions and inflammatory responses in Salmonella Dublin infections using ileal monolayer models derived from adult bovine organoids. Scientific Reports. 14 (1), 11479 (2024).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved