Method Article
זיהוי תאים נגועים ב-EcoHIV בעכברים טרנסגניים שעברו מניפולציה במיקרוגליה
In This Article
Summary
פרוטוקול זה מתאר כיצד השילוב של זיהום EcoHIV עם עכברי Tmem119-EGFP מציע מערכת ביולוגית רבת ערך לחקירת שינויים במיקרוגליה ומאגרים נגיפיים במודלים של מכרסמים של הפרעות נוירו-קוגניטיביות הקשורות ל-HIV.
Abstract
טיפול אנטי-רטרו-ויראלי משולב (cART) שיפר באופן דרמטי את איכות החיים של אנשים החיים עם HIV (PLWH). עם זאת, למעלה מ-4 מיליון PLWH הם מעל גיל חמישים וחווים הפרעות נוירו-קוגניטיביות הקשורות ל-HIV (HAND). כדי להבין כיצד HIV משפיע על מערכת העצבים המרכזית, יש צורך במודל אמין ומעשי של HIV. בעבר, מערכת ביולוגית חדשה המשתמשת בחיסון כימרי HIV (EcoHIV) פותחה במודל חולדות כדי לחקור ליקויים נוירו-קוגניטיביים ותפקוד לקוי של סינפטיקה. עם זאת, נותר אתגר משמעותי בהבהרת ההתפלגות הנוירו-אנטומית של EcoHIV, במיוחד הביטוי הדיפרנציאלי שלו בסוגי תאים שונים במוח. במחקר הנוכחי, EcoHIV עם תיוג פלואורסצנטי mScarlet שונה והוזרק רטרו-אורביטלי לעכברי Tmem119-EGFP (המבטאים חלבון פלואורסצנטי ירוק משופר בעיקר במיקרוגליה) כדי לקבוע אם מיקרוגליה היא סוג התא העיקרי האחראי על ביטוי ויראלי ומאגרים של HIV במוח. הנתונים הנוכחיים מראים כי: (1) במבחנה, אותות פלואורסצנטיים של EcoHIV-mScarlet היו ממוקמים בעיקר בתאים דמויי מיקרוגליה בקרב תאי מוח ראשוניים של מכרסמים; (2) in vivo, הזרקת EcoHIV-mScarlet לעכברי Tmem119-EGFP גרמה לביטוי HIV משמעותי במוח העכבר. הלוקליזציה המשותפת של אותות mScarlet ו-EGFP מצביעה על כך שמיקרוגליה היא סוג התא העיקרי המכיל HIV במוח. בסך הכל, EcoHIV במכרסמים מציע מערכת ביולוגית רבת ערך לחקר שינויים במיקרוגליה, מאגרים נגיפיים במוח והמנגנונים הנוירולוגיים של הפרעות נוירו-קוגניטיביות הקשורות ל-HIV.
Introduction
למרות היתרונות העמוקים הנובעים מטיפול אנטי-רטרו-ויראלי, אנשים החיים עם HIV (PLWH) עדיין חווים הפרעות נוירו-קוגניטיביות. כדי להבין טוב יותר את המנגנונים העצביים של הפרעה נוירו-קוגניטיבית הקשורה ל-HIV (HAND), יש צורך קריטי במודלים של HIV כדי להבהיר עוד יותר את המעורבות של סוג התא הספציפי ב-NeuroHIV.
החולדה הטרנסגנית HIV-1, שיש לה חשיפה מכוננת לחלבונים נגיפיים של HIV-1, היא מודל מכרסמים פופולרי המשמש לחקירת הפרעות נוירו-קוגניטיביות 1,2,3,4 ושינויים נוירו-אנטומיים 5,6,7 הקשורים ל-HAND. המחיקה התפקודית של תחומי ה-gag וה-pol מונעת שכפול ויראלי, מה שהופך את החולדה הטרנסגנית HIV-1 ללא זיהומית 8,9. לאחרונה, מודל זיהום כימרי של HIV (EcoHIV) בעכברים דווח לראשונה על ידי Potash et al.10 ומאוחר יותר הורחב לחולדות, מה שעשוי להועיל למחקרים נוספים על הפרעות שימוש ביד ובחומרים11. במערכת ביולוגית חדשה זו, זיהום מערכתי ב-HIV-1 נצפה יחד עם מאפיינים קליניים רבים של HIV-1 בבני אדם, כולל מעורבות לימפוציטים ומקרופאגים, תגובות חיסוניות אנטי-ויראליות, נוירו-פולשניות ודלקת מוחית.
מיקרוגליה ממלאת תפקיד קריטי כמקרופאגים מיוחדים השוכנים במוח בשמירה על תפקוד המוח והומאוסטזיס. כדי להבחין בין מיקרוגליה לסוגי תאים קרובים (למשל, מונוציטים בדם, מקרופאגים פרי-וסקולריים, מקרופאגים קרום המוח), המחקר הנוכחי השתמש בקו העכברים Tmem119-EGFP. מחקרים קודמים דיווחו כי חלבון טרנסממברני 119 (Tmem119) מציג דפוס ביטוי ספציפי למיקרוגליה באופן בלעדי ברקמת מוח של מכרסמים ובני אדם 12,13,14,15. אות ה-EGFP בעכברי Tmem119-EGFP נצפה בכל המוח והתמקם במיוחד בתאי מיקרוגליה.
במחקר הנוכחי, עכברי Tmem119-EGFP חוסנו בנגיף EcoHIV-mScarlet, וזוהו תאים חיוביים ל-EcoHIV במערכת העצבים המרכזית. כאן, אנו מציגים פרוטוקול לחיסון EcoHIV-mScarlet בעכברי Tmem119-EGFP , המספק מודל אמין להתמקדות טיפולית בשינויים במיקרוגליה ב-HIV.
Protocol
הוועדה לטיפול ושימוש בבעלי חיים באוניברסיטת דרום קרוליינה אישרה את כל הפרוטוקולים לבעלי חיים (מספר הבטחה פדרלי: D16-00028). כל הניסויים עקבו בקפדנות אחר ההנחיות שנקבעו על ידי המכונים הלאומיים לבריאות במדריך לטיפול ושימוש בחיות מעבדה. עכברי Tmem119-EGFP (בני 30 יום, זכר, משקל גוף 23-26 גרם) הושגו ממקור מסחרי ושוכנו במתקנים מוסמכים של AAALAC. כל בעלי החיים שוכנו במחזור אור-חושך של 12/12 שעות עם גישה חופשית למזון ומים. פרטי החיות, הריאגנטים והציוד ששימשו במחקר זה מפורטים בטבלת החומרים.
1. אריזת EcoHIV-mScarlet בתאי 293FT
- דגרו את תאי 293 FT בבקבוק מצופה ג'לטין בגודל 75 ס"מ2 . שמור על תאים גדלים ל-30% מתכנסים בטרנספקציה.
- בצע טרנספקציה של DNA פלסמיד (15 מיקרוגרם) של EcoHIV-mScarlet (קובץ משלים 1) באמצעות ליפופקטמין 3000 (22.5 מיקרוליטר) בהתאם להוראות היצרן (ראה טבלת חומרים).
- תרבית התאים במדיום DMEM עם סרום FBS 10% למשך 3 ימים בטמפרטורה של 37 מעלות צלזיוס.
- אסוף את המדיום המותנה עם מתלה ויראלי. צנטריפוגה בטמפרטורה של 500 × גרם למשך 10 דקות בטמפרטורה של 4 מעלות צלזיוס. העבירו את הסופרנטנט עם פיפטה של 10 מ"ל לצינור סטרילי של 50 מ"ל.
- הוסף כמות מסוימת של רכז Lenti-x (יחס של 1:3) לתערובת הנגיפית (לדוגמה, 8 מ"ל רכז עם 24 מ"ל תערובת ויראלית). הפוך בעדינות את הצינור חמש פעמים.
- שמור את תערובת ריכוז הנגיף-לנטי בטמפרטורה של 4 מעלות צלזיוס למשך יומיים. צנטריפוגה בטמפרטורה של 1,500 × גרם, 45 דקות, 4 מעלות צלזיוס. הסר בזהירות את הסופרנטנט ככל האפשר באמצעות פיפטה.
- השעו מחדש את הגלולה עם 200 מיקרוליטר מקורר מראש של 100 מ"מ PBS. אחסן את הנגיף בטמפרטורה של -80 מעלות צלזיוס.
הערה: הפרטים של אריזות EcoHIV-mScarlet בתאי 293FT תוארו במחקר הקודם שלנו16. אין לערבב או להכניס בועות אוויר לתמיסה הנגיפית.
2. זיהום EcoHIV-mScarlet בתאי מוח ראשוניים של חולדות
- לבצע את בידוד תאי המוח הראשוני מעוברי חולדות (18 יום) בעקבות הדוח שפורסם קודםלכן 16.
- העבר תאים מנותקים לצלחות 12 בארות מצופות מראש של פולי-L-ליזין עם תוספות זכוכית המכילות 1 מ"ל של מדיום DMEM/F12 בתוספת 10% FBS. החלף את המדיום למחרת במדיום נוירובזאלי בתוסף B27.
- תרבית תאי מוח ראשוניים של העובר באינקובטור 5% CO2 למשך 3 שבועות.
- הוסף EcoHIV-mScarlet (60 מיקרוליטר, 1.26 × 106 TU/mL) למדיום התרבית. דגרו על תאי המוח המתורבתים עם EcoHIV-mScarlet למשך 6 ימים.
- לתקן את התאים עם 4% PFA ולבצע צביעה חיסונית על תאי מוח נגועים באמצעות נוגדנים ראשוניים ספציפיים (CD11b/c, Iba1).
- השג תמונות באמצעות אובייקט 40× תחת מערכת מיקרוסקופיה קונפוקלית.
3. זיהום בנגיף EcoHIV-mScarlet בתאי גליה ראשוניים מעכברים בוגרים
- להרדים עכברים בוגרים עם 5% סבופלורן למשך 5 דקות (בהתאם לפרוטוקולים שאושרו על ידי המוסד). עקר את עור הראש עם 70% EtOH.
- לאחר אישור שהעכבר אינו מגיב עוד לגירויים מזיקים, השתמש במספריים מושחזים מעוקרים כדי לבצע עריפת ראש. מעבירים את הראש לצלחת פטרי חדשה במילוי 5 מ"ל HBSS.
- פתחו את הקרקפת והעבירו את רקמת המוח לצלחת פטרי אחרת המכילה 5 מ"ל של HBSS מעוקר. מקלפים את קרומי המוח ומעבירים את קליפת המוח הקדמית ל -2 מ"ל של HBSS.
- מוסיפים לתערובת 20 מיקרוליטר של 0.25% טריפסין-EDTA. דגירה למשך 15 דקות בטמפרטורת החדר; סובב בעדינות את הצינור כל כמה דקות.
- העבירו תאים מנותקים לבקבוק מצופה מראש של פולי-ליזין בגודל 75 ס"מ2 המכיל 10 מ"ל של מדיום DMEM/F12 ו-10% FBS.
- תאי תרבית בטמפרטורה של 37 מעלות צלזיוס, 5% חממת CO2, עד למפגש של 90%. עיכול תאי מוח עם 2 מ"ל של 0.25% טריפסין-EDTA.
- תת-תרבית תאי מוח לכלי זכוכית 35 מ"מ המכילים 5 מ"ל של מדיום גידול DMEM/F12 עד למפגש של 80%.
- הוסף EcoHIV-mScarlet (8 מיקרוליטר, 1.26 × 106 TU/mL) למדיום התרבית. דגירה על תאי גליה של עכבר למשך יומיים.
- בדוק את אותות הקרינה האדומים (mScarlet) מדי יום תחת מיקרוסקופ פלואורסצנטי.
4. הזרקה רטרואורביטלית של נגיף EcoHIV-mScarlet לעכברי Tmem119-EGFP
- השתמש ב-3% סבופלורן כדי להרדים את עכברי Tmem119-EGFP (עכברים זכרים ונקבות כאחד בגיל 30 יום) עד שהם יפסיקו להגיב לגירויים מזיקים.
- אבטח את העכברים במצב רוחבי כשעין ההזרקה פונה כלפי מעלה והנשמה דרך חרוט האף, המקושר למערכת הרדמה. השתמש בגודל חרוט אף מתאים כדי לספק הרדמה רציפה.
- הפשירו את ה-EcoHIV-mScarlet על קרח. מלאו את התמיסה הנגיפית למזרק מזרק תוך עיני עם מחט קהה של 33 גרם.
- הנח את העכבר בשכיבה הצדדית הימנית והשאר את ראשו פונה שמאלה. זהה את מיקום הקנתוס המדיאלי כאתר ההזרקה.
- לאחר התזת העין, יש להכניס לאט ובעדינות מחט (זווית של 45 מעלות) לתוך הקנטוס המדיאלי של העין. הכנס בזהירות את המחט קדימה לתוך הכלים שמאחורי גלגל העין (סינוס רטרו-אורביטלי).
- הזריק בעדינות 6.5 מיקרוליטר של EcoHIV-mScarlet (1.26 ×10 6 TU/mL, חיסון עיניים דו-צדדי) לתוך הסינוס הרטרו-אורביטלי. הסר בזהירות את המחט מהסינוס הרטרו-אורביטלי והפעל בעדינות לחץ על העפעפיים כדי לספק המוסטזיס.
- מרחו חומר סיכה על העין כדי למנוע מהקרנית להתייבש או להיפצע.
- אפשרו לעכברים להתאושש בתא התאוששות עם כרית חימום עד שהם יתעוררו.
הערה: אין למקם את שיפוע המחט עמוק מדי כדי שהעורקים לא ייקרעו או העצמות יישברו. זמן עירוי הנגיף תלוי במספר גורמים (למשל, נפח ההזרקה, טיטר, גודל החיה). עבור עירוי ויראלי של EcoHIV, נצפה ביטוי משמעותי שבוע לאחר זריקות רטרו-אורביטליות 11,16,17.
5. הדמיה של פרוסות רקמת מוח
- הרדמה עמוקה של עכברים באמצעות 5% סבופלורן. עברו לשלב 5.2 כאשר העכברים אינם מראים תגובה לגירויים מזיקים ורפלקסים נעדרים.
- שמור את העכברים במצב שכיבה בתוך מכסה אדים כימי.
- פתח את העור לאורך קו האמצע של בית החזה. הפרד את הסרעפת ופתח את החזה במספריים.
- הכנס מחט 22 G1 1/2 לחדר השמאלי. פתח את האטריום הימני עם מספריים.
- פיוז 50 מ"ל של 100 מ"מ PBS מקורר מראש. פרפיוז 100 מ"ל של מאגר פרפורמלדהיד 4% מקורר מראש16.
- הסר את כל מוח העכבר16.
- יש לתקן למשך הלילה עם 4% פרפורמלדהיד.
- אבטח את רקמת המוח באמצעות דבק רקמות על פלטפורמת המתכת של הוויברטום. חותכים בעובי 50 מיקרומטר של קטעי עטרה עם להבי פלדת פחמן.
- הניחו את פרוסות המוח על שקופיות זכוכית בעזרת מברשת. הוסף מיד 0.1 מ"ל של אמצעי ההרכבה נגד דהייה לכל חלק.
- הנח כיסוי בגודל 22 מ"מ על 50 מ"מ מעל חלקי המוח. יבש את מגלשות הסופר-כפור בחושך למשך יום אחד.
- הגדר את מערכת המיקרוסקופ הקונפוקלי להגדלה של 60× (A/1.4, שמן) והגדר מרווח מישור Z של 0.15 מיקרומטר, עם גודל חור סיכה של 30 מיקרומטר ורדיוס חור מוקרן לאחור של 167 ננומטר.
- השתמש באורכי הגל של 488 ננומטר ו-594 ננומטר כדי לרכוש תמונות רב-ערוציות של אזורי מוח מעניינים.
תוצאות
שבר של mScarlet (1858 bp) המכיל אתרי אנזימים של "Cla1" בקצה 3' ו-"Not1" בקצה 5' הוכנס לווקטור lentiviral pNL4-3-EcoHIV (איור 1). כדי לאמת את הביטוי של EcoHIV-mScarlet, תאי מוח ראשוניים שבודדו מקליפת המוח של עוברי חולדה E18 טופלו ב-EcoHIV-mScarlet (60 מיקרוליטר, 1.26 × 106 TU/mL) במשך 6 ימים במבחנה. הנתונים באיור 2 הראו כי אותות פלואורסצנטיים אדומים של mScarlet היו ממוקמים בעיקר בסוגי תאים גליאליים בהתבסס על המורפולוגיה השונה של התאים. יתר על כן, תיוג CD11b/c ו-Iba1 (סמני תאים למיקרוגליה) הראה כי אותות mScarlet היו ממוקמים במשותף עם תאי CD11b/c + ו/או Iba1 +. הנתונים הצביעו על כך שמיקרוגליה הייתה סוג התא העיקרי של התפלגות EcoHIV-mScarlet במבחנה. לא היה זיהום עצבי משמעותי בתאים המתורבתים (איור משלים 1).
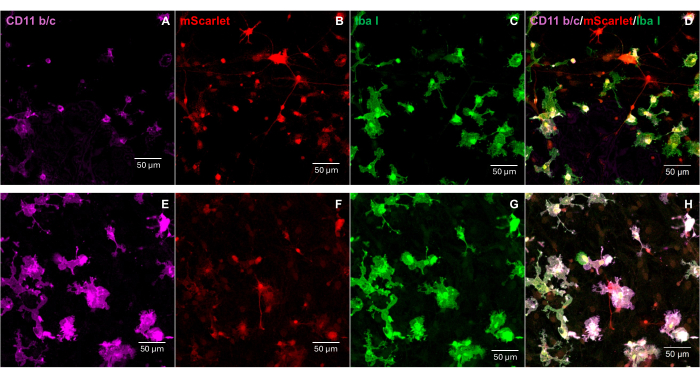
לאחר מכן, ההדבקה של EcoHIV-mScarlet נבדקה על תאי גליה מעורבים ראשוניים של עכברים בוגרים. לשם כך, תאי גליה מעורבים בודדו וטוהרו תחילה מעכברים בוגרים (חודשיים) ונדבקו ב-EcoHIV-mScarlet (8 מיקרוליטר, 1.26 ×-106 TU/mL) למשך יומיים. התמונות באיור 3 הראו ש-EcoHIV-mScarlet הדביק בהצלחה גליה של עכברים בוגרים.
כדי לטפל עוד יותר בדפוס ההתפלגות של EcoHIV-mScarlet במוח העכבר, במיוחד לזיהוי סוג התא הנגוע, EcoHIV-mScarlet הוזרק רטרו-אורביטלי לקו העכברים Tmem119-EGFP שבו מיקרוגליה סומנה באופן ספציפי עם אותות EGFP ללא כל סוגי מקרופאגים אחרים של קונפליקטים5. התוצאות באיור 4 (גם באיור משלים 2) מראות כי אותות פלואורסצנטיים אדומים mScarlet נצפו בתאים חיוביים ל-EGFP, מה שמרמז על מיקרוגליה כסוג התא העיקרי של ביטוי EcoHIV במוחות עכברים.
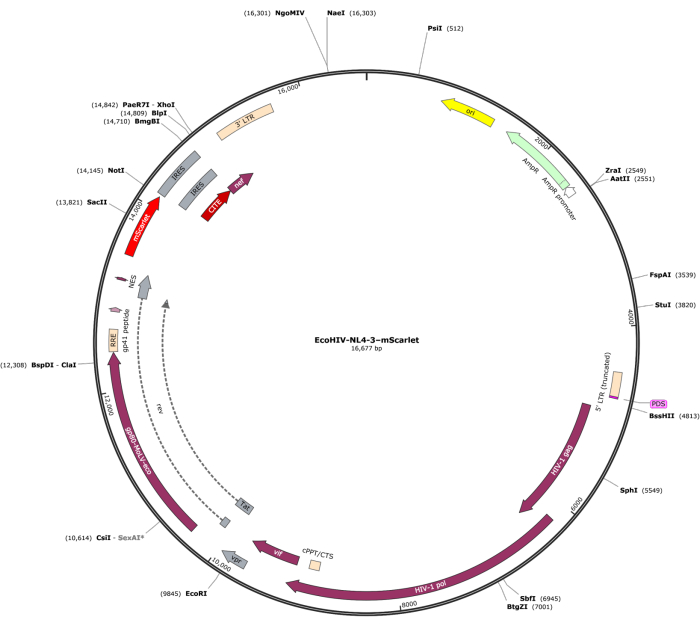
איור 1: מפת הווקטור של EcoHIV-NL-4-3-mScarlet. אנא לחצו כאן כדי לצפות בגרסה גדולה יותר של איור זה.
איור 2: זיהום EcoHIV-mScarlet בתאי מוח ראשוניים של חולדות. (A,E) תמונות מייצגות של צביעת CD11b/c בתאי מוח ראשוניים. תאי המוח בודדו מעוברי חולדות E18 ונדבקו בנגיף EcoHIV-mScarlet למשך 6 ימים. (ב,ו) תמונות מייצגות של אותות פלואורסצנטיים mScarlet מתאי מוח במבחנה . (ג,ז) תמונות מייצגות של צביעת Iba1 בתאי מוח ראשוניים. (ד,ח) תמונות ממוזגות של תיוג משולש של CD11b/c, mScarlet ו-Iba1. פסי קנה מידה: 50 מיקרומטר. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
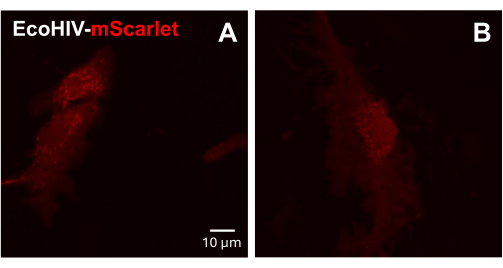
איור 3: זיהום EcoHIV-mScarlet בתאי גליה מעורבים ראשוניים של עכבר. (A,B) תמונות קונפוקליות מייצגות של התפלגות mScarlet במבחנה. תאי הגליה המעורבים הראשוניים בודדו מעכברי C57BL6 בוגרים (בני חודשיים) ותורבו במשך שבועיים לפני ההדבקה הוויראלית. ה-EcoHIV-mScarlet התווסף למדיום התרבית למשך יומיים וצילם את התמונות תחת המטרה של 60× של המיקרוסקופ הקונפוקלי. סרגל קנה מידה: 10 מיקרומטר. אנא לחץ כאן לצפייה בגרסה מוגדלת של איור זה.
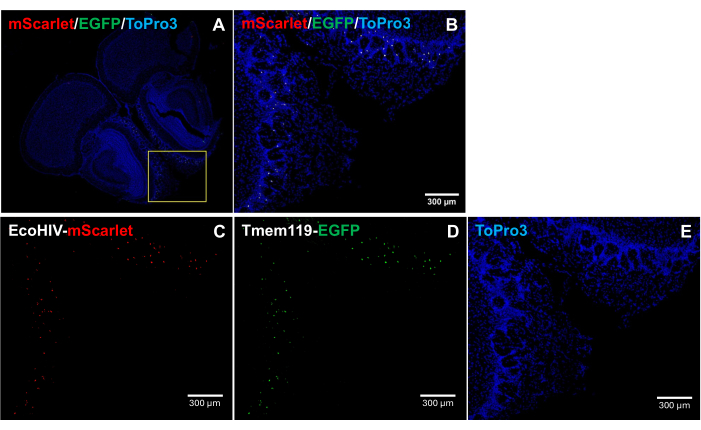
איור 4: התפלגות EcoHIV-mScarlet בקו העכבר Tmem119-EGFP . (א,ב) תמונות ממוזגות של אותות mScarlet/EGFP/ToPro3 בחלקי מוח. המסגרת הצהובה מציינת את אזור היעד של (B). סרגל קנה מידה: 300 מיקרומטר. (C) תמונה מייצגת של התפלגות mScarlet בשכבת הפרספקס החיצונית של אזור הריח של קו העכבר Tmem119-EGFP . (D) תמונה מייצגת של התפלגות EGFP. האותות הפלואורסצנטיים היו ממוקמים בתאי מיקרוגליה בקו העכברים Tmem119-EGFP . (E) תמונה מייצגת של צביעת גרעין TO-PRO-3. פסי קנה מידה: 300 מיקרומטר. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
איור משלים 1: צביעת MAP2 ו-MOG של תאי מוח ראשוניים של חולדות שנדבקו בנגיף EcoHIV-mScarlet. מוטות קנה מידה: 50 מיקרומטר. אנא לחץ כאן להורדת קובץ זה.
איור משלים 2: תמונות קונפוקליות של זיהום EcoHIV-mScarlet בקו עכברים Tmem119-EGFP . מוטות קנה מידה: 75 מיקרומטר. אנא לחץ כאן להורדת קובץ זה.
קובץ משלים 1: רצף DNA פלסמיד EcoHIV-mScarlet. אנא לחץ כאן להורדת קובץ זה.
Discussion
במחקר הנוכחי נמצא כי (1) ה-EcoHIV-mScarlet החדש הדביק בהצלחה תאי מוח ראשוניים של חולדות במבחנה; (2) התיוג המשולש של mScarlet, CD11b/c ו-Iba1 זיהה מיקרוגליה כסוג התא הדומיננטי לביטוי EcoHIV זה בתאי מוח של חולדות במבחנה; (3) תאי מוח ראשוניים של עכברים ממבוגרים במבחנה עדות נוספת לזיהום EcoHIV-mScarlet; (4) התפלגות EcoHIV-mScarlet בקו העכברים Tmem119-EGFP הדגימה דפוס התפלגות ספציפי למיקרוגליה של זיהום EcoHIV.
מחקרים חדשים הציעו כי סוגים שונים של תאי מוח המזוהים במערכת העצבים המרכזית (נוירונים, אסטרוציטים, מיקרוגליה, אוליגודנדרוציטים וכו') מציגים שינויים תפקודיים וטרנסקריפטומיים במהלך HIV והפרעות נוירו-קוגניטיביות הקשורות ל-HIV18,19. לדוגמה, אסטרוציטים תורמים 30%-70% מהמוח ומבצעים מעקב כדי לשמור על הומאוסטזיס במוח20. אסטרוציטים גם מווסתים את תפקוד החיסון ומווסתים את ההפרשה של מולטי-ציטוקינים וכימוקינים, במיוחד במצב של דלקת מוחית וניוון עצבי ב-HIV21,22. זיהום HIV במיקרוגליה לא רק מביא לשחרור רציף של חלבונים נגיפיים וציטוקינים וכימוקינים פרו-דלקתיים, אלא גם מספק מקורות עיקריים למאגרים נגיפיים של HIV 23,24,25,26. יתר על כן, מיקרוגליה מופעלת תורמת לתפקוד אימונולוגי קריטי במערכת העצבים המרכזית; עם זאת, הפעלה ממושכת עלולה גם להחמיר ניוון עצבי בהתקדמות HIV10,27. אוליגודנדרוציטים ממלאים גם תפקיד חשוב, כולל שחרור מספר נוירוטרופינים (כגון גורם גדילה עצבי, גורם נוירוטרופי מוחי וכו')28. מחקר קודם מצא כי מספר האוליגודנדרוציטים ירד משמעותית במוחם של חולי איידס, מה שעשוי להצביע על נזק ישיר לאוליגודנדרוציטים מחלבונים נגיפיים של HIV29. לכן, סוג מסוים של מודל זיהום מניפולטיבי של HIV צריך לספק אמצעים בסיסיים לזיהוי התפקודים הדיפרנציאליים של תאי מוח שונים לאחר הדבקה. במחקר הנוכחי פותחה מערכת ביולוגית לחיקוי תכונות של HIV-1 על ידי חיסון כימרי HIV (EcoHIV). חיסון HIV זה שולב גם עם קו העכברים Tmem119-EGFP כדי ליצור ולאמת מודל מכרסמים של HIV המופעל על ידי מיקרוגליה.
עם זאת, יש להכיר במגבלות המחקר הנוכחי. היו כמה תאים שליליים Iba1/CD11b/c שהציגו אותות פלואורסצנטיים mScarlet במבחנה. סוגים אחרים של תאי מוח, כגון מקרופאגים במוח או פריציטים, עשויים להיות מעורבים בזיהום EcoHIV, או לחילופין, סביבת תרבית התאים עשויה לקדם דפוסי זיהום חריגים ביחס לחיסון in vivo . מחקרים עתידיים בבעלי חיים שלמים צריכים להבהיר עוד יותר את התפקוד של mScarlet+ microglia בתהליך הדבקה ב-EcoHIV, ולהגדיר עוד יותר את ההתפלגות האזורית של mScarlet+EcoHIV microglia במוח. בנוסף, שינויים נוירו-קוגניטיביים המתרחשים כתוצאה מזיהומים במיקרוגליה עשויים להיות מטופלים גם במודל מכרסמים זה. באופן קולקטיבי, החיסון EcoHIV-mScarlet של עכברי Tmem119-EGFP מספק מודל חדשני ואסטרטגיית מחקר לחקירת המנגנונים המונעים על ידי מיקרוגליה של הפרעות נוירו-קוגניטיביות הקשורות ל-HIV.
Disclosures
לאף אחד מהכותבים אין ניגודי אינטרסים להצהיר עליהם.
Acknowledgements
עבודה זו מומנה על ידי מענקי NIH DA059310, DA058586, AG082539 ו-GM109091. אנו מעריכים את התרומה הנדיבה של EcoHIV-NL4-3-EGFP מד"ר פוטאש מבית הספר לרפואה של אייקן בהר סיני.
Materials
| Name | Company | Catalog Number | Comments |
| 293FT cells | ThermoFisher Scientific | R70007 | |
| 33 G, Small Hub RN Needle, (Point Style: 3, Needle Length: 19.25 mm) | Hamilton | 7803-05 | |
| Antibiotic-Antimycotic solution | Cellgro | 30004CI | 100x |
| C57BL/6-Tmem119em2Gfng/J | The Jackson Laboratory | Strain #:031823 | |
| Corning BioCoat Gelatin 75cm² Rectangular Canted Neck Cell Culture Flask with Vented Cap | Life Technologies | 354488 | |
| Corning DMEM with L-Glutamine, 4.5 g/L Glucose and Sodium Pyruvate | Life Technologies | 10013CV | |
| Cover glass | VWR | 637-137 | |
| Dumont #5 Forceps | World Precision Instruments | 14095 | |
| Dumont #7 Forceps | World Precision Instruments | 14097 | |
| EndoFree Plasmid Maxi Kit (10) | Qiagen | 12362 | |
| Eppendorf Snap-Cap Microcentrifuge Biopur Safe-Lock Tubes | Life Technologies | 22600028 | |
| Feather Double Edge Carbon Steel Blades | Ted Pella, inc. | 121-9 | |
| Fisher BioReagents Microbiology Media: LB Broth, Miller | Fisher Scientific | BP1426-500 | |
| Human recombinant anti-CD11b antibody | Miltenyi Biotec | 130-120-214 | 1:50 dilution |
| Intraocular Injector Syringe (6.5 µL), Removable Needle | Hamilton | 6609071-01 | |
| Invitrogen Lipofectamine 3000 Transfection Reagent | Life Technologies | L3000015 | |
| Invitrogen One Shot TOP10 Electrocomp E. coli | Fisher Scientific | C404052 | |
| Iris Forceps | World Precision Instruments | 15914 | |
| Iris Scissors | World Precision Instruments | 500216 | |
| Lentivirus-Associated p24 ELISA Kit | Cell Biolabs, inc. | VPK-107-5 | |
| Lenti-X Concentrator | Takara | PT4421-2 | |
| Opti-MEM I Reduced Serum Medium | Life Technologies | 11058021 | |
| Paraformaldehyde | Sigma-Aldrich | 158127-500G | |
| Paraformaldehyde | Sigma | P6148 | |
| PELCO easiSlicer Vibratory Tissue Slicer | Ted Pella, inc. | 11000 | |
| PELCO Pro CA44 Tissue Adhesive | Ted Pella, inc. | 10033 | |
| PELCO Pro Specimen Retrievers | Ted Pella, inc. | 101-33 | |
| ProLong Gold | Fisher Scientific | P36930 | |
| Rabbit monoclonal anti-Iba1 antibody | Abcam | ab178847 | 1:500 dilution |
| RN Compression Fitting 1 mm | Hamilton | 55750-01 | |
| Sevoflurane | Merritt Veterinary Supply | 347075 | |
| Sprague Dawley pregnant rat | Inotiv | ||
| SuperFrost Plus Slides | Fisher Scientific | 12-550-154% | |
| To-Pro-3 | ThermoFisher Scientific | T3605 | Nucleus staining kit |
| Trypsin-EDTA (0.25%), phenol red | ThermoFisher Scientific | 25200-056 | |
| Vannas Scissors | World Precision Instruments | 500086 |
References
- Vigorito, M., Lashomb, A. L., Chang, S. L. Spatial learning and memory in HIV-1 transgenic rats. J Neuroimmune Pharmacol. 2, 319-328 (2007).
- Moran, L. M., Booze, R. M., Mactutus, C. F. Time and time again: Temporal processing demands implicate perceptual and gating deficits in the HIV-1 transgenic rat. J. Neuroimmune Pharmacol. 8 (4), 988-997 (2013).
- Repunte-Canonigo, , et al. Gene expression changes consistent with neuroAIDS and impaired working memory in HIV-1 transgenic rats. Mol Neurodegener. 9, 26 (2014).
- Reid, W., et al. An HIV-1 transgenic rat that develops HIV-related pathology and immunologic dysfunction. Proc Natl Acad Sci USA. 98 (16), 9271-9276 (2001).
- McLaurin, K. A., Li, H., Booze, R. M., Mactutus, C. F. Disruption of timing: NeuroHIV progression in the post-cART era. Sci Rep. 9, 827 (2019).
- Roscoe, R. F., Mactutus, C. F., Booze, R. M. HIV-1 transgenic female rat: Synaptodendritic alterations of medium spiny neurons in the nucleus accumbens. J Neuroimmune Pharmacol. 9 (5), 642-653 (2014).
- Denton, A. R., et al. Selective monoaminergic and histaminergic circuit dysregulation following long-term HIV-1 protein exposure. J NeuroVirol. 25 (4), 540-550 (2019).
- Peng, J., et al. The HIV-1 transgenic rat as a model for HIV-1 infected individuals on HAART. J Neuroimmunol. 218 (1-2), 94-101 (2010).
- Abbondanzo, S. J., Chang, S. L. HIV-1 transgenic rats display alterations in immunophenotype and cellular responses associated with aging. PLoS ONE. 9, e105256 (2014).
- Potash, M. J., et al. A mouse model for study of systemic HIV-1 infection, antiviral immune responses, and neuroinvasiveness. Proc Natl Acad Sci USA. 102 (10), 3760-3765 (2005).
- Li, H., McLaurin, K. A., Illenberger, J. M., Mactutus, C. F., Booze, R. M. Microglial HIV-1 expression: Role in HIV-1 associated neurocognitive disorders. Viruses. 13 (5), 924 (2021).
- Kaiser, T., Feng, G. Tmem119-EGFP and Tmem119-CreERT2 transgenic mice for labeling and manipulating microglia. eNeuro. 6 (4), (2019).
- Bennett, M. L., et al. New tools for studying microglia in the mouse and human CNS. Proc Natl Acad Sci. USA. 113 (12), E1738-E1746 (2016).
- Satoh, J., et al. TMEM119 marks a subset of microglia in the human brain. Neuropathology. 36 (1), 39-49 (2016).
- Li, H., Aksenova, M., Bertrand, S. J., Mactutus, C. F., Booze, R. M. Quantification of filamentous actin (F-actin) puncta in rat cortical neurons. J Vis Exp. (108), e53697 (2016).
- Li, H., McLaurin, K. A., Mactutus, C. F., Booze, R. M. A rat model of EcoHIV brain infection. J Vis Exp. (167), e62137 (2021).
- Alfar, H. R., et al. Protocol for optimizing production and quality control of infective EcoHIV virions. STAR Protoc. 4 (3), 102368 (2023).
- Malatesta, P., Hartfuss, E., Götz, M. Isolation of radial glial cells by fluorescent-activated cell sorting reveals a neuronal lineage. Development. 127 (24), 5253-5263 (2000).
- Parpura, V., et al. Glutamate-mediated astrocyte-neuron signaling. Nature. 369 (6483), 744-747 (1994).
- Wahl, A., Al-Harthi, L. HIV infection of non-classical cells in the brain. Retrovirology. 20 (1), 1 (2023).
- Pandey, H. S., Seth, P. Friends turn foe-astrocytes contribute to neuronal damage in NeuroAIDS. J. Mol. Neurosci. 69 (2), 286-297 (2019).
- Minagar, A., et al. The role of macrophage/microglia and astrocytes in the pathogenesis of three neurologic disorders: HIV-associated dementia, Alzheimer's disease, and multiple sclerosis. J Neurol Sci. 202 (1-2), 13-23 (2002).
- Borrajo, A., Spuch, C., Penedo, M. A., Olivares, J. M., Agís-Balboa, R. C. Important role of microglia in HIV-1 associated neurocognitive disorders and the molecular pathways implicated in its pathogenesis. Ann Med. 53 (1), 43-69 (2021).
- González-Scarano, F., Martín-García, J. The neuropathogenesis of AIDS. Nat Rev Immunol. 5 (1), 69-81 (2005).
- Li, H., McLaurin, K. A., Mactutus, C. F., Booze, R. M. Microglia proliferation underlies synaptic dysfunction in the prefrontal cortex: Implications for the pathogenesis of HIV-1-associated neurocognitive and affective alterations. J. Neurovirol. 29 (4), 460-471 (2023).
- Kim, B. H., et al. EcoHIV infection of primary murine brain cell cultures to model HIV replication and neuropathogenesis. Viruses. 16 (5), 693 (2024).
- Réu, P., et al. The lifespan and turnover of microglia in the human brain. Cell Rep. 20 (4), 779-784 (2017).
- Jones, J. D. Potential of glial cell modulators in the management of substance use disorders. CNS Drugs. 34 (7), 697-722 (2020).
- Kaalund, S. S., Johansen, A., Fabricius, K., Pakkenberg, B. Untreated patients dying with aids have loss of neocortical neurons and glial cells. Front Neurosci. 13, 1398 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved