Method Article
מנגנון העיכוב של קמנג פאנג של אפופטוזיס פודוציטים בחולדות עם נפרופתיה קרומית דרך מסלול האיתות PI3K/AKT
In This Article
Summary
הפרוטוקול הנוכחי מתאר את הקמת מודל בעלי החיים של נפרופתיה קרומית (MN), וכיצד העיכוב של קמנג פאנג מפחית את אפופטוזיס הפודוציטים של חולדות MN על ידי הפעלת מסלול האיתות PI3K/AKT.
Abstract
נפרופתיה קרומית (MN) היא סוג פתולוגי שכיח של תסמונת נפרוטית במבוגרים. עד 20% מהחולים עם MN מפתחים מחלת כליות סופנית (ESRD). לפודוציטים יש תפקיד חשוב בשמירה על מחסום הסינון הגלומרולרי והם ממלאים תפקיד מכריע בהתרחשות והתפתחות של פרוטאינוריה ו-MN. מסלול האיתות PI3K/AKT מעורב בכל התהליך של צמיחת פודוציטים, התמיינות ואפופטוזיס. Kemeng Fang (KMF) היא פורמולה מסורתית לרפואה סינית ששימשה לעיכוב פגיעה בכליות. עם זאת, המנגנון הטיפולי של KMF ב-MN אינו ברור. כאן, מודל החולדות MN הוקם על ידי הזרקות של אלבומין בסרום בקר (C-BSA), ולאחר מכן ניתנו מעכבי KMF ו-PI3K (LY294002). הנתונים של תפקודי כבד, תפקוד כליות, שומנים בדם, פתולוגיה כלייתית , תפקוד פודוציטים, רמת ביטוי של מסלול איתות PI3K/AKT וטרנסקריפטומיקה של חולדות הראו כי ל-KMF יש השפעה מגנה על הפודוציטים של חולדות MN על ידי הפעלת מסלול האיתות PI3K/AKT, והוא יכול למנוע ביעילות את התקדמות MN.
Introduction
נפרופתיה קרומית (MN) היא סוג פתולוגי נפוץ של תסמונת נפרוטית במבוגרים, עם שיעור היארעות שנתי של כ-5-10 לכל 100,000 אנשים. המחלה מתרחשת בעיקר בין הגילאים 30 ל-50 ונדירה בקרב ילדים (כ-5%). היא שכיחה יותר באופן משמעותי אצל גברים מאשר אצל נשים (2:1). יתר על כן, עד 20% מהחולים עם MN מפתחים מחלת כליות סופנית (ESRD). יתר על כן, ישנה מגמה הולכת וגוברת שבה חולים עם MN מפתחים ESRD שנה אחר שנה 1,2,3. המאפיין הפתולוגי של MN הוא שאימונוגלובין גרגירי G (IgG) וקומפלקס התקפת קרום מערכת משלים (MAC) מופקדים בכבדות בקרום הבסיס הגלומרולרי (GBM) הסמוך לפודוציטים. תצהיר זה מוביל לעיבוי ה-GBM ולשיבוש שלמות מחסום הסינון הגלומרולרי, מה שמוביל בסופו של דבר לפרוטאינוריה4.
טיפול תומך, תרופות מדכאות חיסון ונוגדנים חד-שבטיים ממוקדים הם השיטות העיקריות לטיפול ב-MN. למרות שהתערבויות אלו יכולות להפחית משמעותית את הפרוטאינוריה ולעכב את התקדמות ההידרדרות הכלייתית, יש להן גם חסרונות רבים. ראשית, טיפול תומך מתאים רק לחולים בסיכון נמוך5. שנית, תרופות מדכאות חיסון עלולות לגרום לתגובות שליליות, כגון נמק ראש עצם הירך, זיהום משני ועיכוב תפקוד המטופויאטי של מח העצם6. שלישית, יש צורך במחקר אקראי מבוקר נרחב כדי לספק תרופה מבוססת ראיות לשימוש בנוגדנים חד-שבטיים כגון ofamizumab, otuzumab, daretozumab ו-isatuximab 7,8,9. לכן, לחיפוש פעיל של שיטות טיפול יעילות ל-MN יש משמעות רבה בעיכוב הופעת ESRD ושיפור איכות החיים של חולים עם MN.
פודוציטים, הידועים גם כתאי אפיתל קרביים גלומרולריים, מחוברים לצד החיצוני של GBM, והאנדותל הנימי של GBM יוצרים יחד את מחסום סינון הדם הגלומרולרי. יש להם פונקציות חשובות, כגון שמירה על מחסום סינון החלבון הגלומרולרי, סינתזה של קרום הבסיס הרגיל ומתן תמיכה מבנית למקלעת הנימים הגלומרולרית10,11. מחקרים הראו כי אפופטוזיס של פודוציטים ממלא תפקיד מכריע בהתרחשות והתפתחות של פרוטאינוריה ו-MN, ומסלול האיתות PI3K/AKT מעורב בכל התהליך של צמיחת פודוציטים, התמיינות ואפופטוזיס 12,13,14.
מספר הולך וגדל של מחקרים הראו כי לרפואה הסינית יתרונות משמעותיים בטיפול ב-MN, מה שיכול להפחית משמעותית את הקריאטינין בדם, פרוטאינוריה ופגיעה כלייתית מאוחרת15,16. KMF היא תרכובת רפואה סינית מסורתית עם מרכיבים המופקים מ-13 צמחים: Codonopsis pilosula (Franch.) ננף. (דאנגשן, ד"ש); Astragalus membranaceus (Fisch.) באנג'. (הואנגצ'י, מפקדה); קופטיס צ'יננסיס פרנץ'. (הואנגליאן, HL); Perilla frutescens (L.) Britt. (סויה, SY); Rehmannia glutinosa (Gaertn.) DC. (שודיהואנג, SDH); Ligusticum chuanxiong Hort. (צ'ואן-שיונג, CX); Euryale ferox סאליסב. (צ'יאנשי, QS); סביה יפנית מקסים. (צ'ינפנגטנג, QFT); Rhus chinensis טחנה (Wubeizi, WBZ); Lobelia chinensis לור. (בנביאנליאן, BBL); Oldenlandia diffusa (Willd.) Roxb. (Baihuasheshecao, BHSSC; טבלה 1). ל-KFM יש תפקידים רבים, כגון חיזוק הכליות (שיפור תפקוד הכליות), שיפור הצ'י (חיזוק מערכת החיסון), קידום השתנה וחפירת חומרים נלווים (קידום זרימת הדם). עם זאת, המנגנון הטיפולי של KMF ב-MN אינו ברור 17,18.
נכון לעכשיו, ישנן דרכים רבות לבנות מודלים של MN, כולל מודל נפריטיס היימן, מודל נפריטיס C-BSA, מודל עכבר α3NC1, שבו מודל נפריטיס היימן, חלבון האנטיגן מגלין הפתוגני העיקרי אינו נמצא ב-MN אנושי, ולכן הוא שונה מהפתוגנזה של MN אנושי, מודל עכבר α3NC1, רק הרקע הגנטי DBA/1 של שיעור ההצלחה של מודל העכבר גבוה יותר, שאר העכברים הצליחו פחות במידול, או אפילו לא הצליחו להיות מודלים 19,20,21. מודל נפריטיס C-BSA הוא חסכוני ופשוט לתפעול, והפתוגנזה שלו דומה מאוד לזו של מודל בעלי החיים האנושי MN19. העיקרון הבסיסי הוא שמכיוון שה-GBM טעון שלילית, ו-C-BSA טעון חיובית, הוא יכול בקלות לחצות את ה-GBM ולהפוך לאנטיגן נטוע, הגורם לנוגדנים במחזור להצטבר שם וליצור קומפלקס חיסוני באתרו, ובכך לבנות מודל MN22,23. מטרת מחקר זה הייתה לבחון את ההשפעה הטיפולית של KMF על MN והמנגנון המולקולרי שלו על ידי שילוב של טרנסקריפטומיקה וביולוגיה מולקולרית ולספק בסיס מדעי אמין לטיפול ב-MN עם KMF.
Protocol
מחקר זה נבדק ואושר על ידי הוועדה לניהול ושימוש בבעלי חיים ניסיוניים של המרכז המחוזי לבקרת מחלות ומניעתן של חוביי (מספר תעודת זהות: 202220144). החולדות עברו מחזור של 12 שעות אור/חושך בתנאים לא פתוגניים של 23 ±-1 מעלות צלזיוס ו-50%-60% לחות אטמוספרית. רכשנו 100 חולדות Sprague-Dawley זכרות בנות 8 שבועות מהמרכז המחוזי לבקרת מחלות ומניעתן של חוביי (מספר רישיון: SYXK [E] 2022-0065), והן היו נתונות להזנה אדפטיבית בסביבה ספציפית נטולת פתוגנים למשך שבוע אחד עם הזנת תחזוקה רגילה ושתיית מים סטריליים.
1. הכנת תרופות
- הכנת KMF
- התרופות הסיניות ששימשו סופקו על ידי בית החולים המסונף לאוניברסיטת צ'אנגצ'ון לרפואה סינית מסורתית, ההרכב והמינון הספציפיים מוצגים בטבלה 1. להכנה, השתמש בסך הכל ב -147 גרם תרופות גולמיות-Codonopsis pilosula (20 גרם), Astragalus membranaceus (30 גרם), Coptis chinensis (3 גרם), Perilla frutescens (6 גרם), Rehmannia glutinosa (15 גרם), Ligusticum chuanxiong (15 גרם), Euryale ferox (15 גרם), Sabia japonica (10 גרם), Rhus chinensis (3 גרם), Lobelia chinensis (15 גרם), Oldenlandia diffusa (15 גרם). מערבבים ומשרים ב -1470 מ"ל מים מזוקקים למשך 30 דקות.
- מניחים את תערובת הצמחים בסיר קרמי ומחממים בחום של 100 מעלות למשך 90 דקות למרתח. מסננים דרך שתי שכבות של גזה רפואית ומאחסנים בטמפרטורת החדר.
- הוסף שוב מים מזוקקים (1470 מ"ל) לשאריות תערובת הצמחים וחזור על פעולת המרתח לעיל פעם נוספת, כמתואר בשלב 1.1.2. אחסן את המסנן בטמפרטורת החדר.
- מערבבים את שני המסננים הנ"ל ומייבשים בתנור בחום של 80 מעלות צלזיוס למשך 10 שעות עד שהתמיסה המימית מתאדה לחלוטין ורק המומס נשמר בצורת אבקה.
- שקלו את האבקה והמיסו אותה במי מלח כדי ליצור תמיסה המכילה 1.323 גרם, 2.646 גרם ו-5.292 גרם של התרופה ל-4 מ"ל (הריכוזים היו 0.331 גרם/מ"ל, 0.662 גרם/מ"ל ו-1.323 גרם/מ"ל, בהתאמה), שהוא המינון היומי של התרופה הניתנת לחולדות.
- הכנת בנדריל הידרוכלוריד
- יש להוסיף טבלית בנדריל הידרוכלוריד (90 גרם) ל-100 מ"ל מי מלח ולנער היטב עד להמסה מלאה.
- הכנת מעכב PI3K LY294002
- הוסיפו 82.3 מ"ג של אבקת LY294002 ל-1.1 מ"ל של DMSO ונערו היטב כדי להמיס אותה לחלוטין. לאחר מכן, הוסף 198.9 מ"ל של מי מלח כדי לדלל אותו לקבלת ריכוז של 0.41 מ"ג/מ"ל.
- הכנת מתחלב C-BSA
- מוסיפים 67 מ"ל של אתילנדיאמין נטול מים ל-500 מ"ל מים מזוקקים כפולים ומערבבים. הוסף לאט לאט 350 מ"ל של חומצה הידרוכלורית 6 M והתאם את ה-pH ל-4.75. שמור על טמפרטורת התמיסה הסופית על 25 מעלות צלזיוס.
- ממיסים 5 גרם אלבומין טבעי בסרום בקר ב-25 מ"ל מים מזוקקים כפולים ושומרים על התמיסה בטמפרטורה קבועה של 25 מעלות צלזיוס תוך ערבוב מתמיד. הוסף 1.8 גרם של קרבודימיד הידרוכלוריד ו-30 מ"ל של חומצה אצטית 4 M עם pH 4.75 לאחר שעתיים כדי לקבל את תמיסת C-BSA.
- דיאליזה של התמיסה המתקבלת במים מזוקקים כפולים ב-4 מעלות צלזיוס למשך 72 שעות (כאשר המים מוחלפים כל 3-5 שעות) באמצעות נייר סלניט וייבש בהקפאה לקבלת אבקת ליופיליזציה C-BSA, יש לאחסן בטמפרטורה של -80 מעלות צלזיוס24.
- יש להוסיף 100 מ"ג של אבקת C-BSA מיובשת ב-50 מ"ל מי מלח ליצירת תמיסת C-BSA. מערבבים זאת עם נפח שווה של האדג'ובנט הלא שלם של פרוינד לאמולסיה מלאה; ריכוזו הוא 1 מ"ג/מ"ל.
- הכנת תמיסת C-BSA
- יש להוסיף 640 מ"ג של אבקה יבשה C-BSA ב-100 מ"ל PBS ולנער היטב כדי להמיס אותה במלואה; ריכוזו הוא 6.4 מ"ג/מ"ל.
2. הקמת מודל בעלי חיים MN
הערה: הניסוי חולק לשמונה קבוצות: קבוצת ביקורת נורמלית (CON), קבוצת מודל (MOD), קבוצת בנאזפריל הידרוכלוריד (BEN), קבוצת מינון נמוך KMF (KM-L), קבוצת מינון בינוני של KMF (KM-M), קבוצת מינון גבוה של KMF (KM-H), קבוצת מעכבי PI3K (PI3K) וקבוצת מינון בינוני של מעכב PI3K + KMF (PI3K + KM-M). למעט קבוצת הביקורת הרגילה, כל הקבוצות קיבלו C-BSA כדי לייצר את מודל ה-MN.
- בשבוע התשיעי יש לבצע טרום חיסון: זריקות תת עוריות מרובות של מתחלב C-BSA בבית השחי ובמפשעה.
הערה: קשקוש הצוואר (בין-שכמי) הוא אתר חלופי למתן תת עורי של מתחלב C-BSA.- אחזו בעור האחורי של החולדות ביד שמאל וסובבו את הבטן כלפי מעלה כשעור הבטן מהודק. יש להזריק את המתחלב C-BSA באופן תת עורי לתוך בית השחי והמפשעה של החולדות באמצעות מזרק של 2.5 מ"ל במינון של 1 מ"ל/400 גרם פעם ביומיים למשך שבוע.
- חיסון פורמלי: הזרקת וריד זנב של תמיסת C-BSA
- בשבוע העשירי, הוציאו את החולדות מהכלובים שלהן והניחו אותן על מכסה מוט התיל כשזנבותיהן פונים לנסיין.
- נגב את זנב החולדה עם צמר גפן אלכוהולי וצבט את שני צידי זנב החולדה עם האגודל והאצבע המורה של יד שמאל כדי למלא את הווריד ולשמור על הווריד כלפי מעלה.
- החזק מזרק של 1 מ"ל ביד ימין כך שהמחט תהיה ב-30 מעלות לווריד הזנב. שמור את קצה המחט משופע כלפי מעלה ואת המחט במקביל לכלי מיד לאחר דקירתה בעדינות בעור. אם יש החזרת דם מהמחט, יש להזריק אותו בחזרה יחד עם מינון C-BSA של 2.5 מ"ל/ק"ג 3 פעמים בשבוע למשך 4 שבועות.
- לאחר השלמת ההזרקה, השתמש בצמר גפן יבש כדי ללחוץ על נקודת ההזרקה למשך כדקה אחת כדי לעצור את הדימום. מוציאים את העכברים מהאימובילייזר ומחזירים לכלוב.
3. ניתוח KMF
- שקלו דגימה של 1 גרם לתוך צינור צנטריפוגה של 2 מ"ל, הוסיפו 600 מיקרוליטר של MeOH (מאוחסן בטמפרטורה של -20 מעלות צלזיוס המכיל 2-Amino-3-(2-chloro-phenyl)-חומצה פרופיונית (4 ppm)), ומערבל את התערובת למשך 30 שניות.
- מוסיפים כ-100 מ"ג חרוז זכוכית ומניחים את התערובת במטחנת טישו למשך 90 שניות ב-60 הרץ.
- בצע אולטרסאונד ב -40 קילוהרץ למשך 15 דקות בטמפרטורת החדר.
- צנטריפוגה למשך 10 דקות ב-15,984 x גרם, 4 מעלות צלזיוס, ולסנן את הסופרנטנט דרך ממברנה של 0.22 מיקרומטר. העבר בקבוק זיהוי לזיהוי LC-MS.
4. טיפולים תרופתיים
הערה: בני אדם בוגרים זקוקים ל-147 גרם קמ"ק ליום. על פי נוסחת ההמרה של מינון תרופות בחולדות ניסוי ובבני אדם, מינון הניסוי המקביל לחולדה (גרם/ק"ג) = מינון אנושי (גרם)/משקל גוף (70 ק"ג) x 6.3, המינון היומי של החולדה היה כ-13.23 גרם/ק"ג.
- בשבוע ה-14, בעזרת יד שמאל, תפסו את העור בגב החולדות, סובבו את הבטן כלפי מעלה והדקו את עור הבטן. החזיקו את המחט של מזרק 10 מ"ל ביד ימין והכניסו אותה לפה מצד אחד, החליקו לאורך החך והדופן האחורית של הלוע ובהמשך לקיבה באמצעות פעולת הבליעה.
- יש לתת את התרופה באיטיות באמצעות האצבע המורה של יד ימין ולמשוך את מחט הקיבה החוצה לאחר השלמת המתן. המינון של התרופה הניתנת הוא 10 מ"ל/ק"ג למשך זמן כולל של 4 שבועות.
- עבור קבוצות CON ו-MOD, יש לתת 10 מ"ל/ק"ג/יום של מי מלח על ידי gavage.
- עבור קבוצת BEN, יש לתת תמיסה מימית של 9 מ"ג/ק"ג/יום בנדריל הידרוכלוריד על ידי גבאז'.
- עבור קבוצת KM-L, יש לתת תמצית מימית של 3.3075 גרם/ק"ג/יום של KMF על ידי gavage. עבור קבוצת KM-M, יש לתת תמצית מימית של 6.615 גרם/ק"ג/יום של KMF על ידי gavage. עבור קבוצת KM-H, יש לתת תמצית מימית של 13.23 גרם/ק"ג/יום של KMF על ידי gavage.
- עבור קבוצת PI3K, יש לתת 2.1 מ"ג/ק"ג/יום LY294002 על ידי gavage.
- עבור קבוצת PI3K+KM-M, יש לתת 2.1 מ"ג/ק"ג/יום LY294002 (5 מ"ל/ק"ג) + 6.615 גרם/ק"ג/יום תמצית מימית KMF (5 מ"ל/ק"ג) על ידי גבאז'.
5. הערכת יעילות KMF
- איתור מדדים ביוכימיים של דם ושתן
- מהשבוע ה-14 ואילך, יש לאסוף שתן כל שבועיים לאחר תחילת הניסוי. הניחו חולדה בודדת בכלוב מטבולי למשך 24 שעות. להגביל את התזונה ולספק גישה חופשית למי שתייה. אסוף שתן באמצעות צינור צנטריפוגה של 50 מ"ל הממוקם מתחת לכלוב המטבולי.
- צנטריפוגה של השתן ב-15,984 x גרם למשך 10 דקות והשתמש בסופרנטנט כדי להעריך את רמת החלבון בשתן בהתאם להוראות ערכת בדיקת חלבון השתן.
- בשבוע ה-18, המתת חסד של חולדות על ידי שאיפת איזופלורן 5%. יש להשתמש במשחה וטרינרית על העיניים כדי למנוע יובש. אשר את המוות בשיטת פריקת צוואר הרחם. אחזו בעור בגב החולדות ביד שמאל וחתכו את שפם החולדות במספריים.
- יש לחטא את העור סביב גלגלי העיניים באתנול ולהסיר במהירות את גלגלי העיניים באמצעות מלקחיים המוסטטיים. אסוף את הדם שנפל לתוך צינור הצנטריפוגה והצנטריפוגה למשך 10 דקות ב-15,984 x g לאחר עמידה בטמפרטורת החדר במשך 30 דקות. אסוף את הסופרנטנט.
- זהה אלנין אמינוטרנספראז (ALT), אספרטט טרנסאמינאז (AST), אלבומין (ALB), טריגליצרידים (TG), כולסטרול כולל (TC), חנקן אוריאה בדם (BUN), קריאטינין בסרום (Scr), TotalProtein (TP) ומדדי דם אחרים באמצעות מנתח ביוכימי אוטומטי.
- הפרדת רקמות כליה
- לאחר לקיחת הדם מהחולדות, מקבעים אותם על צלחת הניתוח, וחותכים לאט את הפרווה ושכבת השרירים בקו האמצע של הבטן, דוחפים את צינורות המעי פתוחים כדי לחשוף את אבי העורקים הבטני והכליות25.
- חסום את אבי העורקים הבטני מעל הכליה הימנית באמצעות מהדקי עורקים כירורגיים. חבר מחט קרקפת למזרק של 5 מ"ל כדי לנקב מתחת לבלוק והשתמש במאגר PBS כדי להשקות את הכליות עד ששתי הכליות הופכות לבנות או חיוורות.
- הסר את הכליות והפרד בצורה בוטה את הפריאוסטאום. מחלקים את הכליה הימנית לצינורות אחסון בהקפאה ושומרים במקרר בטמפרטורה של -80 מעלות צלזיוס. תקן את הכליה השמאלית בתמיסת פרפורמלדהיד 4%.
- לאחר 24 שעות של קיבוע, הסר את הכליה. בצע התייבשות, שקיפות והטמעת פרפין. לאחר שגוש השעווה מתמצק, פורסים בעזרת פורס רקמות בעובי של 3 מיקרומטר, דגים עם שקופית נגד פירוק, אופים את הפרוסות בחום של 98 מעלות צלזיוס למשך 20 דקות ושומריםל-26 שעות נוספות.
- ניתוח היסטופתולוגי כלייתי
- הכניסו את החלקים להסרת שעווה קסילן שיפוע והתייבשות אתנול נטול מים ושטפו במים מזוקקים. כפוף לקסילן למשך 15 דקות, ולאחר מכן תמיסת קסילן טרייה למשך 15 דקות. עברו לאתנול נטול מים למשך 5 דקות, החליפו לאתנול נטול מים טרי למשך 5 דקות, ואחריו 90% אתנול למשך 5 דקות, לאחר מכן 80% אתנול למשך 5 דקות, ואז 70% אתנול למשך 5 דקות, ולבסוף שטפו במים מזוקקים.
- עקוב אחר ההוראות לצביעה של המטוקסילין-אאוזין (H&E), חומצה-שיף תקופתית (PAS) וערכות צביעה של מאסון לצביעה לדוגמה.
- בצע התייבשות אתנול נטול מים בשיפוע וקסילן נקי שוב.
- מניחים את הפרוסות באינקובטור בטמפרטורה קבועה, מכוונים את הטמפרטורה ל-90 מעלות צלזיוס ואופים 20 דקות. לאחר האפייה מסירים את הפרוסות ומוסיפים מסטיק ניטרלי טיפה. מכסים אותם בכוס כיסוי.
- התבוננו תחת מיקרוסקופ אור בהגדלה של פי 200 ואספו תמונות.
- ניתוח אימונופלואורסצנטי (IF) של רקמות כליה
- מסירים קטעי שעווה ומייבשים כמתואר בשלב 5.3.1. הנח דגימות בתמיסת חיץ EDTA של 0.01 M לקיבוע בלחץ גבוה ובחום גבוה (125 מעלות צלזיוס ב-103 KPa) למשך 15 דקות. תנו לדגימה להתקרר באופן טבעי, ושטפו 3 פעמים במשך 3 דקות כל אחת ב-PBS.
- מניחים את החלקים בתמיסת מי חמצן 3% ודוגרים למשך 10 דקות. שטפו את הדגימות 3 פעמים למשך 5 דקות כל אחת ב-PBS. לאחר מכן, הניחו את החלקים בסרום עיזים 10%, דגרו למשך 30 דקות ושטפו 3 פעמים למשך 3 דקות כל אחד ב-PBS.
- יש להוסיף נוגדנים ראשוניים IgG (1:100) ו-C3 (1:100) בטיפה ולדגור בקופסה רטובה בטמפרטורה של 4 מעלות צלזיוס למשך הלילה. יחס דילול הנוגדנים העיקרי מוצג בטבלה 2. מוציאים את החלקים מהמקרר ושוטפים עם TBST 3x למשך 3 דקות כל אחד.
- הוסיפו נוגדן משני פלואורסצנטי (1:100) בטיפה, דגרו בטמפרטורה של 37 מעלות צלזיוס למשך שעה, ושטפו עם TBST 3x למשך 3 דקות כל אחד.
הערה: שלב זה וכל השלבים הבאים צריכים להתבצע בחושך27,28. - יש לדגור עם 4',6-דיאמידינו-2-פנילינדול (DAPI) למשך 5 דקות בטמפרטורת החדר ולהימנע מאור, לשטוף עם מי מלח עם טריס עם tween 20 (TBST) 3x למשך 5 דקות כל אחד כדי להסיר עודפי DAPI.
- הוסף מרווה אוטופלואורסצנטי במעגל, דגירה למשך 5 דקות ושטוף במים זורמים למשך 10 דקות. לנער, לייבש את החלקים ולאטום בעזרת סילר מרווה נגד פלואורסצנטי. התבוננו תחת מיקרוסקופ פלואורסצנטי ב-200x ואספו תמונות.
- ניתוח אימונוהיסטוכימי (IHC) של רקמת כליה
- מסירים קטעי שעווה ומייבשים כמתואר בשלב 5.3.1. תיקון בלחץ גבוה (125 °C · 103KPa) בתמיסת חיץ EDTA 0.01M למשך 15 דקות. לאחר קירור טבעי, יש לשטוף עם PBS 3 פעמים למשך 3 דקות כל אחד.
- חסום פרוקסידאז אנדוגני ושיטת פעולת איטום סרום כמתואר בשלב 5.4.2.
- הוסיפו נוגדן ראשוני WT-1 (1:200) ונפרין (1:100) בטיפה ודגרו בקופסה רטובה במקרר בטמפרטורה של 4 מעלות צלזיוס למשך הלילה29.
- מוציאים את החלקים מהמקרר בטמפרטורה של 4 מעלות צלזיוס, שוטפים עם PBS 3x למשך 5 דקות כל אחד. הוסיפו נוגדן משני (1:200) בטיפה, דגרו בטמפרטורה של 37 מעלות צלזיוס למשך 30 דקות, ושטפו עם PBS 3x למשך 3 דקות כל אחד.
- הוסף טיפות של תמיסה כרומוגנית דיאמינובנזידין (DAB) שהוכנה לאחרונה והתבונן תחת מיקרוסקופ האור ב-200x. האות החיובי הוא צהוב חום או חום-חום. יש לשטוף את תמיסת הצביעה מיד במי ברז כאשר נצפה שינוי צבע בקטע.
- השתמש בהמטוקסילין כדי לצבוע מחדש למשך 3 דקות, ולאחר מכן הוסף אלכוהול חומצה הידרוכלורית 1% להתמיינות ושטוף במי ברז למשך 10 דקות.
- יבש את החלקים, שקוף ואוטם, כמתואר בשלב 5.2.4. התבוננו תחת מיקרוסקופ האור ב-200x ואספו תמונות.
- ניתוח של צביעת dUTP בתיווך dUTP (TUNEL) של רקמת כליה
- השתמש בשלב 5.3.1 כדי לנקות ולייבש את החלקים. צייר עיגולים סביב הרקמות באמצעות עט אימונוהיסטוכימיה והוסף 100 מיקרוליטר של תמיסת עבודה Proteinase K טיפתית לכל דגימה. יש לדגור בטמפרטורה של 37 מעלות צלזיוס למשך 20 דקות, לשטוף עם PBS 3x למשך 5 דקות כל אחד, ולאחסן את הדגימות המטופלות בקופסה רטובה.
- מניחים את החלקים בתמיסת מי חמצן 3%, מדגרים למשך 10 דקות ושוטפים עם PBS 3x למשך 5 דקות כל אחד.
- הוסף מאגר שיווי משקל (100 מיקרוליטר) טיפה למעגל כדי לכסות את הרקמה ולדגור במשך 20 דקות בטמפרטורת החדר.
- הוסף 50 מיקרוליטר של תמיסת עבודה לתיוג (תמיסת שיווי משקל: תמיסת תיוג פלואורסצנטית: אנזים TDT = 35 μL: 10 μL: 5 μL) טיפתית לכל דגימה, דגירה בקופסה רטובה בטמפרטורה של 37 מעלות צלזיוס למשך 60 דקות, מוגנת מפני אור, ושטוף עם PBS 3x למשך 5 דקות כל אחד.
- הוסיפו DAPI ודגרו עם DAPI למשך 5 דקות בטמפרטורת החדר תחת אור, שטפו עם PBS 3x למשך 5 דקות כל אחד.
- לאחר שהחלקים ניערו יבשים ונאטמו עם סילר מרווה נגד פלואורסצנטי, התבוננו במיקרוסקופ פלואורסצנטי ב-200x ואספו תמונות.
- הכנת דגימה לאנליזה מיקרוסקופית אלקטרונית של רקמת הכליה
- יש לתקן את רקמות הכליה עם 2.5% גלוטראלדהיד בטמפרטורה של 4 מעלות צלזיוס למשך 2-4 שעות ולשטוף 3 פעמים למשך 15 דקות כל אחת ב-PBS.
- מקבעים חומצת אוסמיום (1%) בטמפרטורת החדר הרחק מהאור למשך שעתיים ושוטפים עם PBS 3x למשך 15 דקות כל אחד.
- בצע התייבשות שיפוע של אלכוהול ואצטון, באמצעות אצטון וחומר הטבעה טבלו בשיפועים של 1:1, 1:2 ו-1:31 למשך 2 שעות, 4 שעות ו-8 שעות, בהתאמה. לאחר מכן, השתמש בחומר הטבעה טהור והטמיע את הדגימות ב-37 מעלות צלזיוס למשך הלילה.
- לאחר 8 שעות, הכניסו את הצלחת המוטמעת לתנור 60 מעלות צלזיוס לפילמור למשך 48 שעות. פורסים את גוש השרף שעובד לעיל בפורס דק במיוחד, בעובי פרוסה מוגדר ל-60-80 ננומטר; השתמש ברשת נחושת כדי לעקור פרוסות.
- השתמש בתמיסת מי חמצן אצטט ואלכוהול 2% לצביעה למשך 8 דקות, ולאחר מכן שטיפת אתנול ומים טהורים במיוחד פי 70. יש להשלים על ידי שטיפה עם 2.6% אתנול ומים טהורים במיוחד.
- התבונן ורכוש תמונות תחת מיקרוסקופ אלקטרונים שידור.
- ניתוח בדיקת תגובת שרשרת פולימראז כמותית בזמן אמת (qRT-PCR)
- הוסף 20 מ"ג של רקמת כליה קפואה לצינור המיקרו-צנטריפוגה וטחן היטב עם מטחנת רקמות במהירות גבוהה עד שאין מסת רקמה נראית לעין.
- יש לאסוף את הסופרנטנט לאחר צנטריפוגה ב-15,984 x גרם למשך 10 דקות. הוסף 250 מיקרוליטר כלורופורם והפוך את הצינור למשך 15 שניות; התמיסה מעורבבת היטב. השאירו לעמוד בטמפרטורת החדר למשך 3 דקות, ולאחר מכן צנטריפוגה בטמפרטורה של 15,984 x גרם למשך 10 דקות בטמפרטורה של 4 מעלות צלזיוס.
- אוספים את השלב המימי העליון ומעבירים לצינור צנטריפוגה חדש ללא RNase. מוסיפים נפח שווה של 70% אתנול (תכשיר מים ללא RNase), הופכים ומערבבים.
- הוסף את התמיסה לעמוד הסופח הטעון בצינור האיסוף לשטיפת RNA. לאחר שטיפת Buffer RW, השאירו את העמוד בטמפרטורת החדר למשך 5 דקות לייבוש.
- הנח את העמוד בצינור צנטריפוגה חדש ללא RNase, הוסף 30-50 מיקרוליטר מים נטולי RNase לאמצע העמוד, אפשר לעמוד בטמפרטורת החדר למשך דקה אחת, ולאחר מכן צנטריפוגה ב-15,984 x g למשך דקה אחת. אוספים את תמיסת ה-RNA ומאחסנים אותה בטמפרטורה של -80 מעלות צלזיוס.
- מוציאים את תמיסת ה-RNA מהמקפיא ומבצעים דנטורציה מראש ב-90 מעלות צלזיוס למשך 10 דקות, ולאחר מכן 40 מחזורים של 95 מעלות צלזיוס למשך 15 שניות, 60 מעלות צלזיוס למשך 35 שניות ו-72 מעלות צלזיוס למשך 25 שניות, ולבסוף ליזה בסדר גודל של 95 מעלות צלזיוס למשך 15 שניות, 60 מעלות צלזיוס למשך 60 שניות, 95 מעלות צלזיוס למשך 15 שניות (טבלה משלימה 1).
- באמצעות β-אקטין כהתייחסות פנימית, חשב את הביטוי היחסי של WT-1 ו-Nephrin בשיטת 2¬-ΔΔCt בהתבסס על ערך ה-Ct של כל דגימה (ΔΔCt = ערך Ct של גן היעד - ערך Ct של גן הייחוס הפנימי)30. מידע מפורט על פריימרים מוצג בטבלה 3.
- ניתוח כתם מערבי (WB).
- הכן את הליזט לפי היחס של מעכב פרוטאז: מעכב פוספטאז: RIPA= 1: 1: 100, והוסף 500 מיקרוליטר ליזט לתוך צינור מיקרוצנטריפוגה.
- הוסף 100 מ"ג של רקמת כליה קפואה לצינור המיקרו-צנטריפוגה וטחן היטב עם מטחנת רקמות במהירות גבוהה עד שאין מסת רקמה נראית לעין.
- הסר את צינור המיקרו-צנטריפוגה, ליז על קרח למשך 30 דקות, ולאחר מכן צנטריפוגה ב-15,984 x גרם למשך 10 דקות. שאפו את הסופרנטנט ואחסנו אותו בטמפרטורה של -80 מעלות צלזיוס.
- זהה את ריכוז החלבון בהתאם להוראות ערכת בדיקת ריכוז החלבון של חומצה ביצינצ'ונינית (BCA) והוסף תמיסת PBS טיפתית כדי להבטיח ריכוז חלבון עקבי בכל קבוצה.
- הוסף מאגר דגימת חלבון פי 5 לצינור המיקרוצנטריפוגה, דגר בטמפרטורה של 100 מעלות צלזיוס למשך 15 דקות כדי לנטרל אותו לחלוטין, והסר לאחר הקירור.
- הפרד את החלבונים על ידי אלקטרופורזה של ג'ל SDS-PAGE של 12.5%, תחילה באמצעות 80 וולט, מה שגורם לכל הדגימות להילחץ לקו כחול שטוח, ולאחר מכן כוונן את המתח ל-130 וולט, עד שהברומופנול הכחול נגמר מתחתית צלחת הג'ל. עצור את האלקטרופורזה.
- הסר את הג'ל. הרטיבו את נייר הסינון עם מאגר העברת ממברנה. הפעל את ממברנת הפוליווינילידן פלואוריד (PVDF) במתנול למשך 30 שניות. לאחר מכן, סדרו הכל בסדר הבא: רשת ספוג/נייר פילטר/ג'ל/ממברנת PVDF/נייר פילטר/נייר פילטר/רשת ספוג בקליפ המשמש להעברת הממברנה.
- הניחו את הג'ל בקוטב השלילי, את קרום ה- PVDF בקוטב החיובי, והעבירו את הממברנה בזרם של 200 MA למשך 90 דקות.
- הסר את קרום ה-PVDF ושטוף עם TBST פעם אחת למשך 5 דקות. הוסף את תמיסת הסגירה בטמפרטורת החדר תוך כדי ניעור למשך 90 דקות. שוטפים עם TBST 3x למשך 5 דקות כל אחד.
- הוסף נוגדנים ראשוניים PI3K (1:1000), PIK3CA (1:1000), AKT (1:1000), P-AKT (1:1000), BAD (1:1000), P-BAD (1:1000), BCL-2 (1:1000), bax (1:4000) ו-c-caspase3 (1:1000) ודגירה בקופסה רטובה למשך הלילה בטמפרטורה של 4 מעלות צלזיוס במקרר31,32.
- הסר את קרום ה-PVDF מהמקרר בטמפרטורה של 4 מעלות צלזיוס, שטוף עם TBST 3x למשך 5 דקות כל אחד. הוסיפו נוגדנים משניים (1:10,000) בטיפה, דגרו בטמפרטורה של 37 מעלות צלזיוס למשך 90 דקות, ושטפו עם TBST 3x למשך 3 דקות כל אחד.
- הכן את הפתרון המתפתח לפי היחס (A: B=1:1) ופתח אותם על המכונה לפי ההוראות.
תוצאות
תוצאות ניתוח של מרכיבי KMF
במצבי היונים החיוביים והשליליים שנותחו על ידי LC-MS/MS, זוהו 147 ו-120 תרכובות, בהתאמה (איור 1A-B). תרכובות מסוימות והמשקל המולקולרי המחושב על ידי MF, ערך m/z, זמן השמירה ויוני האב שלהן מוצגים בטבלה משלימה 2.
KMF שיפר הפרעות בחילוף החומרים של השומנים ופגיעה בכבד ובכליות בחולדות MN
באמצעות חולדות SD ו-C-BSA, הקמנו מודל MN. לאחר שבוע אחד של זריקות לוורידי הזנב של C-BSA, חולדות MN הראו דרגות שונות של עייפות מנטלית, ירידה בתיאבון, צמיחה איטית, צבע שיער עמום, פרווה רכה, תגובה מאוחרת וירידה במשקל, כאשר חלק מהחולדות פיתחו בצקת בשק האשכים. לאחר 4 שבועות של מתן הטיפול, מינונים שונים של KMF הפחיתו באופן משמעותי את רמות הביטוי של חלבון כולל בשתן למשך 24 שעות (24 שעות-UTP), Scr ו-BUN, שיפרו את תפקוד הכליות (איור 2A-C); רמות ביטוי ALT ו-AST מופחתות ורמות ביטוי מוגברות של TP ו-ALB, משפרות את תפקוד הכבד (איור 2D-G); הפחיתה את רמות הביטוי של TC ו-TG, ושיפרה את תפקוד ויסות השומנים (איור 2H-I). תוצאות אלה מצביעות על כך של-KMF יש השפעה מגנה על תפקוד הכליות; עם זאת, מנגנון הפעולה הספציפי שלו עדיין לא ברור.
KMF משפר את הנזק ההיסטופתולוגי של רקמת הכליה בחולדות MN
כדי לבדוק אם KMF יכול לשפר את הפגיעה בכליות בחולדות MN, שימוש ב-H&E, PAS, MASSON ו-IF זיהה נזק היסטופתולוגי של רקמת הכליה. צביעת H&E ו-PAS הראתה היפרטרופיה גלומרולרית, התפשטות קלה של תאים מזנגיאליים, התרחבות צינורית כלייתית וניוון ואקואולרי של תאי אפיתל צינוריים כלייתיים בקבוצת MOD (איור 3A). צביעת מאסון הראתה עלייה משמעותית באזור הפיברוזיס הכלייתי בקבוצת ה-MOD (איור 3B-C). אימונופלואורסצנציה הראתה שעוצמת הקרינה היחסית של IgG ו-C3 בקבוצת ה-MOD הייתה גבוהה משמעותית מזו שבקבוצת ה-CON (איור 3D-F). לאחר מתן מעכבי KMF, BEN או PI3K+KM-M, מידת ההיפרטרופיה הגלומרולרית, כמו גם מידת ההתפשטות של תאים קשורים, הופחתה, אזור הפיברוזיס הכלייתי הצטמצם משמעותית, ועוצמת הקרינה היחסית של IgG ו-C3 הייתה נמוכה משמעותית. תוצאות אלו מצביעות על כך ש-KMF יכול להקל על נזק פתולוגי כלייתי בחולדות MN.
KMF מקל על נזקי הפודוציטים על ידי הפעלת מסלול האיתות PI3K/AKT
הנזק של פודוציטים מרכזיים ב-MN נצפה גם בשיטות המתוארות כאן, כלומר IHC, PCR, TUNEL ו-TEM. תוצאות IHC ו-PCR הראו כי בהשוואה לקבוצת CON, בקבוצת MOD הייתה ירידה משמעותית ברמות הביטוי של חלבוני סמן ספציפיים לפודוציטים ותפקודיים, WT-1 ו-Nephrin, מה שמעיד על נזק לפודוציטים, בעוד שטיפול ב-KMF מעלה את רמות הביטוי של WT-1, Nephrin ומקל על נזק לפודוציטים (איור 4A-E). תוצאות צביעת TUNEL הראו אפופטוזיס חמור של פודוציטים בקבוצת MOD, בעוד שטיפול ב-KMF הפחית משמעותית את עוצמת הקרינה והפחית את שכיחות האפופטוזיס (איור 4F-G). תוצאות ה-TEM הראו כי קרום הבסיס של הגלומרולוס בקבוצת ה-MOD היה מעובה באופן משמעותי בצורה לא אחידה, והמיטוכונדריה של הפודוציטים הראתה נפיחות חמורה, מטריצה דלילה והפצצה ריקה של המטריצה, עם קריסטה מופחתת או נעדרת. לאחר מתן KMF, העיבוי של קרום הבסיס הגלומרולרי הופחת משמעותית, והמורפולוגיה של מיטוכונדריית הפודוציטים שוחזרה באופן משמעותי (איור 4H). תוצאות אלה מצביעות על כך ש-KMF יכול להקל על נזק לפודוציטים בחולדות MN.
זיהוי נוסף של ביטוי חלבונים הקשורים למסלול איתות PI3K/AKT26,27 על ידי WB גילה כי בהשוואה לקבוצת CON, קבוצת ה-MOD הראתה עלייה משמעותית ברמות הביטוי של PI3K, PIK3CA, AKT, P-AKT, BAD, BAX ו-C-caspase3, בעוד שרמות הביטוי של P-BAD ו-BCL-2 ירדו משמעותית. בעוד שטיפול ב-KMF מפחית את רמות הביטוי של PI3K, PIK3CA, AKT, P-AKT, BAD, BAX ו-C-caspase3, הוא מעלה את רמות הביטוי של P-BAD ו-BCL-2 (איור 4I-J). תוצאות אלו מצביעות עוד על כך ש-KMF יכול לשפר את נזקי הפודוציטים בחולדות MN על ידי הפעלת מסלול האיתות PI3K/AKT.
חקר המנגנונים האפשריים של טיפול ב-KMF ל-MN על בסיס טרנסקריפטומיקה
כדי לחשוף עוד יותר את המטרות והמנגנונים הפוטנציאליים של KMF בטיפול ב-MN, נערך ניתוח טרנסקריפטומי המבוסס על Tandem Mass Tag (TMT). התוצאות הראו שהיו 898 גנים בעלי ביטוי דיפרנציאלי (DEGs) בין קבוצות CON ו-MOD, כולל 372 גנים מווסתים ו-526 גנים מווסתים (איור 5A-B). באופן דומה, היו 360 DEGs בין קבוצות KM-L ו-MOD, כולל 202 גנים מווסתים ו-158 גנים מווסתים (איור 5C-D). כדי לזהות את הגנים ומסלולי האיתות שעלולים להיות מושפעים, נערך ניתוח תפקודי של העשרה של אונטולוגיה גנטית (GO) ואנציקלופדיה של גנים וגנומים של קיוטו (KEGG) (איור 5E-H). התוצאות הראו כי התהליכים הביולוגיים של DEG מתמקדים בעיקר בתהליכים תאיים ובוויסות ביולוגי, בעוד שהפונקציות של DEG מתמקדות בעיקר באינטראקציות נוירואקטיביות של ליגנד-קולטן, כגון מסלולי האיתות CAMP, PPAR, PI3K-AKT ו-p53. תוצאות אלה מצביעות על כך ש-KMF עשוי לטפל ב-MN על ידי השפעה על מסלולי איתות אלה, כאשר מסלול האיתות PI3K/AKT אומת בניסויים. לבסוף, 100 ה-DEGs המובילים נבחרו לפי סדר ערך המעלה לבניית רשת אינטראקציית חלבון-חלבון (PPI) (איור 5I-J).
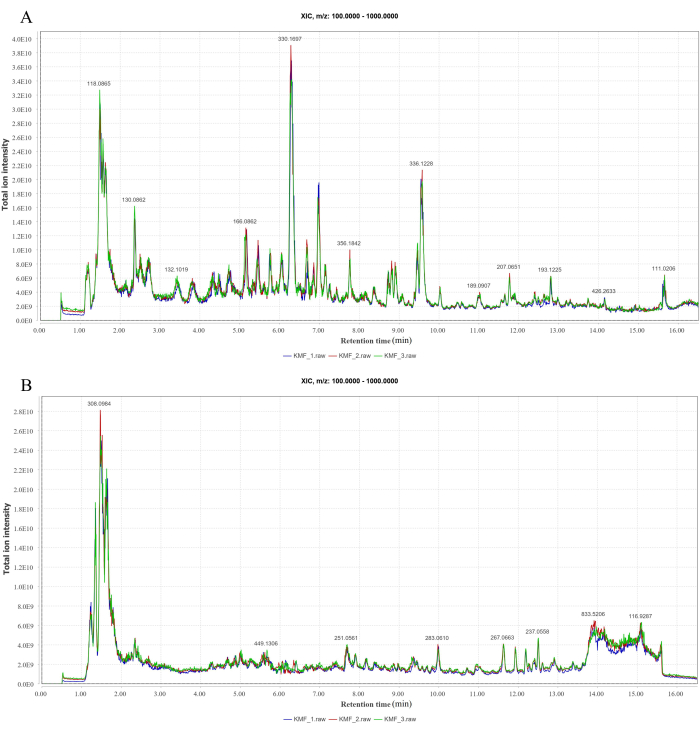
איור 1: כרומטוגרמה של שיא יון LC-MS/MS. (A) אופן יונים חיובי. (B) מצב יונים שליליים. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
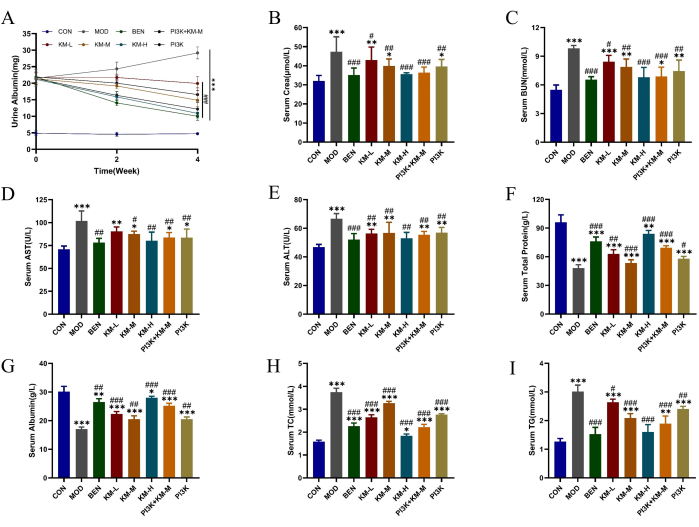
איור 2: KMF משפר הפרעה בחילוף החומרים של שומנים ופגיעה בכבד ובכליות בחולדות MN. (A-C) ההשפעות של Kemeng Fang על תפקוד הכליות, כולל אלבומין שתן של 24 שעות, סרום סרום ו-BUN בסרום. (ד-ג') בין ההשפעות של Kemeng Fang על תפקוד הכבד אלנין אמינוטרנספראז (ALT), אספרטט טרנסמינאז (AST), חלבון כולל ואלבומין בסרום. (ח-י) ההשפעה של קמנג פאנג על ויסות חילוף החומרים של השומנים בדם, כולל טריגליצרידים (TG) וכולסטרול כולל (TC). הנתונים מבוטאים כממוצע ± סטיות תקן של 3-6 דגימות בלתי תלויות, תוך שימוש ב-ANOVA חד-כיווני במבחן T, בהשוואה לקבוצה הריקה, *p<0.05, **p<0.01, ***p<0.001, ובהשוואה לקבוצת המודל, #p < 0.05, ##p < 0.01, ###p < 0.001. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
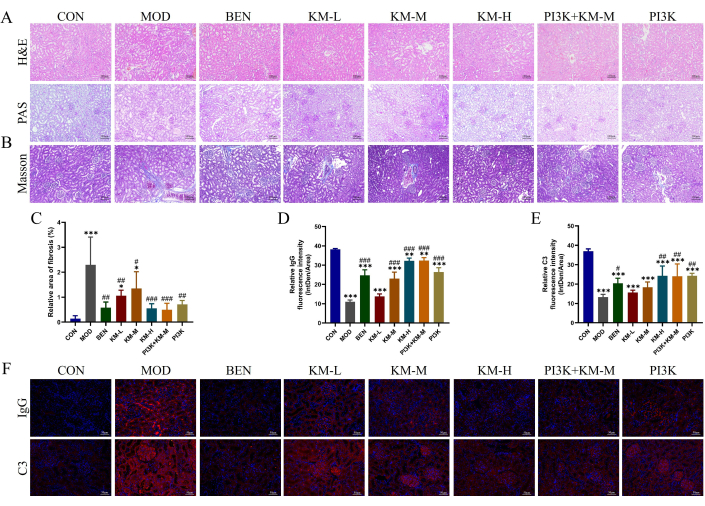
איור 3: Kemeng Fang משפר את הנזק ההיסטופתולוגי לכליות של חולדות MN. (A) בדיקה היסטולוגית כלייתית, כולל H&E ו-PAS (200x). (ב-ג) ניתוח חצי כמותי של פיברוזיס כלייתי (סיבי קולגן כחולים) שטח יחסי באמצעות צביעת מאסון ותוכנת Image J. (ד-ו) ניתוח חצי כמותי של עוצמת הקרינה היחסית (Intden/Area; כאשר Intden היא עוצמת הקרינה האזורית הכוללת, האזור הוא האזור האזורי) של IgG ו-C3 ברקמת הכליה באמצעות תוכנות IF ו-Image J. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
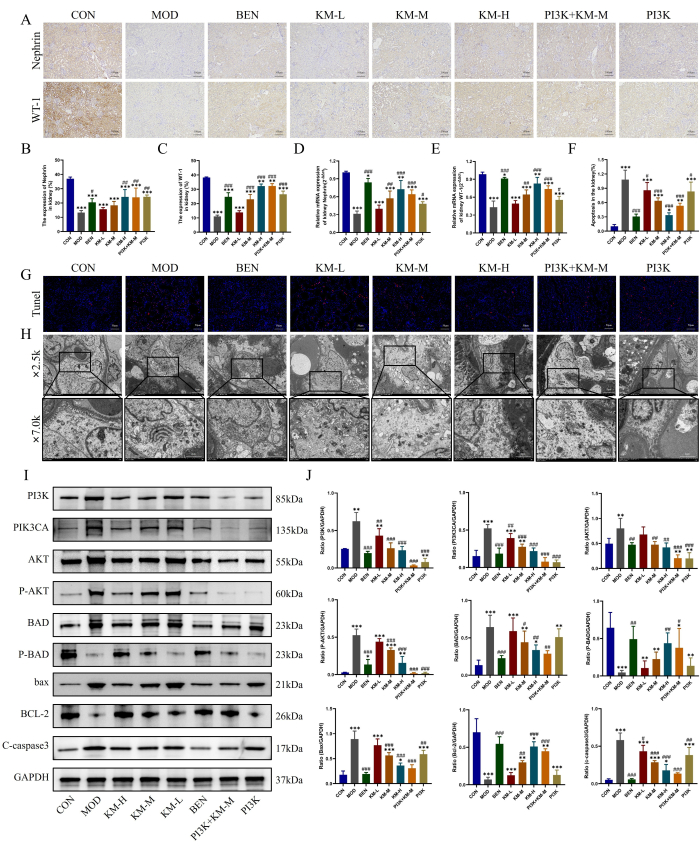
איור 4: Kemeng Fang מקל על נזק לפודוציטים על ידי הפעלת מסלול האיתות PI3K/AKT. (A-C) IHC שימש לאיתור רמות הביטוי היחסיות של שני חלבוני סמן פודוציטים, WT-1 ו-Nephrin, ברקמת הכליה. (ד-ה) זיהוי PCR של ביטוי mRNA יחסי של שני חלבוני סמן פודוציטים, WT-1 ונפרין, ברקמת הכליה. (פ-ז) צביעת TUNEL שימשה לאיתור שכיחות אפופטוזיס ברקמת הכליה. (H) תצפית על קרום הבסיס הגלומרולרי ומבנה המיטוכונדריה של הפודוציטים באמצעות TEM (2,500x, bar=5 μM; 7,000x, bar=2 μM). (I-J) זיהוי WB של רמות ביטוי חלבון יחסיות של PI3K, PIK3CA, AKT, P-AKT, BAD, P-BAD, BCL-2, BAX ו-C-caspase3 ברקמת הכליה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
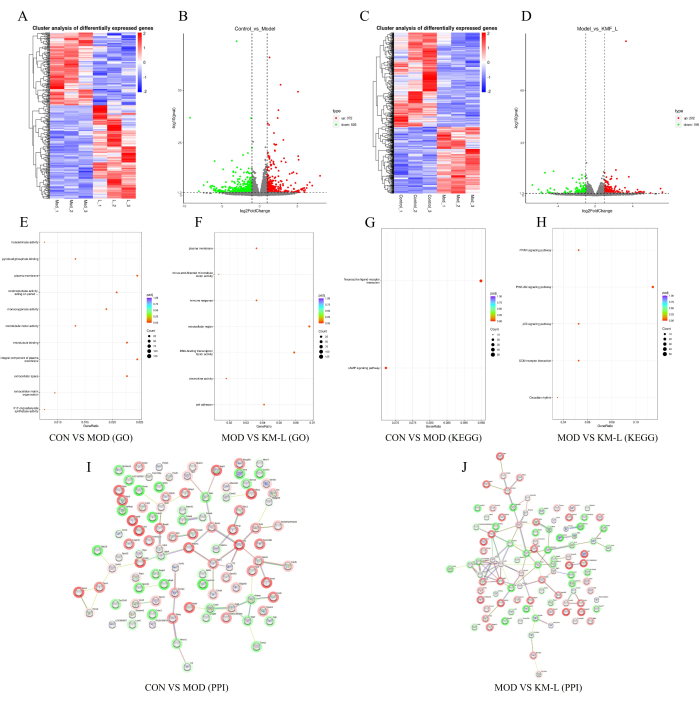
איור 5: חקר המנגנון האפשרי של Kemeng Fang בטיפול ב-MN בהתבסס על טרנסקריפטומיקה. (A-B) מפות חום של גנים דיפרנציאליות ועלילות הרי געש בין קבוצות CON ו-MOD, כאשר כחול מייצג ויסות נמוך ואדום מייצג ויסות מוגבר. (ג-ד) מפות חום דיפרנציאליות של גנים ועלילות הר געש בין קבוצות MOD ו-KM-L, כאשר כחול מייצג ויסות נמוך ואדום מייצג ויסות מוגבר. (ה) העשרת GO בין קבוצות CON ו-MOD. (F) העשרת GO בין קבוצות MOD ו-KM-L. (G) העשרת KEGG בין קבוצות CON ו-MOD. (H) העשרת KEGG בין קבוצות MOD ו-KM-L. (I) תרשים אינטראקציה בין חלבון לחלבון (PPI) של 100 הגנים המובילים המתבטאים באופן דיפרנציאלי בין קבוצות CON ו-MOD. (J) תרשים PPI של ערכי 100 מעלות DEG העליונים בין קבוצות MOD ו-KM-L. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
| לא. | שם סיני | שם לטיני | משפחה | חלק בשימוש | מינון (גרם) |
| 1 | דאנגשן(DS) | קודונופסיס פילוסולה (פרנץ') ננף. | Campanulaceae | שורש | 20 |
| 2 | חואנגצ'י (HQ) | Astragalus membranaceus (Fisch.) באנג'. | קטניות | שורש | 30 |
| 3 | הואנגליאן (HL) | קופטיס צ'יננסיס פרנץ'. | נוריתיים | שורש ופקעת | 3 |
| 4 | סויה(סי אי) | Perilla frutescens (L.) Britt | Labiatae | עלה | 6 |
| 5 | שודיהואנג (SDH) | Rehmannia glutinosa (Gaertn.) DC. | לועניתיים | שורש ופקעת | 15 |
| 6 | צ'ואן-שיונג(CX) | Ligusticum chuanxiong Hort. | אומבליפרה | שורש ופקעת | 15 |
| 7 | קיאנשי (QS) | Euryale ferox סאליסב. | נימפות | זרע | 15 |
| 8 | צ'ינפנגטנג (QFT) | סביה יפנית מקסים. | סביים | שורש, פקעת ועלים | 10 |
| 9 | ווביזי (WBZ) | Rhus chinensis טחנה. | אלתיים | עלה | 3 |
| 10 | Banbianlian (BBL) | Lobelia chinensis לור. | Campanulaceae | פקעת ועלים | 15 |
| 11 | Baihuasheshecao (BHSSC) | Oldenlandia diffusa (Willd.) Roxb. | פואתיים | פקעת ועלים | 15 |
טבלה 1: הרכב קמנג פאנג (KMF).
| נוגדן | דילול כפול |
| IgG | 1:100 |
| ג3 | 1:100 |
| WT-1 | 1:200 |
| נפרין | 1:100 |
| PI3K | 1:1000 |
| PI3K3CA | 1:1000 |
| א.ק.ט | 1:1000 |
| פ-אקט | 1:1000 |
| רע | 1:1000 |
| פי-באד | 1:1000 |
| BCL-2 | 1:1000 |
| באקס | 1:4000 |
| ג-קספאז3 | 1:1000 |
| GAPDH | 1:1000 |
טבלה 2: מכפילי דילול נוגדנים.
| גן | תחל | רצף (5'-3') | מוצרי PCR | |
| עכברוש GAPDH | קדימה | ACAGCAACAGGGTGGTGGAC | 253 נ"ב | |
| הפוך | TTTGAGGGTGCAGCGAACTT | |||
| עכברוש WT-1 | קדימה | AATGGACAGAAGGGCAGAGCA | 209 נ"ב | |
| הפוך | TGGTACGCACACATGAAAGG | |||
| עכברוש נפרין | קדימה | CGGAGAACAAGAACGTGACC | 177 נ"ב | |
| הפוך | ATTGTCTTCTCTCCGCACCA | |||
טבלה 3: מידע מפורט על פריימרים qRT-PCR.
טבלה משלימה 1: תגובת PCR. אנא לחץ כאן להורדת קובץ זה.
טבלה משלימה 2: רשימה כמותית של זיהוי מטבוליטים. מזהה: מספר סידורי של משקל מולקולרי מסדר ראשון; שם: תוצאת זיהוי; Mz: יחס מסה לגרעין; Rt: זמן שמירה (S); מסה מדויקת: משקל מולקולרי מדויק; Ppm: השגיאה בין המשקל המולקולרי שזוהה לבין המשקל המולקולרי התיאורטי, הנמדד ב-ppm; precursor_type: מצב יינון, [M+H]+ הוא מצב יונים חיובי, [M-H]- הוא מצב יונים שלילי; מחלקה: סיווג משולש במסד נתונים HMDB; sub_class: סיווג ארבע רמות במסד הנתונים HMDB; KEGG: מספר תרכובת KEGG; KEGG_Pathway: מסלול איתות KEGG; CAS: מספר רישום של שירות תקצירים כימיים; HMDB: מספר מסד נתונים של HMDB; ספרייה: מסד נתונים; נוסחה: נוסחה מולקולרית תיאורטית; KEGG: מספר תרכובת KEGG; ספרייה: מסד נתונים; רמה: רמת זיהוי מטבוליט; POS: מצב יונים חיובי; נג: מצב יונים שלילי; KMF_1/2/3: עוצמת יונים כוללת של שלושה ניסויים. אנא לחץ כאן להורדת קובץ זה.
Discussion
מחקר זה נועד לבחון את ההשפעות הפרמקולוגיות של KMF ולחקור את המנגנון הספציפי שלו לעיכוב אפופטוזיס של פודוציטים של חולדות MN. ראשית, הוא הוכיח in vivo ש-KMF יכול להקל על אפופטוזיס פודוציטים ולעכב את התקדמות ה-MN על ידי הפעלת מסלול האיתות PI3K/AKT. שנית, תוצאות טרנסקריפטומיות הראו כי KMF עשוי להפעיל את השפעותיו באמצעות מסלולי האיתות PPAR, PI3K/AKT ו-p53, אינטראקציה עם קולטן ECM וכו'. ביניהם, מסלול האיתות PI3K/AKT אומת בניסויים. ממצאים אלה עשויים לספק בסיס מדעי לשימוש הקליני ב-KMF כאופציה טיפולית פוטנציאלית לחולים עם MN.
מחקרים הראו כי אפופטוזיס פודוציטים הוא אחד הגורמים המרכזיים המובילים להתקדמות הדרגתית של MN. יתר על כן, MN מגביל את יכולת החלוקה וההתפשטות של פודוציטים; כתוצאה מכך, לאחר שניזוק או אבד, המשך זה משפיע באופן רציני על תפקוד הכליות. כאשר מספר הפודוציטים יורד עד לנקודה שבה הם אינם יכולים לכסות את ה-GBM במלואו, ה-GBM חשוף לחלוטין ונצמד לקפסולה של באומן, מה שגורם לדחיסה או אפילו לקריסה של הלולאה הנימים הגלומרולרי, ובסופו של דבר מקדם את MN להתפתח ל-ESRD 33,34,35,36. לכן, מחקר נוסף על המנגנון הספציפי של אפופטוזיס פודוציטים ושיטות לחסימה או עיכוב אפופטוזיס פודוציטים הוא המפתח לעיכוב התקדמות MN. מחקרים הראו כי למסלול האיתות PI3K/AKT יש פונקציות מרובות בוויסות אפופטוזיס של תאים, מתח חמצוני ותגובה דלקתית וממלא תפקיד רגולטורי חשוב בהתרחשות והתפתחות של MN. WT-1 ו-Nephrin הם חלבוני ממברנת הנקבוביות המתבטאים על פודוציטים, אשר לא רק ממלאים תפקיד חשוב בשמירה על המבנה והתפקוד התקינים של קרום הנקבוביות, אלא גם יוזמים מסלולי איתות תלויי PI3K/AKT ומשתתפים באיתות פודוציטים. הירידה ברמות הביטוי של חלבונים אלה מעידה לרוב על נזק לפודוציטים 37,38,39.
PI3K הוא דימר המורכב מתת-יחידה רגולטורית, p85, ותת-יחידה קטליטית, p110, הניתנת להפעלה על ידי גורמי גדילה וקומפלקסים שונים. זהו גורם מפתח ויוזם במסלול40 זה. הגן PIK3CA ממוקם על כרומוזום 3 ויש לו בסך הכל 20 אקסונים. תפקידו העיקרי הוא לקודד את אחת מיחידות המשנה הקטליטיות של האנזים PI3K, p110 α חלבון; לפיכך, שינויים ב-PIK3CA יכולים לגרום לאנזים PI3K להישאר במצב פעיל מתמשך41. לאחר הפעלת PI3K, השליח השני, PIP3, ייצור ויעורר באופן רציף את מסלול האיתות AKT במורד הזרם, בעוד p-AKT מקדם את הזרחן של המולקולה הפרו-אפופטוטית, Bad, תוך ניתוק הקומפלקס הפרו-אפופטוטי של Bad עם Bcl-2 ו-Bcl-xL, ויצירת קומפלקס עם החלבון 14-3-3 בציטופלזמה, ובכך מאבד את תפקודו הפרו-אפופטוטי. המולקולות האנטי-אפופטוטיות, BCL-2 ו-Bcl-xL, ניתנות לניתוק מלא ולהשפיע על אפופטוזיס פודוציטים42,43. Caspase-3 הוא פרוטאז הממלא תפקיד מרכזי בשלב הביצוע של אפופטוזיס תאי, מה שמוביל בסופו של דבר לאפופטוזיס תאים על ידי פיצול אנזים תיקון ה-DNA PARP לשברים קטנים44. השראת שחרור ציטוכרום c מהמיטוכונדריה לציטופלזמה על ידי החלבון הפרו-אפופטוטי Bad הוא שלב מפתח בהפעלת קספאז, והקומפלקס של קשירת P-Bad לחלבון 14-3-3 מעכב תהליך זה, ובכך מונע את התרחשות המפל האפופטוטי 45,46,47.
תוצאות טרנסקריפטומיות מצביעות על כך שטיפול ב-KMF ל-MN קשור קשר הדוק למסלולי האיתות PI3K/AKT, PPAR ו-p53. אימת את מסלול האיתות PI3K/AKT באמצעות ניתוח WB. תוצאות הניסוי הראו כי מסלול האיתות PI3K/AKT בחולדות MN עוכב באופן משמעותי, בעוד ש-KMF יכול להפעיל באופן משמעותי את מסלול האיתות PI3K/AKT, להפחית את הייצור של המולקולות הפרו-אפופטוטיות Bad ו-Bax ולקדם את יצירת המולקולה האנטי-אפופטוטית BCL-2, ובכך להגדיל את רמות הביטוי של חלבוני ממברנה היאטלית של פודוציטים, WT-1 ו-Nephrin, והפחתת השכיחות של אפופטוזיס פודוציטים. לכן, KMF מפחית אפופטוזיס פודוציטים על ידי הפעלת מסלול האיתות PI3K/AKT ונמצא שיש לו השפעה מגנה על חולדות מודל MN.
עם זאת, למחקר זה יש כמה מגבלות. ראשית, מחקר זה חקר רק את המנגנון של עיכוב KMF של אפופטוזיס פודוציטים ברמה של ניסויים בבעלי חיים in vivo, שצריך להיות מאומת על ידי ניסויים תאיים במבחנה כמו גם חקירות מעמיקות של המנגנון; שנית, פגיעה בפודוציטים קשורה קשר הדוק גם לאוטופגיה, דלקת חיסונית ופירופטוזיס, ויש לחקור עוד יותר אם KMF יכול להשפיע על MN על ידי ויסות אוטופגיה, דלקת חיסונית ופירופטוזיס48,49.
משפחת PPAR (PPAR α, PPAR β/δ, PPAR γ) היא קולטן הורמונים גרעיניים המסתמך על הפעלת ליגנד ויש לו תפקידים חשובים כגון השתתפות בחילוף חומרים אנרגטי, ויסות אפופטוזיס תאים ותגובה דלקתית50,51. הם משפיעים על שעתוק גנים על ידי יצירת הטרודימריזציה עם קולטן X של חומצה רטינואית (RXR), כאשר PPAR γ שניהם מווסתים את הגורם הדלקתי NF-κB. המפתח להפעלת B טמון בתפקידו להגן על פודוציטים מפני נזק 52,53,54. מחקרים מרובים הראו כי לאגוניסטים γ PPAR (TZD, כגון פיוגליטזון) יש השפעות מגנות על הכליות ללא תלות בהשפעות היפוגליקמיה, מגנים ישירות על פודוציטים מפני נזק ומפחיתים פרוטאינוריה ונזק גלומרולרי במודלים שונים של בעלי חיים למחלות כליות 55,56,57,58,59. ישנם גם דיווחים המצביעים על כך ש-PPAR יכול להפחית אפופטוזיס פודוציטים על ידי עיכוב ההפעלה של Caspase-360. המחקר האחרון מצביע על סוג חדש של PPAR γ, הרגולטור הסלקטיבי GQ-16, יעיל יותר מ-TZD בהפחתת פרוטאינוריה וסיבוכים הקשורים לתסמונת נפרוטית, מה שמביא גם שחר לטיפול במחלת כליות61. ל-KMF יש השפעה מגנה על האפופטוזיס של פודוציטים של חולדות MN על ידי הפעלת מסלול האיתות PI3K/AKT. בהתבסס על התפקיד החשוב של מסלול האיתות PPAR בכליות, נדרשת חקירה מעמיקה נוספת של הקשר בין KMF, PPAR ו-MN בעתיד.
Disclosures
לכל המחברים אין ניגודי אינטרסים להצהיר עליהם.
Acknowledgements
עבודה זו נתמכה על ידי הקרן למדעי הטבע של מחוז ג'ילין (מס' YDZJ202301ZYTS145 ומס'. YDZJ202301ZYTS208).
Materials
| Name | Company | Catalog Number | Comments |
| 2-Amino-3-(2-chloro-phenyl)-propionic acid | Aladdin | 103616-89-3 | |
| 30% H2O2 | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10011218 | |
| 812 embedding agent | SPI | 90529-77-4 | |
| Acetone | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10000418 | |
| Acetonitrile | Thermo | 75-05-8 | |
| Ammonia | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10002118 | |
| Ammonium formate | Sigma | 540-69-2 | |
| Analytical balance | Changzhou Lucky Electronic Equipment Co., Ltd | FA | |
| Anhydrous ethanol | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10009218 | |
| Anti fluorescence quenching and sealing agent | southernbiotech | 0100-01 | |
| Automatic biochemical analyzer | Rayto Life and Analytical Sciences | Chemray240 | |
| BCA Protein Assay Kit | Solarbio | PC0020 | |
| Benazepril hydrochloride tablets | Xinya Minhang | H20044840 | |
| Blender | Kylin-Bell | BE-2600 | |
| Brick and stone cutting blade | Daitome | Ultra45 | |
| BSA | ZSGB-BIO | ZLI-9027 | |
| Buffer RW | Beijing Baiao Leibo | WK191 | |
| Carbodiimide hydrochloride | Hubei Xinghengye Technology | 25952-53-8 | |
| Cell apoptosis detection kit | Elabscience | E-CK-A322 | |
| Chemiluminescence imaging system | Hangzhou Shenhua Technology Co., Ltd | SH-523 | |
| Chloroform | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10006818 | |
| Constant temperature drying oven | Thermo Fisher | Heto PowerDiy LL3000 | |
| Cover glass slide | Jiangsu Shitai Experimental Equipment Co., Ltd | 10212450C | |
| CY3 Conjugated AffiniPure Goat Anti-rabbit IgG (H+L) | BOSTER | BA1032 | |
| DAB reagent kit | Servicebio | G1212-200T | |
| DAPI | Blue Cloud Sky | C1002 | |
| Decolorization shaker | Wuhan Lingsi Biotechnology Co., Ltd | TSY-B | |
| Dehydration machine | Wuhan Junjie Electronics Co., Ltd | JJ-12J | |
| DL2000 DNA Marker | TIANGEN | MD114 | |
| DMSO | MCE | HY-Y0320 | |
| dNTP | TIANGEN | CD117 | |
| EBlot L1 Rapid Wet Rotation Instrument | Kingsray Biotechnology Co., Ltd | L00686C | |
| ECL substrate solution | affinity | KF8003 | |
| Electric constant temperature water bath pot | Fisaff Instrument (Hebei) Co., Ltd | DK-20000-IIIL | |
| Electrophoresis instrument power supply | Beijing Longfang Technology Co., Ltd | LF-600S | |
| Embedding machine | Wuhan Junjie Electronics Co., Ltd | JB-P5 | |
| Equilibrium buffer | Wuhan Lingsi Biotechnology Co., Ltd | E8090 | |
| Ethylenediamine | Ruichengkang Pharmaceutical Technology | 107-15-3 | |
| FA series multifunctional analytical electronic balance | Changzhou Lucky Electronic Equipment Game Company | FA1204 | |
| Filter membrane | Jinteng | Nylon6-0.22μm | |
| Formaldehyde solution | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10010018 | |
| Formic acid | TCI | 64-18-6 | |
| Freezing centrifuge | Xiangyi | H1850-R | |
| Frozen platform | Wuhan Junjie Electronics Co., Ltd | JB-L5 | |
| Glacial acetic acid | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10000218 | |
| Glass bead | Sigma | G8772-500G | |
| Glass slide | Nantong Meiweide Life Science Co., Ltd | PC2-301 | |
| glycine | Biofroxx | 30166428 | |
| Hematoxylin | Wuhan Lingsi Biotechnology Co., Ltd | G1140 | |
| High speed refrigerated centrifuge | Hunan Kecheng Instrument Equipment Co., Ltd | H1-16KR | |
| Horizontal agarose electrophoresis tank | Long Fang | LF-31DS | |
| Horizontal shaker | Jiangsu Haimen Qilin Bell Instrument Manufacturing Co., Ltd | TS-1 | |
| HRP Conjugated AffiniPure Goat Anti-rabbit IgG (H+L) | BOSTER | BA1054 | |
| hydrochloric acid | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10011028 | |
| Imaging system | Nikon | Nikon DS-U3 | |
| Incomplete Freund's adjuvant | MCE | ISA-51 | |
| Intelligent digital magnetic heating stirrer | Hangzhou Miou Instrument Co., Ltd | TP-350E+ | |
| Isoflurane | Sigma | 26675-46-7 | |
| Isopropanol | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 80109218 | |
| KCl | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10020318 | |
| KH2PO4 | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 1115GR500 | |
| Liquid chromatograph | Thermo | IQLAAAGABHFAPUMBJC | |
| marker(10-250KD) | Mei5bio | MF028-plus-01 | |
| marker(20-120KD) | GenScript | M00521 | |
| Mass spectrometer | Thermo | IQLAAEGAAPFALGMBDK | |
| Masson staining kit | BASO | BA4079B | |
| Methanol | Thermo | 67-56-1 | |
| microscope | Nikon | ECLIPSE Ci | |
| microwave oven | Galanz Microwave Oven Electrical Appliance Co., Ltd | P70D20TL-P4 | |
| Multi sample tissue grinder | Shanghai Jingxin Industrial Development Co., Ltd | Tissuelyser-24L | |
| Multiskan FC ELISA reader | Thermo scientific | 1410101 | |
| Na2HPO4.12H2O | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10017618 | |
| NaCl | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10000218 | |
| Neutral resin | Wuhan Lingsi Biotechnology Co., Ltd | G8590 | |
| Normal Goat Serum | Solarbio | SL038 | |
| Organizational spreading machine | Zhejiang Jinhua Kedi Instrument Equipment Co., Ltd | KD-P | |
| Osmic acid | Ted Pella Inc | 18450 | |
| oven | Shanghai Huitai Instrument Manufacturing Co., Ltd | DHG-9140A | |
| Palm centrifuge | Wuhan Lingsi Biotechnology Co., Ltd | D1008E | |
| Paraformaldehyde | Solarbio | P1110 | |
| PAS staining kit | BASO | BA4114B | |
| Pathological slicer | Shanghai Leica Instrument Co., Ltd | RM2016 | |
| PBS | Solarbio | P1020 | |
| PCR instrument | Hangzhou Miou Instrument Co., Ltd | PR-96 | |
| PH meter | Sedolis Scientific Instruments (Beijing) Co., Ltd | PB-10 | |
| PH meter | Sedolis Scientific Instruments (Beijing) Co., Ltd | 2018C132-11 | |
| PI3K inhibitor LY294002 | MCE | HY-10108 | |
| Pipette gun | Dragon | KE0003087/KA0056573 | |
| Protein phosphatase inhibitor complex | Meilunbio | MB12707-1 | |
| PVDF membrane (0.22 μm) | Solarbio | ISEQ00010 | |
| PVDF membrane (0.45 μm) | Solarbio | YA1701 | |
| Quick primary/secondary antibody diluent | Solarbio | A1811 | |
| Rabbit anti-AKT | Affinity | AF0836 | |
| Rabbit anti-BAD | Affinity | AF6471 | |
| Rabbit anti-C3 | Affinity | DF13224 | |
| Rabbit anti-GAPDH | Hangzhou Xianzhi | AB-P-R 001 | |
| Rabbit anti-IgG | CST | 3900S | |
| Rabbit anti-Nephrin | bioss | bs-10233R | |
| Rabbit anti-P-AKT | Affinity | AF0016 | |
| Rabbit anti-p-BAD | invitrogen | PA5-105023 | |
| Rabbit anti-PI3K | Affinity | AF6241 | |
| Rabbit anti-PIK3CA | Bioss | Bs-2067R | |
| Rabbit anti-WT-1 | Affinity | DF6331 | |
| Real-Time PCR System | ABI | QuantStudio 6 | |
| RIPA Lysis Buffer | Meilunbio | MA0151 | |
| SDS | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10019318 | |
| Slide and cover glass | Jiangsu Shitai Experimental Equipment Co., Ltd | 10212432C | |
| Super pure water instrument | Zhiang Instrument (Shanghai) Co., Ltd | Clever-S15 | |
| SYBR Green Master Mix | VAZYME | Q111-02 | |
| Taq Plus DNA Polymerase | TIANGEN | ET105-02 | |
| Tissue grinder | Beautiful Wall | MB-96 | |
| Transmission electron microscope | HITACHI | HT7800/HT7700 | |
| Tris-base | Biofroxx | 10019318 | |
| Trizol | Ambion | 15596-026 | |
| TUNEL Cell Apoptosis Detection Kit (FITC) | Beijing Baiao Leibo | SY0475 | |
| Tween 20 | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 30189328 | |
| Ultra micro UV visible spectrophotometer | Hangzhou Miou Instrument Co., Ltd | ND-100 | |
| Ultra thin slicer | Leica | Leica UC7 | |
| Ultrasonic cleaner | shumei | KQ- 800DE | |
| Upright optical microscope | Nikon | Nikon Eclipse CI | |
| Urinary Protein Test Kit | Nanjing Jiancheng Bioengineering Research Institute | C035-2 | |
| Vertical electrophoresis tank | Beijing 61 Instrument Factory | DYCZ-24DN | |
| Vortex mixer | Wuhan Lingsi Biotechnology Co., Ltd | MX-F | |
| Western Blocking Buffer | Solarbio | SW3010 | |
| xylene | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10023418 |
References
- McQuarrie, E. P., Mackinnon, B., Stewart, G. A., Geddes, C. C., Registry, S. R. B. Membranous nephropathy remains the commonest primary cause of nephrotic syndrome in a northern European Caucasian population. Nephrol Dial Transplant. 25 (3), 1009-1011 (2010).
- Ronco, P. H., Debiec, H. Pathophysiological advances in membranous nephropathy: time for a shift in patient's care. Lancet. 385 (9981), 1983-1992 (2015).
- Xu, X., et al. Long-term exposure to air pollution and increased risk of membranous nephropathy in China. J Am Soc Nephrol. 27 (12), 3739-3746 (2016).
- Fogo, A. B., Lusco, M. A., Najafian, B., Alpers, C. E. AJKD atlas of renal pathology: Membranous nephropathy. Am J Kidney Dis. 66 (3), e15-e17 (2015).
- Li, X., Zhang, X. Comments on the 2021 Kidney Disease: Improving Global Outcomes (KDIGO) clinical practice guideline for anticoagulant therapy in patients with membranous nephropathy. Kidney Int. 101 (1), 186-187 (2022).
- Ruggenenti, P., Fervenza, F. C., Remuzzi, G. Treatment of membranous nephropathy: time for a paradigm shift. Nat Rev Nephrol. 13 (9), 563-579 (2017).
- Klomjit, N., Fervenza, F. C., Zand, L. Successful treatment of patients with refractory PLA2R-associated membranous nephropathy with Obinutuzumab: A report of 3 cases. Am J Kidney Dis. 76 (6), 883-888 (2020).
- Podestà, M. A., Ruggiero, B., Remuzzi, G., Ruggenenti, P. Ofatumumab for multirelapsing membranous nephropathy complicated by rituximab-induced serum-sickness. BMJ Case Rep. 13 (1), e232890-e232896 (2020).
- Stehlé, T., et al. Anti-CD38 therapy for PLA2R-positive membranous nephropathy resistant to conventional immunosuppression. Kidney Int. 101 (2), 416-418 (2022).
- Trimarchi, H., Coppo, R. Podocytopathy in the mesangial proliferative immunoglobulin A nephropathy: new insights into the mechanisms of damage and progression. Nephrol Dial Transplant. 34 (8), 1280-1285 (2019).
- Kopp, J. B., et al. Podocytopathies. Nat Rev Dis Primers. 6 (1), 68-72 (2020).
- Hoxha, E., Reinhard, L., Stahl, R. A. K. Membranous nephropathy: new pathogenic mechanisms and their clinical implications. Nat Rev Nephrol. 18 (7), 466-478 (2022).
- Chiou, T. T., et al. Rapamycin attenuates PLA2R activation-mediated podocyte apoptosis via the PI3K/AKT/mTOR pathway. Biomed Pharmacother. 144 (8), 112349-112356 (2021).
- Chen, J., et al. Danshen injection induces autophagy in podocytes to alleviate nephrotic syndrome via the PI3K/AKT/mTOR pathway. Phytomedicine. 107 (7), 154477-154489 (2022).
- Wang, Y., et al. Fangji Huangqi decoction ameliorates membranous nephropathy through the upregulation of BNIP3-mediated mitophagy. J Ethnopharmacol. 324 (13), 117734-117743 (2024).
- Wei, L., et al. Shenqi granule upregulates CD2AP and α-actinin4 and activates autophagy through regulation of mTOR/ULK1 pathway in MPC5 cells. J Ethnopharmacol. 303 (16), 115942-115954 (2023).
- Wang, P., et al. A review of the botany, phytochemistry, traditional uses, pharmacology, toxicology, and quality control of the Astragalus memeranaceus. Front Pharmacol. 14 (2), 1242318-1242325 (2023).
- Wang, Q., et al. Traditional Chinese medicine method of tonifying kidney for hypertension: Clinical evidence and molecular mechanisms. Front Cardiovasc Med. 20229 (16), 1038480-1038487 (2022).
- Tang, X., et al. Experimental models for elderly patients with membranous nephropathy: Application and advancements. Exp Gerontol. 185 (8), 112341-112353 (2024).
- Zhang, J. J., et al. Murine membranous nephropathy: immunization with α3(IV) collagen fragment induces subepithelial immune complexes and FcγR-independent nephrotic syndrome. J Immunol. 188 (7), 3268-3277 (2012).
- Hopfer, H., et al. The importance of cell-mediated immunity in the course and severity of autoimmune anti-glomerular basement membrane disease in mice. FASEB J. 17 (8), 860-868 (2003).
- Fleuren, G., Grond, J., Hoedemaeker, P. J. In situ formation of subepithelial glomerular immune complexes in passive serum sickness. Kidney Int. 17 (5), 631-637 (1980).
- Border, W. A., Ward, H. J., Kamil, E. S., Cohen, A. H. Induction of membranous nephropathy in rabbits by administration of an exogenous cationic antigen. J Clin Invest. 69 (2), 451-461 (1982).
- Border, W. A., Ward, H. J., Kamil, E. S., Cohen, A. H. Induction of membranous nephropathy in rabbits by administration of an exogenous cationic antigen. J Clin Invest. 69 (2), 451-461 (1982).
- Rubio-Navarro, A., et al. Phenotypic characterization of macrophages from rat kidney by flow cytometry. J Vis Exp. (116), e54599(2016).
- Hou, Y., et al. Longzhibu disease and its therapeutic effects by traditional Tibetan medicine: Ershi-wei Chenxiang pills. J Ethnopharmacol. 249, 112426(2020).
- Sethi, S., et al. Hematopoietic stem cell transplant-membranous nephropathy is associated with protocadherin FAT1. J Am Soc Nephrol. 33 (5), 1033-1044 (2022).
- Gong, Q., Lai, T., Liang, L., Jiang, Y., Liu, F. Targeted inhibition of CX3CL1 limits podocytes ferroptosis to ameliorate cisplatin-induced acute kidney injury. Mol Med. 29 (1), 140-148 (2023).
- Li, H., et al. IL-23 reshapes kidney resident cell metabolism and promotes local kidney inflammation. J Clin Invest. 131 (12), e142428-e142441 (2021).
- Wang, C., et al. Artificially cultivated Ophiocordyceps sinensis alleviates diabetic nephropathy and its podocyte injury via inhibiting P2X7R expression and NLRP3 inflammasome activation. J Diabetes Res. 356 (11), 1390418-1390431 (2018).
- Cheng, H., et al. PI3K/Akt signaling pathway and Hsp70 activate in hippocampus of rats with chronic manganese sulfate exposure. J Trace Elem Med Biol. 50 (12), 332-338 (2018).
- Ji, K., et al. The immunoreaction and antioxidant capacity of juvenile blunt snout bream (Megalobrama amblycephala) involves the PI3K/Akt/Nrf2 and NF-κB signal pathways in response to dietary methionine levels. Fish Shellfish Immunol. 105 (10), 126-134 (2020).
- Chiou, T. T., et al. Rapamycin attenuates PLA2R activation-mediated podocyte apoptosis via the PI3K/AKT/mTOR pathway. Biomed Pharmacother. 144 (3), 112349-112357 (2021).
- Lv, Q., Yang, F., Chen, K., Zhang, Y. Autophagy protects podocytes from sublytic complement induced injury. Exp Cell Res. 341 (2), 132-138 (2016).
- Mundel, P., Shankland, S. J. Podocyte biology and response to injury. J Am Soc Nephrol. 13 (12), 3005-3015 (2002).
- Sun, Z., Xu, Q., Ma, Y., Yang, S., Shi, J. Circ_0000524/miR-500a-5p/CXCL16 axis promotes podocyte apoptosis in membranous nephropathy. Eur J Clin Invest. 51 (3), e13414-e13422 (2021).
- Huber, T. B., et al. Nephrin and CD2AP associate with phosphoinositide 3-OH kinase and stimulate AKT-dependent signaling. Mol Cell Biol. 23 (14), 4917-4928 (2003).
- Ai, Z., et al. Deciphering the pharmacological mechanisms of Rostellularia procumbens (L) Nees. Extract alleviates adriamycin-induced nephropathy in vivo and in vitro. Phytomedicine. 113 (6), 154736-154742 (2023).
- Wang, X., et al. Nicorandil alleviates apoptosis in diabetic cardiomyopathy through PI3K/Akt pathway. J Cell Mol Med. 23 (8), 5349-5359 (2019).
- Fox, M., Mott, H. R., Owen, D. Class IA PI3K regulatory subunits: p110-independent roles and structures. Biochem Soc Trans. 48 (4), 1397-1417 (2020).
- Miricescu, D., et al. PI3K/AKT/mTOR signaling pathway in breast cancer: From molecular landscape to clinical aspects. Int J Mol Sci. 22 (1), 173-179 (2020).
- Feng, C., et al. Neuroprotective effect of Danhong injection on cerebral ischemia-reperfusion injury in rats by activation of the PI3K-Akt pathway. Front Pharmacol. 11 (4), 298-312 (2020).
- Zhou, Y., et al. 1,3-Dicaffeoylquinic acid targeting 14-3-3 tau suppresses human breast cancer cell proliferation and metastasis through IL6/JAK2/PI3K pathway. Biochem Pharmacol. 172 (12), 113752-113761 (2020).
- Li, J., et al. Tetrandrine inhibits colon carcinoma HT-29 cells growth via the Bcl-2/Caspase 3/PARP pathway and G1/S phase. Biosci Rep. 39 (5), (2019).
- Downward, J. How BAD phosphorylation is good for survival. Nat Cell Biol. 1 (2), E33-E35 (1999).
- Fan, J., et al. A model of ischemia and reperfusion increases JNK activity, inhibits the association of BAD and 14-3-3, and induces apoptosis of rabbit spinal neurocytes. Neurosci Lett. 473 (3), 196-201 (2010).
- Chipuk, J. E., Green, D. R. How do BCL-2 proteins induce mitochondrial outer membrane permeabilization. Trends Cell Biol. 18 (4), 157-164 (2008).
- Yin, L., Yu, L., He, J. C., Chen, A. Controversies in podocyte loss: Death or detachment. Front Cell Dev Biol. 9 (11), 771931-771942 (2021).
- Yang, C., et al. Research progress on multiple cell death pathways of podocytes in diabetic kidney disease. Mol Med. 29 (1), 135-143 (2023).
- Calvier, L., et al. PPARγ links BMP2 and TGFβ1 pathways in vascular smooth muscle cells, regulating cell proliferation and glucose metabolism. Cell Metab. 25 (5), 1118-1134 (2017).
- Dai, Z. W., Cai, K. D., Xu, L. C., Wang, L. L. Perilipin2 inhibits diabetic nephropathy-induced podocyte apoptosis by activating the PPARγ signaling pathway. Mol Cell Probes. 53 (3), 101584-101596 (2020).
- Kota, B. P., Huang, T. H., Roufogalis, B. D. An overview on biological mechanisms of PPARs. Pharmacol Res. 51 (2), 85-94 (2005).
- Wahli, W. Peroxisome proliferator-activated receptors (PPARs): from metabolic control to epidermal wound healing. Swiss Med Wkly. 132 (7-8), 83-91 (2002).
- Agrawal, S., He, J. C., Tharaux, P. L. Nuclear receptors in podocyte biology and glomerular disease. Nat Rev Nephrol. 17 (3), 185-204 (2021).
- Miglio, G., et al. Protective effects of peroxisome proliferator-activated receptor agonists on human podocytes: proposed mechanisms of action. Br J Pharmacol. 167 (3), 641-653 (2012).
- Miglio, G., et al. The subtypes of peroxisome proliferator-activated receptors expressed by human podocytes and their role in decreasing podocyte injury. Br J Pharmacol. 162 (1), 111-125 (2011).
- Agrawal, S., Guess, A. J., Benndorf, R., Smoyer, W. E. Comparison of direct action of thiazolidinediones and glucocorticoids on renal podocytes: protection from injury and molecular effects. Mol Pharmacol. 80 (3), 389-399 (2011).
- Sonneveld, R., et al. Sildenafil prevents podocyte injury via PPAR-γ-mediated TRPC6 inhibition. J Am Soc Nephrol. 28 (5), 1491-1505 (2017).
- Agrawal, S., et al. Pioglitazone enhances the beneficial effects of glucocorticoids in experimental nephrotic syndrome. Sci Rep. 6 (3), 24392-24404 (2016).
- Kanjanabuch, T., et al. PPAR-gamma agonist protects podocytes from injury. Kidney Int. 71 (12), 1232-1239 (2007).
- Bryant, C., et al. Selective modulator of nuclear receptor PPARγ with reduced adipogenic potential ameliorates experimental nephrotic syndrome. iScience. 25 (4), 104001(2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved