A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
יצירת תאי T רגולטוריים של קולטן אנטיגן כימרי אנושי
In This Article
Summary
פרוטוקול זה מספק זרימת עבודה יעילה ליצירה ובדיקה של תאי T רגולטוריים של קולטני אנטיגן כימריים אנושיים (CAR Tregs).
Abstract
טיפול בתאי T של קולטן אנטיגן כימרי (CAR) עיצב מחדש את פני הטיפול בסרטן, והוביל לשיעורי הפוגה שיא בסרטן המטולוגי שהיה בעבר חשוך מרפא. הצלחות אלה עוררו עניין בהתאמת פלטפורמת CAR לתת-קבוצה קטנה אך מרכזית של תאי CD4+ T האחראים בעיקר על ויסות ועיכוב התגובה החיסונית, תאי T רגולטוריים (Tregs). ליכולת לכוון מחדש את הפעילות החיסונית של Tregs לכל מטרה חוץ-תאית יש השלכות עצומות על יצירת טיפולים תאיים למחלות אוטואימוניות, דחיית השתלות איברים ומחלת השתל נגד המאכסן. כאן, אנו מתארים בפירוט מתודולוגיות לבידוד Treg בתום לב מדם היקפי אנושי, שינוי גנטי של Tregs אנושיים באמצעות lentivirus או CRISPR/Cas9-aided knock-in באמצעות אספקת תבנית תיקון מכוון הומולוגי בתיווך וירוס (HDR) הקשורים לאדנו, והרחבה ex vivo של CAR Tregs אנושי יציב. לבסוף, אנו מתארים את ההערכה של יציבות פנוטיפית של CAR Treg אנושי ותפקוד מדכא במבחנה , אשר מספק תובנות לגבי האופן שבו CAR Tregs האנושי יתנהג ביישומים פרה-קליניים וקליניים.
Introduction
טיפולים בתאי T של קולטן אנטיגן כימרי (CAR) חוללו מהפכה בטיפול בממאירויות המטולוגיות, והשיגו שיעורי הפוגה גבוהים להפליא בסוגי סרטן שלא ניתן היה לטפל בהם בעבר 1,2. תוצאות מוקדמות מעודדות באמצעות תאי CAR T לטיפול בגליובלסטומה 3,4,5 מדגישות את הרבגוניות של טכנולוגיית CAR ואת הפוטנציאל העתידי שלה להתמקד במגוון רחב של ממאירויות. ככל שהתחום בוחן יישומים נוספים של CARs, תאי T רגולטוריים (Tregs) התגלו כסוג תא מבטיח. Tregs ממלאים תפקיד מכריע בשמירה על הומאוסטזיס חיסוני, וויסות תגובות החיסון באמצעות מספר מנגנונים, כולל בידוד IL-2, הפרשת ציטוקינים מדכאי חיסון, ומווסת תאים מציגי אנטיגן 6,7.
עם טכנולוגיית CAR, Tregs יכול להיות ממונף לטיפול בדחיית השתלות איברים, מחלות אוטואימוניות, והפרעות דלקתיות כמו אלרגיות ואסתמה 6,8,9. CAR Tregs יכול להוביל לשיפור משמעותי בתוצאות המטופלים ובאיכות החיים על ידי הפחתת השימוש בתרופות מדכאות חיסון, המעכבות את המערכת החיסונית כולה וקשורות לתופעות לוואי מזיקות10,11. מודלים פרה-קליניים הראו תוצאות מבטיחות בתרגום טכנולוגיית CAR ל-Tregs, עם יישומים מוצלחים במחלות כגון סוכרת מסוג 1, טרשת נפוצה, מחלת השתל נגד המאכסן ומחלות מעי דלקתיות 9,12,13,14,15. במרפאה, CAR Tregs נבדקים כעת כדי למנוע דחייה מוצקה של השתלת איברים16.
מאמר זה מציג מתודולוגיה מפורטת ליצירת תאי T רגולטוריים של קולטן אנטיגן כימרי אנושי (CAR Tregs). פרוטוקול זה כולל בידוד Tregs מדם היקפי אנושי ושינוי גנטי שלהם באמצעות טכניקות כגון התמרה לנטי-ויראלית ודיוק גנים באמצעות עריכת גנים CRISPR/Cas9 ווקטורים הקשורים לנגיף אדנו (AAV). אנו מתארים גם את הערכת היציבות הפנוטיפית והתפקוד המדכא של טרגים מהונדסים אלה, שהם צעדים חיוניים לאימות הפוטנציאל הטיפולי שלהם 17,18,19. גישה זו מייעלת את התכנון והבדיקות המוקדמות של טיפולי CAR Treg, אשר טומנים בחובם פוטנציאל להרחיב את ההשפעה הטרנספורמטיבית של טיפול בתאי CAR T כדי לווסת את המערכת החיסונית. על ידי שיתוף המתודולוגיה שלנו, אנו מקווים לעורר השראה למחקר וחדשנות נוספים במרחב הטיפול המתפתח CAR Treg 9,20.
Protocol
1. בידוד טרג אנושי
- עיבוד Leukopak
- מעבירים את התוכן של leukopak לתוך צינור חרוטי 50 מ"ל. הוסף נפח שווה של סרום בקר עוברי (DPBS) + 2% סרום בקר עוברי (FBS) של Dulbecco על ידי ערבוב עדין עם פיפטה.
- יש לסחוט ב-300 × גרם במשך 10 דקות בטמפרטורת החדר (RT). בזהירות לשאוף את supernatant. לבנות מחדש את גלולת התא ב 2 מ"ל של DPBS + 2% FBS. הוסף 8 מ"ל של תמיסת אמוניום כלוריד על ידי פיפטה לתרחיף התא ביחס של 4:1, ערבב על ידי היפוך עדין, ואפשר ליזה של תאי הדם האדומים הנותרים על קרח במשך 15 דקות.
- סובבים ב 300 × גרם במשך 10 דקות ב RT. בזהירות לשאוף את supernatant. הוסף 30 מ"ל של DPBS + 2% FBS כדי לשטוף את התאים. כשהבלם כבוי, סובבו את התאים שנשטפו ב-150 × גרם למשך 10 דקות ב-RT. שאפו בזהירות את הסופרנטנט. להשעות מחדש את גלולת התא ב 30 מ"ל של DPBS + 2% FBS.
- ספרו את תאי הדם החד-גרעיניים ההיקפיים (PBMCs) המבודדים כעת עם כחול טריפאן ביחס של 1:1.
- בשל ריכוז התאים הגבוה, בתחילה לדלל 10 μL של תאים 1: 100 עם DPBS; לאחר מכן, ערבבו 10 μL של התאים המדוללים בקנ"מ 1:100 עם 10 μL של תמיסה כחולה מסוג טריפאן לקבלת דילול סופי של 1:1. בעת שימוש במונה תאים אוטומטי, תקן את ספירת התאים כך שתשקף את הדילול פי 200 על ידי הכפלת הריכוז המדווח ב- 100, מכיוון שרוב המונים מניחים דילול של פי 2. צפו להניב 1-2.5 × 109 PBMC מלוקופאק 1/10.
- בידוד תאי T CD4+ (בחירה שלילית)
- סובב למטה 108-10 9 PBMCs ב- 500 × גרם למשך 5 דקות ב- RT והשהה מחדש במאגר הפרדת תאים (DPBS + 1 mM EDTA + 2% FBS) ב- 5 × 107 תאים / מ"ל.
הערה: כדי להשיג מספיק Tregs אנושיים לשינוי גנטי, אנו ממליצים להתחיל עם 1 × 109 PBMCs. - בצע הפרדה מגנטית בהתאם להוראות היצרן עבור ערכת העשרת תאי CD4+ T.
- קבע את כמות תאי CD4+ T שבודדו על ידי ספירה עם כחול טריפאן (10 μL של תאים + 10 μL של כחול טריפאן).
- סובב למטה 108-10 9 PBMCs ב- 500 × גרם למשך 5 דקות ב- RT והשהה מחדש במאגר הפרדת תאים (DPBS + 1 mM EDTA + 2% FBS) ב- 5 × 107 תאים / מ"ל.
- בידוד תאי T CD8+ (ברירה שלילית)
- ספין 5 × 107 PBMCs ב- 500 × גרם למשך 5 דקות ב- RT. השהיה מחדש במאגר הפרדת תאים (DPBS + 1 mM EDTA + 2% FBS) ב- 5 × 107 תאים / מ"ל.
הערה: אנו ממליצים להתחיל עם 5 × 107 PBMC כדי להשיג 2-5 × 106 תאי CD8+ T. - בצע הפרדה מגנטית בהתאם להוראות היצרן עבור ערכת העשרת תאי CD8+ T.
- קבע את מספר תאי CD8+ T שבודדו על ידי ספירה עם כחול טריפאן (10 μL של תאים + 10 μL של כחול טריפאן).
- ספין 5 × 107 PBMCs ב- 500 × גרם למשך 5 דקות ב- RT. השהיה מחדש במאגר הפרדת תאים (DPBS + 1 mM EDTA + 2% FBS) ב- 5 × 107 תאים / מ"ל.
- מיון תאים בסיוע פלואורסצנטיות Treg (FACS)
- בודד תאי T CD4+ כמתואר בשלב 1.2 ואחסן אותם למשך הלילה ב- DPBS עם 2% FBS ב- 4 ° C (אובדן מינימלי במספר התא ובכדאיות) עבור FACS למחרת. קבע את מספר תאי CD4+ T משלב 1.2 על ידי ספירה עם כחול טריפאן (10 μL של תאים + 10 μL של כחול טריפאן).
- סובב תאי CD4+ במהירות של 500 × גרם למשך 5 דקות. לבנות מחדש תאים ב 200 μL של DPBS.
- לכל 1 × 106 תאים, הוסף 1 μL של CD4 FITC אנטי אנושי, 1 μL של CD25 APC אנטי אנושי, ו 1 μL של CD127 PE אנטי אנושי. מערבבים בעדינות ומניחים במקרר כהה בטמפרטורה של 4 מעלות למשך 30 דקות.
- לשטוף את התאים עם 10 מ"ל של DPBS עם 2% FBS. מסתובבים ב 500 × גרם במשך 5 דקות. השהה מחדש בעדינות את התאים המוכתמים ב- 1.5 × 107 תאים/מ"ל ב- DPBS עם FBS של 2%. זהו ריכוז התאים המומלץ למיון באמצעות מיון תאים המופעל על ידי פלואורסצנטיות (FACS).
- העבירו את מתלה התאים המוכתמים דרך מכסה מסנן של 40 מיקרומטר לתוך צינורות FACS, ולאחר מכן השאירו את הצינורות על קרח.
- מכינים 15 מ"ל צינורות איסוף המכילים 3 מ"ל של RPMI10 בינוני ומניחים על קרח.
הערה: מדיום זה מורכב RPMI1640 מדיום בסיסי, 10% FBS, 1x פניצילין-סטרפטומיצין, 1x L-alanyl-L-גלוטמין, 1x חומצות אמינו לא חיוניות, 1x נתרן פירובט, ו 1x HEPES. - מיין CD4+CD25גבוהCD127- תאי T רגולטוריים (Tregs) ו- CD4 + CD25נמוךCD127+ תאי T קונבנציונליים (Tconv) באמצעות FACS כפי שמוצג באיור 1A.
- לקבוע את תפוקת התא ואת הכדאיות; לאחר מכן המשך בניתוח במורד הזרם או בהפעלת תאי T.
2. הפעלת תאי T
- ספירת תאי T מבודדים עם כחול טריפאן (10 מיקרוליטר תאים + 10 מיקרוליטר כחול טריפאן).
- יש לשטוף 25 μL של חרוזים נגד CD3 / CD28 (106 חרוזים) עבור כל 1 × 106 תאי T המתקבלים, תוך שמירה על יחס של 1:1 בין חרוזים לתאי T. שטפו חרוזים נגד CD3/CD28 על ידי הוספת DPBS, דגירה על מגנט למשך 3 דקות והסרת מאגר החרוזים האנטי-CD3/CD28 המדולל כעת, שעלול להיות רעיל לתאים.
- הסר את הצינור מהמגנט והשהה מחדש את החרוזים שנשטפו במדיום RPMI10 כדי לקבל 1 × 106 חרוזים / 1 מ"ל של RPMI10.
- השהה מחדש תאי T עם חרוזי אנטי-CD3/CD28 בתווך RPMI10 בריכוז של 1 × 106 תאי T/מ"ל. לאחר מכן, הוסף 1,000 IU/mL של תאי IL-2 לתאי Treg, 100 IU/mL של תאי IL-2 ל- CD4+ Tconv ו- 300 IU/mL של תאי IL-2 ל- CD8+ T.
- תאי תרבית T ב 1 × 106 תאים לכל באר של צלחת 24 באר עם כמויות שונות של חרוזים נגד CD3 / CD28 ו- IL-2. מניחים את הצלחת בת 24 הבארות באינקובטור תרבית רקמה של 37°C, 5% CO2 .
- הרחבת תאי T פעילים למשך 9-12 ימים בנוכחות IL-2 עד שישמשו לניסויים או הפעלה מחדש עם חרוזי אנטי-CD3/CD28 להרחבה נוספת. החלף את המדיה כל 2-3 ימים והוסף IL-2 בכל פעם שנוסף מדיום טרי. שמור על צפיפות התאים של Tregs על 5 × 10,5 עד 1 × 10,6 תאים למ"ל במהלך ההתפשטות על ידי ספירת התאים או על ידי בדיקה חזותית לפני פיצול.
3. טרנסדוקציה אנושית Treg lentiviral
- השהה מחדש וספור Tregs 48 שעות לאחר ההפעלה. סחרור ב-500 × גרם במשך 5 דקות ב-RT. השהה מחדש Tregs בסל"ד 10 ב-1.25 × 106 תאים/מ"ל עם 1,000 IU/mL של IL-2.
- מחממים מראש את הצנטריפוגה ל 32 °C (75 °F).
- הפשירו את מבנה ה-CAR המכיל לנטיוירוס על קרח.
הערה: אנו מאחסנים aliquots lentivirus חד פעמי עם מספיק lentivirus כדי להמיר 2.5 × 105 תאים ב MOI של 1 ב -80 ° C. - הוסף כל aliquot lentivirus ל 2.5 × 105 Tregs ב 200 μL בצינור microcentrifuge, כל צינור מציין תגובה. Spinoculate ב 1,000 × גרם במשך 1 שעה ב 32 ° C.
- העבר כל תגובה של 200 μL לצלחת של 24 בארות. ודא שהתקשורת מכסה את כל הבאר. לדגור על צלחת 24 בארות עם Tregs מומר באינקובטור תרבית רקמות לילה (16-18 שעות). העלו כל באר ל-2 מ"ל עם מדיום RPMI10 כאשר הריכוז הסופי של IL-2 הוא 1,000 IU/mL.
- המשך להרחיב את Tregs המותמר 9-12 ימים לאחר ההפעלה על ידי פיצול התאים והשלמת RPMI10 טרי שחומם מראש ו- IL-2 לפי הצורך (כל 2-3 ימים). הריכוז האידיאלי של תאים הוא 5 × 105-1 × 106 תאים / מ"ל.
- הערך את יעילות שינוי הגנים באמצעות ציטומטריית זרימה כפי שמוצג באיור 2.
הערה: מבני ה-CAR הלנטי-ויראליים שלנו מכילים תג Myc על ה-N-terminus של הגן CAR וגן כתב GFP המקושר לגן CAR על ידי פפטיד 2A, המאפשר כימות יעילות התמרה ללא צביעת נוגדנים (GFP) ואישור ביטוי פני השטח של CAR (תג Myc). אנו מעריכים את יעילות שינוי הגנים 5 ימים לאחר ההתמרה. יעילות התמרה יכולה לנוע בין 30% ל -70% בהתאם לתורם ולמבנה הרכב בו נעשה שימוש. ניתן למיין תאי CAR+ לפי הצורך. - ודא כי Tregs שונה להשלים את מחזור ההפעלה שלהם (9-12 ימים) ולנוח 24 שעות בהיעדר IL-2 לפני השימוש בכל הניסויים.
4. נוק-אין גנטי בתיווך CRISPR/Cas9 בטרגס אנושי
- להשעות מחדש Tregs ולהעביר צינור חרוטי 15 מ"ל 48 שעות לאחר ההפעלה. דוגרים על תרחיף התא במגנט למשך 3 דקות.
- בעודם במגנט, מעבירים את התאים בתווך באמצעות פיפטה לצינור חדש. החרוזים נגד CD3/CD28 יישארו מחוברים לדופן הצינור. אפשר לטרגס החרוזים לנוח בסל"ד 10 למשך שעתיים לאחר הסרת החרוזים כדי להתאושש מהלחץ המיידי של הסרת החרוזים, ובכך לשפר את יעילות ההולכה העתידית ואת ההתאוששות מהתחשמלות.
- ספרו את הטרגס החרוזים עם כחול טריפאן.
- טרום חם מופחת סרום בינוני ללא FBS עד 37 ° C.
- הכינו צלחת 6 בארות עם 2.5 מ"ל של RPMI10 בינוני ללא אנטיביוטיקה (פניצילין-סטרפטומיצין) ועם 1,000 IU/mL IL-2 לכל באר. מחממים מראש את הצלחת ל-37°C באינקובטור לתרבית רקמות.
- הפשיר את תבנית CAR homology-directed repair (HDR) המכילה וירוס הקשור לאדנו (AAV) על קרח.
הערה: אנו מאחסנים aliquots חד פעמי עם מספיק AAV כדי להדביק 4 × 106 תאים ב MOI של 20,000 ב -80 ° C. - סובב Tregs ב 500 × גרם במשך 5 דקות. לאחר פירוק הסופרנטנט, יש להשהות מחדש תאים בתווך סרום מופחת שחומם מראש ב 4 × 107 תאים / מ"ל.
- תאי Aliquot ב 100 μL ב חלבון נמוך מחייב 1.5 מ"ל צינורות צנטריפוגה. הוסף CAR AAV ב- MOI של 20,000 לכל דגימה והשהה מחדש. לדגור על צינורות התגובה באינקובטור תרבית הרקמה למשך שעה אחת.
- במהלך הדגירה של שעה אחת, הכינו והרכיבו קומפלקסים של CRISPR/Cas9 ribonucleoprotein (RNP) על ידי הוספה איטית של 8.3 μL של חלבון Cas9 (1 מ"ג/מ"ל במלאי) ל-2.5 μL של sgRNA המכוון למוקד הגן TRAC (מלאי של 100 מיקרומטר) ליחס מולארי של Cas9 ל-sgRNA של 1:1 ונפח RNP כולל של 10.8 μL לדגימה. מזלפים בעדינות למעלה ולמטה כדי לערבב. יש לדגור על תערובת ה-RNP למשך 15 דקות בטמפרטורה של 37°C באינקובטור תרביות הרקמה.
הערה: מתחמי RNP יכולים להישאר ב- RT לאחר מכן עד שהם מוכנים לשימוש. - מלא צינור אלקטרופורציה טרי (צינור E) עם 3 מ"ל של מאגר אלקטרופורציה אוסמולריות גבוהה. הכנס את צינור E המלא לתחנת פיפטה של מערכת האלקטרופורציה עד לשמיעת קליק. הגדר תנאי אלקטרופורציה ל- 2,200 וולט, 20 אלפיות השנייה, פעימה אחת במערכת האלקטרופורציה.
- כאשר הדגירה של שעה אחת עם AAV הושלמה, סובב את התאים עם AAV ב 300 × גרם במשך 5 דקות ב RT. בזהירות לשאוף את supernatant ולהשהות מחדש את גלולת התא ב 100 μL של חיץ ההשעיה התא שסופק על ידי מערכת electroporation לכל דגימה.
הערה: עבוד במהירות והימנע מהשארת תאים במאגר למשך יותר מ- 15 דקות. הימנעו מיצירת בועות. - הוסף 10.8 μL של קומפלקס RNP לכל דגימה. מערבבים היטב עם פיפטה מבלי ליצור בועות.
- הכנס קצה אלקטרופורציה של 100 μL על ידי דחיפת פיפטה לתחנה השנייה שלה כדי לפתוח את המהדק. מקמו את הראש העליון של הפיפט בתוך קצה האלקטרופורציה עד שהמהדק יתחבר היטב עם גזע ההרכבה של הבוכנה. שחררו את הכפתור בהדרגה תוך שמירה על לחץ כלפי מטה על פיפטה כדי להבטיח שהקצה יתאים היטב ללא רווחים.
- לחץ על פיפטה לתחנה הראשונה וטבול את קצה האלקטרופורציה לתוך תערובת התא-RNP. משכו בעדינות את הדגימה לתוך פיפטה ללא בועות.
הערה: לא יכולות להיות בועות בתוך הקצה במהלך התחשמלות. - הכנס את הפיפטה עם קצה האלקטרופורציה המותקן המכיל את הדגימה במאונך לתוך צינור E עד שיישמע צליל קליק. הימנעו מיצירת בועות.
- ודא שהוזנו הגדרות אופטימליות עבור Tregs אנושיים (2,200 V, 20 ms, 1 Pulse) ולחץ על Start במסך המגע כדי לחשמל את התאים.
- המתן עד שמסך המגע יוצג הושלם עם השלמת ההתחשמלות. מוציאים בעדינות את הפיפטה ומעבירים מיד את הדגימה לצלחת 6 בארות מוכנה המכילה 2.5 מ"ל של מדיום RPMI10 מחומם מראש וללא אנטיביוטיקה עם 1,000 IU/מ"ל של IL-2 לכל באר. חזור על הפעולה עם הדגימות הנותרות. נענעו בעדינות את הצלחת בתנועות ליניאריות (משמאל לימין, מלמעלה למטה) כדי להבטיח פיזור אחיד של התאים בכל באר ומקמו אותה באינקובטור תרביות הרקמה.
הערה: שימוש חוזר בחוד אלקטרופורציה מקובל עד פי 3 אם אותם תאים וקומפלקס RNP נמצאים בשימוש. אפשר תקופת התאוששות של 30 דקות לפני ספירת התאים או הפרעה להם בכל דרך שהיא, כגון הוספת משפר HDR במידת הצורך. - למחרת, 16-18 שעות מאוחר יותר, להחליף את המדיה עם מדיה המכילה אנטיביוטיקה, לספור את Tregs electroporated עם טריפאן כחול, תרבית ב 106 תאים / מ"ל עם 1,000 IU / mL IL-2. המשך להרחיב את Tregs מחושמלים על ידי פיצול התאים והשלמת RPMI10 ו- IL-2 טריים כמתואר בשלב 2.6.
- שמור דגימות על קרח לניתוח על ידי ציטומטריית זרימה.
- הגדר פקדי פיצוי בצבע יחיד והחל על קובץ הניסוי.
- קרא תחילה את הדגימה הלא מוכתמת כדי להתאים את רווחי FSC ו- SSC כך שאוכלוסיית הלימפוציטים תהיה באמצע תרשים הנקודות 'כל האירועים'.
- הגדר אסטרטגיית gating של לימפוציטים לתאים שאינם פסולת/תאים בודדים לתאים בני קיימא לתאי CD4+ , כפי שמוצג באיור 3C.
- להעריך את יעילות שינוי הגנים באמצעות ציטומטריית זרימה.
הערה: מבני ה-AAV CAR שלנו מכילים, בנוסף לזרועות הומולוגיה של מוקד TRAC, גן מדווח של קולטן גורם גדילה אפידרמלי קטוע (EGFRt) המקושר לגן CAR על-ידי פפטיד 2A כפי שמוצג באיור 3. יעילות הדפיקה של גנים נקבעת על ידי צביעת פני השטח עבור CD3, שאובדנם מצביע על אובדן ביטוי פני השטח של TCR, ומכאן מיקוד מוצלח של מוקד TRAC עם CRISPR/Cas9, ו- EGFRt, שהביטוי שלו מצביע על שילוב מוצלח של טרנסגן CAR. טרג נוק-אין לרכב הם תאי CD3-EGFRt+. אנו מעריכים את יעילות שינוי הגן 5 ימים לאחר אלקטרופורציה. - ודא כי Tregs שונה להשלים את מחזור ההפעלה שלהם (9-12 ימים) ולנוח 24 שעות בהיעדר IL-2 לפני השימוש בכל הניסויים.
5. הפעלת CAR Treg אנושית
- מערך תרבות משותפת (יום 0)
- אספו את קו תאי המטרה המבטאים אנטיגן CAR לתוך צינור חרוט.
הערה: אנו משתמשים בתאי K562, קו תאי לוקמיה מיאלוגנית אנושית חסר ביטוי HLA, CD80 ו- CD86 כתאי מטרה להפעלת CAR Treg. תאי K562 הוריים משמשים כבקרה שלילית ותאי K562 המבטאים אנטיגן CAR משמשים להפעלת CAR Tregs17,21. - להקרין קווי תאי מטרה עם 4,000 ראד במקרן צזיום-137 או רנטגן. במקרה של חוסר גישה למקרין, בצע טיפול מיטומיצין C כדי לעצור את התפשטות התאים תוך שמירה על ביטוי אנטיגן פני השטח בתאי המטרה22.
- אם עדיין לא עשיתם זאת, השעו את ה-Tregs על ידי השעיית ה-Tregs הקשורים לחרוזים נגד CD3/CD28 והעברתם לצינור חרוטי בנפח 15 מ"ל. דוגרים על תרחיף התא במגנט למשך 3-5 דקות. בעודם עדיין במגנט, מעבירים את התאים בתווך באמצעות פיפטה לצינור חדש; החרוזים נגד CD3/CD28 יישארו מחוברים לדופן הצינור.
- קבע את תא המטרה המוקרן ואת ריכוזי CAR Treg חרוזים עם כחול טריפאן.
- ספין תאי מטרה מוקרנים ו- CAR Tregs ב 500 × גרם במשך 5 דקות. יש להשהות מחדש עם RPMI10 שחומם מראש ב-106 תאים/מ"ל בצינורות הנפרדים שלהם. הוסף IL-2 ל- CAR Tregs לקבלת ריכוז של 2,000 IU/mL.
הערה: כמות זו של IL-2 תדולל פי 2 ברגע שה-CAR Tregs ישולבו עם תאי המטרה לריכוז IL-2 סופי של 1,000 IU/mL. - תרבות משותפת 1 × 105 CAR Tregs (100 μL) עם 1 × 105 (100 μL) CAR אנטיגן שלילי, תאי מטרה מוקרנים (בקרה שלילית להפעלה), 1 × 105 (100 μL) CAR אנטיגן חיובי, תאי מטרה מוקרנים (ניסוי), או 2.5 μL של חרוזי אנטי CD3 / CD28 (בקרה חיובית להפעלה) ו 97.5 μL של RPMI10 בינוני בלוח תחתון עגול 96 באר. מניחים את הצלחת באינקובטור תרבית רקמה של 37°C, 5% CO2 למשך 48 שעות.
הערה: הנפח הסופי לכל באר הוא 200 μL. ודא שלכל תנאי יש שלושה עותקים משוכפלים.
- אספו את קו תאי המטרה המבטאים אנטיגן CAR לתוך צינור חרוט.
- קריאת ציטומטריית זרימה
- אלא אם כן אתה משתמש בקורא לוחות, השהה מחדש את התוכן של כל באר מהצלחת בעלת תחתית עגולה 96 והעבר אותם לצינור FACS. סחרור ב 500 x גרם במשך 5 דקות. מרוקנים את הסופרנאטנט ומערבלים בעדינות את כדורית התא.
- הכן תערובת מאסטר של נוגדנים ציטומטריה זרימה: 100 μL / דגימה המכילה DPBS, CD4 PE / Cy7 אנטי אנושי 1:200, CD71 PE אנטי אנושי 1:100, ו- Ghost Viability Dye BV510 1:2000.
הערה: פאנל זה פועל היטב אם הגן של כתב הרכב הוא GFP. אם גן מדווח מקודד חלבון פני שטח הדורש צביעת נוגדנים, כגון EGFRt, ניתן להשתמש בנוגדן מצומד FITC, למשל. - פיפטה 100 μL של מאסטר נוגדנים לערבב לתוך כל דגימה, בעדינות, לדגור, במשך 30 דקות במקרר 4 מעלות צלזיוס.
- יש לשטוף עם 500 מיקרוליטר של DPBS על ידי סיבוב ב 500 × גרם במשך 5 דקות. להשעות מחדש את גלולת התא ב 200 μL של DPBS.
- שמור דגימות על קרח לניתוח על ידי ציטומטריית זרימה.
- הגדר פקדי פיצוי בצבע יחיד והחל על קובץ זרימת ניסוי.
- קרא דגימות לא מוכתמות כדי להתאים את רווחי SSC ו- FSC כך שאוכלוסיית הלימפוציטים תהיה באמצע תרשים הנקודות 'כל האירועים'.
- הגדר אסטרטגיית gating של לימפוציטים לתאים שאינם פסולת/תאים בודדים לתאים בני קיימא לתאי CD4+ , כפי שמוצג באיור 3C (פלואורופורים שונים בשימוש).
- קרא דגימות בקצב אירועים של כ-1,500 אירועים/שנייה כדי להעריך את הפעלת Treg.
הערה: התוצאה הצפויה היא הגברת הוויסות של ביטוי פני השטח של CD71 ב-CAR Tregs בנוכחות אנטיגן CAR כפי שמוצג באיור 4. אם upregulation לא נראה בנוכחות אנטיגן CAR, אז איתות טוניק יכול להיות נוכח.
6. יציבות רכב אנושי Treg
- הקמה והרחבה של תרבות משותפת (ימים 0-9)
- הגדר תרביות משותפות להפעלת CAR Tregs כמתואר בשלב 5.1.
- לאחר 48 שעות, העבירו תרבית משותפת מכל צלחת בעלת תחתית עגולה של 96 בארות היטב לצלחת בת 24 בארות המכילה 2 מ"ל של RPMI10 שחוממו מראש עם 1,000 IU/mL IL-2 כדי לאפשר הרחבת תאים.
- הוסף RPMI10 טרי שחומם מראש עם 1,000 IU/mL IL-2 ופצל לצלחות נוספות של 24 בארות לפי הצורך.
- קריאת ציטומטריית זרימה
- השהה מחדש והעבר את התוכן של כל משוכפל לתוך צינור חרוטי 15 מ"ל או 50 מ"ל. לקבוע ריכוזי תאים.
- העבר בין 5 × 10,5 ו- 1 × 106 תאים לצינור FACS עבור כל שכפול. סובבים ב 500 × גרם במשך 5 דקות.
- הכן תערובת אב נוגדנים ציטומטריה זרימה לצביעת פני השטח: 100 μL / דגימה המכילה DPBS, CD4 PE / Cy7 אנטי אנושי 1:200, CD25 APC אנטי אנושי 1:200, ו- Ghost Viability Dye BV510 1:2000. כלול נוגדן מצומד FITC עבור חלבון כתב CAR במידת הצורך.
- מסלקים את הסופרנאטנט משלב 6.2.2 ומערבלים בעדינות את כדורית התא. פיפטה 100 μL של תערובת מאסטר נוגדנים מכתימי פני השטח לכל צינור FACS. מערבולות קצרות ומניחים במקרר 4 מעלות צלזיוס למשך 30 דקות בחושך.
- באמצעות ערכת חיץ צביעת גורם שעתוק, להכין חיץ קיבוע/חדירות על ידי הוספת 3 נפחים של דילול קיבוע/פרמביליזציה לנפח אחד של ריכוז קיבוע/פרמביליזציה. כל דגימה דורשת 100 μL של חיץ קיבוע/חדירה.
- יש לשטוף תאים מוכתמים בפני השטח עם 500 μL של DPBS. מסתובבים ב 500 × גרם במשך 5 דקות ומרוקנים את הסופרנטנט. פיפטה 100 μL של חיץ קיבוע/חדירה מוכן לכל צינור. מערבולת קצרה ולאפשר קיבוע להתרחש ב 4 ° C במשך 30-60 דקות בחושך.
- באמצעות ערכת חיץ צביעת גורם שעתוק, להכין 1x חיץ Permeabilization על ידי הוספת 9 נפחים של מים מזוקקים לנפח 1 של Permeabilization Buffer 10x תרכיז. כל דגימה דורשת 1,000 μL של חיץ Permeabilization לשטיפה ו-100 μL של חיץ Permeabilization להכתמה עם נוגדנים המכוונים לחלבונים תוך תאיים.
- שטפו את התאים הקבועים/חדירתיים על ידי הוספת 500 μL של מאגר Permeabilization 1x. סובב ב 500 × גרם במשך 5 דקות ב RT.
- הכינו תערובת אב של נוגדני צביעה תוך תאיים עם 1x חיץ חדירות, FOXP3 eFluor 450 1:50 אנטי-אנושי, HELIOS PE 1:50 אנטי-אנושי ו-CTLA-4 PerCP-e710 1:50 אנטי-אנושי. כל דגימה תדרוש 100 μL של תערובת מאסטר נוגדנים.
הערה: פאנל זה פועל אם הגן של כתב הרכב הוא GFP או אם חלבון כתב הרכב (למשל, EGFRt) מוכתם בנוגדן מצומד FITC. - דקנט את הסופרנאטנט משלב 6.2.8. הוסיפו 100 μL של תערובת הנוגדנים המכתימים התוך-תאיים, ערבלו לזמן קצר ודגרו ב-RT למשך 30 דקות בחושך.
- שטפו את התאים המוכתמים הקבועים/חדירים, על ידי הוספת 500 μL של 1x Permeabilization buffer. מסתובבים ב 500 × גרם במשך 5 דקות. דקרו את הסופרנטנט, השהו מחדש את כדורית התא ב-300 מיקרוליטר של DPBS, ואחסנו אותה על קרח.
- נתח לפי ציטומטריית זרימה כפי שמוצג באיור 5. התוצאה הצפויה היא שרוב רכבי ה-Treg יהיו תאי FOXP3+HELIOS+. השתמש בתאי CD4+ Tconv כבקרה שלילית עבור צביעת FOXP3 ו- HELIOS.
7. דיכוי רכב טרג אנושי
- Responder T cell (Tresp) עקבות צבע צבע והפעלה בלילה
- אספו את תאי CAR Treg המורחבים, תאי CD4+ Tconv שבודדו לאחרונה ותאי T CD8+ שבודדו לאחרונה לצינורות חרוטיים נפרדים של 15 מ"ל וחרוזי debead נגד CD3 / CD28 אם עדיין לא עשו זאת.
- הכינו תאי מטרה מבטאי אנטיגן CAR מוקרנים כמתואר בשלב 5.1.
- קבע ריכוזי תאי T לא פעילים וריכוזי תאי מטרה מוקרנים.
- שלב 5 × 106 תאי CD4+ Tconv עם 5 × 106 תאי CD8+ T (יחס 1:1). אלה הם תאי T מגיבים (Tresp) להיות מעוכב על ידי CAR Tregs בבדיקה. ספין תאי Tresp ב 500 × גרם במשך 5 דקות ב RT. בזהירות לשאוף את supernatant ולהשהות מחדש תאי Tresp ב 1 מ"ל של DPBS.
- הוסף 1 מ"ל של 5 mM CellTrace Violet (CTV) צבע שהורכב מחדש ב- DMSO ל- 107 תאי Tresp ב- 1 מ"ל של DPBS לקבלת ריכוז סופי של 5 מיקרומטר CTV. יש להכניס לאמבט מים בטמפרטורה של 37°C למשך 20 דקות. ב-10 דקות, מערבלים בעדינות כדי לחלק מחדש את ה-CTV המיושב.
- לשטוף עם 9 מ"ל של RPMI10 מחומם מראש בינוני מלא. מסתובבים ב 500 × גרם במשך 5 דקות. השהה מחדש ב 5 מ"ל של RPMI10 מחומם מראש בינוני מלא.
- קבע ריכוז תאי Tresp המסומן ב- CTV. הוסף 5 × 104 תאי Tresp לא מופעלים המסומנים ב- CTV ב- 200 μL של RPMI10 בינוני ב- 3-6 בארות של לוח בעל תחתית עגולה של 96 בארות כבקרות התפשטות מינימליות.
- הפעל תאי Tresp המסומנים ב- CTV עם חרוזים נגד CD3/CD28 ביחס של 1:10 חרוז לתא Tresp ללא IL-2 בתווך RPM10. יש לחלק 106 תאי Tresp המסומנים ב-CTV ב-1 מ"ל של RPMI10 בינוני לכל באר של צלחת 24 בארות באינקובטור תרביות הרקמה למשך הלילה.
- במקביל, להשיג 106 CAR+ Tregs. כמות זו מכסה טריפליקטים של ארבעה יחסי CAR Treg:Tresp, 1:1, 1:2, 1:4, 1:8, ב- 5 × 104 תאי מטרה לכל צלחת תחתונה עגולה של 96 בארות היטב, כמו 5 × 104 × 3 + 2.5 × 104 × 3 + 1.25 × 104 × 3 + 0.625 × 104 × 3 = 2.81 × 105 CAR Tregs, על פני שני תנאי הפעלת CAR Treg: תאי מטרה שליליים CAR אנטיגן מוקרן (בקרה שלילית, ללא הפעלה), ותאי מטרה מוקרנים מסוג CAR אנטיגן חיובי (ניסוי, הפעלת CAR).
- שלב 3 × 105 CAR Tregs עם 3 × 105 תאי CAR אנטיגן שליליים מוקרנים (יחס 1:1) ו- 3 × 105 CAR Tregs עם 3 × 105 תאי מטרה חיוביים לאנטיגן CAR מוקרנים (יחס 1:1), בשני צינורות חרוטיים נפרדים של 15 מ"ל וסחרור ב 500 × גרם במשך 5 דקות ב- RT. שאפו בזהירות את הסופרנטנט.
- השהה מחדש את הגלולה בכל צינור משלב 7.1.10 ב- 600 μL של מדיום RPMI10 שחומם מראש. התוצאה היא 200 μL עבור כל אחד מהטריפליקטים 1:1 Treg: Tresp. בצע דילול סדרתי על צלחת תחתונה עגולה 96 בארות כדלקמן:
- מתוך 600 μL מוכן של Treg + השעיית תא המטרה, פיפטה 200 μL של תרחיף התא לתוך כל 3 בארות יחס 1:1.
- הוסף 100 μL של RPMI10 מחומם מראש לכל אחת מהבארות הריקות ביחס של 1:2, 1:4 ו-1:8.
- עבור כל אחד מהטריפליקטים, פיפטה 100 μL של תרחיף התא מבארות 1:1 לתוך הבארות ביחס 1:2 הקשורות.
- עבור כל אחד מהטריפליקטים, פיפטה 100 μL של השעיית התא, מבארות 1:2, לתוך הבארות ביחס 1:4 הקשורות.
- עבור כל אחד מהטריפליקטים, פיפטה 100 μL של תרחיף התא, מבארות 1:4, לתוך הבארות ביחס 1:8 הקשורות.
- פיפטה, 100 μL הנותרים של תרחיף התא מבארות יחס 1:8 לתוך מיכל פסולת.
הערה: כל באר צריכה להכיל 100 μL של תרחיף התא עם 5 × 104 (1:1), 2.5 × 104 (1:2), 1.25 × 104 (1:4), או 0.625 × 104 (1:8) CAR Tregs ומספר שווה של תאי מטרה מוקרנים.
- CAR Treg ו- Tresp דגירה משותפת של תאים
- לאחר 16-18 שעות לאחר ההפעלה, לאסוף תאי Tresp מופעלים מן צלחת 24 בארות לתוך צינור חרוטי ולהסיר חרוזים נגד CD3 / CD28 באמצעות מגנט.
- קבע ספירת תאי Tresp עם תווית CTV ללא חרוזים .
- לשטוף ולסובב 2 × 106 תאי Tresp ב 500 × גרם במשך 5 דקות. בזהירות לשאוף את supernatant. להשעות מחדש את התאים ב 4 מ"ל של RPMI10 מדיום מלא.
- הוסף 100 μL של מתלה תאי T (5 × 104 תאי T) לכל באר עם CAR Tregs, כמו גם 3-6 בארות עם 100 μL של מדיום RPMI10 בלבד לבקרות התפשטות מקסימליות. מניחים את הצלחת באינקובטור תרבית רקמה של 37°C, 5% CO2 למשך 72 שעות.
הערה: בלוח התחתון העגול של 96 בארות יש כעת 3-6 בארות עם תאי Tresp לא מופעלים בלבד (בקרת התפשטות מינימלית), 3-6 בארות עם תאי Tresp מופעלים בלבד (בקרת התפשטות מקסימלית) ותאי Tresp מופעלים בנוכחות מספר הולך ופוחת של Tregs CAR.
- קריאת ציטומטריית זרימה
- השהה מחדש והעבר את התוכן של כל צלחת תחתונה עגולה בת 96 בארות היטב לתוך צינור FACS מסומן. לחלופין, העבר ללוח V תחתון של 96 בארות אם ציטומטר זרימה עם מצב קריאת לוחות זמין. מסתובבים ב 500 × גרם במשך 5 דקות.
- בינתיים, הכינו תערובת מאסטר נוגדנים עם DPBS, CD4 PE/Cy7 אנטי-אנושי 1:200 ו-CD8 PerCP 1:200 אנטי-אנושי. כל דגימה תדרוש 100 μL של תערובת מאסטר נוגדנים.
- מערבלים בעדינות את גלולת התא. פיפטה 100 μL של נוגדנים מאסטר לערבב לתוך כל צינור FACS. מערבול קצר לדגור ב 4 ° C במשך 30 דקות בחושך.
- יש לשטוף עם 500 מיקרוליטר של DPBS. יש לשטוף 2x עם 100 μL של DPBS אם משתמשים בתחתית V של 96 באר. מסתובבים ב 500 × גרם במשך 5 דקות. דקרו את הסופרנטנט, השהו מחדש את גלולת התא ב-200 מיקרוליטר של DPBS, ואחסנו צינורות על קרח בחושך.
- נתח לפי ציטומטריית זרימה כפי שמוצג באיור 6. התוצאה הצפויה היא תאי Tresp לא מופעלים בלבד (התפשטות מינימלית) כדי להציג שיא פלואורסצנטי CTV גבוה אחיד, תאי Tresp מופעלים לבדם המציגים שיאים מרובים של עוצמת CTV, אחד המתאים לכל חלוקת תאים (התפשטות מרבית), ותאי T CD4+ ו- CD8+ מופעלים בנוכחות CAR Tregs מופעלים המציגים ירידה במספר ובגובה שיאי CTV, ומכאן, בהתפשטות.
- חישוב דיכוי בתיווך תאי Treg באופן הבא:
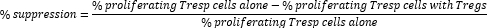
הערה: אם אתה משתמש בתוכנת FlowJo, ניתן גם להשתמש במידול התפשטות תאים כדי לחשב את מדד החלוקה (DI) עבור כל דגימה ולחשב דיכוי אחוזים באמצעות DI במקום אחוז התאים המתרבים בנוסחה לעיל.
תוצאות
הפרוטוקול המתואר כאן מספק צינור יעיל וסטנדרטי להערכת מבנים חדשים של קולטן אנטיגן כימרי (CAR) בתאי T רגולטוריים אנושיים (Tregs), במטרה ליצור טיפולים חיים למחלות אוטואימוניות, מחלת השתל נגד המאכסן, דחיית השתלות איברים ואלרגיה. איור 1 מתאר כיצד אנו משיגים Tregs אנוש...
Discussion
פרוטוקול זה מספק מתודולוגיה יעילה ומקיפה ליצירה והערכה של תאי T רגולטוריים של קולטני אנטיגן כימריים אנושיים (CAR Tregs). הצלחתה של טכנולוגיית CAR בטיפול בסרטן המטולוגי היוותה השראה ליישומה בתת-קבוצה המדכאת-חיסונית של תאי T, Tregs. שלא כמו תאי T קונבנציונליים, Tregs מעכבים תגובות חיס?...
Disclosures
LMRF הוא ממציא וקיבל תמלוגים מפטנטים על תאי חיסון מהונדסים ומייעץ עבור Guidepoint Global ו- McKesson. שאר המחברים מצהירים שאין אינטרסים מתחרים.
Acknowledgements
LMRF ממומן על ידי Human Islet Research Network (HIRN) Emerging Leader in Type 1 Diabetes grant U24DK104162-07, American Cancer Society (ACS) Institutional Research Grant IRG-19-137-20, South Carolina Clinical and Translational Research (SCTR) Pilot Project Discovery Grant 1TL1TR001451-01, Diabetes Research Connection (DRC) Grant IPF 22-1224, ו-Swim Across America Grant 23-1579. RWC נתמך על ידי T32GM132055 מענק ההכשרה למדעים תאיים, ביוכימיים ומולקולריים ומלגת Lowvelo Graduate Fellowship של מרכז הסרטן הולינגס. מחקר זה נתמך בחלקו על ידי Flow Cytometry and Cell Sorting Shared Resource, Hollings Cancer Center, Medical University of South Carolina (P30 CA138313). תודה מיוחדת לד"ר צ'יז'י טאנג מאוניברסיטת קליפורניה, סן פרנסיסקו (UCSF) על הענקת הפלסמידים המוטנטים CAR במתנה.
Materials
| Name | Company | Catalog Number | Comments |
| Adeno-associated virus (AAV) | Charles River Laboratories | ||
| CAR target-expressing K562 cells | e.g., CD19-K562 | ||
| Cesium-137 irradiator | |||
| Anti-human CD8 PerCP (clone SK1) | Biolegend | 344708 | |
| Anti-human CD4 PE/Cy7 (clone SK3) | Biolegend | 344612 | |
| DynaMag-15 magnet | ThermoFisher | 12301D | |
| Ghost BV510 viability dye | TONBO | 13-0870-T100 | |
| K562 cells | American Type Culture Collection | CCL-243 | |
| 0.5 M EDTA, pH 8.0 | Gibco | 15575020 | |
| 1 M HEPES | Gibco | 15630080 | |
| Ammonium chloride solution | STEMCELL Technologies | 7850 | |
| Anti-human CD127 PE (clone hIL-7R-M21) | BD Biosciences | 557938 | |
| Anti-human CD25 APC (clone BC96) | Biolegend | 302610 | |
| Anti-human CD4 FITC (clone SK3) | Biolegend | 344604 | |
| Anti-human CD71 PE (clone SK1) | Biolegend | 334106 | |
| Anti-human CD8 PerCP (clone SK1) | Biolegend | 344707 | |
| Anti-human CTLA-4 PerCP-e710 | ThermoFisher | 46-1529-42 | |
| Anti-human EGFR APC (clone AY13) | Biolegend | 352905 | |
| Anti-human FOXP3 eFluor 450 | ThermoFisher | 48-4776-42 | |
| Anti-human HELIOS PE | Biolegend | 137216 | |
| Ca2+ and Mg2+ free Dulbecco’s Phosphate Buffered Saline (DPBS) | Gibco | 14190144 | |
| Cell counter (TC20 Automated Cell Counter) | Bio-Rad | 1450102 | |
| Cell Counting Slides | Bio-Rad | 1450016 | |
| CellTrace Violet Cell Proliferation Kit | ThermoFisher | C34571 | |
| DNA LoBind Tubes | Eppendorf | 22431021 | |
| Easy 50 EasySep magnet | STEMCELL Technologies | 18002 | |
| EasySep Human CD4+ T cell Enrichment Kit | STEMCELL Technologies | 19052 | |
| EasySep Human CD8+ T cell Enrichment Kit | STEMCELL Technologies | 19053 | |
| EasySep magnet | STEMCELL Technologies | 18000 | |
| eBioscience Foxp3 transcription factor staining buffer set | ThermoFisher | 00-5523-00 | |
| Falcon Round-Bottom Polystyrene Test Tubes with Cell Strainer Snap Cap, 5 mL | Fisher Scientific | 08-771-23 | 40μm |
| Fetal Bovine Serum (FBS) | Gibco | 26140079 | |
| Flow cytometer | Beckman Coulter | CytoFLEX LX U3-V5-B3-Y5-R3-I2 | |
| Fluorescence-activated cell sorter | BD Biosciences | FACS Aria III Cell Sorter | |
| GlutaMAX | Gibco | 35050061 | |
| Human CD3/28 T Cell Expansion and Activation Dynabeads | Gibco | 11131D | |
| Invitrogen Neon Transfection System | ThermoFisher | 10431915 | |
| Invitrogen Neon Transfection System 100 μL Kit | ThermoFisher | 10114334 | |
| Lentivirus | VectorBuilder | ||
| MEM Non-Essential Amino Acids Solution | Gibco | 11140050 | |
| Myc Tag antibody A647 (clone 9B11) | Cell Signaling Technologies | 2233S | |
| Opti-MEM I Reduced Serum Medium | ThermoFisher | 31985062 | |
| Penicilin-Streptomycin solution | Gibco | 15140122 | |
| Recombinant human interleukin-2 (rhIL-2) | Peprotech | 200-02 | |
| RPMI 1640 medium, no glutamine | Gibco | 11875093 | |
| Sodium pyruvate | Gibco | 11360070 | |
| Spectral Flow Cytometer | Cytek | Northern Lights | |
| TRAC gRNA | Synthego | Sequence (CAGGGTTCTGGATATCTGT) | |
| TrueCut Cas9 Protein v2 | ThermoFisher | A36496 | |
| Trypan Blue solution | Sigma | T8154-100ML | |
| 1/10 Leukopak | STEMCELL Technologies | 200-0092 | 1-2 billion PBMC |
References
- Zhang, X., Zhu, L., Zhang, H., Chen, S., Xiao, Y. CAR-T cell therapy in hematological malignancies: current opportunities and challenges. Front Immunol. 13, 927153 (2022).
- Cappell, K. M., Kochenderfer, J. N. Long-term outcomes following CAR T cell therapy: what we know so far. Nat Rev Clin Oncol. 20 (6), 359-371 (2023).
- Choi, B. D., et al. Intraventricular CARv3-TEAM-E T cells in recurrent glioblastoma. N Engl J Med. 390 (14), 1290-1298 (2024).
- Brown, C. E., et al. Locoregional delivery of IL-13Ralpha2-targeting CAR-T cells in recurrent high-grade glioma: a phase 1 trial. Nat Med. 30 (4), 1001-1012 (2024).
- Bagley, S. J., et al. Intrathecal bivalent CAR T cells targeting EGFR and IL13Ralpha2 in recurrent glioblastoma: phase 1 trial interim results. Nat Med. 30 (5), 1320-1329 (2024).
- Ghobadinezhad, F., et al. The emerging role of regulatory cell-based therapy in autoimmune disease. Front Immunol. 13, 1075813 (2022).
- Sakaguchi, S., Yamaguchi, T., Nomura, T., Ono, M. Regulatory T cells and immune tolerance. Cell. 133 (5), 775-787 (2008).
- Sakaguchi, S., et al. Regulatory T cells and human disease. Annu Rev Immunol. 38, 541-566 (2020).
- Ferreira, L. M. R., Muller, Y. D., Bluestone, J. A., Tang, Q. Next-generation regulatory T cell therapy. Nat Rev Drug Discov. 18 (10), 749-769 (2019).
- Rosenblum, M. D., Gratz, I. K., Paw, J. S., Abbas, A. K. Treating human autoimmunity: current practice and future prospects. Sci Transl Med. 4 (125), 125sr121 (2012).
- Sawitzki, B., et al. Regulatory cell therapy in kidney transplantation (The ONE Study): a harmonised design and analysis of seven non-randomised, single-arm, phase 1/2A trials. Lancet. 395 (10237), 1627-1639 (2020).
- Spanier, J. A., et al. Tregs with an MHC class II peptide-specific chimeric antigen receptor prevent autoimmune diabetes in mice. J Clin Invest. 133 (18), e168601 (2023).
- Muller, Y. D., et al. Precision engineering of an anti-HLA-A2 chimeric antigen receptor in regulatory T cells for transplant immune tolerance. Front Immunol. 12, 686439 (2021).
- MacDonald, K. G., et al. Alloantigen-specific regulatory T cells generated with a chimeric antigen receptor. J Clin Invest. 126 (4), 1413-1424 (2016).
- Boardman, D. A., et al. Flagellin-specific human CAR Tregs for immune regulation in IBD. J Autoimmun. 134, 102961 (2023).
- Schreeb, K., et al. Study design: human leukocyte antigen Cclass I molecule A(*)02-chimeric antigen receptor regulatory T cells in renal transplantation. Kidney Int Rep. 7 (6), 1258-1267 (2022).
- Zimmerman, C. M., Robino, R. A., Cochrane, R. W., Dominguez, M. D., Ferreira, L. M. R. Redirecting human conventional and regulatory T cells using chimeric antigen receptors. Methods Mol Biol. 2748, 201-241 (2024).
- Tang, Q., et al. Selective decrease of donor-reactive T(regs) after liver transplantation limits T(reg) therapy for promoting allograft tolerance in humans. Sci Transl Med. 14 (669), eabo2628 (2022).
- Bender, C., et al. A phase 2 randomized trial with autologous polyclonal expanded regulatory T cells in children with new-onset type 1 diabetes. Sci Transl Med. 16 (746), eadn2404 (2024).
- Ferreira, L. M. Conference report: Advanced Therapies Week 2023. Regen Med. 18 (4), 297-299 (2023).
- Cochrane, R. W., et al. How to test human CAR T cells in solid tumors, the next frontier of CAR T cell therapy. Methods Mol Biol. 2748, 243-265 (2024).
- Roy, A., Krzykwa, E., Lemieux, R., Neron, S. Increased efficiency of gamma-irradiated versus mitomycin C-treated feeder cells for the expansion of normal human cells in long-term cultures. J Hematother Stem Cell Res. 10 (6), 873-880 (2001).
- Eyquem, J., et al. Targeting a CAR to the TRAC locus with CRISPR/Cas9 enhances tumour rejection. Nature. 543 (7643), 113-117 (2017).
- Negrini, M., Wang, G., Heuer, A., Bjorklund, T., Davidsson, M. AAV Production everywhere: a simple, fast, and reliable protocol for in-house AAV vector production based on chloroform extraction. Curr Protoc Neurosci. 93 (1), e103 (2020).
- Velasco Cardenas, R. M., et al. Harnessing CD3 diversity to optimize CAR T cells. Nat Immunol. 24 (12), 2135-2149 (2023).
- Boomer, J. S., Green, J. M. An enigmatic tail of CD28 signaling. Cold Spring Harb Perspect Biol. 2 (8), a002436 (2010).
- Suhoski, M. M., et al. Engineering artificial antigen-presenting cells to express a diverse array of co-stimulatory molecules. Mol Ther. 15 (5), 981-988 (2007).
- Fung, V. C. W., Rosado-Sanchez, I., Levings, M. K. Transduction of human T cell subsets with lentivirus. Methods Mol Biol. 2285, 227-254 (2021).
- Bailey-Bucktrout, S. L., et al. Self-antigen-driven activation induces instability of regulatory T cells during an inflammatory autoimmune response. Immunity. 39 (5), 949-962 (2013).
- Nakagawa, H., et al. Instability of Helios-deficient Tregs is associated with conversion to a T-effector phenotype and enhanced antitumor immunity. Proc Natl Acad Sci U S A. 113 (22), 6248-6253 (2016).
- Dawson, N. A. J., et al. Functional effects of chimeric antigen receptor co-receptor signaling domains in human regulatory T cells. Sci Transl Med. 12 (557), eaaz3866 (2020).
- Rana, J., et al. CAR- and TRuC-redirected regulatory T cells differ in capacity to control adaptive immunity to FVIII. Mol Ther. 29 (9), 2660-2676 (2021).
- Battaglia, M., Stabilini, A., Tresoldi, E. Expanding human T regulatory cells with the mTOR-inhibitor rapamycin. Methods Mol Biol. 821, 279-293 (2012).
- Brady, B. L., Steinel, N. C., Bassing, C. H. Antigen receptor allelic exclusion: an update and reappraisal. J Immunol. 185 (7), 3801-3808 (2010).
- Samarasinghe, S., et al. Functional characterization of alloreactive T cells identifies CD25 and CD71 as optimal targets for a clinically applicable allodepletion strategy. Blood. 115 (2), 396-407 (2010).
- Voss, K., et al. FOXP3 protects conventional human T cells from premature restimulation-induced cell death. Cell Mol Immunol. 18 (1), 194-205 (2021).
- Collison, L. W., Vignali, D. A. In vitro Treg suppression assays. Methods Mol Biol. 707, 21-37 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved