Galleria mellonella כמודל סינון אנטי-מיקרוביאלי
In This Article
Summary
מחקר זה מציג מסגרת מתוקננת לאופטימיזציה של מודלים של זיהום G. mellonella לשימוש בהערכה אנטי-מיקרוביאלית פרה-קלינית. יישום מודל G. mellonella כחלק מצנרת פיתוח אנטי-מיקרוביאלית פרה-קלינית עשוי להפחית את מספר התרכובות הלא יעילות המתקדמות לניסויים קליניים.
Abstract
כדי להילחם בבעיה העולמית הגוברת של עמידות לאנטיביוטיקה, הפיתוח המואץ של אנטיביוטיקה חדשה הוא חיוני. הפיתוח האנטי-מיקרוביאלי הפרה-קליני הנוכחי מניב מספר משמעותי של לידים שהוכחו כלא מתאימים לפני או במהלך ניסויים קליניים. כדי להגביר את יעילות הפיתוח הפרה-קליני יש לפתח מודלים רלוונטיים, סטנדרטיים, נגישים וחסכוניים. זחלי גלריה מלונלה (עש שעווה גדול) נמצאים בשימוש נרחב כמודל זיהום להערכת אלימות מיקרוביאלית, ביצוע בדיקות רעילות לתרופות ומשמשים כאמצעי ראשוני להערכת יעילות in vivo של תרכובות אנטי-מיקרוביאליות חדשות. למודלים אלה של זיהום יש רלוונטיות ביולוגית גדולה יותר מאשר למסכים רבים במבחנה בעלי תפוקה דומה, והם מפחיתים את ההסתמכות על מודלים של יונקים כאשר הם משמשים כמסך מקדים לבדיקות אנטי-מיקרוביאליות. פרוטוקול זה מתאר מתודולוגיה סטנדרטית לאופטימיזציה של מודלים של זיהום G. mellonella , אשר ניתן ליישם על מיני חיידקים וטיפולים מיקרוביאליים לפי בחירה. באמצעות הפתוגן המועדף של ארגון הבריאות העולמי Pseudomonas aeruginosa כדוגמה, אנו מתארים צעדים שניתן לנקוט כדי לפתח מודל ניתן לשחזור של זיהום ובדיקות טיפוליות. זה כולל המלצות על מערך הניסוי, הכנת דגימות ופרוטוקולי זיהום וטיפול. שילוב מודל זה בצנרת הפיתוח האנטי-מיקרוביאלית הפרה-קלינית יפחית את ההסתמכות על מודלים של יונקים, יפחית את מספר התרכובות הלא יעילות המגיעות לניסויים קליניים, ובסופו של דבר יגביר את יעילות הפיתוח האנטי-מיקרוביאלי הפרה-קליני.
Introduction
זחלי גלריה מלונלה (עש השעווה הגדול) נמצאים בשימוש נרחב ברחבי מדעי הביולוגיה כמודלים לזיהום עבור מיני מיקרובים, ולבדיקת רעילות של תרכובות תרופות חדשות 1,2. יש להם פוטנציאל לתועלת רבה בצנרת בדיקות אנטי-מיקרוביאלית פרה-קלינית, מכיוון שהם בעלי תפוקה גבוהה, משכפלים מאפיינים אינטגרליים in vivo של זיהום אנושי, ומפחיתים את ההסתמכות על מודלים של יונקים, בהתאם לעקרונות של הפחתה, עידון והחלפה השולטים בשימוש אתי במינים של יונקים במחקר.
פיתוח אנטיביוטיקה חדשה דורש בדיקות פרה-קליניות מקיפות במודלים במבחנה ו-in vivo לפני תיקוף קליני3. רק סוכנים חדשים מעטים עם חבילות נתונים פרה-קליניים מבטיחות מתורגמים אי פעם למרפאה, ואחד התורמים לשיעור שחיקה גבוה זה הוא כישלון של מסכים פרה-קליניים ללכוד את המורכבות של סביבות זיהום4. בעיות אלה תורמות לא רק לשיעור תרגום נמוך של חומרים אנטי-מיקרוביאליים למרפאה, אלא גם לשימוש מוגבר בבעלי חוליות ניסיוניים במהלך בדיקות פרה-קליניות בשלב מאוחר. כדי לשפר את ההערכה הפרה-קלינית של תרופות אנטי-מיקרוביאליות חדשות ולהפחית את השימוש במודלים יקרים, גוזלי זמן, מורכבים ובעייתיים מבחינה אתית, נדרשים כלים טובים יותר לסינון תרופות בשלב מוקדם המפחיתים את מספר התרכובות הבלתי מבטיחות המתקדמות לבדיקות במערכות בעלי חוליות.
ל- G. mellonella מחזור חיים קצר של 8 שבועות, המורכב מארבעה שלבי חיים: ביצה, זחלים, גלמים ובוגרים, מהם צורת הזחל מנוצלת בפרוטוקול זה1. G. mellonella קלים לתחזוקה במהלך ניסוי ללא צורך בציוד מומחה או מתקן ייעודי לחקר בעלי חיים. אין דרישה לבקש אישור אתי לשימוש בהם, וחוקרים יכולים לגדל את האורגניזם בבית כדי לשפר את איכות הניסוי 2,5,6,7. מערכת החיסון G. mellonella דומה מאוד לזו של מערכת החיסון המולדת של יונקים, עם יכולת להגיב לגירויים "עצמיים" ו"לא עצמיים"8. המוציטים אחראים לזיהוי תבניות מולקולריות הקשורות לפתוגן ולפאגוציטוזה שלאחר מכן, וממלאים תפקיד מקביל מבחינה תפקודית לזה של נויטרופילים בבני אדם9. G. mellonella מקודד שלושה סוגים של קולטנים דמויי אגרה שזוהו על ידי הומולוגיה של רצפים לבני אדם, ומייצרים חלבונים דמויי השלמה, המזהים חומר שאינו עצמי ויוצרים קומפלקסים מקומיים של מלניזציה בעקבות הפעלה ופילמור של פנולוקסידאז למלנין10. זה יכול לשמש קריאה חזותית של בריאות הזחל במהלך ניסויים זיהום, כמו הקוטיקולה מוחשכת על ידי מלניזציה. יש לציין, עם זאת, כי ציר המלניזציה בחרקים, הכולל פנולוקסידאז, שונה באופן מהותי מציר טירוסינאז-מלנין ביונקים11,12. בנוסף, G. mellonella מייצר 18 פפטידים אנטי-מיקרוביאליים מושרים, כולל ליזוזים והומולוגים של דפנסין13. דמיון זה, כמו גם נהלי תחזוקת הזחלים הפשוטים ואופי התפוקה הגבוהה של המודל, הפכו את G. mellonella לאורגניזם בשימוש נרחב בהערכת תרופות חדשות. בפיתוח אנטיביוטיקה פרה-קלינית, G. mellonella הגדיל את התועלת בהשוואה למודלים במבחנה, מכיוון שהם יכולים למדל בצורה מדויקת יותר אינטראקציות מארח-פתוגן-תרופה בסביבה מורכבת עם חסינות פעילה.
נכון לעכשיו, אין ספק סטנדרטי ברמת מחקר של G. mellonella באירופה. במקום זאת, על החוקרים לרכוש זחלי G. mellonella מחנויות פיתיון או לתחזק מושבה משלהם. בעוד ששיטות לשמירה על מושבת G. mellonella פנימית תוארו ויכולות להגדיל את עקביות הניסוי 5,6,7, אפשרות זו עשויה להיות אטרקטיבית רק למי שמשתמש בזחלים לעתים קרובות. ככזה, פרוטוקול זה מתמקד במערך הניסוי לאחר רכישת זחלים מספק פיתיון חי. שיטה זו אמנם נגישה יותר, אך מגדילה את מורכבות הניסוי ויכולה להכניס שונות נוספת לבדיקות עקב חוסר עקביות בבריאות הזחלים בנקודה שבה הם מתקבלים מהספקים. כדי שאקדמאים, תעשייה ורגולטורים יקבלו ויאמצו בדיקות G. mellonella כחלק מצנרת פיתוח אנטי-מיקרוביאלית פרה-קלינית, יש צורך במערכת סטנדרטית לאופטימיזציה והערכה של יעילות מיקרוביאלית.
מחקר זה מייעל את התכנון הניסויי של מודל זיהום G. mellonella לפיתוח אנטיביוטיקה. בעוד מודלים של זיהום G. mellonella תוארו14,15, המתודולוגיה הנוכחית מתעדת צעדים נוספים כדי למתן את המורכבות הנוספת שנוצרה על ידי חוסר עקביות של אספקה ומספק מסגרת להערכה של מיקרוביאלים חדשים. כמקרה מבחן, G. mellonella היה נגוע בעדיפות אחת של ארגון הבריאות העולמי Pseudomonas aeruginosa, והטיפול עם סוכן aminoglycoside (tobramycin) היה אופטימלי. מסגרת זו, המודגמת באיור 1, מספקת בסיס למחקרי סינון אנטי-מיקרוביאליים פרה-קליניים עתידיים עם חומרים חדשניים.
Protocol
במחקר זה נבחרו זחלי גלריה מלונלה (עש שעווה גדול) כמודל לבדיקות רגישות לאנטיביוטיקה ולניסויי רעילות חריפה. אין צורך באישור אתי לשימוש ניסיוני בגלריה מלונלה. פרטי הריאגנטים והציוד בהם נעשה שימוש מפורטים בטבלת החומרים.
1. תכנון ניסיוני
- לקבוע את גודל קבוצת זחלי המלונלה המתאימים בהתבסס על השינוי היחסי בהישרדות הזחלים שהמחקר שואף ללכוד. טבלה 1 מפרטת את גודל הקבוצות הדרוש כדי לזהות שינויים ספציפיים באחוזים בהישרדות באמצעות מודל זיהום מסוג Pseudomonas aeruginosa זן PAO1.
הערה: בעת שימוש בפתוגן חדש, קבע תחילה שונות בין בדיקות בהישרדות היחסית של זחלים נגועים אך לא מטופלים, מכיוון שהדבר ישפיע על קביעת גודל הדגימה.- כלול שתי קבוצות של בקרות PBS: אחת מוזרק לפני שאר הזיהומים כדי להבטיח שהמזרק חד וראוי לשימוש, ואחרת מוזרק במהלך או אחרי זיהומים חיידקיים כדי להבטיח עיקור תקין בין קבוצות הזיהום. אם אתם מבצעים אופטימיזציה עם פתוגן חדש, יש לכלול בקרה שטופלה בחום כדי להבטיח שהמוות אינו תוצאה של תגובה חיסונית לחלקיקים זרים.
הערה: מזרקי אינסולין יכולים לשמש לזריקות, הפחתת הסיכונים של קהות וזיהום. עם זאת, ניסויים עשויים להשתמש באופן שגרתי במאות G. mellonella, מה שהופך את השימוש מזרקי אינסולין יקר ובזבזני. - עבור מחקרים המייעלים את הטיפול האנטיבקטריאלי, יש לכלול שתי בקרות נוספות: קבוצה שנדבקה בחיידק ולאחר מכן הוזרק לה טיפול "דמה" ברכב, וקבוצה שהזריקה פעמיים לרכב, פעם אחת בזמן ההדבקה למצבים האחרים ופעם אחת בזמן הטיפול.
הערה: הראשון הוא ביקורת לא מטופלת, ואילו האחרון שולט על כל טראומה שנגרמה על ידי הזריקות. טראומה כזו סבירה יותר כאשר משתמשים במחטים קהות.
- כלול שתי קבוצות של בקרות PBS: אחת מוזרק לפני שאר הזיהומים כדי להבטיח שהמזרק חד וראוי לשימוש, ואחרת מוזרק במהלך או אחרי זיהומים חיידקיים כדי להבטיח עיקור תקין בין קבוצות הזיהום. אם אתם מבצעים אופטימיזציה עם פתוגן חדש, יש לכלול בקרה שטופלה בחום כדי להבטיח שהמוות אינו תוצאה של תגובה חיסונית לחלקיקים זרים.
- להזמין G. mellonella מספק פיתיון חי, או להחזיק מושבה של G. mellonella כפי שתואר לעיל 5,6,7. עבור הספק המופיע בטבלת החומרים, הזמינו פי 1.8 ממספר הזחלים המתוכנן, שכן כ-33% יוחרגו על בסיס גודלם, ו-10% נוספים עלולים למות בעקבות עיקור ציפורניים.
- לקבוע את השתנות המשקל של G. mellonella לפני השימוש הניסיוני, ולוודא שטווח המשקל אינו עולה על סטיית תקן אחת של הממוצע.
הערה: עבור ספקים שאינם רשומים בטבלת החומרים, דאג שהספק יספק מלאי חדש.
- לקבוע את השתנות המשקל של G. mellonella לפני השימוש הניסיוני, ולוודא שטווח המשקל אינו עולה על סטיית תקן אחת של הממוצע.
- עם קבלתו, יש לאחסן את G. mellonella בטמפרטורת החדר כדי להגביל את הסיכוי לפקעת, המתרחשת לאחר הדגירה ב-37°C.
הערה: לא כל הזחלים מספקים מסחריים יוצרים פקעות, אשר שימשו בעבר כאינדיקטור לבריאות הזחלים16. - השתמש הזחלים בתוך שבוע אחד של קבלה, ובמקרה זה הם אינם דורשים האכלה.
הערה: למרות ששלב חיי הזחל ישתנה בין קבוצות, רוב הזחלים מועברים במהלך הכוכב האחרון לפני הגור. בשלב זה, ההזנה יורדת באופן טבעי בהשוואה לשלבים מוקדמים יותר17.
2. עיקור ובחירה של זחלי G. mellonella
- לשקול זחלי גלריה mellonella ולהשליך כל מי שנמצא מחוץ לטווח של 224 מ"ג ± 49.2 מ"ג, שהוא המשקל הממוצע של הזחלים פלוס או מינוס סטיית תקן אחת. הדבר יביא להרחקה של כ-33% מהזחלים.
הערה: שינויי המשקל עשויים להשתנות בין ספקים. עבור ספקים שאינם רשומים בפרוטוקול זה, חשב טווח משקל מתאים. - בצע את השלבים הבאים בתנאים אספטיים.
- רססו 70% אתנול לתוך צלחת פטרי, כדי להבטיח מספיק כדי לכסות את החלק התחתון של המנה.
- לעקר את פני השטח של G. mellonella בקבוצות של 10-20 זחלים.
- מניחים כל אצווה בנפרד בצלחת ומרססים את הזחלים פעמיים באתנול 70%.
- השתמשו בפינצטה כדי לגלגל את הזחלים, ולהבטיח כיסוי מלא.
- מוציאים את הזחלים מהאתנול ומניחים אותם בצלחת פטרי סטרילית. השאירו את התבשיל חשוף כדי לאפשר לזחלים להתייבש.
זהירות: השארת G. mellonella באתנול למשך יותר מ-15 שניות תגרום לתמותה גבוהה.
- לאחר שכ-90% מהזחלים חזרו לפעילות לאחר שעתיים, יש להפריד את הזחלים שהתאוששו לקבוצות בגודל שיאפשר זיהוי מספיק של שינויי הישרדות בהתאם לחישובי העוצמה המפורטים בטבלה 1.
- יש להשתמש ב-G. mellonella תוך 6 שעות מהעיקור.
3. אופטימיזציה של צפיפות החיסון החיידקי
- הכינו מלאי זיהום חיידקי של CFU/מ"ל ידוע לפני ההדבקה. שיטות ליצירת מניות ישתנו לפי אורגניזם. כאן, Pseudomonas aeruginosa גדל לשלב אמצע לוג בציר חומרים מזינים, aliquoted, וקפוא בצפיפות של 6 x 107 CFU/mL.
- משחררים את מלאי ההדבקה על ידי צנטריפוגה של 10,000 x גרם בטמפרטורת החדר למשך 5 דקות, ומשהים מחדש ב-PBS. לדלל באופן סדרתי את מלאי החיידקים פי עשרה כדי ליצור מגוון של מנות חיסון של 101-10 7 CFU לכל זחל, בהתחשב בכך שכל זחל מוזרק עם 10 μL של inoculum.
הערה: טווח מינון החיסון הספציפי ישתנה בהתאם לאלימות חיידקית, אך הטווח המוצע כאן צריך להתאים לרוב המינים הפתוגניים. קביעת קצב גדילה במבחנה יכולה לסייע בבחירת טווח מינון מתאים, שכן קצב גדילה ספציפי לזן בתרבית נוזלית מתואם עם תמותת זחלים. - לפני תחילת ההדבקות, מנה את החיסון עם דילול סדרתי של מיילס ומצרה כדי לקבוע במדויק את צפיפות החיסון18.
- הכינו שלוש שפופרות מיקרופוגה 1 מ"ל המכילות dH2O סטרילי, 70% אתנול או PBS סטרילי. אלה ישמשו ללא הרף כדי לעקר את המזרק המשמש להזרקת הזחלים.
- בדקו מזרק סטרילי בנפח 100 מיקרוליטר המילטון, וודאו שקצה המחט חד ולא פיתח וו, שיגרום לטראומה משמעותית לאתר הזיהום.
זהירות: קצה מחט מזרק המילטון יתחיל להתעקם לאחר כ-300 זיהומים. אם קצה המחט מעוות, יש להחליפו. - יש לשטוף את המזרק ברצף עם dH2O, אתנול ו-PBS לפני זיהומים, תוך ציור והשלכה של הקיבולת המרבית של המזרק.
- מערבלים את החיסון נגד זיהום מרחף ומושכים מקסימום של 100 μL לתוך מזרק המילטון, מספיק כדי להזריק 10 μL לכל זחל.
- להזריק לכל זחל 10 μL של inoculum ברגל ימין האחורית. ודא כי המחט חודרת כ 2 מ"מ לתוך הגוף.
הערה: ניתן להשתמש בשיטות שונות של זיהום. אלה כוללים החזקת הזחל מעל קצה פיפטה כדי לחשוף את הרגליים, אבטחת המזרק באופן סטטי ומיקום G. mellonella ביד, או הזרקת יד חופשית. - בין כל קבוצה של זיהומים, לעקר את המזרק כמפורט בשלב 2.5 כדי למנוע זיהום משאריות העור.
- לדגור על הזחלים הנגועים בטמפרטורה מספקת לצמיחה מיקרוביאלית, בין 20 ° C ל 42 ° C, שהוא טווח מתאים להישרדות G. mellonella 5.
- עקוב אחר הישרדות G. mellonella במרווחי זמן קבועים מהזמן שבו התמותה נצפתה בדרך כלל לראשונה כדי למדוד במדויק את זמן המוות. יש להעריך זאת במסך ראשוני. הסר את כל הזחלים המתים ורשום את זמן מותם.
- בחר את מינון הזיהום האופטימלי למחקר בדיקה טיפולית המבוסס על המינון שמניב 50% תמותה עד 18 שעות ומעל 80% עד 72 שעות. זה מאפשר פיתוח מסך חד יומי מהיר תוך הבטחת אלימות מספקת וחלון טיפולי מתאים.
4. בדיקת רעילות של חומרים אנטי-מיקרוביאליים חדשים בזחלים לא נגועים
- להעריך את הרעילות של אנטי-מיקרוביאלים חדשים וכלי רכב נבחרים בגלריה מלונלה לפני השימוש בהם עם זחלים נגועים בניסוי. הכינו מגוון רחב של מינונים החורגים מהטווח הטיפולי הצפוי של האנטי-מיקרוביאלית, מונחה על ידי נתוני רעילות במבחנה (למשל, קו תאים), אם זמינים.
- שקול כי הזחלים יוזרקו עם 10 μL של הטיפול. הכינו בקרות רכב בלבד בריכוזים התואמים את אלה שבהם מועבר הטיפול.
- הזריקו G. mellonella בריא וסטרילי בקבוצות בגודל מתאים עם ריכוזי הרכב האנטי-מיקרוביאליים וה-PBS השונים, כמפורט בשלבים 3.2-3.10. במחקר הנוכחי, האנטי-מיקרוביאלית שבה נעשה שימוש הייתה טוברמיצין.
הערה: עבור סוכן הדורש DMSO כממס, יש להזריק עם מחט מד 26s, במקום מחט מד 22 סטנדרטית, מכיוון שטראומה ממחטים גדולות יותר מגבירה את התמותה בעת שימוש ב- DMSO. - הגדירו מינון בטוח ככזה שאינו מניב הבדל משמעותי בתמותה בהשוואה לזחלים המוזרקים עם PBS בלבד.
5. ייעול הטיפול בזיהום חיידקי G. mellonella עם סוכן מיקרוביאלי
- הכינו מגוון מנות של הסוכן האנטי-מיקרוביאלי, בהתחשב בכך שזחלים נגועים מטופלים במינון של 10 מיקרוביאלית. השתמש במגוון מינונים עם רעילות מינימלית, כפי שהוערך בשלב 4.
- בצע את שלבים 1 ו -2 של פרוטוקול זה כדי להכין ולהדביק Galleria mellonella בקבוצות מתאימות במינון הזיהום האופטימלי בעבר.
- בשעה 2 שעות לאחר ההדבקה, לטפל בזחלים עם סוכן מיקרוביאלי מוכן או פתרון בקרת הרכב. בצע את שלבים 3.2-3.8, הזרקה לתוך הפרוג הנגדי מזה מוזרק במהלך ההדבקה. לעקר את המחט בין קבוצות.
הערה: טיפול בשעה 2 שעות נבחר עבור אופטימיזציה זו כדי לקבל נתוני תגובת מינון חזקים, שמהם נקבע אופטימיזציה עוקבת של תזמון הטיפול19. - עקוב אחר הישרדות G. mellonella במרווחים של 30 דקות או בתדירות גבוהה יותר מהזמן שבו התמותה נצפתה בדרך כלל לראשונה. הסר את כל הזחלים המתים ורשום את זמן מותם.
- חישוב השינוי ביחסי ההישרדות בין קבוצות הטיפול. השתמש בניתוח הישרדות קפלן-מאייר כדי לקבוע אם הטיפול מוביל לשינוי משמעותי בתמותת הזחלים. כלול תיקון פוסט-הוק מתאים עבור ריבוי זוגות בניתוחים מרובי קבוצות.
6. אופטימיזציה של תזמון הטיפול של G. mellonella נגוע
- בצע את שלבים 1 ו -2 כדי להכין Galleria mellonella בקבוצות מתאימות במינון הזיהום האופטימלי בעבר.
- הכן את הסוכן האנטי-מיקרוביאלי במינון שקודם לכן מוטב בשלב 4.
- בשעתיים, 4 שעות, 6 שעות, 9 שעות או 12 שעות לאחר ההדבקה, יש לטפל בזחלים הנגועים לפי שלבים 3.2-3.8 כדי להשוות כיצד עיתוי הטיפול משפיע על התמותה.
- עקוב אחר הישרדות G. mellonella במרווחים של 30 דקות או בתדירות גבוהה יותר מהזמן שבו התמותה נצפתה בדרך כלל לראשונה. הסר את כל הזחלים המתים ורשום את זמן מותם. העיתוי האופטימלי הוא זה ששומר על ההישרדות שנצפתה לאחר האופטימיזציה הראשונית של מינון הטיפול.
הערה: בעת בדיקת יעילות מיקרוביאלית ב- G. mellonella, מטב הן את מינון הטיפול והן את העיתוי בנפרד, תוך שימוש בראשון כדי ליידע את מינון הטיפול באחרון.
תוצאות
הערכת שונות אצווה במשקל G. mellonella
מקור פוטנציאלי לשונות לא רצויה בניסויי זיהום נובע מהבדלי גודל בין יחידות ניסוי בודדות (כלומר, זחלים) ובין אצוות. ניתן למתן את ההשפעות של שונות זו על ידי התאמת מינון הטיפול או הזיהום על בסיס משקל, או על ידי בחירת הזחלים בטווח משקל מוגדר בלבד לשימוש בניסויים. ההתאמה האחרונה היא פרגמטית יותר ואינה כפופה לטעויות אנוש שעלולות להתעורר במהלך הכנת המינון. יתרון נוסף של שקילת הזחלים הוא שהיא מאפשרת המרה של מנות טיפול מאלה הניתנות לזחלים למקביליהם האנושיים במ"ג/ק"ג. כדי לכמת את השונות בתוך האצוות ולרוחבן, נשקלו שלוש אצוות של 50 זחלים, שהוזמנו בזמנים שונים. המשקל הממוצע בכל קבוצה היה 225.5 מ"ג, 230.54 מ"ג ו-215.86 מ"ג, עם סטיות תקן של 49.1 מ"ג, 53.7 מ"ג ו-44.3 מ"ג, בהתאמה (איור 2A). בין האצוות לא היה הבדל משמעותי במשקל. בין אצוות, המשקל נע בין 107.5 מ"ג ל 341.0 מ"ג, עם ממוצע של 224.0 מ"ג ± 49.2 מ"ג.
כדי להשיג תוצאות ניתנות לשחזור, הזחלים נשקלו לפני הניסויים ונבחרו אם משקלם היה 224 מ"ג ± 49.2 מ"ג, מה שהפחית את טווח המשקל מ-233.5 מ"ג ל-98.4 מ"ג, והסיר 33% מהזחלים. זה עולה בקנה אחד עם עבודות קודמות שזיהו שונות משמעותית בהישרדות של זחלים נגועים MRSA עם רצועות משקל מעל 100 מ"ג14,20. כמו כן, השווינו את משקל G. mellonella בנקודת הלידה למשקל שבוע לאחר הלידה, שכן כל שינוי משמעותי במשקל יכול להשפיע על תוצאות הניסוי כאשר הזחלים אינם בשימוש מיד עם הגעתם. המשקל הממוצע של G. mellonella היה 230.54 מ"ג ±-53.7 מ"ג. שבוע לאחר הלידה, המשקל הממוצע היה 221.8 מ"ג ± 45.7 מ"ג סטיית תקן (איור 2B). לא נמצא הבדל משמעותי בין המשקל עם ההגעה למשקל לאחר שבוע, וממנו אנו מסיקים כי ניתן להשתמש בזחלים למטרות ניסוי בכל שלב בשבוע הראשון מהלידה. חשוב לציין כי תוצאות אלו מייצגות רק את G. mellonella שנרכשו מספק אחד, והמשקל עשוי להיות שונה משמעותית בין ספקים או כאשר הזחלים מוזמנים בזמנים שונים.
אופטימיזציה של צפיפות החיסון של P. aeruginosa PAO1
האלימות של חמישה מבודדי P. aeruginosa בארבע צפיפויות חיסון הוערכה, כולל שלושה זני מעבדה נפוצים, PAO1, PA14 ו- PAK, ושני מבודדים קליניים מזיהום נשימתי כרוני, LESB58 ו- IST27-M. אלה שימשו כחלק מפאנל זן רלוונטי ל-CF שפותח על ידי Mahenthiralingam et al.21 והם מייצגים את הפילוגנזה העולמית של המין. נתוני גדילה ראשוניים במרק מזין הראו קצב גדילה נמוך יותר עבור מבודדים מזיהום כרוני (איור 3). בהתחשב בכך, G. mellonella נדבקו בקבוצות של 10 זחלים עם מינונים של 101, 102, 103, או 104 CFU/larva ב 10μl של PBS עבור PAO1, PA14, ו PAK, ומינונים של 102, 103, 104, או 105 CFU/larva עבור LESB58 ו- IST27-M. שתי קבוצות של 10 זחלים הוזרקו גם עם PBS בלבד, קבוצה אחת לפני וקבוצה אחת אחרי הזיהומים. זריקות PBS לפני זיהומים מבקרות PBS מזוהם או זיהום של מחטים עם מיני חיידקים מהקוטיקולה של גלריה, ואילו זריקות PBS לאחר בקרת זיהום עבור כל זיהום של מחטים עם חיידקים המשמשים בתהליך הזיהום. המינונים האופטימליים עבור PAO1, PA14 ו-PAK היו 10 CFU/זחלים, שכן צפיפות גדולה יותר הביאה למוות של >-50% תוך 18 שעות (איור 4). 10 CFU היה המינון הנמוך ביותר שניתן היה להכין באופן אמין ומשכפל לזיהום. מינונים גבוהים יותר של LESB58 ו-IST27-M נדרשו כדי להשיג את קינטיקה ההישרדות הרצויה, המשקפת את הצמיחה האיטית יותר ואת יכולת הנשיאה הנמוכה יותר של מבודדים אלה בתנאי מבחנה (איור 4). המינון האופטימלי עבור שניהם היה 104 CFU/זחלים. LESB58 ו- IST27-M הם מבודדים קליניים מאנשים עם זיהומים כרוניים, ו- LESB58 הוכיח בעבר אלימות נמוכה יותר במודלים של מכרסמים מאשר PAO122.
בדיקת רעילות של טוברמיצין וקוליסטין בגלריה מלונלה
לפני הערכת היעילות של תרכובות אנטי-מיקרוביאליות חדשות, יש להעריך את רעילותן על ידי הזרקת מגוון רחב של מינונים רלוונטיים מבחינה קלינית. זה מאפשר להסיר תרכובות עם רעילות גבוהה מבדיקות בשלב מוקדם בצנרת הפרה-קלינית. טוברמיצין וקוליסטין הוערכו כנגד זחלי G. mellonella לא נגועים, כפי שהם ניתנים בדרך כלל לטיפול בזיהום P. aeruginosa אצל אנשים עם סיסטיק פיברוזיס (pwCF)23. השימוש הקליני בטוברמיצין נע בין 3 מ"ג/ק"ג ביום לחולים קשים ללא סיסטיק פיברוזיס ל-11 מ"ג/ק"ג כל 24 שעות לחולי סיסטיק פיברוזיס24,25. ערכים אלה שימשו כמדריך למינון בגלריה מלונלה, עם 1 מ"ג/ק"ג, 2.5 מ"ג/ק"ג, 5 מ"ג/ק"ג, 10 מ"ג/ק"ג, 25 מ"ג/ק"ג, 50 מ"ג/ק"ג, 100 מ"ג/ק"ג, 250 מ"ג/ק"ג טוברמיצין שנבחר לבדיקת רעילות. לא נצפה מוות בשום ריכוז. בהתחשב בחוסר הרעילות של טוברמיצין בריכוזים גבוהים, הוערכה רעילות קוליסטין מכיוון שהיא נקשרה בעבר עם נפרו או נוירו-רעילות ב-29.8% של pwCF, עם מינון העמסה של 2.9 (±1.5) מ"ג/ק"ג והמינון היומי הכולל של 4.1 (±1.1) מ"ג/ק"ג26. זה הפך אותו למועמד בעל ערך לבדיקת רעילות, אם כי ההשפעות הספציפיות לאיברים בבני אדם הציעו שהרעילות עשויה שלא להיות מתורגמת ל- G. mellonella. ואכן, כאשר ניתנו מינונים של 1 מ"ג/ק"ג, 2.5 מ"ג/ק"ג, 5 מ"ג/ק"ג, 10 מ"ג/ק"ג, 25 מ"ג/ק"ג, 50 מ"ג/ק"ג, 100 מ"ג/ק"ג ו-250 מ"ג/ק"ג קוליסטין, לא נצפה מוות של זחלים במשך 72 שעות. ככזה, קוליסטין ניתן לבסוף במסיסותו הגבוהה ביותר ב- H2O, ב- 2000 מ"ג / ק"ג. מוות של כל הזחלים נצפה בתוך 12 שעות, המאשר כי רעילות סמים ניתן להעריך G. mellonella, אבל זהירות צריכה להיות מיושמת כאשר מנסים לחזות קדימה רעילות אנושית.
אופטימיזציה של מינון הטיפול של tobramycin נגד זיהום P. aeruginosa PAO1
מגוון מינונים רלוונטיים מבחינה קלינית של טוברמיצין ניתנו לזחלים נגועים ב-P. aeruginosa כדי למטב את מינון הטיפול. עבור תרופות אנטי-מיקרוביאליות חדשניות, ניתן לבחור תחילה את המינון בהתבסס על שימוש קליני באנטיביוטיקה קיימת דומה או על סמך נתונים פרה-קליניים עבור החומר החדש, כגון ריכוזים מעכבים מינימליים של מרק. כדי להעריך את יעילות הטוברמיצין נגד P. aeruginosa PAO1, זחלי G. mellonella היו נגועים ב-10 CFU של P. aeruginosa PAO1, כפי שנקבע בעבר, והוזרקו להם 1 מ"ג/ק"ג, 2.5 מ"ג/ק"ג או 5 מ"ג/ק"ג טוברמיצין שעתיים לאחר ההדבקה. מינונים אלה נבחרו על סמך עבודה קודמת של G. mellonella עם טוברמיצין והם עולים בקנה אחד עם המינונים הקליניים הנוכחיים של טוברמיצין באנשים ללא סיסטיק פיברוזיס 24,27,28.
סף ההצלחה הראשוני היה עלייה של 50% בהישרדות G. mellonella בהשוואה לקבוצת הביקורת שלא טופלה. לטיפול PAO1 עם 1 מ"ג/ק"ג טוברמיצין הייתה השפעה מועטה בלבד על התמותה מ-G. mellonella , עם 90% מוות לאחר 28 שעות לאחר ההדבקה (איור 5). טיפול עם 2.5 מ"ג/ק"ג טוברמיצין עיכב את התמותה אך הניב 80% תמותה כללית עם 5 מ"ג/ק"ג טוברמיצין, וכתוצאה מכך הישרדות אופטימלית של 90%. המינון היעיל עבור PA14 היה 5 מ"ג / ק"ג, אבל עבור PAK היה 2.5 מ"ג / ק"ג. המינון היעיל עבור IST27-M היה גבוה יותר ועמד על 10 מ"ג/ק"ג, בעוד שריכוז טוברמיצין שנבדק לא הספיק כדי להציל את הזחלים מזיהום LESB58. מגמה זו תאמה עם ערכי ריכוז מעכב מינימלי (MIC) עבור טוברמיצין במרק מולר הינטון מותאם קטיון, שבו 1 מיקרוגרם/מ"ל היה מספיק כדי לעכב 90% מהצמיחה בכל הזנים למעט LESB58, שהיה לו מיקרופון של 8 מיקרוגרם/מ"ל. לפיכך, ניתן להשתמש בבדיקת MIC ראשונית כדי להצביע על עמידות יחסית בין זנים, אם כי אין להשתמש בה כדי לקבוע טווחי מינון ב- G. mellonella, אשר יש לייעל בנפרד.
אופטימיזציה של תזמון הטיפול בטוברמיצין נגד זיהום P. aeruginosa PAO1
יישום קליני של אנטיביוטיקה אינו מתרחש בדרך כלל בתוך שעות מההדבקה אלא ימים או שבועות לאחר מכן. בדיקת אנטי-מיקרוביאלים חדשים באופן זה אינה ניתנת להשגה ב- G. mellonella, שכן תמותה גבוהה נצפית תוך 24 שעות מההדבקה ב- P. aeruginosa PAO1. כדי להגדיל את הרלוונטיות של מודל הזיהום, מיקרוביאלים חדשים צריכים להינתן מאוחר ככל האפשר במהלך הזיהום. כדי לייעל את תזמוני הטיפול, 5 מ"ג/ק"ג של טוברמיצין ניתנו לזחלי G. mellonella נגועים ב-PAO1 לאחר 2 שעות, 4 שעות, 6 שעות, 9 שעות ו-12 שעות לאחר ההדבקה. הצלחת הניסוי הוגדרה כטיפול אנטיביוטי שהניב עלייה של >50% בהישרדות בהשוואה לזיהום ב-PAO1. הטיפול ב-9 שעות וב-12 שעות עיכב את התמותה, אף על פי שהוא לא הצליח לפתור את הזיהום (איור 6). טיפול בשעתיים, 4 שעות ו-6 שעות הניב הישרדות של מעל 50%.
אופטימיזציה של גודל קבוצת G. mellonella
גודל קבוצת הניסוי חושב בהתבסס על שונות שנצפתה בהישרדות G. mellonella לאחר זיהום עם 10 CFU / זחלים של P. aeruginosa PAO1. גודל הקבוצה יכול להשתנות בהתאם לאחוז השינוי הצפוי בין קבוצת הביקורת הלא מטופלת לבין קבוצת הטיפול בכל מחקר (טבלה 1). חישובים בעקבות מה שמתואר על ידי Charan et al.29. המשוואה בה נעשה שימוש מתוארת להלן.
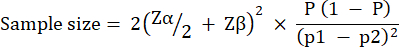
איפה:
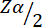 = 1.96 בשגיאה מסוג 1 של 5%.
= 1.96 בשגיאה מסוג 1 של 5%.
Zβ = 0.842 הוא הערך המספק 80% כוח סטטיסטי.
p1 = שיעור האירועים בקבוצת הבדיקה, המחושב כ- p2 + אחוז השינוי הצפוי
p2 = שיעור האירועים בקבוצת הביקורת (זיהום לא מטופל), מחושב על בסיס השתנות הישרדות P. aeruginosa PAO1 ב- 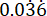 .
.
P = שכיחות מאוגמת, המוגדרת כ- (p1 + p2)/2.
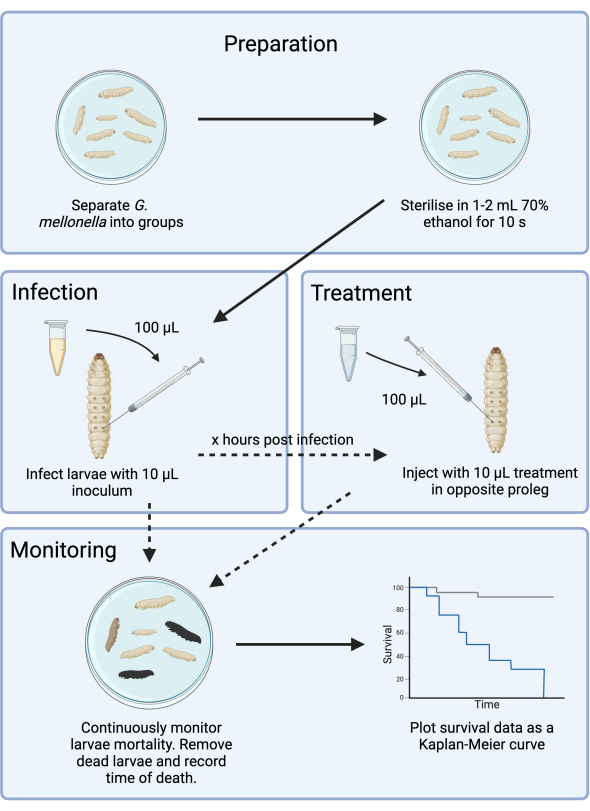
איור 1: סכמטי של מחקר זיהום G. mellonella . הפרוטוקול הכללי כולל הכנה של זחלי G. mellonella לפני ההדבקה, זיהום בחיסון 10 μL, טיפול אופציונלי במספר שעות לאחר ההדבקה, וניטור רציף. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
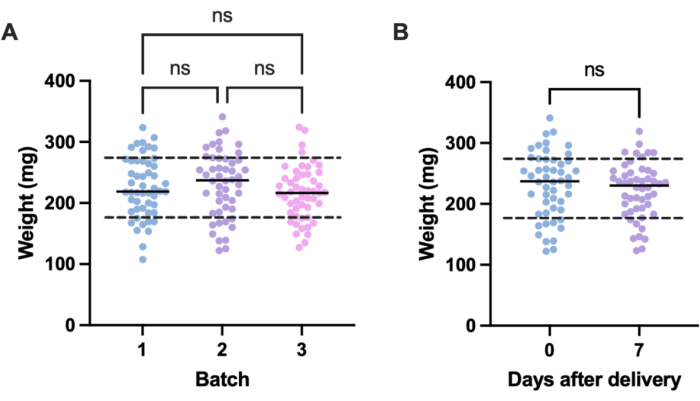
איור 2: שונות תלוית אצווה וזמן במשקל זחלי Galleria mellonella . (A) משקל של שלוש קבוצות של 50 זחלי גלריה מלונלה שנשקלו מיד עם הלידה. כל אצווה הוזמנה בזמנים שונים. לא היה הבדל משמעותי במשקל בין האצוות כפי שחושב על ידי ANOVA חד-כיווני (P > 0.05). (B) משקל של 50 זחלים שנשקלו עם קבלתם לעומת אותה אצווה שנשקלה שבוע לאחר מכן. לא היה הבדל משמעותי במשקל כפי שחושב על ידי מבחן t של סטודנט (P > 0.05). נ.ס.: לא משמעותי. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
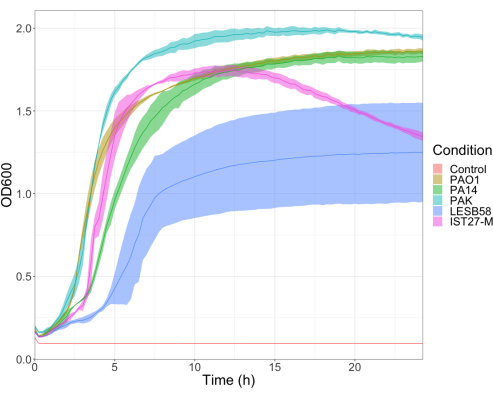
איור 3: עקומות גדילה של זני P. aeruginosa PAO1, PA14, PAK, LESB58 ו-IST27-M. כל זן גדל ב-LB מ-OD600 ראשוני של 0.08-0.13, ו-OD600 נמדד לאחר מכן כל 15 דקות במהלך 24 שעות צמיחה סטטית ב-37°C. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
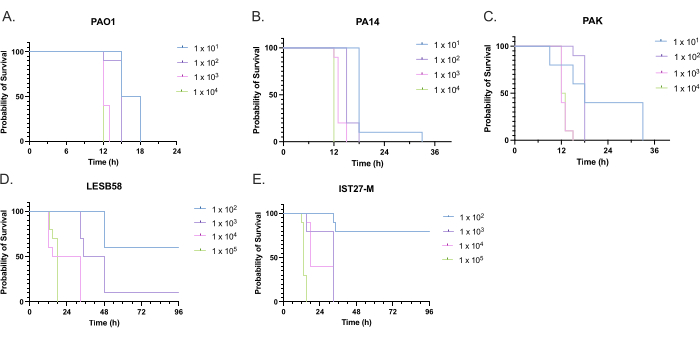
איור 4: אופטימיזציה של צפיפות החיסון של זני Pseudomonas aeruginosa להדבקה של זחלי Galleria mellonella . הישרדות זחלי גלריה מלונלה לאחר הזרקה עם צפיפויות שונות של יחידות יוצרות מושבה (CFU) לכל זחל. צפיפות החיסון שנבדקה הייתה 10, 10², 10³ או 104 CFU לכל זחל עבור (A) PAO1, (B) PA14 או (C) PAK, ו- 10², 10³, 104 או 105 CFU לכל זחל עבור (D) LESB58 ו- (E) IST27-M. בכל קבוצה נעשה שימוש בעשרה זחלים, שלכל קבוצה הוזרקו 10 מיקרוליטר של חיסון בפרולג האחורי הימני. ההישרדות נוטרה כל 30 דקות החל מ -16 שעות לאחר ההדבקה, וזמן המוות נרשם. כל הזנים הראו אלימות תלוית מינון כפי שנקבע על ידי מבחן לוג-דרג (מנטל-קוקס) למובהקות. P < 0.05 עבור כל השוואות המינון בתוך הזן למעט PAK 101 לעומת . PAK 102, PAK 103 לעומת PAK 104, LESB58 104 לעומת LESB58 105, ו- IST27-M 103 לעומת IST27-M 104, שלא היו משמעותיים. נתון זה מייצג שלושה שכפולים ביולוגיים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
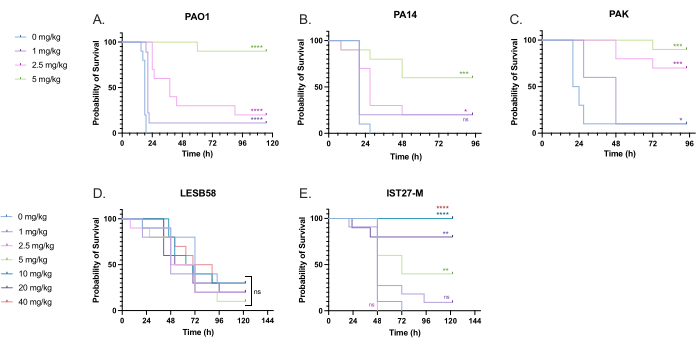
איור 5: הישרדות של זחלי גלריה מלונלה לאחר הזרקה עם זני פאנל P. aeruginosa וטיפול בטוברמיצין סולפט שעתיים לאחר ההדבקה. 10 זחלי G. mellonella לכל קבוצת ניסוי היו נגועים ב-10 CFU של (A) PAO1, (B) PA14, או (C) PAK או 103 CFU של (D) LESB58 או (E) IST27-M לזחלים ב-10 מיקרוליטר של PBS. זיהומים ניתנו לפלג השמאלי האחורי. שעתיים לאחר ההדבקה, PAO1, PA14 ו-PAK הוזרקו עם 10 מיקרוליטר של PBS כבקרה ללא טיפול, 1 מ"ג/ק"ג, 2.5 מ"ג/ק"ג או 5 מ"ג/ק"ג טוברמיצין, כאשר LESB58 ו-IST27-M טופלו ב-PBS של 10 מיקרוליטר, 1 מ"ג/ק"ג, 2.5 מ"ג/ק"ג, 5 מ"ג/ק"ג, 10 מ"ג/ק"ג, 20 מ"ג/ק"ג או 40 מ"ג/ק"ג טוברמיצין, כפי שמצוין באיור. טוברמיצין נמהל במים מזוקקים וניתן ברגל ימין אחורית. ההישרדות נוטרה באופן רציף, וזמן המוות נרשם. מבחן לוג-דרג (מנטל-קוקס) למובהקות לעומת בקרת PBS עבור כל זן. ns: לא משמעותי, *P < 0.05, **P < 0.005, ***P < 0.0005 ****P < 0.0001. נתון זה מייצג שלושה שכפולים ביולוגיים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
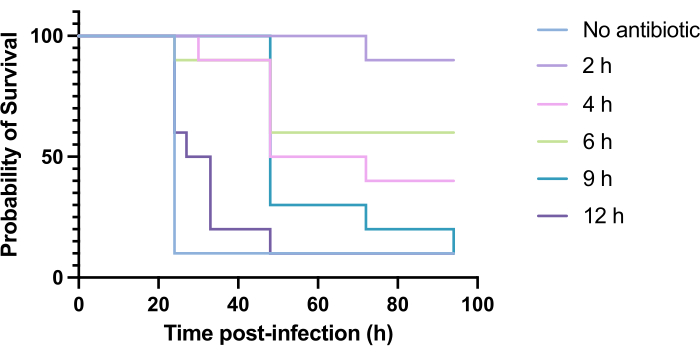
איור 6: הישרדות של זחלי Galleria mellonella לאחר זיהום ב-Pseudomonas aeruginosa PAO1 ולאחר מכן טיפול בטוברמיצין בנקודות זמן שונות לאחר ההדבקה. 10 זחלי G. mellonella לכל קבוצת ניסוי היו נגועים ב-10 CFU של PAO1 ב-10 μL של PBS, שהוזרקו לרגל הימנית האחורית. הזחלים הוזרקו לאחר מכן 2 שעות, 4 שעות, 6 שעות, 9 שעות או 12 שעות לאחר ההדבקה עם 5 מ"ג/ק"ג טוברמיצין סולפט ב-10 מיקרוליטר מים מזוקקים בפרולג השמאלי האחורי. ההישרדות נוטרה באופן רציף, וזמן המוות נרשם. מבחן לוג-דרג (מנטל-קוקס) למובהקות לעומת שליטה לא מטופלת. P < 0.0005, ****P < 0.0001. נתון זה מייצג שלושה שכפולים ביולוגיים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
| השינוי הצפוי בהישרדות (%) | גודל קבוצה |
| 30 | 26 |
| 40 | 18 |
| 50 | 13 |
| 60 | 10 |
| 70 | 8 |
| 80 | 6 |
| 90 | 5 |
| 100 | 4 |
טבלה 1: גודל הקבוצה עבור ניסויי הישרדות של G. mellonella שבהם זחלי G. mellonella נגועים ב-10 CFU/זחלים עם P. aeruginosa PAO1 ולאחר מכן נותנים להם סוכן.
Discussion
נטל העמידות האנטי-מיקרוביאלית (AMR) הולך וגדל. בשנת 2019, כ -4.95 מיליון מקרי מוות היו קשורים ל- AMR ברחבי העולם30. עד שנת 2050, התמותה הנגרמת על ידי AMR מוערכת להגיע ל -10 מיליון31. כדי להתמודד עם סיכון זה, יש לפתח ולבדוק תרופות אנטי-מיקרוביאליות חדשניות בצורה יעילה וחסכונית, דבר המחייב שימוש במודלים פרה-קליניים המנבאים במדויק יעילות אנטי-מיקרוביאלית. שיעור השחיקה הגבוה שנצפה במהלך התרגום לניסויים קליניים הוא גורם מגביל מרכזי. מחקר אחד תיאר 13 מועמדים אנטיביוטיים שנכשלו בניסויים קליניים, כאשר 11 לא הצליחו להתקדם לשלבII 32.
המחקר הנוכחי מספק מסגרת לאופטימיזציה של מחקרי סינון אנטי-מיקרוביאליים פרה-קליניים של G. mellonella ושיטה להערכת יעילות מיקרוביאלית. לזחלי G. mellonella יש תועלת רבה בהערכת רעילות תרופות, קביעת MIC ובדיקות אלימות, תוך תרומה להפחתת יונקים המשמשים בפיתוח פרה-קליני. לזחלי המלונלה תפוקה גבוהה יחסית, הם רלוונטיים ביולוגית ומתורגמים היטב למודלים מורכבים יותר של יונקים. בינתיים, בעוד עכברי מעבדה מסוג בר עולים בין 8 ל -30 ליש"ט כל אחד עם ~ 7 ליש"ט תחזוקה שבועית לעכבר, G. mellonella עולה ~ 2 ליש"ט עבור 50 זחלים. בדיקת 10 תרכובות במודל G. mellonella תעלה אפוא ~60 ליש"ט, בהשוואה ליותר מ-4000 ליש"ט לאותו מחקר בעכברים. יתר על כן, מחקרים קודמים השוו את הרעילות והיעילות של תרכובות חדשות וזיהו מתאם בין רעילות חריפה ב- G. mellonella לבין עכברים 8,19,33. לכן, מומלץ להשתמש במסך G. mellonella כדי לתעדף תרכובות שייבדקו עוד יותר בדגמי עכברים.
למרות התועלת הברורה של המודל, ישנם מספר שיקולים כדי להבטיח יישום מוצלח. היעדר זחלים סטריליים ברמה מחקרית מסבך את הכנתם לשימוש ניסיוני, שכן נדרש עיקור אתנול, או שהחוקרים נדרשים לתחזק מושבת G. mellonella משלהם, אשר תפחית את הסיכון לזיהום ותשפר את איכות הניסוי הכוללת 5,6. עיקור לא נכון יכול להניב תמותה ניכרת, וזה מאתגר לעקר לחלוטין את האורגניזם, שכן זמן חשיפה ארוך יותר לאתנול מוביל למוות. שיטות חלופיות של עיקור כוללות ספוג של כל זחל עם 70% אתנול לפני ההדבקה, אשר יפחית את התמותה במהלך העיקור, אבל היא שיטה אינטנסיבית יותר עבודה. ניתן להשתמש גם בחומרי חיטוי אחרים, אם כי לא הוערכו חלופות במחקר זה, שכן עיקור אתנול הניב <10% מוות, לאחר אופטימיזציה. יתר על כן, לעתים קרובות לא ברור אם ספקים מטפלים ב- G. mellonella שלהם באנטיביוטיקה, מכיוון שספקים עשויים להשיג את הזחלים שלהם מספקים אחרים במקום לתחזק מושבות בעצמם.
הביולוגיה של G. mellonella שונה במידה ניכרת מיונקים, מה שמטיל מגבלות על התועלת שלהם. מערכת החיסון שלהם חסרה חסינות נרכשת, אם כי קיימים היבטים מסיסים ותאיים מרכזיים של מערכת החיסון המולדת. המוציטים הם ההגנה החיסונית המולדת העיקרית של G. mellonella ומציגים תכונות דמויות פגוציטים. תוארו תת-קבוצות שונות של תאים אלה, כולל גרנולוציטים ופלסמטוציטים, בין היתר34. G. mellonella גם לא יכול לשחזר אתרי זיהום רלוונטיים, כגון אלה של זיהומים בדרכי הנשימה או שלפוחית השתן. עם זאת, בצנרת פרה-קלינית, G. mellonella ישמש כמסך מקדים למודלים של מורין, ויבטיח שרק התרכובות המבטיחות ביותר יתקדמו למערכת היונקים המורכבת הדומה יותר לסביבות זיהום אנושיות. לבסוף, המודל יפיק תועלת מאפיון גנומי נוסף של G. mellonella כדי לקבוע את התאמתו להערכת שינויים בסמנים ביולוגיים רלוונטיים מבחינה קלינית. בפרט, זה מחייב לשפר את ההבנה שלנו של חסינות G. mellonella .
בסך הכל, מודל זיהום המלונלה הוא כלי רב ערך להערכה פרה-קלינית של תרכובות אנטי-מיקרוביאליות חדשות לפני הערכתן במודלים של יונקים. בעוד שהשימוש בהם מסובך בגלל היעדר סטנדרטיזציה של אספקה, היישום שלהם הוא בעל תפוקה גבוהה, פשוט, וניתן ליישם אותו באופן נרחב בנוף הפיתוח האנטי-מיקרוביאלי. בעתיד, שילוב מודל זה בצנרת פרה-קלינית מתוקננת עשוי להאיץ את הפיתוח של תרכובות אנטי-מיקרוביאליות חדשות כדי להגדיל את שיעור המועמדים המתקדמים מהערכה פרה-קלינית לניסויים קליניים.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
TB, AK, JF ו-DN קיבלו תמיכה במענקים עבור מרכז המחקר האסטרטגי (SRC) "מסגרת פרה-קלינית מבוססת ראיות לפיתוח טיפולים אנטי-מיקרוביאליים בסיסטיק פיברוזיס" (PIPE-CF; מס' פרויקט SRC 022) מקרן סיסטיק פיברוזיס הבריטית וקרן סיסטיק פיברוזיס האמריקאית. LD ו-JF מכירים במימון של Kidney Research North West (פרויקט מס' 49/19).
Materials
| Name | Company | Catalog Number | Comments |
| 22s gauge, Small Hub RN Needle, 2 in, point style 2 | Hamilton | 7758-03 | Replacement for the Hamilton syringe. |
| Bacterial infection stocks | Bacterial stocks of a known density (CFU/mL) frozen during mid-exponential phase of growth. | ||
| Ethanol | Fisher Scientific | 10610813 | Other manufacturers may be used. |
| G. mellonella larvae | Livefoods | 5.06045E+12 | For this supplier, orders are marked as “New stock for lab use”. As of April 2024, new stock is delivered to the supplier on Mondays. Orders should be placed then, for delivery on Wednesdays. |
| Microliter syringe | Hamilton | 80630 | The 80630 syringe has a 100 µL capacity. Other volumes exist, such as the 80430, 80530 or 80730. |
| Petri dish | Fisher Scientific | 12674785 | Other manufacturers may be used. |
References
- Menard, G., Rouillon, A., Cattoir, V., Donnio, P. Y. Galleria mellonella as a suitable model of bacterial infection: Past, present and future. Front Cell Infect Microbiol. 11, 782733 (2021).
- Piatek, M., Sheehan, G., Kavanagh, K. Galleria mellonella: The versatile host for drug discovery, in vivo toxicity testing and characterizing host-pathogen interactions. Antibiotics. 10 (12), 1545 (2021).
- Miethke, M., et al. Towards the sustainable discovery and development of new antibiotics. Nat Rev Chem. 5 (10), 726-749 (2021).
- Seyhan, A. A. Lost in translation: The valley of death across preclinical and clinical divide - identification of problems and overcoming obstacles. Transl Med Commun. 4 (1), (2019).
- Firacative, C., et al. Rearing and maintenance of Galleria mellonella and its application to study fungal virulence. J Fungus. 6 (3), 130 (2020).
- Pereira, M. F., Rossi, C. C. Overview of rearing and testing conditions and a guide for optimizing Galleria mellonella breeding and use in the laboratory for scientific purposes. APMIS. 128 (12), 607-620 (2020).
- Jorjão, A. L., et al. From moths to caterpillars: Ideal conditions for Galleria mellonella rearing for in vivo microbiological studies. Virulence. 9 (1), 383-389 (2018).
- Tsai, C. J. -. Y., Loh, J. M. S., Proft, T. Galleria mellonella infection models for the study of bacterial diseases and for antimicrobial drug testing. Virulence. 7 (3), 214-229 (2016).
- Gallorini, M., et al. Immunophenotyping of hemocytes from infected Galleria mellonella larvae as an innovative tool for immune profiling, infection studies and drug screening. Sci Rep. 14, 759 (2024).
- Smith, F. Q., Casadevall, A. Fungal immunity and pathogenesis in mammals versus the invertebrate model organism Galleria mellonella. Pathog Dis. 79 (3), ftab013 (2021).
- Sugumaran, M. Comparative biochemistry of eumelanogenesis and the protective roles of phenoloxidase and melanin in insects. Pigment Cell Res. 15 (1), 2-9 (2002).
- Sheehan, G., Garvey, A., Croke, M., Kavanagh, K. Innate humoral immune defences in mammals and insects: The same, with differences. Virulence. 9, 1625-1639 (2018).
- Wright, C. L., Kavanagh, O. Galleria mellonella as a novel in vivo model to screen natural product-derived modulators of innate immunity. Appl Sci. 12 (13), 6587 (2022).
- Newton, S. M., et al. Use of the invertebrate Galleria mellonella as an infection model to study the Mycobacterium tuberculosis complex. J Vis Exp. (148), e59703 (2019).
- Frankel, G., Collins, J. W., Schroeder, G. N., Harding, C. R. Use of Galleria mellonella as a model organism to study Legionella pneumophila infection. J Vis Exp. (81), e50964 (2013).
- Romera, D., et al. The Galleria mellonella infection model as a system to investigate the virulence of Candida auris strains. Pathog Dis. 78 (9), ftaa067 (2020).
- Kwadha, C. A., Ong'amo, G. O., Ndegwa, P. N., Raina, S. K., Fombong, A. T. The biology and control of the greater wax moth, Galleria mellonella. Insects. 8 (2), 61 (2017).
- Miles, A. A., Misra, S. S., Irwin, J. O. The estimation of the bactericidal power of the blood. J Hyg. 38, 732-749 (1938).
- Ignasiak, K., Maxwell, A. Galleria mellonella (greater wax moth) larvae as a model for antibiotic susceptibility testing and acute toxicity trials. BMC Res Notes. 10 (1), 428 (2017).
- Hesketh-Best, P. J., Mouritzen, M. V., Shandley-Edwards, K., Billington, R. A., Upton, M. Galleria mellonella larvae exhibit a weight-dependent lethal median dose when infected with methicillin-resistant Staphylococcus aureus. Pathog Dis. 79 (2), ftab003 (2021).
- Mahenthiralingam, E., Weiser, R., Floto, R. A., Davies, J. C., Fothergill, J. L. Selection of relevant bacterial strains for novel therapeutic testing: a Guidance document for priority cystic fibrosis lung pathogens. Curr Clin MicrobiolRep. 9 (4), 33-45 (2022).
- Carter, M. E. K., et al. A subtype of a Pseudomonas aeruginosa cystic fibrosis epidemic strain exhibits enhanced virulence in a murine model of acute respiratory infection. J Infect Dis. 202 (6), 935-942 (2010).
- Herrmann, G., et al. Colistin-tobramycin combinations are superior to monotherapy concerning the killing of biofilm Pseudomonas aeruginosa. J Infect Dis. 202 (10), 1585-1592 (2010).
- Hennig, S., Standing, J. F., Staatz, C. E., Thomson, A. H. Population pharmacokinetics of tobramycin in patients with and without cystic fibrosis. Clin Pharmacokinet. 52 (4), 289-301 (2013).
- Reyhanoglu, G., Reddivari, A. K. R. . Tobramycin. , (2023).
- Crass, R. L., Rutter, W. C., Burgess, D. R., Martin, C. A., Burgess, D. S. Nephrotoxicity in patients with or without cystic fibrosis treated with polymyxin b compared to colistin. Antimicrob Agents Chemother. 61 (4), e02329-e02416 (2017).
- Deacon, J., et al. Antimicrobial efficacy of tobramycin polymeric nanoparticles for Pseudomonas aeruginosa infections in cystic fibrosis: Formulation, characterization and functionalization with dornase alfa (DNase). J Control Release. 198, 55-61 (2015).
- Tamma, P. D., et al. Infectious Diseases Society of America 2022 guidance on the treatment of extended-spectrum β-lactamase producing enterobacterales (ESBL-E), carbapenem-resistant enterobacterales (CRE), and Pseudomonas aeruginosa with difficult-to-treat resistance (DTR-P. aeruginosa). Clin Infect Dis. 75 (2), 187-212 (2022).
- Charan, J., Kantharia, N. D. How to calculate sample size in animal studies. J PharmacolPharmacother. 4 (4), 303-306 (2022).
- Murray, C. J. L., et al. Global burden of bacterial antimicrobial resistance in 2019: A systematic analysis. Lancet. 399 (10325), 629-655 (2022).
- de Kraker, M. E. A., Stewardson, A. J., Harbarth, S. Will 10 million people die a year due to antimicrobial resistance by 2050. PLoS Med. 13 (11), e1002184 (2016).
- Prasad, N. K., Seiple, I. B., Cirz, R. T., Rosenberg, O. S. Leaks in the pipeline: A failure analysis of gram-negative antibiotic development from 2010 to 2020. Antimicrob Agents Chemother. 66 (5), e0005422 (2022).
- Wang, S., et al. A novel Galleria mellonella experimental model for zoonotic pathogen Brucella. Virulence. 14 (1), 2268496 (2023).
- Senior, N. J., Titball, R. W. Isolation and primary culture of Galleria mellonella hemocytes for infection studies. F1000Res. 9, 1932 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved