A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הגדרת מיון מוצלח לבידוד שלפוחית חוץ-תאית
In This Article
Summary
פרוטוקול זה מספק תיאור מפורט של מיון שלפוחיות חוץ-תאיות (EVs) המשתחררות על ידי תאי סטרומה מזנכימליים. בפרט, הוא מתמקד בהגדרת המכשיר ובאופטימיזציה של תנאי המיון. המטרה היא למיין שלפוחיות חוץ-תאיות תוך שמירה על המאפיינים שלהן.
Abstract
שלפוחיות חוץ-תאיות (EVs) המשתחררות על ידי תאי סטרומה מזנכימליים (MSCs) מכילות קבוצה של מיקרו-רנ"א עם תפקידים רגנרטיביים ואנטי דלקתיים. לכן, MSC-EVs מטוהרים צפויים להיות אופציה טיפולית מהדור הבא למגוון רחב של מחלות. בפרוטוקול זה, אנו מדווחים על האסטרטגיה למיון מוצלח של EVs מהסופרנטנט של MSCs שמקורם בשומן (ASCs), המשמש לעתים קרובות ביישומי רפואה רגנרטיבית אורתופדית.
ראשית, תיארנו את הכנת הדגימה, תוך התמקדות בבידוד EV ושלבי תיוג עם קרבוקסיפלואורסצין סוקסינימידיל אסטר (CFSE) לזיהוי פלואורסצנטי; בהמשך פירטנו את תהליך המיון, המהווה את החלק העיקרי בפרוטוקול.
בנוסף לכללים שהוגדרו על ידי הנחיות MISEV 2023 ו-MIFlowCyt EV, יישמנו תנאי ניסוי ספציפיים הנוגעים לגודל הזרבובית, התדירות ולחץ הנדן. פרמטרים מורפולוגיים נקבעים באמצעות חרוזים בקטרים שנבחרו כדי לכסות את הטווח התיאורטי של גודל EV. לאחר מיון ASC-EVs, ביצענו בדיקת טוהר של השבר הממוין על ידי ניתוחו מחדש עם הממיין ואימות התפלגות גודל ה-EV בטכניקת ניתוח מעקב אחר ננו-חלקיקים.
בשל החשיבות הגוברת של רכבים חשמליים, אוכלוסייה טהורה לחקור ולאפיין הופכת להיות קריטית. כאן, אנו מדגימים אסטרטגיה מנצחת להגדרת מיון להשגת מטרה זו.
Introduction
שלפוחיות חוץ-תאיות (EVs) הן קבוצה הטרוגנית של שלפוחיות מובנות ממברנה המשתחררות כמעט על ידי כל התאים, תחומות על ידי שכבת שומנים, שאינן מסוגלות להשתכפל בעצמן1. ניתן למצוא אותם במספר נוזלים ביולוגיים כגון פלזמת דם, סרום, רוק, חלב אם, שתן, נוזל שטיפת סימפונות, מי שפיר, נוזל מוח שדרה ומיימת ממאירה2. אחד התפקידים העיקריים של EVs הוא להעביר מולקולות שונות, כולל חומצות גרעין, חלבונים, שומנים ופחמימות, בין תא תורם לתא מקבל. זה יכול להתרחש באמצעות מנגנונים שונים, כגון היתוך ישיר של הממברנה, אינטראקציה בין קולטן-ליגנד, אנדוציטוזיס ופגוציטוזיס 3,4. מסיבה זו, הוכח שהם ממלאים תפקיד חשוב בהרבה תהליכים פיזיולוגיים ופתולוגיים, והם מראים הבטחה ניכרת כסמנים ביולוגיים חדשים של מחלות, ככלי להעברת תרופות וכסוכנים טיפוליים 5,6.
תאי סטרומה מזנכימליים (MSCs) הם תאים רב-פוטנטיים שניתן לבודד מרקמות רבות, כולל רקמת שומן, מוך שיניים, דם טבורי, שליה, מי שפיר, ג'לי וורטון, ואפילו המוח, הריאות, בלוטת התימוס, הלבלב, הטחול, הכבד והכליות. בשנים האחרונות הם משכו עניין רב ברפואה רגנרטיבית7. ניתן לקצור תאי גזע מזנכימליים שמקורם בשומן (ASCs) מרקמת השומן בהליך פחות פולשני בהשוואה למקורות אחרים כמו מח עצם, וכתוצאה מכך סיכונים נמוכים יותר לסיבוכים חמורים והימנעות מבעיות אתיות8.
בנוסף, רקמת השומן מכילה ריכוז גבוה משמעותית של MSCs מאשר מח עצם (1% לעומת >0.01%) ומקורות אחרים כגון הדרמיס, מוך השן, חבל הטבור והשליה. MSCs חיוניים בהתחדשות של רקמות ותאים פגועים בשל יכולת ההתמיינות שלהם והפרשת רפרטואר רחב של גורמי גדילה, כימוקינים וציטוקינים; היתרונות הטיפוליים הללו מיוחסים ליכולת ההתמיינות שלהם, אך גם לעובדה שהם מפרישים רפרטואר רחב של גורמי גדילה, כימוקינים וציטוקינים. דוגמה בולטת ניתנת על ידי הפוטנציאל הטיפולי של MSCs למצבים אורטופדיים, כאשר למונח "מחלות שרירים ושלד" יש את המספר הגבוה יותר של מחקרים קליניים רשומים תחת clinicaltrials.gov (גישה ל-13במאי 2024).
יתר על כן, MSCs יכולים גם להפריש EVs הלוקחים חלק בהתחדשות רקמות באמצעות העברת מידע לתאים או רקמות פגועים ולהפעיל פעילות ביולוגית הדומה לתאי האם 9,10. מסיבה זו, MSC-EVs עשויים להוות תחליף רב ערך לטיפול תאי להשגת גישה נטולת תאים11, עם שני מחקרים קליניים הכוללים MSC-EVs למצבים אורטופדיים (NCT05261360 ו-NCT04998058). עם זאת, עדיין קיימים מספר אתגרים עבור היישומים הקליניים של רכבים חשמליים. לדוגמה, ישנם כמה חששות לגבי טכניקות בידוד EV: רובן אינן מבטיחות טוהר או שלמות השלפוחית. יתר על כן, חלק מטכניקות הבידוד הן מורכבות, גוזלות זמן ובעלות יכולת חזרה נמוכה, מה שהופך אותן ללא מתאימות לשימוש קליני12.
מיון תאים, לעומת זאת, הוא שיטה נפוצה המאפשרת בידוד של תאים בודדים מתרחפי תאים הטרוגניים על ידי שימוש בסמנים פלואורסצנטיים ספציפיים13. ניתן להשתמש בו עבור יישומים רבים ולהתאים אותו לסוגי דוגמאות שונים. עם זאת, למרות שמיון תאים הוא טכנולוגיה מבוססת ונמצאת בשימוש נרחב, מיון EV עדיין מאתגר מאוד מכיוון שרוב הרכבים החשמליים נמצאים מתחת לסף הזיהוי המינימלי אפילו עבור ציטומטרי הזרימה הרגישים ביותר. ישנן כמה תכונות שהופכות את הממיין למתאים יותר למטרה זו. ראשית, שימוש במערכת סילון באוויר שבה הזרם התלויה את החלקיקים נחקר על ידי לייזרים באוויר, ולא בתוך תא זרימה; מערכת זו משמרת את הדגימה על ידי הפחתת הלחץ אליו היא נתונה. נקודה חשובה שנייה היא נוכחותו של פס "ערפול" בין הזרם לעדשת האיסוף המפחית את רעש הרקע האופטי של המכשיר. למרות שהוא נמוך, רעש הרקע אינו מתבטל לחלוטין ומהווה התייחסות המספקת חלון חלקי לאירועים הנופלים מתחת לסף: חשוב מאוד לניתוח אירועים הקרובים ל"גבול הגילוי "של מכשיר14. לבסוף, הממיין כולל פיזור קדימה דו-נתיבי (FSC) עם שתי מסכות שונות המאפשרות הבחנה משופרת בין חלקיקים קטנים וגדולים במדגם.
על סמך זה, פיתחנו פרוטוקול שמטרתו להפריד בין קרבוקסיפלואורסצאין סוקסינימידיל אסטר (CFSE) המסומן MSC-EVs באמצעות ממיין תאים בעל רגישות גבוהה. כדי למזער את המניפולציה של רכבים חשמליים ולשמור על שלמותם וכמותם, נמנענו משלבי אולטרה-צנטריפוגה במהלך הכנת הדגימה. יתר על כן, תנאי המיון הותאמו כדי למזער את הלחץ על השלפוחית, כולל אופטימיזציה נוספת של המכשיר שלנו על ידי הפחתת לחץ המיון הקשור לגודל הזרבובית (זרבובית של 70 מיקרומטר ללחץ של 35 psi).
Access restricted. Please log in or start a trial to view this content.
Protocol
הפרוטוקול כאן מורכב מארבעה חלקים: (1) הכנת דגימה, (2) אפיון ASC-EVs, (3) מיון ASC-EVs ו-(4) ניתוח לאחר מיון. סכימה המייצגת את זרימת העבודה מוצגת באיור 1.
איור 1: תרשים זרימת פרוטוקול. תרשים הזרימה מציג את השלבים המעורבים בפרוטוקול. (1) הכנת דגימה, (2) אפיון שלפוחיות לפני מיון, (3) מיון, ו-(4) ניתוח שלפוחיות לאחר מיון. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
1. הכנת מדגם
- אוסף סופרנטנטים מועשר בשלפוחיות חוץ-תאיות (EV)
- הפשרה או איסוף של MSCs שומן (ASCs) שתרבית את המעבר לפני איסוף EVs (בדרך כלל מעבר 1 עד 5) וזרעים לכל ASC מבודדים כמות זהה של תאים (למשל, מיליון תאים לכל 175 ס"מ2 של משטח הבקבוק מביאים למפגש של כ-60%-70%).
- גדל ASCs במדיום התרבית המתאים (DMEM-F12 לפרוטוקול זה) בתוספת סרום בקר עוברי נטול EV (FBS) או ליזאט טסיות דם אנושי (hPL), לפי הפרוטוקול המבוקש, למשך 48-72 שעות.
- כדי להשיג FBS או hPL ללא EV, אולטרה-צנטריפוגה ב-120,000 x גרם במהלך הלילה ב-4 מעלות צלזיוס והשתמש ב-supernatant.
הערה: מנקודה זו ואילך, הכוח הצנטריפוגלי המצוין נועד תמיד כממוצע עבור המכשיר, הרוטור והצינורות המשומשים. זכור כי לרוטורים או צינורות שונים עשוי להיות כוח g משתנה לכל סל"ד וגורם k. לדרך קלה להשוות רוטורים ולהתאים את כוח ה-g והמהירות, עיין באחת מטבלאות ההמרה הזמינות https://www.beckman.it/centrifuges/rotors/calculator.
- כדי להשיג FBS או hPL ללא EV, אולטרה-צנטריפוגה ב-120,000 x גרם במהלך הלילה ב-4 מעלות צלזיוס והשתמש ב-supernatant.
- במפגש תאים של 90%, נתק וספור ASCs והשהה בנפח מתאים של מדיום נטול סרום, באופן אידיאלי 1 מ"ל לכל 1 x 106 ASCs. זרעי ASCs בתרחיף בצלחות של 24 בארות עם 1 מ"ל לבאר. ללא סרום, התאים יישארו בהשעיה ויצרו ספרואיד. לאחר 96 שעות, אספו את הסופרנטנט.
- הסר תאים צפים ופסולת על ידי צנטריפוגה טורית ב-4 מעלות צלזיוס: 400 x גרם למשך 10 דקות, 1,000 x גרם למשך 10 דקות, 2,000 x גרם למשך 10 דקות ופעמיים 4,000 x גרם למשך 10 דקות.
- סננו את ה-supernatant דרך מסנן של 0.22 מיקרומטר כדי להסיר חלקיקים שנותרו גדולים מ-220 ננומטר.
הערה: השתמש מיד עבור יישומים במורד הזרם, או אחסן למשך לילה אחד לכל היותר ב-4 מעלות צלזיוס או הקפיא ב-80 מעלות צלזיוס אם לא בוצעו שלבים נוספים תוך 24 שעות.
- רכבים חשמליים מכתימים למיון
- הכן תמיסה של 5 מ"מ של 5(6)-Carboxyfluorescein diacetate N-succinimidyl ester (CFSE). השתמש בו שהוכן טרי או הקפיא בטמפרטורה של -20 מעלות צלזיוס מוגן מאור.
- המשך ישירות משלב 1.1.1-1.1.5 (תוך 24 שעות) או הפשיר -80 מעלות צלזיוס מאוחסנים ב-EVs המכילים סופרנטנטים ב-4 מעלות צלזיוס.
- לפני הצביעה, יש לחמם סופרנטנטים ב-37 מעלות צלזיוס ולהוסיף CFSE לריכוז סופי של 10 מיקרומטר (דילול פי 500). יש לדגור למשך שעה בטמפרטורה של 37 מעלות צלזיוס בחושך.
- במהלך הדגירה, הוסף 2 מ"ל PBS לרכז צנטריפוגלי (קרום תאית מחודש, MWCO 100 kDa), מכסה וצנטריפוגה ב-4,000 x גרם למשך 10 דקות ברוטור דלי מתנדנד. הסר את ה-PBS הלא מסונן מתחתית מכשיר המסנן ושאף את המסנן מצינור האיסוף.
הערה: פרוטוקול האולטרה-סינון הצנטריפוגלי המתואר מבוסס על עיבוד של עד 15 מ"ל מהדגימה (נפח מקסימלי). - הוסף עד 15 מ"ל דגימה לרכז הצנטריפוגלי וכסה את המכשיר. צנטריפוגה ב-4,000 x גרם למשך עד 30 דקות.
הערה: זה יניב דגימה סופית של 500 מיקרוליטר בממוצע. עם זאת, בהתאם לגורמים כמו אופי הדגימה וקצב הזרימה, זמן הצנטריפוגה הנדרש להשגת הריכוז הרצוי יכול להשתנות. - הסר את המכשיר מהצנטריפוגה ורוקן את צינור האיסוף. הוסף 14 מ"ל PBS למכשיר המסנן. צנטריפוגה ב-4,000 x גרם למשך עד 30 דקות.
- חזור על שלב 1.2.6.
- שחזר דגימת EVs מרוכזת מוכתמת CFSE מהתקן המסנן, כ-500 מיקרוליטר, ואחסן 100 מיקרוליטר ב-4 מעלות צלזיוס בחושך תוך המשך מיון הדגימה הנותרת.
2. אפיון ASC-EVs
- ניתוח כתמים מערביים של סמני EV
- ASCs גלולה (1 x 106) ב-376 x גרם ב-RT למשך 5 דקות והשעיה במאגר ליזה מתאים בתוספת מעכבי פרוטאז. בצע כימות חלבון עם מבחן הבחירה.
הערה: כפי שחווינו במחקר זה, תוצאות הכימות הטובות ביותר מתקבלות בטכניקת בדיקת חומצה ביצינצ'ונינית. - כימות סופרנטנט מרוכז ASCs שווה ערך ל-1 x 106 ASCs בטכניקת ברדפורד או EVs גלולה המתאימים ל-1 x 106 ASCs ב-100,000 x g ב-4 מעלות צלזיוס למשך שעה אחת והשהה במאגר ליזה מתאים בתוספת מעכבי פרוטאז. בצע כימות חלבון עם מבחן הבחירה.
הערה: כפי שחוו במחקר זה, תוצאות הכימות הטובות ביותר עבור כדורי EV מתקבלות בטכניקת בדיקת חומצה ביצינצ'ונינית. - אם משתמשים בסופרנטנט מרוכז במקום EVs מטוהרים, יש ליז את הדגימות ב-5% 2-Mercaptoethanol ו-2x Laemmli buffer.
הערה: כפי שחוו במחקר זה, גם סופרנטנטים מרוכזים וגם EVs מטוהרים נותנים תוצאות דומות עבור סמני EV חיוביים ושליליים. - טען והפרד דגימות (1-10 מיקרוגרם) בג'ל פוליאקרילאמיד 10% ב-110 וולט למשך 90 דקות.
- מעבירים לקרום ניטרוצלולוזה ב -250 mA למשך 120 דקות.
- קרום כתמים עם Ponceau S כדי להמחיש דגימות והעברת סולם. יש להסיר את Ponceau S עם PBS תחת ניעור עדין.
- חסום ממברנות עם 5% חלב מיובש ללא שומן ו-0.1% טווין ב-PBS למשך 60 דקות.
- בדיקה של ממברנות עם נוגדנים מתאימים בדילול עבודה, כולל חיובי (למשל, בעבודה זו CD9, CD81, TSG101 ו-Flotillin) ושלילי (למשל, בעבודה זו Calnexin), ב-4 מעלות צלזיוס במהלך הלילה.
- יש לשטוף עם 0.1% טווין ב-PBS ולדגור עם נוגדנים משניים מתאימים מצומדים לפרוקסידאז למשך 45 דקות ב-RT לפני שהלהקה מתגלה עם מערכת ECL לבחירה. רכוש תמונות עם מערכת הדמיה זמינה (איור 2A).
- ASCs גלולה (1 x 106) ב-376 x גרם ב-RT למשך 5 דקות והשעיה במאגר ליזה מתאים בתוספת מעכבי פרוטאז. בצע כימות חלבון עם מבחן הבחירה.
- ניתוח ציטומטריית זרימה של סמני EV: צביעת פני השטח
- לפני השימוש, צנטריפוגה כל נוגדן חד שבטי (mAb) ב-15,000-17,000 x g למשך 30 דקות ב-4 מעלות צלזיוס כדי לחסל אגרגטים, שעלולים לגרום לאותות חיוביים כוזבים. יתר על כן, סנן mAbs לצינורות סינון צנטריפוגליים נפרדים של 0.22 מיקרומטר ב-1,000 x g ב-4 מעלות צלזיוס עד שכל התערובת עברה דרך המסנן ולא נשאר נוזל נוגדנים על פני המסנן. יש לאחסן mAbs בטמפרטורה של 4 מעלות צלזיוס.
- הכן דילול של 1:10 של EVs מוכתמים CFSE (ראה שלב 1.2.1-1.2.8) ב-PBS מסוננים של 0.22 מיקרומטר.
- דגירה של 100 מיקרוליטר של דגימות, או PBS מסוננים של 0.22 מיקרומטר, עם או בלי mAbs ספציפיים ל-EV (anti-CD9/63/81) או mAbs ספציפיים ל-MSC (anti-CD44), שעברו טיטרציה בעבר. בצע דגירה בטמפרטורה של 4 מעלות צלזיוס בחושך למשך 30 דקות.
הערה: פרוטוקול זה, שפותח כדי לזהות EVs טיפוסיים וסמני שושלת MSC, עשוי להיות מורחב לכל שאר שושלת התאים או סמני פני השטח הספציפיים לתת-סוג EVs. אל תשתמש בפלואורוכרומים הנופלים בתעלת הפלואורסצאין איזותיוציאנט (FITC) כדי למנוע חפיפה עם צביעת CFSE של EVs. בצע צביעה בודדת על ידי שימוש בכל mAb מצומד עם פלואורוכרום אחד, למשל, אלופיקוציאנין (APC). צביעה צבעונית אפשרית, אך יש לכלול בקרות כדי לטפל בבעיות פוטנציאליות של הפרעה סטרית של נוגדנים. יש צורך לבדוק את הנוגדנים הבודדים לבד או בתוך תערובת ולוודא שהאות ניתן להשוואה. בנוסף, יש לכלול FMO בין הבקרות. - הגדר כיול פיזור כמתואר בשלב 3.2.
- צור תרשים נקודות של סולם היומן של פיזור הצד (SSC) לעומת סולם היומן של FITC והפעל שפופרת של PBS או EVs לא מוכתמים בסינון של 0.22 מיקרומטר; הגדר את הסף בערוץ FITC והתאם אותו לערכים הגבוהים ביותר שאינם כוללים את רוב רעשי הרקע. צייר אזור המזהה את האירועים החיוביים של CFSE.
- צור תרשים היסטוגרמה של APC מגודר באזור אירועים חיוביים של CFSE והפעל שפופרת של PBS או EVs מסוננים של 0.22 מיקרומטר.
הערה: לרווח APC, השתמש ברווח שנקבע עם ה-QC של המכשיר, אם כי מומלץ לבצע רווח ספציפי על מנת לייעל את ביצועי המכשיר. - הוסף 200 μL של PBS מסונן-0.22 μm לדגימות מוכתמות ורכוש. השתמש בקצב זרימה נמוך (10 מיקרוליטר לדקה) לרכישה והקלטה. במידת האפשר, רשום לפחות 5,000 אירועים בשער החיובי של FITC.
- השתמש בבקרת PBS המוכתמת ב-mAb כדי לזהות אותות לא ספציפיים אפשריים של ה-mAbs. קרא את כל צינורות הדגימה באותו קצב זרימה כדי להבטיח עקביות בין ריצות.
- כדי למנוע זיהום צולב של הדגימה, הפעילו חומר ניקוי למשך 10 שניות בין כל שפופרת מנותחת, ואחריה 10 שניות עם מים נטולי יונים (DI) (איור 2B).
הערה: כדי למנוע חוסר יציבות של מכשיר נוזלי, רכוש את הדגימה למשך 10 שניות ולאחר מכן התחל להקליט.
- ניתוח ציטומטריית זרימה של סמן EV: צביעה תוך תאית
הערה: לצביעה תוך תאית, השתמש בערכה ספציפית המכילה ריאגנטים לקיבוע וחדירה. Anti-Caveolin mAb מצומד עם Alexa 488. צביעת ה-IC בוצעה בהיעדר CFSE.- לפני השימוש, צנטריפוגה את ה-mAb כפי שתואר קודם לכן (שלב 2.2.1).
- עבור צביעה תוך-תאית, עקוב אחר הוראות היצרן (איור 2C).
- אפיון ריכוז וגודל EV על ידי ניתוח מעקב אחר ננו-חלקיקים (NTA)
- בצע דילולים מתאימים של הדגימות כדי להשיג 20-120 אירועים במסגרת הצפייה של תצוגת המכשירים של NTA.
- הזרקו את הדגימות לתא הדגימה של מכשיר NTA באמצעות מזרק אינסולין של 1 מ"ל.
- הגדר את תוכנת NTA להקלטה באופן הבא: 5 מדידות סטנדרטיות, 60 שניות כל אחת, ומשאבת זרימה מוגדרת ל-30.
- הגדר את עוצמת האור לערך מתאים המאפשר להבחין בבירור בין חלקיקים מהרקע ולהפעיל את סקריפט הלכידה בתוכנת NTA.
הערה: הגדרת רמת המצלמה עשויה להשפיע על זיהוי החלקיקים. אם הערך גבוה מדי, נוצר רקע חלבי ופיזור אור חלקיקי חזק, המכסה את רוב אותות החלקיקים. אם הערך נמוך מדי, למרות שמתקבל רקע כהה יותר, יתכן שרוב האירועים הפחות בהירים מתפספסים. יש לעקוב אחר כל דגימה להגדרה אופטימלית. - התאם את גורם הדילול אם החלקיקים למסגרת נמוכים מ-20 או יותר מ-80.
- הגדר את הסף ל-4 כדי לנתח את הגודל המודאלי הממוצע וריכוז החלקיקים של הסופרנטנט. קח בחשבון גורמי דילול ראשוניים.
- נקה את תא המכשיר במים נטולי יונים לאחר כל דגימה כדי למנוע זיהום צולב.
- יש לפתוח את תוכנת הניתוח של נת"ע ולבצע אנליזה על דגימות שנרכשו, תוך התחשבות במקדם הדילול (איור 2D).
- אפיון מורפולוגיה של EV על ידי מיקרוסקופ אלקטרונים הולכה (TEM)
- אסוף סופרנטנט מרוכז ASC או בודד EVs על ידי אולטרה-צנטריפוגה (100,000 x g ב-4 מעלות צלזיוס למשך שעה) ואחריו תרחיף גלולה באותו נפח של PBS.
- אפשר ל-5 מיקרוליטר של הסופרנטנט המרוכז או EVs להיספג על רשתות מצופות פחמן למשך 10 דקות. כתם טיפות נוזל עודפות בנייר פילטר.
- בצע צביעה שלילית עם 2% אורניל אצטט בתרחיף מימי למשך 10 דקות תוך שימוש בנפח זהה של טיפת הדגימה (5 מיקרוליטר). הסר את עודפי האורניל אצטט על ידי נגיעה ברשת עם נייר פילטר.
- יבשו את הרשת בטמפרטורת החדר (RT) ובחנו אותה עם מיקרוסקופ אלקטרונים שידור ב-120 קילו וולט (איור 2E).
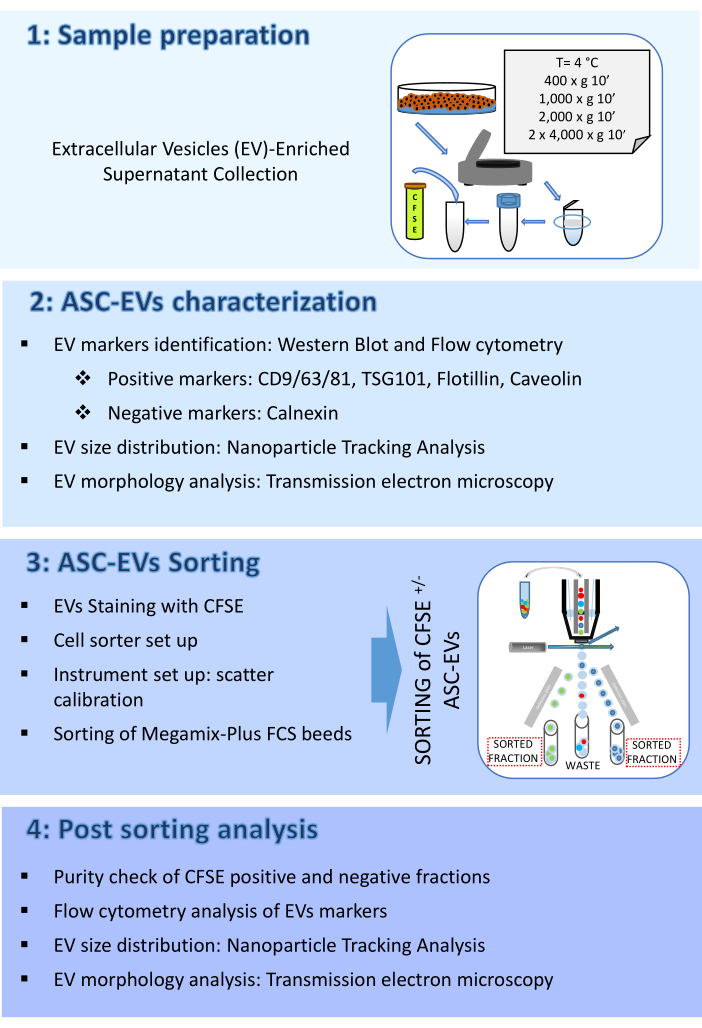
איור 2: אפיון ASC-EVs. (A) כתם מערבי מייצג של סמנים חיוביים (CD9, CD81, TSG101 ו-Flotillin) ושליליים (Calnexin). מדווחים על משקלים מולקולריים מתאימים, וליזטים של ASCs שימשו כבקרה. (B) ניתוח ציטומטריית זרימה של סמני EVs. הביטוי של הסמנים הבאים נותח: CD9, CD63, CD81 ו- CD44. רק ASC-EVs חיוביים ל-CFSE נותחו לביטוי סמן. היסטוגרמות מייצגות ASC-EVs לא מוכתמים (היסטוגרמות אדומות) ומוכתמים (היסטוגרמות כחולות). (C) ניתוח תוך-תאי של ציטומטריית זרימה של סמן EVs Caveolin. היסטוגרמות מייצגות ASC-EVs לא מוכתמים (היסטוגרמה אפורה) ומוכתמים (היסטוגרמות כחולות). (ד) אפיון של ASC-EVs על ידי NTA. היסטוגרמות מייצגות את הריכוז (חלקיקים/מ"ל)/גודל (ננומטר) של הדגימה. (ה) הדמיה של ASC-EVs על ידי TEM. פסי קנה מידה = 100 ננומטר. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
3. מיון ASC-EVs
- הגדרת סדרן תאים
הערה: סדרן תאים הוא ציטומטר זרימה המאפשר בידוד של אוכלוסייה טהורה מדגימת התחלה הטרוגנית. סדרן תאים מפריד בין חלקיקי המטרה על ידי תנודת הזרם עם פיזואלקטרי בתדר גבוה כדי ליצור טיפות המכילות אירוע. הטיפות שהכילו את החלקיקים המעניינים, כגון תאים או שלפוחיות, נטענות ומוטות דרך לוחות הסטה מתכתיים. השבר הממוין משמש לביצוע ניתוח במורד הזרם.- פתח את קו הלחץ ושואב אבק.
הערה: לחלק מהממיינים יש הפעלה אוטומטית, בעוד שלאחרים יש הפעלה ידנית. עדיף סדרן עם הפעלה ידנית, מכיוון שהוא מאפשר אופטימיזציה של כמה תכונות טכניות כגון תדירות, לחץ ובחירת קצה הזרבובית. בפרט, מומלץ לעבוד בתדר של 66,000 הרץ, לחץ של 35 psi וזרבובית של 70 מיקרומטר. - הפעל את המכשיר, פתח את ארון הבטיחות הביולוגית והפעל את תוכנת המיון.
- לחץ על הנוזלים ולאחר מכן הפעל את מערכת הנוזלים.
- הפעל את Drop Drive, הגביש הפיזואלקטרי בזרבובית שרוטט כדי לקבל טיפות.
- בצע הליך Debubbling כדי למנוע נוכחות של בועות במערכת ולאחר מכן הפעל צינור של 5 מ"ל של תמיסת ניקוי למשך 5 דקות בלחץ דיפרנציאלי גבוה וצינור 5 מ"ל של מי DI למשך 5 דקות.
- בצע הליך אתחול ידני.
- בכרטיסייה בקרת לייזר, לחץ על לחצן הפעלת הלייזר כדי להפעיל את הפעלת הלייזר.
הערה: חזור על הליך זה עבור כל הלייזרים: כחול 488 ננומטר, צהוב-ירוק 561 ננומטר, סגול 405 ננומטר ואדום 640 ננומטר. - בחן את היישור האנכי של הנחל.
הערה: במקרה הצורך, הזז את שלב הרכבת הזרבובית, בפרט, מיקרומטר קדמי ואחורי, מיקרומטר שמאל וימני וגימבל כדי לכוונן את היישור האנכי ולאמת את הזרם האנכי עם מיקרומטר למעלה ולמטה; ליישור הטוב ביותר, הזרם חייב להיות אנכי בכל לייזר. אם זו הפעם הראשונה שמשתמשים בזרבובית ספציפית, יש לבצע עיכוב לייזר . בלוח מסך המגע, בכרטיסייה יירוט לייזר וזרם , בחר את גודל הזרבובית הנכון, לחץ על לחצן עיכוב לייזר ופעל לפי הוראות עיכוב הלייזר כדי לבצע את הליך עיכוב הלייזר. באופן כללי, בעת שינוי לחץ הנדן וכתוצאה מכך קצה הזרבובית, קביעת עיכוב הלייזר מתבצעת לפני מציאת היישור. בתום הליך עיכוב הלייזר , מוצע לבצע את הליך חיסור תמונת הרקע בהתאם להוראות שעל המסך על מנת למזער את אות הרקע. - בצע קביעת נקודת לייזר על ידי לחיצה על הכרטיסייה יירוט זרם לייזר , לחצן החץ הירוק וביצוע ההוראות בצג מסך המגע.
- בכרטיסייה בקרת לייזר, לחץ על לחצן הפעלת הלייזר כדי להפעיל את הפעלת הלייזר.
- אתחול Intellisort. הגדר את תדר כונן הנפילה וערך ברירת מחדל של משרעת, מה שגורם לזרם ליצור טיפה.
- לאחר ביצוע שלב זה, טען תצורה שמורה. כדי לטעון תצורת הגדרה שמורה, בחר Load Sort Setting בסרגל הכלים של תוכנת המיון. לאחר בדיקת תדרים ומשרעות שונות, בחר את הטוב ביותר שמבטיח את יציבות הטיפה הטובה ביותר. עבודה בתדר של 66,000 הרץ ומשרעת של סביב 40-45 וולט.
- בצע הליך יישור לייזר עדין .
- טען בדגימה צינור של 5 מ"ל של חרוזי יישור QC והפעל אותו; בחר בכרטיסייה יישור עדין את הפרמטר הרצוי על ציר X ו-Y על מנת לדמיין חרוזים דחוסים וקולימיים היטב. באזור תצוגת הנתונים, בחר קודם כל 488 - 513/26-H עבור פרמטר ציר ה-Y ו-488-FSC1-H עבור פרמטר ציר ה-X. לאחר מכן, כדי לכוונן את כל הלייזרים, בחר 405-488/59-H עבור פרמטר ציר ה-Y ו-640-795/70-H עבור פרמטר ציר ה-X.
הערה: הפרמטרים שנבחרו תלויים בתצורת הלייזר של הממיין. ההצעה של מדריך המכשיר היא בחירת הלייזרים שיש להם את ההפרדה המרחבית הגדולה ביותר על רצועת חור הסיכה. לשם כך השתמש בלייזר סגול (405 ננומטר) ובלייזר אדום (640 ננומטר). - לאחר בדיקת היישור הידני על ידי מומחה המיון, בצע את ה-QC האוטומטי. בחר את קוטר חרוזי ה-QC: קוטר 3 מיקרומטר.
הערה: בסוף הליך זה, התוצאה יכולה להיות QC לא עבר או QC עבר. במקרה שה-QC נכשל, יש צורך לבצע אופטימיזציה ידנית של היישור. - שמור את רכישת QC בפרוטוקול יישור התוכנה.
- טען בדגימה צינור של 5 מ"ל של חרוזי יישור QC והפעל אותו; בחר בכרטיסייה יישור עדין את הפרמטר הרצוי על ציר X ו-Y על מנת לדמיין חרוזים דחוסים וקולימיים היטב. באזור תצוגת הנתונים, בחר קודם כל 488 - 513/26-H עבור פרמטר ציר ה-Y ו-488-FSC1-H עבור פרמטר ציר ה-X. לאחר מכן, כדי לכוונן את כל הלייזרים, בחר 405-488/59-H עבור פרמטר ציר ה-Y ו-640-795/70-H עבור פרמטר ציר ה-X.
- השלמת הליך Intellisort
- אתר את לוחות הסטייה במיקום הנכון במיון והפעל את כרךtage (מומלץ טעינה של 3,000 וולט על לוחות הסטה).
- בחר פלט מיון של 6 Tube Holder, הפעל את הזרמים הנבחרים אותם במחוון הזרם ובצע את זרם הבדיקה.
הערה: אם הזרמים אינם מופרדים ומוגדרים בבירור, התאם את שלב הטעינה, הגדר או שנה פרמטרים אחרים על מנת לקבל זרם מוגדר בבירור ולא מתנודד. - הפעל את לחצן Intellisort Automatic Drop Delay Determination . שלב זה מאפשר להגדיר את עיכוב הנפילה הנכון. לאחר שלב זה, אמת שוב את הזרמים.
- הפעל את Intellisort Maintenance Mode. אמת את עיכוב השחרור באופן ידני.
- טען את פרוטוקול Drop Delay הידני בתוכנת המיון. רכוש חרוזי בקרה פלואורסצנטיים.
- הכנס את מחזיק השקופיות הנכון. בתוכנת המיון, בחר אשף עיכוב מיון > שחרור. בחר מיין לוגיקה.
- ודא במיקרוסקופ פלואורסצנטי את נוכחותם של 97% מחרוזי הפלורסנט בשלולית החמישית.
- פתח את קו הלחץ ושואב אבק.
- הגדרת מכשיר: כיול פיזור
הערה: כיול הפיזור מתבצע באמצעות חרוזי Verity Shells (המכונים מעתה והלאה חרוזי סיליקה אורגנו חלולים). חרוזי סיליקה אורגנו אלה מאופיינים בהתפלגות מקדם שבירה ותכונות פיזור אור קרובות יותר ל-EVs מאשר חרוזי פוליסטירן, ובכך מאפשרים להגדיר את מתח ה-SSC וה-FSC כדי להבחין טוב יותר בין אירועים דמויי EV לבין הרעש האלקטרוני. חרוזי הסיליקה האורגניים מורכבים משני בקבוקונים עם תערובות חרוזים, VER01A (חרוזים של 189 ננומטר) ו-VER01B (חרוזים של 374 ננומטר). כל בקבוקון מכיל תערובת של חרוזי סיליקה אורגנו חלולים וחרוזי פלואורסצנט ירוקים בגודל 380 ננומטר, המכונים חרוזי ייחוס. ריכוז חרוזי הסיליקה האורגנו החלולים הוא 1 x 108 חרוזים/מ"ל.- הכן דגימה של חרוזי VER01A ו-VER01B על ידי דילול טיפה אחת (50 מיקרוליטר) מכל אחד מהם ב-1 מ"ל של PBS מסוננת של 0.22 מיקרומטר עם ריכוז סופי של 5,000 חרוזים/מיקרוליטר.
הערה: מערבול את החרוזים במשך 5 שניות לפני השימוש. - צור תרשים נקודות של סולם יומן SSC לעומת סולם יומן FITC.
- רכשו חרוזי VER01B והתאימו את המתח כדי להבחין היטב בחרוזי הייחוס בחלק הימני העליון של עלילת הנקודות SSC/FITC (איור 3A).
- הגדר אזור סביב אוכלוסיית החרוזים הזו.
- צור תרשים נקודות של סולם יומן SSC לעומת סולם יומן FSC. זהה את חרוזי הייחוס ואת אוכלוסיית חרוזי VER01B. הגדר אזור סביב אוכלוסיית החרוזים VER01B (איור 3B).
- רכשו חרוזי VER01A וצרו אזור סביב אוכלוסיית החרוזים הזו (איור 3C).
הערה: אוכלוסיית חרוזים זו חופפת בחלקה לרעשי הרקע של הכלי. - רכוש PBS מסונן של 0.22 מיקרומטר והתאם את הסף כדי להפחית את רעשי הרקע של המכשיר מבלי לאבד את ההדמיה של החרוזים הקטנים ביותר.
הערה: ניתן לבצע כיול פיזור באמצעות חרוזי FSC Megamix (המכונים מעתה ואילך חרוזי פוליסטירן FSC), תערובת של חרוזי פלורסנט בקטרים הבאים: 100 ננומטר, 300 ננומטר, 500 ננומטר ו-900 ננומטר. יש להעדיף את השימוש בחרוזי סיליקה אורגנו חלולים על פני חרוזי פוליסטירן FSC מכיוון שיש להם התפלגות מקדם שבירה ותכונות פיזור אור הדומות ל-EVs. האוכלוסייה של 300 ננומטר חרוזי פוליסטירן FSC חופפת להתייחסות של חרוזי הסיליקה האורגנו החלולים. לכן, שער המבוסס על חרוזי סיליקה אורגנו חלולים בוחר EVs בגודל דומה על ציטומטר הזרימה.
- הכן דגימה של חרוזי VER01A ו-VER01B על ידי דילול טיפה אחת (50 מיקרוליטר) מכל אחד מהם ב-1 מ"ל של PBS מסוננת של 0.22 מיקרומטר עם ריכוז סופי של 5,000 חרוזים/מיקרוליטר.
- רכישת מדגם
- צור תרשים נקודות של סולם הלוג SSC לעומת סולם הלוג FITC, רכוש PBS מסונן μm 0.22 והגדר את רעש הרקע הייחוס (איור 4A).
הערה: הגדר את קצב הזרימה של הציטומטר לנמוך ושלוט בקצב הזרימה. מספר האירועים לא יעלה על 2,000 אירועים/ים. קצב זרימה נמוך פירושו בלחץ דיפרנציאלי נמוך. - רכוש את דגימת הבקרה (EVs לא מוכתמים) ובדוק את קצב הזרימה. ודא שמספר האירועים הוא בסביבות 5,000 אירועים/ים.
הערה: אם מספר האירועים עולה על המוצע, יש לדלל את הדגימה. - רכוש PBS מוכתם ומטופל כדגימת CFSE ובדוק שלא נראים אירועים חיוביים (איור 4B).
- רכוש את הדגימה המוכתמת CFSE. מדללים אותו על סמך קצב הזרימה. צייר אזור המזהה את האירועים החיוביים של CFSE ואחד המזהה את האירועים השליליים של CFSE. השתמש בדגימה לא מוכתמת כבקרה (איור 5A, B). אלה הם אזורי המיון.
- צור תרשים נקודות של סולם הלוג SSC לעומת סולם הלוג FITC, רכוש PBS מסונן μm 0.22 והגדר את רעש הרקע הייחוס (איור 4A).
- מיון לדוגמה
- בתוכנת המיון, פתח פרוטוקול חדש (בסרגל הכלים בחר קובץ > פרוטוקול > חדש).
- בתוכנת המיון, לחץ על הגדרת רכישת נתונים; בחלון פרמטר רכישה, בחר את הערוצים המעניינים והשבת את האחרים. עבור פאנל ספציפי זה, האות המופעל הם: 488-FSC1, 488-FSC2, 488-SSC ו-488-513/26 (עבור אות CFSE).
- אתר על הדגימה צינור 5 מ"ל של הדגימה. במסך המגע, לחץ על כפתור הטעינה , ובסרגל הכלים של תוכנת הממיין, בחר רכישה > התחל (או לחץ על כפתור F2 ). יופיע חלון של מאפיינים לדוגמה; הוסף את שם הדוגמה ולחץ על OK.
- צור את הפאנל, עם העלילה המעניינת וצור את אסטרטגיית השער.
- בסרגל הכלים של תוכנת המיון, בחר היסטוגרמה > צור היסטוגרמה.
- בסביבת העבודה, צור שלוש עלילות נקודות, הראשונה עם פרמטר יומן גובה על ציר x 488-FSC1 וציר y 488-SSC Height-Log, השנייה עם פרמטר יומן גובה על ציר x 488-FSC2 וציר y 488-SSC Height-Log, השלישית עם פרמטר יומן גובה על ציר x 488-513/26 CFSE וציר y 488-SSC Height-Log.
- בכרטיסיה מיון, זהה את האזורים שיש למיין. בתוכנת מיון, לחץ על הגדרת מיון. בחלון מיון לוגיקה וסטטיסטיקה, בחר את האזור שיש למיין בבונה הלוגיקה.
הערה: כדי לקבל החלטת מיון, יש לקחת בחשבון הגדרות שונות: לוגיקת מיון, מצב מיון ומעטפה נפתחת. לוגיקת המיון מתייחסת לאסטרטגיית השער. האירועים שנמצאים מחוץ לשער שנבחר אינם ממוינים. מצב המיון קשור לפלט הסופי. עבדו במצב טיהור, בדרך זו, כל הטיפות הממוינות מכילות רק את האירועים החיוביים הרצויים. מעטפת השחרור מגדירה כמה טיפות יחויבו וימוינו ביחס למיקום בטיפה של האירוע החיובי: בחרו 1-2 טיפות על מנת להיות בטוחים שכל האירועים החיוביים ממוינים. - כאשר קצב הזרימה יציב, הפסק את הרכישה (בסרגל הכלים של תוכנת המיון, בחר רכישה > עצור או לחץ שוב על כפתור F2 ). התחל מיון (בסרגל הכלים של תוכנת המיון, בחר מיין > התחל או לחץ על לחצן F4 ).
הערה: לפני שתתחיל במיון, בדוק את זרם הבדיקה. ודא שהשבר הממוין נופל כהלכה לתוך צינור האיסוף. - שמור את הגדרת המיון. בסרגל הכלים של תוכנת המיון, בחר מיין > שמור הגדרות מיון.
- בדיקת טוהר אוכלוסייה ממוינת
- שטפו את המכשיר על ידי רכישת צינור של 5 מ"ל של תמיסת ניקוי למשך 10 דקות בלחץ דיפרנציאלי גבוה וצינור של 5 מ"ל של מי DI למשך 10 דקות.
- רכוש PBS מסונן של 0.22 מיקרומטר ובדוק שאין אירועים חיוביים ל-CFSE.
- לדלל 5 מיקרוליטר מהדגימה הממוינה ב-100 מיקרוליטר של PBS מסוננים של 0.22 מיקרומטר.
- רכוש ורשום את כל נפחי הדגימה (איור 5C, D).
הערה: מדווח על ניתוח מחדש של EVs ממוינים חיוביים ושליליים של CFSE.
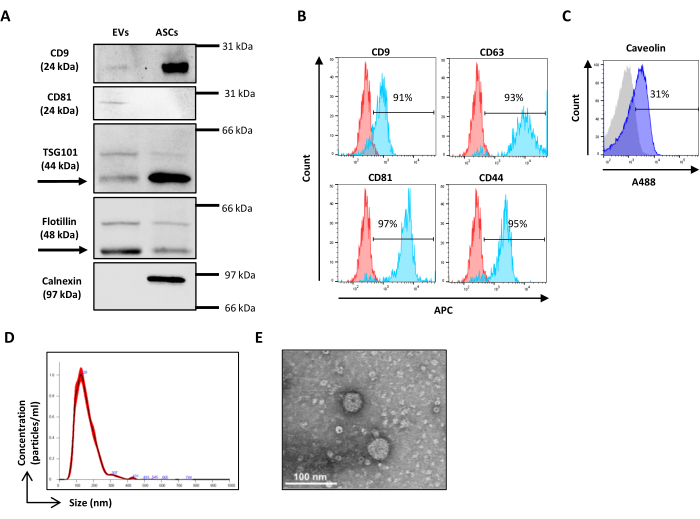
איור 3: הגדרת פרמטרים פיזיקליים עם חרוזי סיליקה אורגנו חלולים. (A) תרשים נקודות SSC/FITC: חרוזים פלואורסצנטיים ירוקים ייחוס שימשו לקביעת פרמטר SSC. תרשים נקודות SSC/FSC של חרוזי (B) VER01B ו-(C) VER01A. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
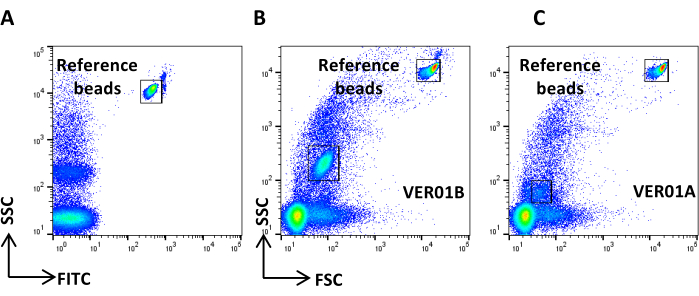
איור 4: רעש רקע ייחוס. (A) תרשים נקודות SSC/CFSE של מדגם PBS. (B) תרשים נקודות SSC/CFSE של מדגם PBS + CFSE. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
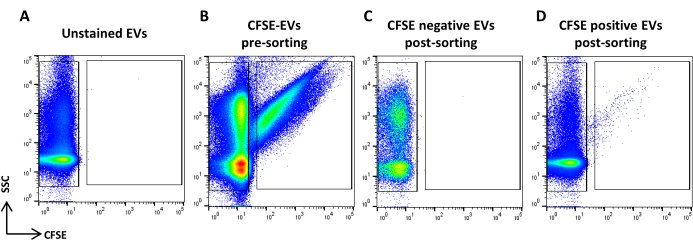
איור 5: מיון ASC-EVs מוכתמים ב-CFSE. (A) תרשים נקודות SSC/CFSE של EVs לא מוכתמים, (B) EVs מוכתמים CFSE, (C) EVs שליליים CFSE לאחר מיון, ו-(D) EVs חיוביים CFSE לאחר מיון. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
4. ניתוחים לאחר מיון
הערה: בשל כמות החומר המוגבלת לאחר המיון, ייתכן שלא ניתן יהיה לבצע את כל הניתוחים. עם הסכום המתקבל, הפעולות הבאות מבוצעות.
- אפיון EV על ידי ציטומטריית זרימה: צביעת פני השטח (ראה שלב 2.2)
הערה: כפי שתואר קודם לכן למיון מראש של דגימות למעט הכנת דגימה. ניתן להשתמש בדגימות לאחר המיון ללא דילול.- השתמש בדגימות ממוינות לא מדוללות והמשך לפי שלב 2.2.3. (איור 6A)
- אפיון ריכוז וגודל EV על ידי NTA (ראה שלב 2.4)
הערה: כפי שתואר קודם לכן למיון מראש של דגימות למעט הכנת דגימה. ניתן להשתמש בדגימות לאחר המיון ללא דילול.- השתמש בדגימות ממוינות לא מדוללות והמשך לפי שלב 2.4.2. (איור 6B)
- אפיון מורפולוגיה של EV על ידי TEM (ראה שלב 2.5)
הערה: כפי שתואר קודם לכן למיון מראש של דגימות למעט הכנת דגימה.- הוסף 2 מ"ל PBS לרכז צנטריפוגלי (קרום תאית מחודש, MWCO 100 kDa), מכסה וצנטריפוגה ב-4,000 x גרם למשך 10 דקות ברוטור דלי מתנדנד. הסר PBS לא מסונן מתחתית מכשיר המסנן.
- שאפו פילטר מצינור האיסוף. פרוטוקול האולטרה-סינון הצנטריפוגלי המתואר מבוסס על עיבוד של עד 15 מ"ל דגימות (נפח מקסימלי).
- הוסף עד 15 מ"ל דגימה למסנן AU-15 וכסה את המכשיר. צנטריפוגה ב-4,000 x גרם למשך עד 30 דקות. התרכז עד לנפח המינימלי שהמכשיר מאפשר, כ-100-150 מיקרוליטר.
- שחזר את דגימת ה-EV הממוינה המרוכזת מהתקן המסנן והמשך כמתואר קודם לכן עבור דגימות מיון מראש TEM (שלב 2.5.2) ( איור 6C).
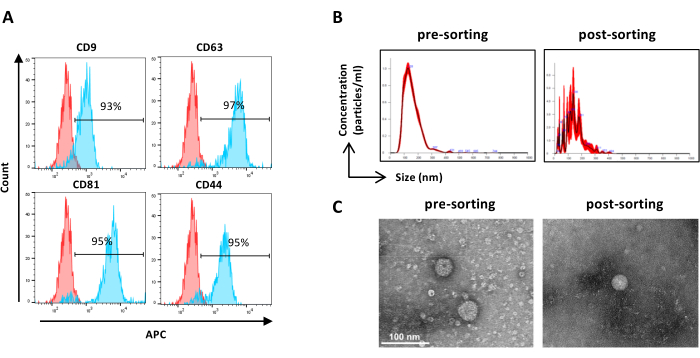
איור 6: אפיון של ASC-EVs ממוינים. ניתוח ציטומטריית זרימה של סמני EV. הביטוי של הסמנים הבאים נותח: CD9, CD63, CD81 ו-CD44. רק ASC-EVs חיוביים ל-CFSE נותחו לביטוי סמן. (A) היסטוגרמות מייצגות ASC-EVs לא מוכתמים (היסטוגרמות אדומות) ומוכתמים (היסטוגרמות כחולות). (ב) אפיון של ASC-EVs על ידי NTA. היסטוגרמות מייצגות את הריכוז (חלקיקים/מ"ל)/גודל (ננומטר) של הדגימות לפני המיון (משמאל) ואחרי המיון (מימין). (C) הדמיה של ASC-EVs על ידי TEM של דגימה לפני מיון (משמאל) ואחרי מיון (מימין). פסי קנה מידה = 100 ננומטר. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
Access restricted. Please log in or start a trial to view this content.
תוצאות
חרוזי הפוליסטירן FSC מוינו כדי לאמת את הגדרת המכשיר ותנאי המיון. חרוזי פוליסטירן FSC הם תערובת של חרוזי פלורסנט הנעים בין 100 ננומטר, 300 ננומטר, 500 ננומטר ו-900 ננומטר ונראים בערוץ FITC. איור 7A מציג את סולם היומן SSC לעומת תרשים הנקודות בקנה מידה של FITC עם ארבע אוכלוסי...
Access restricted. Please log in or start a trial to view this content.
Discussion
ניתוח ומיון EVs הוא מאתגר בשל גודלם הקטן והעובדה שהם קרובים לגבול הזיהוי של רוב ציטומטרי הזרימה. המטרה שלנו הייתה לפתח פרוטוקול לבידוד רכבים חשמליים שמקורם ב-AMSCs המסומנים ב-CFSE. CFSE נבחרה כשיטת הצביעה בשל יעילות התיוג הגבוהה המדווחת שלה (≥90%), ללא היווצרות חלקיקים לא רצויים כ...
Access restricted. Please log in or start a trial to view this content.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
אנו מודים לעמנואל קאנוניקו על התמיכה הטכנית. חלק מעבודה זו בוצע ב-ALEMBIC, מעבדת מיקרוסקופיה מתקדמת שהוקמה על ידי IRCCS Ospedale San Raffaele ו-Università Vita-Salute San Raffaele. עבודתם של אנריקו ראגני ולורה דה ג'ירולמו נתמכה על ידי משרד הבריאות האיטלקי, "Ricerca Corrente".
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 5(6)-Carboxyfluorescein diacetate N-succinimidyl ester | Merck | 150347-59-4 | |
| Adipose Mesenchymal Stromal Cells | Wepredic, Parc d'affaires, 35760 Saint-Grégoire, France | Cells used in this study | |
| Alexa 488 anti-Caveolin | R&D Systems | IC5736G | Flow cytometry antibody |
| APC anti-human CD44 | BioLegend | 338805 | Flow cytometry antibody |
| APC anti-human CD63 | BioLegend | 353007 | Flow cytometry antibody |
| APC anti-human CD81 (TAPA-1) | BioLegend | 349509 | Flow cytometry antibody |
| APC anti-human CD9 | BioLegend | 312107 | Flow cytometry antibody |
| BC CytoFLEX S | Beckman Coulter | BC CytoFLEX S equipped with 3 lasers, Blue, Red and Violet | |
| Flow-Check Pro Fluorospheres | Beckman Coulter | A63493 | Fluorescent control beads for MoFLO Astrios EQ |
| FlowJo software (version 10.8.1) | BD | version 10.8.1 | Analysis software |
| IntraSure kit | BD Biosciences | 641776 | Fixation and permeabilization for intracellular staining |
| Megamix-Plus FSC | BioCytex | 7802 | FSC polystyrene beads |
| MoFLO Astrios EQ | Beckman Coulter | MoFLO Astrios EQ equipped with 4 lasers, Blue, Yellow - Green, Violet and Red | |
| Mouse anti-FLOT1 antibody | BD Transduction Laboratories | 610820 | Western Blot antibody |
| NanoSight NS300 | Malvern | NS300 | |
| Rabbit anti-Calnexin antibody | Origene | TA336279 | Western Blot antibody |
| Rabbit anti-CD9 and CD81 antibody (ExoAb antibody kit) | System Biosciences | EXOAB-KIT-1 | Western Blot antibodies |
| Rabbit anti-TSG101 antibody | Merck | HPA006161 | Western Blot antibody |
| Triton X-100 | Merck | 9036-19-5 | |
| Ultra Rainbow Fluorescent Particles | Spherotech | URFP-30-2 | |
| Ultracel 100 kDa MWCO | Merck | UFC910024 | |
| VER01 - Verity Shells | Exometry | Organo silica beads for scatter calibration |
References
- Welsh, J. A., et al. Minimal information for studies of extracellular vesicles (misev2023): From basic to advanced approaches. J Extracell Vesicles. 13 (2), e12404(2024).
- Xu, R., Greening, D. W., Zhu, H. J., Takahashi, N., Simpson, R. J. Extracellular vesicle isolation and characterization: Toward clinical application. J Clin Invest. 126 (4), 1152-1162 (2016).
- Dixson, A. C., Dawson, T. R., Di Vizio, D., Weaver, A. M. Context-specific regulation of extracellular vesicle biogenesis and cargo selection. Nat Rev Mol Cell Biol. 24 (7), 454-476 (2023).
- Witwer, K. W., Wolfram, J. Extracellular vesicles versus synthetic nanoparticles for drug delivery. Nat Rev Mater. 6 (2), 103-106 (2021).
- Cheng, L., Hill, A. F. Therapeutically harnessing extracellular vesicles. Nat Rev Drug Discov. 21 (5), 379-399 (2022).
- Du, S., et al. Extracellular vesicles: A rising star for therapeutics and drug delivery. J Nanobiotechnology. 21 (1), 231(2023).
- Keshtkar, S., Azarpira, N., Ghahremani, M. H. Mesenchymal stem cell-derived extracellular vesicles: Novel frontiers in regenerative medicine. Stem Cell Res Ther. 9 (1), 63(2018).
- Orbay, H., Tobita, M., Mizuno, H. Mesenchymal stem cells isolated from adipose and other tissues: Basic biological properties and clinical applications. Stem Cells Int. 2012, 461718(2012).
- Caplan, A. I., Dennis, J. E. Mesenchymal stem cells as trophic mediators. J Cell Biochem. 98 (5), 1076-1084 (2006).
- Rani, S., Ryan, A. E., Griffin, M. D., Ritter, T. Mesenchymal stem cell-derived extracellular vesicles: Toward cell-free therapeutic applications. Mol Ther. 23 (5), 812-823 (2015).
- Galipeau, J., Sensébé, L. Mesenchymal stromal cells: Clinical challenges and therapeutic opportunities. Cell Stem Cell. 22 (6), 824-833 (2018).
- Jia, Y., et al. Small extracellular vesicles isolation and separation: Current techniques, pending questions and clinical applications. Theranostics. 12 (15), 6548-6575 (2022).
- Ohnuma, K., Yomo, T., Asashima, M., Kaneko, K. Sorting of cells of the same size, shape, and cell cycle stage for a single cell level assay without staining. BMC Cell Biol. 7, 25(2006).
- Morales-Kastresana, A., et al. High-fidelity detection and sorting of nanoscale vesicles in viral disease and cancer. J Extracell Vesicles. 8 (1), 1597603(2019).
- Mortati, L., et al. In vitro study of extracellular vesicles migration in cartilage-derived osteoarthritis samples using real-time quantitative multimodal nonlinear optics imaging. Pharmaceutics. 12 (8), 734(2020).
- Andreu, Z., Yanez-Mo, M. Tetraspanins in extracellular vesicle formation and function. Front Immunol. 5, 442(2014).
- Mildmay-White, A., Khan, W. Cell surface markers on adipose-derived stem cells: A systematic review. Curr Stem Cell Res Ther. 12 (6), 484-492 (2017).
- Welsh, J. A., Tang, V. A., Van Der Pol, E., Gorgens, A. MIFlowCyt-EV: The next chapter in the reporting and reliability of single extracellular vesicle flow cytometry experiments. Cytometry A. 99 (4), 365-368 (2021).
- Maia, J., et al. Employing flow cytometry to extracellular vesicles sample microvolume analysis and quality control. Front Cell Dev Biol. 8, 593750(2020).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved