A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
גישת מידול אלמנטים סופיים מבוססת תמונת אולטרסאונד תוך-וסקולרית לכימות תכונות מכניות in vivo של העורק הכלילי האנושי
* These authors contributed equally
In This Article
Summary
תמונות אולטרסאונד תוך-וסקולריות in vivo מראות את תנועת החתך הכלילי המתאימה לתנאי עומס לחץ שונים. בהתבסס על מודל אלמנטים סופיים, נעשה שימוש בתוכנית איטרטיבית כדי לקבוע את התכונות המכניות הספציפיות למטופל של עורקים כליליים in vivo על ידי התאמת תנועה כלילית מהמודל החישובי ותמונות רפואיות.
Abstract
כימות התכונות המכניות של דפנות העורקים הכליליים יכול לספק מידע משמעותי לאבחון, ניהול וטיפול במחלות עורקים כליליים. מכיוון שדגימות כליליות ספציפיות למטופל אינן זמינות לחולים הזקוקים לניטור רציף, בדיקה ניסויית ישירה של תכונות חומר כלי הדם הופכת לבלתי אפשרית. מודלים כליליים נוכחיים משתמשים בדרך כלל בפרמטרים חומריים מהספרות הזמינה, מה שמוביל לשגיאות חישוב מתח/מתח מכניות משמעותיות. כאן, נציג גישת עדכון מבוססת מודל אלמנטים סופיים (FEMBUA) כדי לכמת את תכונות החומר in vivo הספציפיות למטופל של העורקים הכליליים על סמך תמונות רפואיות. תמונות אולטרסאונד תוך-וסקולרי (IVUS ) והיסטולוגיה וירטואלית (VH)-IVUS של העורקים הכליליים נרכשו מחולה עם מחלת עורקים כליליים. תמונות Cine IVUS המציגות את תנועת כלי הדם על פני מחזור לב אחד חולקו, ושתי מסגרות IVUS עם היקף לומן מקסימלי ומינימלי נבחרו כדי לייצג את הגיאומטריה הכלילית בתנאי לחץ סיסטולי ודיאסטולי, בהתאמה. תמונת VH-IVUS חולקה גם היא כדי לקבל את קווי המתאר של כלי הדם, ועובי שכבה של 0.05 ס"מ נוסף לקווי המתאר של VH-IVUS כדי לשחזר את הגיאומטריה הכלילית. מודל אלמנטים סופיים חישוביים נוצר עם מודל חומר מוני-ריבלין אנזוטרופי המשמש לתיאור התכונות המכניות של הכלי ותנאי לחץ הדם הפועמים שנקבעו למשטח הלומינלי הכלילי כדי לגרום לו להתכווץ ולהתרחב. לאחר מכן, נעשה שימוש בגישת עדכון איטרטיבית כדי לקבוע את הפרמטרים החומריים של מודל מוני-ריבלין האנזוטרופי על ידי התאמת היקפי לומן מינימליים ומקסימליים ממודל האלמנטים הסופיים החישוביים לאלה מתמונות IVUS בקולנוע. ניתן להרחיב בהצלחה את גישת העדכון מבוססת המודל של אלמנטים סופיים מבוססת תמונה כדי לקבוע את תכונות החומר של דפנות העורקים במיטות כלי דם שונות וטומנת בחובה פוטנציאל להערכת סיכון למחלות לב וכלי דם.
Introduction
מחלת עורקים כליליים (CAD) היא אחד הגורמים המובילים לתמותה ותחלואה, ואחראית ליותר מ-9.14 מיליון מקרי מוות בשנת 2019 ברחבי העולם 1,2. התפתחות מחלות עורקים כליליים, כגון טרשת עורקים והיצרות, מלווה לרוב בשינויים בכוחות מכניים ושינויים בתכונות החומר של דופן כלי הדם3. התכונות החומריות של העורקים הכליליים הן לא רק אבן הפינה לקביעת תגובתם המכנית לעומס הפיזיולוגי, אלא גם מרכיבי המפתח להדמיית ההתנהגות המכנית של כלי הדם, חיזוי התפתחות נגעים טרשת עורקים והערכת ההשפעה הטיפולית של מכשירים רפואיים שונים 4,5. כתוצאה מכך, הבנה מעמיקה וכימות מדויק של תכונות החומר הכלילי הם בעלי ערך עליון לאבחון מוקדם של מחלות, רפואה מדויקת והערכת פרוגנוזה6.
ניסויים מכניים של רקמות כליליות מבודדות, כגון בדיקה דו-צירית מישורית, בדיקת הזחה, הארכת ניפוח ובדיקת הארכה חד-צירית, הן גישות נפוצות לכימות התכונות המכניות של דפנות כלי דם כליליים ex vivo 7,8,9. מגישות אלה התקבלו דגימות עורקים כליליים מחולים או מחיות ניסוי. בוצעו בדיקות מכניות כדי לקבוע את תגובות המתח של דופן הכלי בתנאי לחץ שונים, ולאחר מכן נקבעו הפרמטרים החומריים על ידי התאמת נתוני הניסוי10. מחקרים קודמים הראו כי תכונות כליליות הן מאוד לא ליניאריות ואניזוטרופיות11. למרות שניסויים ex vivo יכולים לספק נתונים מדויקים על תכונות החומר, קיימות גם מגבלות משמעותיות, שהן כדלקמן: ראשית, ההתנהגות המכנית של הדגימה לאחר הוצאת הנבדקים החיים תהיה שונה מזו בתנאי in vivo, מה שעלול להשפיע על דיוק תוצאות הבדיקה. שנית, בשל אילוצים אתיים ומעשיים, קשה להשיג אוסף גדול של רקמות תקינות או פתולוגיות של עורקים כליליים לביצוע הבדיקה המכנית.
כדי להתגבר על מגבלות אלה, חוקרים חקרו טכניקות חדשות לכימות in vivo, בזמן אמת וספציפי למטופל של תכונות החומר הכלילי. ביניהם, גישת העדכון המבוססת על מודל האלמנטים הסופיים (FEMBUA) המבוססת על תמונה רפואית טומנת בחובה את ההבטחה לטפל בסוגיות מאתגרות אלה. גישה זו עושה שימוש בטכניקות הדמיה מתקדמות כמו אולטרסאונד תוך-וסקולרי (IVUS) והיסטולוגיה וירטואלית (VH)-IVUS כדי ללכוד גיאומטריה כלילית מפורטת, הרכבי רקמות ותנועתה12. על ידי בניית מודלים תלת מימדיים של אלמנטים סופיים (FE) ושילוב מצבי לחץ דם פיזיולוגיים ספציפיים למטופל, ניתן לשחזר התנהגות כלי דם דינמית במהלך מחזורי לב על ידי אופטימיזציה של פרמטרים חומריים כדי להתאים לנתוני תמונה לכימות מהיר ומדויק של תכונות החומר הכלילי13. היתרונות של גישת עדכון FE in vivo על פני ניסויים ex vivo כוללים הערכה in vivo ללא כריתת רקמות, הקלה על הערכות בקנה מידה גדול והדמיית דינמיקה של כלי דם בתנאים מורכבים כדי לסייע להבנת הפתופיזיולוגיה של מחלות כליליות.
במאמר זה, מוצגים שלבים מרכזיים של גישת העדכון המבוססת על מודל אלמנטים סופיים, הכוללים פילוח ועיבוד מפורט של תמונת IVUS ו-VH-IVUS, שחזור של מודל חישובי של מבנה שכבה דקה בלבד, ביצוע התוכנית האיטרטיבית לחיפוש פרמטרים חומריים אופטימליים עבור רקמות עורקים כליליים. מטרת פרוטוקול זה היא לכמת את תכונות החומר של העורק הכלילי מחולה דגימה עם CAD באמצעות שיטת FEMBUA כהדגמה, במיוחד המחשה של שיטות שלב אחר שלב. סיימנו בדיון על המשמעות והיבטים אחרים של שיטת in vivo זו.
המשתתפת שנבחרה היא אישה בת 64 ללא היסטוריה קלינית קודמת של מחלת עורקים כליליים. חולה זה אובחן עם מחלת עורקים כליליים לאחר שסבל מתסמינים של כאבים בחזה. האנגיוגרמה הכלילית וסריקת IVUS בוצעו כדי לאשר את האבחנה. נגע פלאק עם היצרות של 60% נמצא באמצע העורק היורד הקדמי השמאלי. לאחר הערכה, אומץ טיפול רפואי אופטימלי לטיפול בחולה.
Protocol
נתונים קליניים לא מזוהים, כולל תמונות IVUS in vivo ונתוני לחץ דם, נרכשו מחולה עם CAD בבית החולים Zhongda, אוניברסיטת דרום-מזרח, עם הסכמה מדעת שהושגה. המטופל המדגם נבחר מתוך מאגר המטופלים של מחקר קליני על נגעים טרשת עורקים כליליים בינוניים כדי להדגים את השיטה לכימות תכונות החומר של כלי דם כליליים ספציפיים למטופל14. המחקר נערך בהתאם לפרוטוקול שאושר על ידי ועדת האתיקה של המחקר הקליני של בית החולים ז'ונגדה, אוניברסיטת דרום-מזרח (מספר אישור: 2017ZDSYLL023-p01).
1. איסוף ועיבוד נתונים
- רכישת תמונות Cine IVUS ו-VH-IVUS
- הנח את קטטר ה- IVUS דיסטלי לנגע טרשת העורקים בהנחיית אנגיוגרמה כלילית ומשוך אותו בחזרה לצד הפרוקסימלי. צור תמונות IVUS בגווני אפור לאורך הדרך כדי לדמיין את חתך הרוחב של כלי הדם הכלילי.
- השתמש במערכת ההדמיה IVUS המצוידת בצנתר פלטינה 20 מגה-הרץ 2.9F בעל ביצועים גבוהים כדי להשיג תמונות IVUS של מקטע העורקים הכליליים עם רובד טרשת עורקים מהמטופל עם CAD (איור 1).
- במהלך רכישת התמונה של IVUS, השהה את הצנתר באתר הנגע שנבחר מראש למשך כ-2 שניות כדי לקבל רצף של תמונות IVUS הנקרא cine IVUS. תמונות ה-IVUS הראו בבירור את שינויי החתך הדינמיים באתר הרובד הנתון לאורך מחזור הלב.
- צור תמונות VH-IVUS המבוססות על מסגרות IVUS שנרכשו ברגע שיא R באלקטרוקרדיוגרמות כדי להמחיש רכיבי פלאק בצורה מקודדת צבע באמצעות מערכת ההדמיה.
הערה: תמונות VH-IVUS מספקות מפת צבעים אינטואיטיבית לארבעה מרכיבי רובד מרכזיים ברובד טרשת עורקים: ליבה נמקית עשירה בשומנים (ליפיד) באדום, הסתיידות בלבן, רקמה סיבית בירוק כהה ורקמת שומן סיבית בירוק בהיר. - שמור תמונות VH-IVUS ו-cine IVUS בפורמט DICOM לניתוח לא מקוון.
- פילוח ועיבוד תמונה
- פתח קובצי DICOM באמצעות המציג, לחץ פעמיים על שם הרצף המתאים כדי לפתוח את התמונה ולחץ על Export > Export Images כדי לשמור כל מסגרת cine IVUS או מסגרת VH-IVUS כתמונה נפרדת בפורמט BMP. כל תמונת BMP כוללת 500 x 500 פיקסלים, כפי שמצוין בקובץ DICOM המקורי.
- בחן את תמונת ה-IVUS הקולנועית מסגרת אחר מסגרת כדי למצוא את המסגרות הרצופות המתקבלות באתר הפלאק שנבחר מראש במהלך מחזור לב אחד. היו 26 מסגרות IVUS קולנועיות שנוצרו במהלך מחזור לב אחד עבור אתר פלאק דגימה זה.
- בדוק את כל תמונות ה-VH-IVUS שנוצרו כדי למצוא את תמונת ה-VH-IVUS שהתקבלה באתר הפלאק הנתון. תמונות ה-VH-IVUS המשמשות כאן נוצרו באמצעות מסגרת IVUS אחת ממסגרות ה-IVUS הקולנועיות במחזור לב אחד.
- פלח תמונות VH-IVUS ו-cine IVUS באמצעות תוכנת ImageJ כדי להשיג את קווי המתאר של גבולות כלי הדם וגבולות רכיבי הפלאק (ראה איור 1C).
- בחר בכרטיסייה קו ישר > מקוטע ותוחם ידנית את קווי המתאר של הלומן, הגבול החיצוני של כלי הדם הכלילי ורכיבי הפלאק בתמונות IVUS ו-VH-IVUS. עבור תמונת ה-IVUS הפנימית, פלח רק את קווי המתאר של הלומן וגבול הכלי החיצוני, ואילו עבור תמונת VH-IVUS, פלח את קווי המתאר של הלומן, גבול הכלי החיצוני וגבולות רכיבי הפלאק.
- לשם הפשטות, שמור רק רכיבי ליפידים גדולים ליצירת מודל של אלמנטים סופיים והתעלם מרכיבי ליפידים קטנים ומבודדים. רק ליפיד אחד היה נוכח בדגימת הפלאק הזו. שכב את קווי המתאר המתוחמים על התמונות המקוריות באמצעות הכרטיסייה Image > Overlay > Add Selection .
- נווט לתפריט To ROI Manager כדי לנהל קווי מתאר, להתאים מאפיינים ולהגדיר צבעים ורוחב קו לערכים מתאימים להדמיה טובה יותר. בחרו בכרטיסייה 'מאפיינים ', קבעו את צבע הקו לצבע אחר ומלאו את רוחב הקו ברוחב. כאן, הגדר את צבעי הקווים כירוק, כחול ואדום עבור קווי מתאר לומן, גבול חיצוני ושומנים, בהתאמה, ואת רוחב הקו כ- 3.
- החלקת קווי מתאר באמצעות Edit > Selection > Fit Spline מסרגל הפקודות לאחר בחירת קו מתאר ספציפי לקבלת קו מתאר חלק. פעולה זו משתמשת בטכניקות התאמת עקומת ספליין כדי להחליק אוטומטית את קווי המתאר.
- לחץ על קובץ > הכרטיסייה Save As > XY Coordinates כדי לשמור קואורדינטות נקודתיות של כל אחד מקווי המתאר, כגון לומן, גבול חיצוני ורכיב פלאק בקובץ TXT נפרד. קובץ זה מכיל את ערכי הקואורדינטות x ו-y של הנקודות המרכיבות את קווי המתאר, עם פיקסלים כיחידה.
- רשמו את הגודל הפיזי האמיתי של כל פיקסל בתמונות cine IVUS ו-VH-IVUS (מסומנות כגודל פיקסל) מקובץ DICOM. המרחק האמיתי לפיקסל אחד בנתוני IVUS המשמשים כאן הוא 0.002 ס"מ. מידע זה ישמש להמרת קואורדינטות הנקודה עם הפיקסל כיחידה למרחק אמיתי עם ס"מ כיחידה.
- עיבוד נתוני קווי מתאר
- עיבוד נתוני קווי מתאר של Cine IVUS
- קרא קבצי txt של קווי מתאר לומן מכל תמונות IVUS במחזור לב אחד עם MATLAB.
- הכפל את כל קווי המתאר של הלומן בגודל הפיקסלים כדי לקבל את הגודל האמיתי של קווי המתאר של הלומן.
- חשב את היקפי הלומן עבור כל קווי המתאר של הלומן וזהה את מסגרות ה-IVUS עם היקפי לומן מקסימליים (Cmax) ומינימליים (Cmin), המייצגים תנאים דיאסטוליים וסיסטוליים, בהתאמה.
- עיבוד נתוני קווי מתאר VH-IVUS
- קרא קבצי txt של קווי המתאר של רכיבי הלומן, הגבול החיצוני והפלאק מתמונת VH-IVUS עם MATLAB.
- הכפל את כל קווי המתאר בגודל הפיקסלים כדי לקבל את הגודל הממשי של כל קווי המתאר.
- חלקו מחדש כל קו מתאר ל-100 נקודות במרווחים שווים ובצעו החלקה דו-ממדית כדי לקבל נתוני קווי מתאר חדשים של VH-IVUS שיחליפו את הישנים.
- עיבוד נתוני קווי מתאר של Cine IVUS
2. מודל אלמנטים סופיים
- שחזור גיאומטריה של כלי דם כלילי
- צור שכבה אחת של קווי מתאר במרחב תלת-ממדי על ידי הוספת ערך קואורדינטות z עבור כל הנקודות של קווי המתאר של VH-IVUS, כולל לומן, גבול חיצוני ושומנים, והגדר z = 0 עבור כל הנקודות (איור 2).
- צור שכבה נוספת של קווי מתאר על ידי הוספת ערך קואורדינטות z עבור כל הנקודות של קווי המתאר של VH-IVUS ואיפוס z = 0.05 ס"מ עבור כל הנקודות.
הערה: שתי שכבות קווי המתאר הללו משחזרות את הגיאומטריה התלת-ממדית של כלי הדם הכליליים עבור מודל מבנה השכבה הדקה בלבד על ידי הוספת עובי שכבה קבוע של 0.05 ס"מ לקווי המתאר של VH-IVUS (איור 2).
- יצירת רשת של אלמנטים סופיים
- צור שני קווי מתאר עזר על ידי אינטרפולציה ליניארית של לומן וקווי מתאר בגבול החיצוני עם משקולות 1/3 ו-2/3 (איור 3A) עבור כל שכבה.
- חלקו את שטח הכלי ל-8 חלקים היקפיים ו-3 חלקים רדיאליים (ראה איור 3B) על ידי חיבור גבול הלומן/חיצוני לנקודה הקרובה ביותר על קווי המתאר של השומנים (למשל, נקודות A ו-B באיור 3B) או שני קווי מתאר עזר עם קווים רדיאליים.
- חבר את כל הנקודות בין שכבות עם קווים ישרים, ויוצר מבנה תלת-ממדי עם 3 x 8 נפחים (איור 3B). חלקו כל נפח באמצעות אלמנטים משושים כדי ליצור את רשת האלמנטים הסופיים (איור 3C) וקבוצות חומרים שונות (איור 3D).
- בצע ניתוח רשת על ידי חידוד צפיפות הרשת ב -10% עד לשינויים בתמיסות < 5%.
- הגדרת מאפיין מהותי
- השתמש במודל חומר אניזוטרופי שונה של מוני-ריבלין כדי לתאר את תכונות החומר של דופן כלי הדם הכליליים. ההנחה הייתה שכלי דם כליליים ורכיבי פלאק הם חומרים היפר-אלסטיים, אנאיזוטרופיים, כמעט בלתי ניתנים לדחיסה והומוגניים, ופונקציית צפיפות אנרגיית המתח של מודל החומר האנאיזוטרופי השונה של מוני-ריבלין היא:
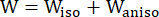 (1)
(1)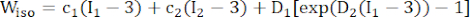 (2)
(2)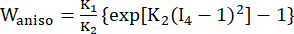 (3)
(3)
כאשר I1 ו-I2 הם האינווריאנטים הראשונים והשניים של טנזור העיוות הירוק-קושי הימני C המוגדר כ-c = [cij] = XTX, X = [Xij] = [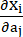 ], (Xi) היה המיקום הנוכחי (aj) היה המיקום המקורי, I4 = cij(nc)i(nc)j, nc היה וקטור היחידה בכיוון ההיקפי של הכלי. ג1, c2, D1, D2, K1 ו-K2 היו פרמטרים של חומר ספציפי למטופל.
], (Xi) היה המיקום הנוכחי (aj) היה המיקום המקורי, I4 = cij(nc)i(nc)j, nc היה וקטור היחידה בכיוון ההיקפי של הכלי. ג1, c2, D1, D2, K1 ו-K2 היו פרמטרים של חומר ספציפי למטופל. - הקצה את הערכים הראשוניים של פרמטרים חומריים עבור כלי דם כלילי ספציפי למטופל על פי תוצאות הבדיקה הדו-צירית ex vivo, כלומר, c1 = −1,312.9 kPa, c2 = 114.7 kPa, D1 = 629.7 kPa, D2 = 2.0, K1 = 35.9 kPa ו- K2 = 23.5 (איור 4A-B) 13,15.
- הקצה את פרמטרי החומר עבור רכיב הפלאק אם קיים. ליתר דיוק, עבור שומנים, c1=0.5 kPa, c2=0, D1=0.5 kPa ו-D2=1.5; לצורך הסתיידות, השתמשנו ב-c1=920 kPa, c2=0, D1=360 kPa ו-D2=2.0 (איור 4B)16.
הערה: רכיבי הפלאק (שומנים והסתיידות) הונחו כהיפר-אלסטיים, איזוטרופיים וכמעט בלתי ניתנים לדחיסה, ותכונותיהם המכניות תוארו על ידי מודל חומר מוני-ריבלין איזוטרופי עם פונקציות צפיפות אנרגיית המתח הניתנות בנוסחה (2).
- השתמש במודל חומר אניזוטרופי שונה של מוני-ריבלין כדי לתאר את תכונות החומר של דופן כלי הדם הכליליים. ההנחה הייתה שכלי דם כליליים ורכיבי פלאק הם חומרים היפר-אלסטיים, אנאיזוטרופיים, כמעט בלתי ניתנים לדחיסה והומוגניים, ופונקציית צפיפות אנרגיית המתח של מודל החומר האנאיזוטרופי השונה של מוני-ריבלין היא:
- משוואות שולטות וקביעת תנאי גבול
- הגדר משוואות שולטות עבור מודל מבנה השכבה הדקה בלבד, הכולל משוואת תנועה, יחס מתח-תזוזה לא ליניארי של קושי-ירוק ומודל חומר כלי דם כלילי11.
- רשמו צורות גל של לחץ דם ספציפי למטופל על פני הלומן כדי לדמות תנאים פיזיולוגיים אמיתיים (איור 4C). כדי להשיג צורות גל לחץ דם ספציפיות למטופל, קנה מידה של צורת גל לחץ אבי העורקים טיפוסית עם ערכי לחץ סיסטולי ודיאסטולי הנמדדים על ידי שרוול הזרוע (איור 4D).
3. גישת עדכון מבוססת מודל אלמנטים סופיים עבור תכונות חומר העורקים הכליליים הספציפיים למטופל
הערה: התהליך האיטרטיבי לקביעת תכונות החומר הכלילי הספציפי למטופל מתואר באיור 5.
- קבע את הגיאומטריה ללא עומס המתאימה למצב הלחץ האפס כגיאומטריה הראשונית עבור המודל החישובי על ידי כיווץ הגיאומטריה הכלילית המשוחזרת מתמונת VH-IVUS באופן צירי עם קצב הצטמקות קבוע של 95% והיקפי עם הצטמקות היקפית (מסומנת כ-S) שנקבעה בתחילה כ-98%.
הערה: מכיוון שהגיאומטריה הכלילית המשוחזרת מתמונת VH-IVUS הייתה בתנאי in vivo עם לחץ דם שנקבע על הלומן והמתיחה הצירית מקטעי עורקים כליליים דיסטליים ופרוקסימליים קשורים, הגיאומטריה הכלילית in vivo צריכה להתכווץ בצורה היקפית וצירית כדי להשיג את גיאומטריית הלחץ האפס. - תקן את קצב ההתכווצות הצירית ב-95% ועדכן את ההתכווצות ההיקפית במהלך השלבים הבאים.
- הגדר את יחס החומר (המסומן כ-k) כדי להקצות את תכונות החומר הספציפיות למטופל של הכלי הכלילי כ: כלומר, c1 = k*(−1,312.9) kPa, c2 = k*114.7 kPa, D1 = k*629.7 kPa, K1 = k*35.9 kPa, ותקן D2 = 2.0 ו-K2 = 23.5.
הערה: מכיוון שהתקבלו רק שתי נקודות נתונים (היקף לומן מינימלי ומקסימלי המתאים ללחצים דיאסטוליים וסיסטוליים) כדי לקבוע את הפרמטרים הלא ידועים (קצב הצטמקות היקפי S ופרמטרים חומריים של מודל מוני-ריבלין), הפחתנו את מספר הפרמטרים הלא ידועים על ידי ההנחה שתכונות החומר הספציפיות לחולה in vivo של כלי הדם הכלילי היו פרופורציונליות לניחוש הראשוני עם יחס החומר המסומן כ-k: כלומר, c1 = k*(−1,312.9) kPa, c2 = k*114.7 kPa, D1 = k*629.7 kPa, K1 = k*35.9 kPa, בעוד ש-D2 = 2.0 ו-K2 = 23.5 היו קבועים. - עדכן את הערך k שהוגדר לערך התחלתי k של 1 יחד עם קצב הצטמקות היקפי S במהלך ההליך האיטרטיבי הבא.
- הפעל תוכנה כדי לפתור את המודל החישובי כדי להשיג את התוצאות המספריות.
- כתוב את כל הפקודות ליצירת מודל המבנה של השכבה הדקה בלבד לקובץ אצווה (קובץ משלים 1) באמצעות MATLAB.
- טען קובץ אצווה זה באמצעות ממשק המשתמש המתקדם (AUI) כדי ליצור את המודל (איור 6A). פתור את מודל המבנה של השכבה הדקה בלבד על ידי לחיצה על קובץ נתונים/פתרון ושמור אותו כקובץ .dat (איור 6C). דמו שלושה מחזורי לב ואמצו את הפתרון במחזור האחרון כדי להציג תוצאות מספריות.
- ייצא תוצאות של קואורדינטות צומת לקובץ txt על-ידי ניווט ברשימת > רשימת ערכים > אזור ובחירה ב - X-POSITION, Y-POSITION ו - Z-POSITION במשתנים לרשימה תחת קואורדינטה. לחץ על Apply and Export כדי לייצא את תוצאות הקואורדינטות.
- שמור נתוני קווי מתאר לומן המתאימים לתנאי לחץ דיאסטולי וסיסטולי כדי .txt files לחישובי היקף לומן.
- השווה את היקפי הלומן המחושבים על ידי מודל FE (מודל מבנה שכבת פרוסה דקה בלבד) בתנאי לחץ דיאסטולי עם נתוני IVUS in vivo cine (Cmin) ובדוק אם השגיאה היחסית הייתה <1%. אם התנאי התקיים, עבור לשלב הבא, או עדכן אחרת את יחס החומר k באמצעות שיטת סקאנט ועבור לשלב 3.3 כדי להריץ שוב17,18.
הערה: באיטרציה הראשונה, נעשה שימוש בשיטת ניוטון כדי לעדכן את יחס החומרים במקום שיטת הסקאנט. - השווה את היקפי הלומן המחושבים על ידי מודל FE במצב לחץ סיסטולי עם נתוני IVUS in vivo cine (Cmax) ובדוק אם השגיאה היחסית הייתה <1%. אם כן, הפסק את ההליך האיטרטיבי, או עדכן אחרת את קצב ההתכווצות ההיקפי S והפנה לשלב 3.4 כדי להפעיל שוב.
הערה: באיטרטיבה הראשונה, נעשה שימוש בשיטת ניוטון כדי לעדכן את קצב ההתכווצות ההיקפי במקום בשיטת הסקאנט. - רשום ערכי S ו-k אופטימליים וחשב את הפרמטרים החומריים המתאימים של מודל החומר מוני-ריבלין.
- שרטט את עקומות יחס המתח-מתיחה ההיקפי והצירי של כלי הדם הכלילי (איור 7), שניתן לגזור באופן הבא:
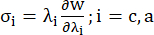 (4)
(4)
כאשר σ מייצג מתח קושי, λ מייצג יחס מתיחה, i = c, a מייצג את הכיוונים ההיקפיים והציריים.- כדי לצייר עקומת חומר בכיוון מסוים, תקן את יחס המתיחה בכיוון השני ל-1. חשב את מודול יאנג האפקטיבי בהיקפי והצירי (מסומן YMc ו-YMa, בהתאמה) כשיפוע של פונקציית קנה המידה של עקומת החומר במרווח יחס המתיחה [1.0, 1.1] כדי לשקף את קשיחות החומר הכללית של העורק הכלילי13:
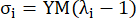 (5)
(5)
- כדי לצייר עקומת חומר בכיוון מסוים, תקן את יחס המתיחה בכיוון השני ל-1. חשב את מודול יאנג האפקטיבי בהיקפי והצירי (מסומן YMc ו-YMa, בהתאמה) כשיפוע של פונקציית קנה המידה של עקומת החומר במרווח יחס המתיחה [1.0, 1.1] כדי לשקף את קשיחות החומר הכללית של העורק הכלילי13:
- חלץ את התפלגות המתח/מתח של הפלאק בכל עת ורשום את התפלגות הצמתים וערכי המאמץ המקסימליים במהלך השלבים הסיסטוליים והדיאסטוליים (איור 8).
תוצאות
אנו מתארים בפירוט את שיטת FEMBUA, המאפשרת ניתוח מהיר של חומר פלאק וניתוח מתח של פלאק כלילי לאחר הדמיית IVUS בזמן אמת ויכולה לקבוע את תכונות החומר in vivo ואת התוצאות הביומכניות של פלאק. הפרמטרים החומריים in vivo של מודל החומר Mooney-Rivlin עבור כלי כלילי זה מסופקים בטבלה 1
Discussion
שלבים קריטיים בפרוטוקול
השלב הקריטי ביותר בגישת העדכון המבוססת על מודל אלמנטים סופיים טמון בהליך האיטרטיבי. בגישה, מודל האלמנטים הסופיים אמור לשחזר במדויק את תנועת כלי הדם הכליליים בחתך כלי הדם מתמונות IVUS in vivo cine. לשם כך, מזעור הפרש היקף הלומן בין מודל הא?...
Disclosures
המחברים מצהירים שאין ניגוד עניינים.
Acknowledgements
מחקר זה נתמך בחלקו על ידי פרויקט המדע והטכנולוגיה הרפואית של מחוז שאנדונג (מס' 202425020256 ו-202403010254), הקרן הלאומית למדעי הטבע של סין מענקים 11972117 ו-11802060, הקרן למדעי הטבע של מחוז ג'יאנגסו תחת מענק מספר BK20180352, והקרן למדעי הטבע של מחוז שאנדונג תחת מענק מספר ZR2024QA110.
Materials
| Name | Company | Catalog Number | Comments |
| Bee DICOM Viewer | SinoUnion Healthcare Inc. | Version 3.5.1 | A DICOM image reader software |
| ADINA | Adina R & D | Version 9.0 | Finite element solver |
| ImageJ | National Institutes of Health | Segmented IVUS contours | |
| MATLAB | MathWorks | Version R2018a | Commercial programming platform |
| Volcano s5 imaging system | Volcano Company | Intravascular ultrasound imaging system |
References
- Roth, G. A., et al. Global burden of cardiovascular diseases and risk factors, 1990-2019: update from the GBD 2019 study. J Am Coll Cardiol. 76 (25), 2982-3021 (2020).
- Kanwar, S. S., et al. Acute coronary syndromes without coronary plaque rupture. Nat Rev Cardiol. 13 (5), 257-265 (2016).
- Milzi, A., et al. Coronary plaque composition influences biomechanical stress and predicts plaque rupture in a morpho-mechanic OCT analysis. Elife. 10, e64020 (2021).
- Stefanati, M., et al. Effect of variability of mechanical properties on the predictive capabilities of vulnerable coronary plaques. Comput Methods Programs Biomed. 254, 108271 (2024).
- Laurent, S., et al. Expert consensus document on arterial stiffness: methodological issues and clinical applications. Eur Heart J. 27 (21), 2588-2605 (2006).
- Daisuke, K., et al. Coronary plaque phenotype associated with positive remodeling. J Cardiovasc Comput Tomogr. 18 (4), 401-407 (2024).
- Macrae, R. A., Miller, K., Doyle, B. J. Methods in mechanical testing of arterial tissue: A review. Strain. 52, 380-399 (2016).
- Hayashi, K. Experimental approaches on measuring the mechanical properties and constitutive laws of arterial walls. J Biomech Eng. 115 (4B), 481-488 (1993).
- Sacks, M. S., Sun, W. Multiaxial mechanical behavior of biological materials. Annu Rev Biomed Eng. 5, 251-284 (2003).
- Charis, C., et al. Impact of combined plaque structural stress and wall shear stress on coronary plaque progression, regression, and changes in composition. Eur Heart J. 40 (18), 1411-1422 (2019).
- Wang, L., et al. Quantifying patient-specific in vivo coronary plaque material properties for accurate stress/strain calculations: An IVUS-based multi-patient study. Front Physiol. 12, 721195 (2021).
- Guo, X. Y., et al. Quantify patient-specific coronary material property and its impact on stress/strain calculations using in vivo IVUS data and 3D FSI models: a pilot study. Biomech Model Mechanobiol. 16 (1), 333-344 (2017).
- Wang, L., et al. Quantification of patient-specific coronary material properties and their correlations with plaque morphological characteristics: An in vivo IVUS study. Int J Cardiol. 371, 21-27 (2023).
- Lu, W., et al. Accurate identification of potential critical coronary lesions for the reduction of risk of cardiovascular events: study protocol for a randomized, open-label, active-controlled multi-center trial. Clin Trial Degenerat Dis. 3 (3), 106-110 (2018).
- Lv, R., et al. Using optical coherence tomography and intravascular ultrasound imaging to quantify coronary plaque cap stress/strain and progression: A follow-up study using 3D thin-layer models. Front Bioeng Biotechnol. 9, 713525 (2021).
- Camasao, D. B., Mantovani, D. The mechanical characterization of blood vessels and their substitutes in the continuous quest for physiological-relevant performances. A critical review. Mater Today Bio. 10, 100106 (2021).
- Holistic Numerical Methods Institute at University of South Florida. . Secant Method. , (2003).
- Barnes, J. An algorithm for solving nonlinear equations based on the secant method. Comp J. 8 (8), 66-72 (1965).
- Liu, M., Liang, L., Sun, W. A new inverse method for estimation of in vivo mechanical properties of the aortic wall. J Mech Behav Biomed Mater. 72, 148-158 (2017).
- Yu, H., et al. Patient-specific in vivo right ventricle material parameter estimation for patients with tetralogy of Fallot using MRI-based models with different zero-load diastole and systole morphologies. Int J Cardiol. 276, 93-99 (2019).
- Meuwissen, M. H. H., Oomens, C. W. J., Baaijens, F. P. T., Petterson, R., Janssen, J. D. Determination of the elasto-plastic properties of aluminium using a mixed numerical-experimental method. J Mater Process Technol. 75, 204-211 (1998).
- Davis, F. M., Luo, Y., Avril, S., Duprey, A., Lu, J. Local mechanical properties of human ascending thoracic aneurysms. J Mech Behav Biomed Mater. 61, 235-249 (2016).
- Fan, L., Wang, H., Kassab, G. S., Lee, L. C. Review of cardiac-coronary interaction and insights from mathematical modeling. WIREs Mech Dis. 16 (3), e1642 (2024).
- Andreas, W., et al. A finite element updating approach for identification of the anisotropic hyperelastic properties of normal and diseased aortic walls from 4D ultrasound strain imaging. J Mech Behav Biomed Mater. 58, 122-138 (2016).
- Liu, M., et al. Identification of in vivo nonlinear anisotropic mechanical properties of ascending thoracic aortic aneurysm from patient-specific CT scans. Sci Rep. 9, 12983 (2019).
- Trabelsi, O., Duprey, A., Favre, J. P., Avril, S. Predictive models with patient specific material properties for the biomechanical behavior of ascending thoracic aneurysms. Ann Biomed Eng. 44, 84-98 (2016).
- Cosentino, F., et al. On the role of material properties in ascending thoracic aortic aneurysms. Comput Biol Med. 109, 70-78 (2019).
- Krauz, K., et al. The role of epicardial adipose tissue in acute coronary syndromes, post-infarct remodeling and cardiac regeneration. Int J Mol Sci. 25 (7), 3583 (2024).
- McCracken, I. R., Smart, N. Control of coronary vascular cell fate in development and regeneration. Semin Cell Dev Biol. 155 (Pt C), 50-61 (2024).
- Holzapfel, G. A., et al. Determination of layer-specific mechanical properties of human coronary arteries with nonatherosclerotic intimal thickening and related constitutive modeling. Am J Physiol Heart Circ Physiol. 289 (5), H2048-H2058 (2005).
- Han, Y., et al. Ventricle stress/strain comparisons between Tertalogy of Fallot patients and healthy using models with different zero-load diastole and systole morphologies. PLoS One. 14 (8), e0220328 (2019).
- Ryo, K., et al. Role of the low-density lipoprotein-cholesterol/high-density lipoprotein-cholesterol ratio in predicting serial changes in the lipid component of coronary plaque. Circ J. 81 (10), 1439-1446 (2017).
- Thomas, T. W., et al. In vivo characterization and quantification of atherosclerotic carotid plaque components with multidetector computed tomography and histopathological correlation. Arterioscler Thromb Vasc Biol. 26 (10), 2366-2372 (2006).
- Masanori, K., et al. In vivo quantitative tissue characterization of human coronary arterial plaques by use of integrated backscatter intravascular ultrasound and comparison with angioscopic findings. Circulation. 105 (21), 2487-2492 (2002).
- Roach, M. R., Burton, A. C. The reason for the shape of the distensibility curves of arteries. Can J Biochem Physiol. 35, 681-690 (1957).
- Fung, Y. C., Liu, S. Q. Strain distribution in small blood vessel with zero-stress state taken into consideration. Am J Physiol. 262, 544-552 (1992).
- Ohayon, J., et al. Influence of residual stress/strain on the biomechanical stability of vulnerable coronary plaques: Potential impact for evaluating the risk of plaque rupture. Am J Physiol Heart Circ Physiol. 293, 1987-1996 (2007).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved