È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Una procedura ottimizzata per fluorescenza selezione delle cellule attivate (FACS) Isolamento del Sistema Nervoso Autonomo progenitori neurali da organi viscerali di topi fetali
In questo articolo
Erratum Notice
Riepilogo
Una procedura ottimizzata per purificare neurali cresta progenitori neuronali derivate da tessuti fetali del mouse è descritto. Questo metodo sfrutta espressione da alleli reporter fluorescenti per isolare popolazioni discreti fluorescenza selezione delle cellule attivate (FACS). La tecnica può essere applicata per isolare sottopopolazioni neuronali durante lo sviluppo o da tessuti adulti.
Abstract
Durante lo sviluppo cresta neurale (NC) di derivazione progenitori neuronali migrano dal tubo neurale per formare gangli autonomo negli organi viscerali come l'intestino e delle basse vie urinarie. Sia durante lo sviluppo e nei tessuti maturi queste cellule sono spesso disperse in tutta tessuti in modo che l'isolamento delle popolazioni discrete mediante metodi come la cattura laser micro-dissezione è difficile. Possono comunque essere visualizzati direttamente tramite l'espressione di giornalisti fluorescenti guidati da regioni regolatorie dei geni specifici neuroni, come la tirosina idrossilasi (TH). Noi descriviamo un metodo ottimizzato per alte rese di + TH vitale progenitori neuronali da tessuti di topo fetali viscerali, inclusi intestino e inferiore del tratto urogenitale (LUT), basata su fluorescenza dissociazione e selezione delle cellule attivate (FACS).
Il gene codifica per la Th enzima limitante per la produzione di catecolamine. Enterici progenitori neuronali cominciano a esprimere TH durcorso del loro migrazione nell'intestino fetale 1 e TH è anche presente in un sottoinsieme di adulti neuroni gangli pelvico 2-4. La prima comparsa di questa linea e la distribuzione di questi neuroni in altri aspetti della LUT, e il loro isolamento non è stata descritta. Progenitori neuronali che esprimono TH possono essere facilmente visualizzati tramite espressione di EGFP in topi portatori del transgene costrutto Tg (Th-EGFP) DJ76Gsat/Mmnc 1. Abbiamo ripreso espressione di questo transgene nei topi fetali per documentare la distribuzione dei TH + celle nella LUT sviluppando a 15,5 dopo il coito giorni (DPC), che designa la mattina del rilevamento Plug come 0,5 DPC, e ha osservato che un sottoinsieme di progenitori neuronali nel coalescenza pelvica gangli express EGFP.
Per isolare LUT TH + progenitori neuronali, abbiamo ottimizzato metodi che sono stati inizialmente utilizzati per purificare le cellule della cresta neurale staminali da intestino del mouse fetale 2-6. Sforzi precedenti per isolare NC-derivati popolazioni invocatidigestione con un cocktail di collagenasi e tripsina per ottenere sospensioni cellulari per citometria a flusso. Nelle nostre mani questi metodi di sospensioni di cellule prodotte dal LUT con la vitalità relativamente bassa. Data la già bassa incidenza dei progenitori neuronali nei tessuti fetali LUT, abbiamo deciso di ottimizzare i metodi di dissociazione tali che la sopravvivenza delle cellule si dissocia in finale sarebbe aumentato. Abbiamo determinato che la dissociazione dolce in Accumax (Cell Technologies innovative, Inc), manuale di filtraggio, e il flusso di smistamento a basse pressioni ci hanno permesso di ottenere la sopravvivenza sempre maggiore (> 70% delle cellule totali) con rese successivi di progenitori neuronali sufficiente per l'analisi a valle. Il metodo che descriviamo può essere generalmente applicato a isolare una varietà di popolazioni di neuroni da entrambi i tessuti fetali o adulto di topo.
Protocollo
1. Preparazione di Media (Tutte le fasi fatto in cappa di coltura di tessuti)
- Combina il seguente: 44 L-15 ml media, 0,5 ml 100X penicillina / streptomicina (P / S), 0,5 ml 100 mg / ml di albumina sierica bovina (BSA), 0,5 ml HEPES 1M, 5 ml di acqua Tissue Culture Grade. Assicurarsi di mescolare BSA e P / S bene prima di aggiungere. Questo volume dovrebbe essere adeguato per la dissociazione di un massimo di cinque tipi diversi tessuti. Questo supporto sarà utilizzato nel passaggio 3,4 per preparare le soluzioni di raffreddamento rapido per l'uso dopo dissociazione enzimatica del tessuto.
- Media filtrante sebbene 0,22 micron polieteresulfone (PES) del filtro.
- Preparare la soluzione Balanced Salt 1X Hank (HBSS) e fosfato 1X Buffered Saline (PBS) provenienti dalle scorte di 10X usando cultura dell'acqua dei tessuti di qualità. Filtrare su filtro 0,22 micron PES. Grandi volumi di questi reagenti possono essere preparate in anticipo e conservato a 4 ° C, aliquotando piccoli volumi in una cappa coltura tissutale come necessario.
- Riempire più provette da 15 ml coniche con 1x HBSS (numero di tubi per eguagliare il numero di tessuti si ha intenzione di sub-dissezione), mantenendo i tubi su ghiaccio.
2. Dissezione
- Eutanasia cronometrato del mouse in stato di gravidanza in conformità con la cura degli animali istituzionali e protocolli delle commissioni di utilizzo autorizzati e trasferimento in utero di 60 o 100 mm Petri contenente ghiacciata 1X PBS.
- Rimuovere embrioni da utero e l'eutanasia per decapitazione in ghiacciato 1X PBS. Schermo individualmente sotto l'illuminazione a fluorescenza, dividendosi in positivo transgenici e wild-type (WT) nontransgenic piscine. Mantenere gli embrioni in ghiacciato 1X PBS in tutta la dissezione.
- Sotto un microscopio da dissezione, sub-sezionare il tratto urogenitale. Tenere l'embrione in atto a livello degli arti anteriori con pinze sottili. Rimuovere il visceri dal fegato fino al tubercolo genitale inserendo pinza a livello del diaframma poi bruscamente tirando gli organi interni basso e lontano dalla parete del corpo dorsale.
- Ulteriori sub-sezionare il tessuto diinteresse dal tessuto circostante (Figura 1). Collocare ciascuna singolarmente sub-sezionato tipo di tessuto in una provetta da 15 ml contenente ghiaccio HBSS freddo 1X. Pool ogni tipo di tessuto insieme secondo fenotipo embrionale (ossia tutte le GFP + campioni di intestino fetale sono raggruppate in un unico tubo 15 ml).
- In parallelo, sezionare i tessuti comparabili da wild-type embrioni da utilizzare per i controlli di compensazione in citometria a flusso.
3. La dissociazione dei tessuti Subdissected
- Pellet sub-sezionato tessuto mediante centrifugazione a 210 centrifuga relativa (RCF), 4 ° C per 5 min. Dopo la centrifugazione, aspirare fuori come HBSS il più possibile.
- Risospendere il precipitato di tessuto in Accumax (Innovative Cell Technologies, Inc), avendo cura di cambiare puntali per pipette tra ciascun campione per evitare la contaminazione incrociata dei tipi di tessuto. La quantità di Accumax aggiunto può essere scalato per quantità maggiori o minori di tessuto. Tipicamente per 1-5 Campioni dell'intestino fetale, 1 ml di Accumax verrebbe utilizzato ma piscine tessuto più grandi richiedono un maggior volume per ottenere dissociazione.
- Porre le provette 37 ° C in bagno d'acqua per 20-45 min a seconda fase del tessuto che viene isolato (per es 13,5 intestino DPC 20 min, 15,5 intestino DPC 35 min). A metà se il tempo dissociazione, manualmente rompere il tessuto battendo il tubo contro il lato del bagno d'acqua (o qualsiasi superficie solida) e da "sfogliare" il tubo (come si shake down un vecchio termometro a mercurio). Alla fine del tempo di dissociazione ripetere la shake giù operazione più volte per dissociare ulteriormente il campione. Per i campioni più fragili, ridurre il vigorousness del shake down e di utilizzare invece triturazione pipetta durante il Passo 3,5 per raggiungere un adeguato livello di dissociazione. I tempi tipici di dissociazione per 14,5 e 15,5 DPC DPC LUT sono 35 e 45 min, rispettivamente.
- Mentre il tessuto è in incubazione Accumax, make up Quenching cosìluzioni, chiamato Quench e Quench 1:5. Quench è fatto con l'aggiunta di 45 microlitri 5 mg / ml DNasi I a 6 ml L-15 Media. Quench 01:05 è fatta con l'aggiunta di 45 microlitri 5 mg / ml DNasi I 30 ml L-15 Media.
- Alla fine di dissociazione, spostare provette da 15 ml su ghiaccio e subito aggiungere 1 ml Quench in ciascun tubo. IMPASTARE ciascun campione su e giù finché il tessuto è quasi completamente dissociato (Figura 2). Ci saranno ancora alcuni piccoli pezzi di tessuto presente nella soluzione. Il raggiungimento di un campione del tutto omogeneo non è né facilmente realizzabile né auspicabile in quanto può portare a scarsa vitalità delle cellule.
- Mantenere campione su ghiaccio per quanto possibile per il resto del protocollo. Assicurarsi di utilizzare un nuovo puntale per pipetta quando pipettando su Quench o Quench 01:05 per evitare la contaminazione incrociata dei campioni.
4. Filtraggio sospensione cellulare
- Utilizzo di pinze che sono stati immersi in 70% etanolo, posizionare un 3 cm quadrati di 38 um membrana maglia di nylon (Sefar America) sulla bocca di un nuovo tubo di 15 ml. Celle filtranti attraverso la rete pipettando nella centro della membrana usando punte strette foro. Se la membrana si satura mentre filtraggio, rimuoverlo, asciugare la bocca del tubo con un Kimwipe, e utilizzare un nuovo pezzo di maglia di nylon per filtrare il resto della sospensione cellulare. Una volta che tutte le cellule sono stati filtrati, usare 1 ml Quench 1:5 a sciacquare il tubo e filtrare tutte le cellule rimanenti.
- Quando il filtro è completa, o quando si sostituisce una membrana intasato, utilizzare forcipe per arrotolare i lati della maglia e pulire la membrana attraverso superiore del tubo per rimuovere eventuali gocce di cellule sospese.
- Pellet sospensione cellulare mediante centrifugazione a 210rcf, 4 ° C per 5 min. Aspirare off surnatante e risospendere pellet in 1 ml Quench 1:5.
- Sospensione cellulare attraverso il filtro rete di nylon in 5 provette di polistirene ml. Lavare tubo di 15 ml con 1 ml Quench 1:5 e filtro per catturare tutte le cellule rimanenti.
5. Preparazione dei campioni per FACS
- Se si utilizza lo stesso tessuto per l'ordinamento e per i controlli di compensazione, trasferire 1/10 ° a 1/20 del volume esimo campione ad un nuovo tubo 5 ml polistirene da utilizzare per i controlli di compensazione. Dividere il wild-type campione di tessuto in due parti. Una parte viene macchiata di tipo selvatico (WT solo) mentre la seconda metà avrà 7-Aminoactinomycin D (7-AAD, un intercalatore fluorescente escluso dalle cellule vivi utilizzati come "viabilità macchia") aggiunto ad esso (7-AAD solo ). Questi singoli controlli sono necessari per consentire la compensazione di eventuali sovrapposizioni tra le spettrali emissione di fluorofori discreti al selezionatore di flusso. Ad esempio, per un reporter fluorescente come EGFP, necessari controlli dovrebbe includere: EGFP solo, non marcate cellule in peso, e un tubo colorato con 7-AAD solo (figura 3).
- Riempire tutte le provette da 5 ml contenenti sospensione cellulare con Quench 1:5 e centrifugare a 210rcf, 4 ° C per 5 min. Aspirare il surnatante, lasciando circa 200 ul di liquidoin provetta.
- Diluire 7-AAD 1:1000 in Quench 1:5. Aggiungi 7-AAD diluizione colorazione a 7-AAD controllo della compensazione solo e campioni da ordinati. Non aggiungere 7-AAD alla EGFP solo o WT controlli di compensazione solo. Volume di 7-AAD da aggiungere variano in base alla quantità di materiale di partenza e dimensione del pellet cellulare ottenuto. Dopo 7-AAD è stato aggiunto a tubi appropriati, i campioni sono pronti per essere ordinati.
Tessuto Esempio Pool Size Volume 7-AAD da aggiungere * provetta 15,5 DPC Intestino 1-5 200 pl 15,5 DPC LUT 1-5 150 pl
Tabella 1. Quantità di 7-AAD aggiunto dissocia tessuti diversi * l'ammontare totale finale in ciascun tubo varia da una quantità variabile dal 50-100 pl poiché l'aspirazione di media è unn processo approssimativo ed eseguito per evitare il pellet. Volumi finali non sono misurate in modo da minimizzare la manipolazione di cellule in soluzione. - Preparare le provette di raccolta per catturare le cellule per l'isolamento di RNA con l'aggiunta di 0,75 ml TRIzol-LS ai tubi microcentrifuga 1,5 ml.
- Se la raccolta di cellule per la coltura in vitro, anziché isolamento RNA, cellule ordinamento direttamente in automantenimento media in piastre da 6 pozzetti di coltura, rivestito con fibronectina e riempito con mezzi come descritto in precedenza. 2,6,7
6. Citometria a Flusso
- Al citofluorimetro, valutare la compensazione controlli prima, avendo cura di lavare di nuovo tra ciascun campione per evitare la contaminazione. Utilizzare i profili dei campioni di compensazione per impostare tensioni / cancelli per l'ordinamento. Si noti che se le cellule positive nel tessuto desiderato sono presenti in numero di limitazione, un tessuto distinto può essere utilizzato per stabilire le impostazioni di compensazione finché l'intensità di fluorescenza e la dimensione della cellatra i campioni sono paragonabili.
- Impostare i parametri di compensazione e cancelli per evitare le cellule morte che occupano 7-AAD dye e raccogliere le cellule che presentano alta intensità di fluorescenza GFP rispetto ai controlli non colorati (Figura 4).
- Ordinare massimamente 25.000 cellule in ciascuna provetta. L'ordinamento deve essere effettuata presso la pressione più bassa possibile con un ugello largo foro e bassa portata (ad esempio, 17psi, 100 ugelli um, 3000 eventi al secondo) per preservare la vitalità neuronale progenitore. Per i tipi di isolare le cellule EGFP + svolgiamo le nostre isolamenti su un BD Biosciences FACSAriaII utilizzando un laser 488nm 20mW per eccitare il reporter EGFP.
- Se i campioni di cellule contengono concentrazioni elevate, si consiglia di diluire la sospensione cellulare inoltre, si avvale 1:1000 7-AAD macchia per raggiungere efficienze di cattura più elevati durante l'ordinamento.
- Vortex ogni provetta delle cellule catturato in TRIzol-LS subito dopo l'ordinamento.
7. Risultati rappresentativi
Tissue dissociazione per produrre un sospensioni cellulari per l'ordinamento di flusso è un delicato equilibrio tra adeguata digestione enzimatica ed evitare l'eccessiva digestione che può portare a Viabilità di cellule basse. Un esempio di tessuto desiderato livello di dissociazione è mostrato in Figura 2. Nel tessuto opportunamente digerito pezzi prima triturazione manuali di organi sub-sezionati sono ancora ben evidente (Figura 2b, 2f). In tessuti che vengono trattate enzimaticamente per troppo tempo un periodo di tempo o eccessivamente alta concentrazione di enzima, la sospensione risultante manchino pezzi residui grandi quantità di tessuto (figura 2d, 2h).
Adeguata dissociazione e filtraggio manuale produrre profili di ordinamento in citometria a flusso che mostrano tipicamente superiore al 90% di cellule vitali e mostrano alti livelli di espressione di EGFP (Figura 4). Popolazioni cellulari ottenuti con questo metodo illustrano beneeconomico-finanziaria e può essere catturata per la cultura o la successiva analisi dell'espressione genica mediante gating per la cattura di EGFP + progenitori neuronali.
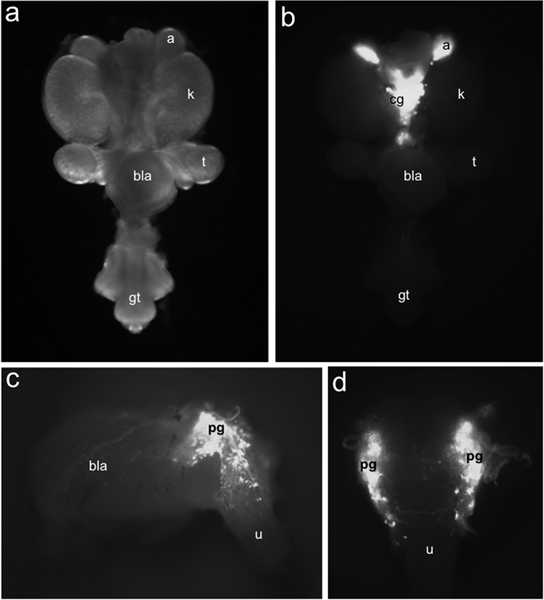
Figura 1. Distribuzione dei TH-EGFP + progenitori neuronali LUT del mouse fetale. Whole-mount tratto urogenitale a 15.5 dpc visto ventralmente sotto illuminazione in campo chiaro (a) rispetto alla distribuzione delle cellule EGFP + etichettati da TH-EGFP espressione del transgene identificato con l'illuminazione a fluorescenza (b). TH-EGFP espressione è presente in ghiandole surrenali (a) e nei gangli celiaco trova medialmente (cg). Laterale (c) vista di 15,5 DPC TH-EGFP sotto-sezionati mostre vescica fluorescenza da espressione del transgene nei gangli pelvica (pg), la parete della vescica (bla) e l'uretra (u). In vista dorsale (d) EGFP celle + sono evidenti nell'uretra anteriore dorsale. Altre etichette: reni (k), del testicolo (t), della vescica (bla) e tubercolo genitale (gt).

Figura 2. Immagini brightfield del 15 LUT DPC fetale (a) e intestino (e), rispettivamente, ripresa metà del periodo di incubazione dissociazione, alla fine dell'incubazione dissociazione prima interruzione (b, f), dopo la rottura manuale (c, g), e in un campione che è stato troppo dissociata (d, h).
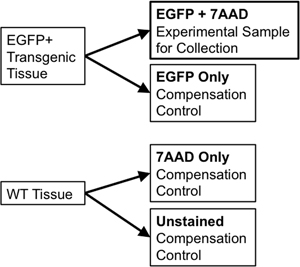
Figura 3. Schema illustra compensazione controlli necessari per stabilire rigorosi parametri di gating FACS.
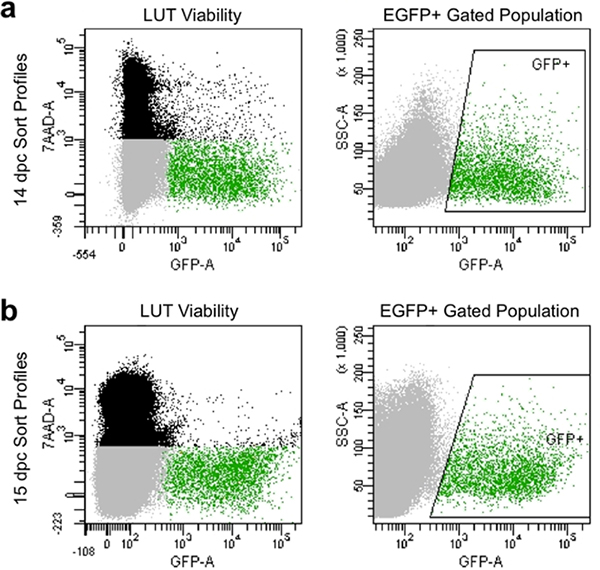
Figura 4. Immagine rappresentativa di profili di ordinamento di flusso a 14,5 DPC (a) e 15,5 DPC (b). Popolazione di colore è composta da singole cellule basate sulla dispersione in avanti e laterale che sono morti ed etichettati da7-AAD fluorescenza. Grigio popolazione è composta da cellule di singoletto a base di scatter in avanti e laterale che hanno escluso 7-AAD e sono quindi vitali. Verde popolazione gated è indicato dal box "GFP +" area ed è costituito da singole celle sono esclusi 7-AAD (vitale) e presentano fluorescenza EGFP.
Discussione
Linee giornalista del mouse che esprimono giornalisti fluorescenti sono sempre ampiamente disponibili attraverso molteplici sforzi nella genetica murina comunità 1,8,9. Come risultato il metodo dissociazione illustrato qui può essere ampiamente utilizzato per l'isolamento di distinti sottotipi neuronali basato su neurotrasmettitore o pattern di espressione del recettore da entrambi i tessuti fetali o adulto. Mentre ci sono ottimizzate questo metodo basato su espressione di un reporter fluorescente trans...
Divulgazioni
Non ci sono conflitti di interesse dichiarati.
Riconoscimenti
Gli autori desiderano ringraziare Catherine Alford per suggerimenti su metodi di dissociazione cellulare e Kevin Weller, David Flaherty e Bretagna Matlock per il supporto nel Resource Citometria a Flusso in comune presso la Vanderbilt University Medical Center e Melissa A. Musser per l'assistenza artistica con illustrazioni. Ringraziamo Drs. Jack Mosher e Sean Morrison per consigli sulla realizzazione di isolamento dei progenitori neuronali. Il VMC Resource Citometria a Flusso in comune è sostenuta dalla Vanderbilt Ingram Cancer Center (P30 CA68485) e la Vanderbilt Digestive Disease Research Center (P30 DK058404). Questo lavoro è stato sostenuto da un finanziamento da US National Institutes of sovvenzioni Salute DK064251, DK086594 e DK070219.
Materiali
| Name | Company | Catalog Number | Comments |
| Reagente Nome | Venditore | Numero di catalogo | Comments |
| Accumax | Sigma (MFR: Cell Technologies innovative) | A7089-100ML | Conservare congelato in aliquote da 1 ml |
| DNasi I | Sigma | D-4527 | Conservati congelati a -20 ° C 5 mg / ml in 1xHBSS, (Usato in Quench, Quench 01:05) |
| 10X PBS pH 7,4 | Gibco | 70011-044 | Portare a 1x con acqua grado coltura tissutale poi filtrare sterile |
| 10X HBSS w / o Ca o Mg | Gibco | 14185-052 | Portare a 1x con acqua grado coltura tissutale poi filtrare sterile |
| Leibovitz L-15 | Gibco | 21083027 | |
| Penicillina / streptomicina 100X | Gibco | 15140-133 | Conservare aliquote a -20 ° C |
| BSA | Sigma | A3912-100G | Conservare aliquote a -20 ° C, 100 mg / ml in acqua |
| Biowhittaker 1M in HEPES 0,85% NaCl | Lonza | 17-737E | |
| 38 micron NITEX Nylon Mesh Membrane | Sefar l'America | 3-38/22 | Tagliare a ~ 3 cm quadrati. UV trattare durante la notte a sterilizzare in cappa coltura tissutale. |
| 7-AAD | Invitrogen | A1310 | 1 mg / ml |
| TRIzol LS | Invitrogen | 10296-028 | |
| 5 ml in polistirolo tubi | Falco | 352058 | |
| Provette da 15 ml coniche | Corning | 430790 | |
| Belle dissettore | Strumenti scientifici Belle | 11251-30 | Dumont # 5 forcep, Dumoxel, standard punta 0.1x0.06mm |
| Dissezione Spoon | Strumenti scientifici Belle | 10370-18 |
Riferimenti
- Gong, S. A gene expression atlas of the central nervous system based on bacterial artificial chromosomes. Nature. 425, 917-925 (2003).
- Morrison, S. J., White, P. M., Zock, C., Anderson, D. J. Prospective identification, isolation by flow cytometry, and in vivo self-renewal of multipotent mammalian neural crest stem cells. Cell. 96, 737-749 (1999).
- Kruger, G. M. Neural crest stem cells persist in the adult gut but undergo changes in self-renewal, neuronal subtype potential, and factor responsiveness. Neuron. 35, 657-669 (2002).
- Bixby, S., Kruger, G. M., Mosher, J. T., Joseph, N. M., Morrison, S. J. Cell-intrinsic differences between stem cells from different regions of the peripheral nervous system regulate the generation of neural diversity. Neuron. 35, 643-656 (2002).
- Walters, L. C., Cantrell, V. A., Weller, K. P., Mosher, J. T., Southard-Smith, E. M. Genetic background impacts developmental potential of enteric neural crest-derived progenitors in the Sox10Dom model of Hirschsprung disease. Human Molecular Genetics. , (2010).
- Corpening, J. C. Isolation and live imaging of enteric progenitors based on Sox10-Histone2BVenus transgene expression. Genesis. 49, 599-618 (2011).
- Morrison, S. J. . Isolation of fetal rat neural crest stem cells (NCSC) from gut and sciatic nerve. , (2012).
- Skarnes, W. C. A conditional knockout resource for the genome-wide study of mouse gene function. Nature. 474, 337-342 (2011).
- Harding, S. D. The GUDMAP database--an online resource for genitourinary research. Development. 138, 2845-2853 (2011).
- Joseph, N. M. Enteric glia are multipotent in culture but primarily form glia in the adult rodent gut. J. Clin. Invest. 121, 3398-3411 (2011).
- Newgreen, D. F., Murphy, M. Neural crest cell outgrowth cultures and the analysis of cell migration. Methods Mol. Biol. 137, 201-211 (2000).
Erratum
Formal Correction: Erratum: An Optimized Procedure for Fluorescence-activated Cell Sorting (FACS) Isolation of Autonomic Neural Progenitors from Visceral Organs of Fetal Mice
Posted by JoVE Editors on 10/01/2012. Citeable Link.
The authors middle initials were omitted from the publication of An Optimized Procedure for Fluorescence-activated Cell Sorting (FACS) Isolation of Autonomic Neural Progenitors from Visceral Organs of Fetal Mice.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon