Method Article
Formazione Light-mediata ed il modello di idrogel per colture cellulari
In questo articolo
Riepilogo
We describe a sequential process for light-mediated formation and subsequent biochemical patterning of synthetic hydrogel matrices for three-dimensional cell culture applications. The construction and modification of hydrogels with cytocompatible photoclick chemistry is demonstrated. Additionally, facile techniques to quantify and observe patterns and determine cell viability within these hydrogels are presented.
Abstract
Clicca chimiche sono stati studiati per l'impiego in numerose applicazioni biomateriali, tra cui la somministrazione di farmaci, ingegneria dei tessuti, e la coltura cellulare. In particolare, reazioni click luce-mediata, quali reazioni tiolo-ene e tiolo-ino photoinitiated, garantire un controllo spaziotemporale sopra proprietà del materiale e consentire la progettazione di sistemi con un alto grado di controllo di proprietà dall'utente diretto. Fabbricazione e modifica di biomateriali a base di idrogel che utilizzano la precisione offerta dalla luce e la versatilità offerta da questi chimiche tiolo-X Photoclick sono di crescente interesse, in particolare per la coltura di cellule all'interno di ben definiti, microambienti biomimetici. Qui, descriviamo i metodi per la photoencapsulation delle cellule e la successiva photopatterning di segnali biochimici all'interno di matrici di idrogel che utilizzano blocchi di costruzione versatili e modulari polimerizzati da una reazione Photoclick tiolo-ene. In particolare, un approccio è presentato per constructing idrogel da allilossicarbonil (Alloc) legami crociati del peptide -functionalized e frazioni peptidiche ciondolo e poli tiolo-funzionalizzati (glicole etilenico) (PEG), che rapidamente polimerizzare in presenza di litio acylphosphinate fotoiniziatore e dosi cytocompatible di lunghezza d'onda ultravioletta (UV). Facile tecniche di visualizzare photopatterning e quantificare la concentrazione di peptidi aggiunti sono descritti. Inoltre, i metodi sono stabiliti per le cellule incapsulamento, in particolare le cellule staminali mesenchimali umane, e determinare la loro vitalità e l'attività. Mentre la formazione ed il modello iniziale di idrogel tiolo-alloc sono mostrati qui, queste tecniche ampiamente possono essere applicati ad un certo numero di sistemi materiali altra luce e radicale-iniziati (ad esempio, tiolo-norbornene, tiolo-acrilato) per generare substrati fantasia.
Introduzione
Istruzioni chimiche sono sempre più utilizzati nella progettazione di materiali per numerose applicazioni biomediche, tra somministrazione di farmaci, ingegneria dei tessuti, e coltura cellulare controllata, a causa dei loro selettive, reattività cytocompatible efficienti, e spesso. 1-3 chimiche Photoclick che utilizzano la luce per attivare o avviare reazioni (ad esempio, azide-alchino, 4 tiolo-ene, 5 e tetrazolo-alchene 6) sono di particolare interesse per la formazione o la modifica di biomateriali. Tassi rapidi in condizioni miti e il controllo di quando e dove si svolgono con la luce rendono queste reazioni particolarmente adatto per il controllo user-diretto di proprietà biomateriali in presenza di cellule. 7,8 In particolare, sono stati utilizzati chimiche tiolo-ene Photoclick per generare biomateriali a base di idrogel con robuste caratteristiche meccaniche 5,9 e per l'incapsulamento di una grande varietà di tipi di cellule, tra cui, ma nont limitato a, le cellule umane staminali mesenchimali (hMSCs), i fibroblasti, condrociti e cellule pancreatiche, con la promessa per coltura cellulare e la consegna. 10,11 Inoltre, questi chimiche sono state utilizzate per il patterning spaziale di segnali biochimici per imitare gli aspetti chiave della microambienti cellulari nativi e agevola gli opportuni interazioni cellula-matrice, tra cui l'adesione, la differenziazione, e l'invasione. 3,12
Per la costruzione di idrogel tiolo-ene con luce, peptidi contenenti residui di cisteina (tiolo) comunemente vengono fatte reagire con polimeri funzionalizzati con acrilati o norborneni ( 'ene') per una rapida, la polimerizzazione photoinitiated in condizioni cytocompatible. 13 Espansione questa cassetta degli attrezzi, abbiamo cercato di stabilire metodi per la formazione di idrogel con nuovi blocchi di costruzione versatile e accessibile che ha richiesto l'elaborazione di sintesi minimo o erano disponibili in commercio verso la loro ampio utilizzo come matrici extracellulari sintetici.Uno per il ciondolo, gruppi integrine vincolante per promuovere l'adesione delle cellule [K (alloc) GWGRGDS = Pep1Alloc] o due per legami crociati non degradabili o cellule-degradabili [K (14: In particolare, i peptidi sono stati modificati con allilossicarbonil (Alloc) lisine -protected alloc) RGKGRKGK (alloc) G o KK (alloc) GGPQGIWGQGK (alloc) K = Pep2Alloc, rispettivamente]. Con queste sequenze, le condizioni sono state stabilite per la reazione rapida (1-5 min), con quattro bracci poli tiolo-modificato (glicole etilenico) (PEG4SH) utilizzando dosi cytocompatible della lunghezza d'onda della luce UV (10 mW / cm 2 a 365 nm) e litio fotoiniziatore fenil-2,4,6-trimethylbenzoylphosphinate (LAP). Gli idrogel risultanti erano stabile in condizioni di coltura cellulare per settimane. Per abilitare la degradazione delle cellule-driven e rimodellamento, un peptide enzimaticamente-cleavable è stata costituita entro i legami crociati gel (cioè, GPQGIWGQ), 15 e un modello di cellula primaria, le cellule staminali mesenchimali umane (hMSCs), è rimasto altamente praticabile dopo l'incapsulamento e during cultura all'interno di queste matrici. Inoltre, i peptidi sono stati spazialmente fantasia all'interno di questi materiali, e hMSCs rimanere vitali e metabolicamente attiva in condizioni photopatterning. Alternative sequenze peptidiche pendente, non è riportato (es IKVAV, YIGSR, GFOGER, ecc), anche può essere incorporato all'interno di matrici per sondare interazioni cellulari aggiuntivi con il microambiente circostante. Questi risultati sono promettenti per l'applicazione di questi materiali idrogel a base per tridimensionale coltura cellulare (3D) e la consegna di studiare e interazioni dirette cellula-matrice per una varietà di tipi cellulari.
Qui, metodi per photoencapsulate cellule e segnali biochimici successivamente photopattern all'interno del sistema idrogel proposto sono presentati (Figura 1). Tecniche per osservare e quantificare questi photopatterns anche sono dimostrati: in particolare, i) l'utilizzo quantitativo e qualitativo dei test di Ellman per determinare la Modificazione dei tioli liberi all'interno substrati a motivi geometrici e ii) l'uso qualitativa complementare di peptidi fluorescenti (AF488Pep1Alloc) per osservare questi modelli in tre dimensioni. Inoltre, metodi per determinare la vitalità (Live / Dead vitalità / citotossicità colorazione) e l'attività metabolica (MTS; 3- (4,5-dimetiltiazol-2-il) -5- (3-carboxymethoxyphenyl) -2- (4-solfofenil) -2H-tetrazolium) sono presentati in modo tale che gli utenti possono determinare il citocompatibilità delle condizioni photoencapsulation e photopatterning per le diverse linee di cellule all'interno di matrici di idrogel. Mentre il protocollo è dimostrata per un sistema Photoclick idrogel basato sulla luce facile, le tecniche possono essere applicate a numerosi altri sistemi idrogel radicalmente avviate per photoencapsulation e photopatterning in presenza di cellule.
Protocollo
1. Preparazione dei Materiali per Hydrogel Formazione
- Sintetizzare ciondolo (Pep1Alloc, AF488Pep1Alloc) e peptidi reticolazione (Pep2Alloc) di peptide sintesi in fase solida standard (SFF) tecniche e tiolo-funzionalizzati polimero di procedura in tre fasi per la modifica gruppo terminale (PEG4SH). 14,16 In alternativa, acquistare PEG4SH (M n ~ 20 kDa), Pep1Alloc, e Pep2Alloc commercialmente.
- Sintetizzare il fotoiniziatore (LAP) dalla reazione in due fasi descritto di seguito. 14,17 Eseguire i passaggi di sintesi (1.2.1-1.2.11) in una cappa aspirante e usare cautela quando si maneggiano prodotti chimici (indossare guanti, indumenti e occhiali di protezione) . LAP può anche essere acquistato in commercio.
- Secco tutta la vetreria in forno (> 2 ore, 80 ° C).
- Aggiungere un ancoretta a un singolo collo fiasco vuoto a fondo tondo (100 ml) e coprire con un setto.
- Fissare il matraccio in cima ad una piastra calda agitazione magnetica con un supporto ad anello e morsetto.
- ioNSERT un ago (18 G) attraverso il setto e lasciare l'estremità esterna aperta all'atmosfera. Inserire un secondo ago collegato a una linea di gas inerte. Aprire la linea di gas inerte (per esempio, argon o azoto) e spurgare il matraccio per 10-15 min.
NOTA: Il sistema sarà continuamente spurgato con gas inerte, argon o azoto, durante la reazione. - Trasferimento 1,5 g (~ 1,4 ml) dimetil fenilfosfonito (ATTENZIONE) al pallone, usando una siringa con ago per perforare attraverso il setto. Accendere il piatto mescolare (velocità media) e fare attenzione che i contenuti non spruzzata su pareti del pallone.
- Aggiungere 1,6 g (~ 1,46 ml) 2,4,6-trimetilbenzoil cloruro (ATTENZIONE) goccia a goccia al pallone contenente dimetil fenilfosfonito, utilizzando una siringa con un ago per perforare il setto.
- Coprire il recipiente di reazione con un foglio per proteggere dalla luce e agitare per 18 ore sotto argon o azoto.
- Il giorno successivo, aumentare l'altezza del pallone, generare un bagno di olio sulla agitatore,ND attenzione abbassare il pallone nel bagno d'olio. Riscaldare il bagno ed il pallone a 50 ° C, mantenendo sotto agitazione magnetica.
- Sciogliere 3,05 g bromuro di litio in 50 ml di 2-butanone. Sollevare la beuta dal bagno d'olio e aggiungere la soluzione di bromuro di litio al pallone a fondo tondo, rimuovendo brevemente il setto per versare nel pallone.
- Sigillare il pallone di nuovo con il setto (ATTENZIONE: setto avrà ancora un ago che porta alle linee di argon e un ago per sfogare), abbassare il pallone di nuovo in bagno d'olio riscaldato, e consentire la reazione di procedere per 10 minuti. Un precipitato solido formerà.
- Dopo 10 minuti, spegnere argon, togliere il pallone dal fuoco, e lasciare che la miscela di riposare per 4 ore (ricoperto di un foglio al riparo dalla luce come un promotore sensibile alla luce è stato prodotto. Tenere il posto di sfiato ago.
- Versare prodotto in un imbuto di vetro fritta o un imbuto foderato con carta da filtro appropriato. filtrato Risciacquare 3 volte con 50 ml di 2-butanone per rIMUOVERE qualsiasi bromuro di litio che non ha reagito.
- Secco (prima sul banco e poi in essiccatore a vuoto) e analizzare prodotto da 1 H NMR in D 2 O. Punte caratteristiche a 1,8-1,9 (6H, s), 2.1-2.2 (3H, s), 6,7-6,8 (2H, s), 7,3-7,4 (2H, m), 7,4-7,5 (1H, m), e 7,5 -7.7 (2H, m). 14,17
- Utilizzare un foglio di calcolo per calcolare il volume e la concentrazione di ciascuna soluzione madre (PEG4SH, Pep1Alloc, Pep2Alloc, LAP) che deve essere preparato a fare idrogeli (Tabella 1). Per rendere gel non-fantasia, in modo che [SH] = [Alloc] in modo che tutti i gruppi reattivi sono consumati durante la polimerizzazione. Se è prevista photopatterning di gel, comprende una quantità in eccesso di gruppi funzionali tiolici durante la formazione gel a base di stechiometria (ad esempio, 0,2-5 mM, [SH]> [Alloc]) per la reazione successiva con Pep1Alloc.
NOTA: Gel dovrebbe contenere più del 5 per cento in peso (% in peso) PEG4SH per assicurare una rapida polimerizzazione (entro 5 minuti). Tuttavia, la gamma più bassa% in pesos può essere esplorato se l'applicazione chiama per idrogel con moduli inferiori (ad esempio, <0,5 kPa); polimerizzazione deve essere controllato e regolato di conseguenza per queste basse composizioni% in peso. Analogamente, la concentrazione Pep1Alloc può essere regolata per diverse applicazioni (ad esempio, 0,2-5 mM) come riportato in letteratura per peptidi tiolici-funzionalizzato. 18-21 concentrazione LAP raccomanda circa 0,067% in peso (2,2 mM) o inferiore, come descritto, come concentrazioni elevate possono diminuire la vitalità cellulare. - Preparare soluzioni di Pep1Alloc, Pep2Alloc, PEG4SH, e LAP in condizioni sterili per colture cellulari basati su calcoli in tabella 1.
- Per Pep1Alloc e Pep2Alloc, pesare singolarmente la massa totale di Pep1Alloc e Pep2Alloc dalla sintesi peptidica e sciogliere in sterile tampone fosfato salino (PBS) contenente 1% di penicillina / streptomicina (PS) e 0,5 mg / ml fungizone (FZ). Le concentrazioni tipiche del preparato gamma soluzioni madredal 20-100 mg / ml di peptide. Mescolare questi stock per ottenere gel con moduli finale rilevanti per le applicazioni dei tessuti molli (modulo di Young ~ 0,5-5 kPa). 22,23 Aliquota e conservare a -20 ° C fino al momento dell'uso.
- Per PEG4SH, pesare PEG4SH in una provetta sterile e sciogliere in PBS + PS + FZ. Le concentrazioni tipiche di questa gamma di soluzione da 250-430 mg / ml (20-30% PEG4SH in peso).
- Per LAP, pesare LAP in una provetta sterile e sciogliere in PBS + PS + FZ ad una concentrazione finale di 7,5 mg / ml.
NOTA: La preparazione di soluzioni fresche di PEG4SH e LAP è consigliato per ogni incapsulamento o esperimento gel per garantire tempi di polimerizzazione coerenti.
- Preparare siringa sterile Tip Stampo per la formazione di idrogel.
- Tagliare con cautela le punte al largo di 1 ml siringhe con una lama di rasoio e successivamente rimuovere i pistoni dagli alberi siringa.
- Immergere gli alberi siringa e pistoni in etanolo al 70% per 15 minuti und posto in una cappa sterile coltura cellulare a secco (30 min). Se gocce eccesso di etanolo rimangono all'interno dell'albero della siringa, usare lo stantuffo per spingere fuori.
- Preparare sterile vetrino Stampo per la formazione di idrogel.
- Immergere vetrini (multipli di 2) e le guarnizioni in gomma (spessore 0,254 mm; 2 piccoli pezzi utilizzati come spessori, un rettangolo con dischi perforato, o la forma cornice quadrata) in etanolo al 70% per 15 minuti, e il luogo in cappuccio coltura cellulare sterili asciugare.
- Coat metà dei vetrini sterilizzati con rivestimento antiaderente alle istruzioni del produttore per impedire l'adesione della parte superiore del gel alla superficie di scorrimento (per esempio, se ci sono 4 scivoli, 2 scivoli saranno rivestite con anti-adesivo). Questi serviranno come la parte superiore dello stampo vetrino.
- Calibrare la lampada per siringa o diapositive di vetro stampi.
NOTA: Per questi esperimenti, una lampada a vapori di mercurio con un gruppo adattatore filtro esterno e 365 nm filtro esterno è stato utilizzato. Altro lampadas che producono intensità adeguate di lunghezza d'onda della luce UV può essere utilizzata come riportato da altri. 24-27- Attaccare un collimatore alla fine della guida di luce a liquido per garantire intensità relativamente luce uniforme per tutti i campioni. Se necessario, regolare la distanza della guida di luce dal campione (s) per ottenere una dimensione del punto che coprirà campioni di interesse.
- Mettere uno stampo siringa taglio in un supporto provetta (per tenere la muffa siringa in posizione verticale). Tenere il radiometro all'altezza della punta della siringa dove si terranno i campioni e regolare otturatore (% aperto) per ottenere un'intensità luminosa di 10 mW / cm 2 a 365 nm. Registrare le impostazioni regolate per un uso successivo.
- Posizionare uno stampo vetrino sulla parte superiore di una superficie sterile (ad esempio, la parte superiore di una scatola puntale entro un armadio biosicurezza). Tenere il rilevatore radiometro all'altezza dello stampo vetrino e regolare otturatore (% open) per ottenere un'intensità luminosa di 10 mW / cm 2 a 365 nm. Registrare le impostazioni regolate per un uso successivo.
2. Hydrogel Formazione e photopatterning
- Preparazione di idrogel non-fantasia.
NOTA: A questo punto nel protocollo, se idrogel devono essere utilizzati in applicazioni di coltura cellulare, tutti i passi successivi devono essere eseguite in condizioni sterili in un armadio sterile o cappuccio.- Mescolare soluzioni stock di PEG4SH, Pep2Alloc, Pep1Alloc, LAP, e PBS + PS + FZ secondo il calcolo foglio di calcolo (vedi tabella 1 esempio). Pipettare la soluzione di gel precursore risultante vigorosamente per assicurare una miscelazione uniforme della soluzione.
- Preparare idrogel spessi stampati in siringhe pipettando 10-20 ml di soluzione di gel precursore (PEG / Pep / LAP / PBS) nella punta di un sterili, taglio siringa. Fare un unico gel per siringa, circa 0,5-1,5 mm di spessore basati sul volume e diametro della siringa.
NOTA: i volumi più grandi possono essere esplorati basate sula dimensione del gel desiderata in cui limiti superiori può esistere sulla base di limitazioni diffusionali per Pep1Alloc durante photopatterning e / o sostanze nutritive / rifiuti a / da cellule incapsulate in coltura cellulare. - Preparare idrogel sottili in stampi vetrino disponendo la guarnizione di gomma (spessore 0,254 mm) attorno ai bordi del vetrino non ricoperte. Pipetta 5-10 ml soluzione di gel precursore (5-10 gel singole o multiple microlitri può essere effettuata pipettando uno o più punti di soluzione su una singola diapositiva) sul vetrino non rivestito e posizionare il vetrino rivestito con trattamento anti-adesivo in cima alla soluzione di gel (gel grandi, fino alla dimensione del vetrino, possono essere apportate a seconda dell'applicazione finale). Fissare i vetrini con piccole clip legante per stabilizzare.
- Collocare i modelli sotto la lampada e impostare l'intensità della lampada (ad esempio,% otturatore aperto) per ottenere 10 mW / cm 2 sulla superficie del gel per gli stampi siringa o stampi vetrino sulla base di misurazioni al punto 1.7.2 e1.7.3 rispettivamente.
- Applicare luce da 1 a 5 minuti per consentire la completa polimerizzazione del gel. Utilizzare un tempo di polimerizzazione più breve per gel con più elevato contenuto PEG4SH (8% in peso o superiore, 1 min) e più a lungo per gel con minore contenuto PEG4SH (5-8% in peso, 3-5 min) per la produzione di idrogel completamente polimerizzati con moduli all'interno la gamma di tessuti molli (0,5-5 kPa).
- Luogo gel da stampi punta della siringa in un piatto sterile, non trattata 48-bene, e diapositive di vetro posto in un piatto sterile.
- Lavare 3 x 15 min con terreno di coltura cellulare o tampone appropriato (ad esempio, PBS + PS + FZ, tampone di reazione di Ellman) sulla base di esperimenti previsti, come di seguito dettagliato.
- Preparazione del Patterned idrogel.
- Mescolare soluzioni stock di PEG4SH, Pep2Alloc, LAP, e PBS + PS + FZ secondo il calcolo foglio di calcolo, lasciando tioli liberi (0,2-5 mm) per la reazione dopo con Pep1Alloc. Pipettare la soluzione precursore vigorosamente per assicurare una miscelazione uniforme della soluzione.
- Preparare idrogel spessi e sottili come stabilito nei passaggi 2.1.2 a 2.1.6.
NOTA: non collocare gel nel terreno di crescita prima di photopatterning. Tioli liberi possono essere utilizzati da specie nel mezzo di crescita (ad esempio, disolfuro formazione con proteine contenente il tiolo) e non permetterà patterning del gel senza ulteriori fasi di lavorazione (ad esempio, la riduzione dei legami disolfuro). - Preparare le soluzioni di Pep1Alloc (concentrazione finale ~ 3-20 mg / ml) e 2,2 mm LAP.
- Coprire gel preformati con soluzione / LAP Pep1Alloc e incubare per 1 ora a 37 ° C.
- Rimuovere la soluzione Pep1Alloc / LAP eccesso. Se gel sono stati stampati in una siringa, utilizzare una spatola per trasferire accuratamente il gel dalla piastra 48 pozzetti in cui sono incubando un vetrino sterile per patterning.
- Inserire un fotomaschera con il modello desiderato direttamente sopra gel da siringhe e vetro scorrevole moulding. Assicurarsi che la parte stampata della maschera tocca il gel per patt ottimalefedeltà ERN (vale a dire, la maschera dovrebbe leggere a destra ed essere emulsione verso il basso). I campioni sotto la lampada e irradiano per 1 min con le impostazioni di utilizzo della lampada per vetrini (step 1.7.3).
- Dopo patterning, gel posto siringa-modellato in un piatto trattati sterili, cultura 48 pozzetti non-tessuti, e il luogo in vetro gel che vengano rispettati i vetrini in un piatto sterile, slide-modellato.
- Lavare 3 x 15 min con terreno di coltura cellulare o tampone appropriato (ad esempio, PBS + PS + FZ, tampone di reazione di Ellman) sulla base di esperimenti previsti.
3. Visualizzazione e quantificazione di photopatterning
- Saggio di Ellman per rilevare e quantificare tioli liberi in Photopatterned idrogel.
- Preparare tampone di Ellman reazione, soluzione di lavoro cisteina, gli standard e il reagente di Ellman come descritto di seguito.
- Per Reaction Buffer di Ellman, sciogliere 2,4 g sodio fosfato bibasico (Na 2 HPO4) e 74,4 mg di acido etilendiamminotetraacetico (EDTA) in 200 ml DIH 2 O (0,1 M Na 2 HPO 4, 1 mM EDTA). Portare il pH a 7,5-8 con soluzioni di idrossido di sodio (NaOH) o acido fosforico (H 3 PO 4).
- Per la soluzione di lavoro cisteina, sciogliere 5,27 mg cisteina in 15 ml tampone di reazione (2 mm cisteina).
- Per Cisteina Standards diluita lavorando cisteina in tampone di reazione ad una concentrazione finale di 2, 1,5, 1,25, 1, 0,75, 0,5, 0,25 e 0 mM cisteina.
- Per reagente di Ellman, sciogliere 4 mg reagente di Ellman in 1 ml di tampone di reazione. Sonicare per sciogliere completamente il reagente del Ellman.
- Quantificare la concentrazione di tioli liberi in gel con dosaggio di Ellman (Figura 2).
NOTA: 'sottili' 5 idrogel microlitri, stampata tra le diapositive in vetro, sono descritti nella procedura riportata di seguito e consigliato per consentire una rapida diffusione di reagente t di Ellmanttraverso il gel (cioè, ci vuole il reagente più tempo per diffondersi attraverso gel di spessore).- Determinare il volume di gel gonfio di gel 'sottili' 5 ml (V S) sulla base del rapporto volumetrico gonfiore, Q.
- Fare tre 20 microlitri gel 'spesse' utilizzando stampi siringa. Luogo gel nel tampone di reazione di Ellman per 24 ore e successivamente pesano (equilibrio di massa gonfia, M S). Lyophilize i gel e successivamente pesare (massa secca, M D).
- Utilizzando le masse misurate per gel di spessore, calcolare il rapporto volumetrico gonfiore 28 da Q = 1 + ρ polimero / ρ solvente (M S / M D -1) dove ρ polimero = 1,07 g / cm 3 per PEG, 29 ρ solvente = 1.0 g / cm 3 per PBS / H 2 O.
- Calcolare la massa teorica secca del gel da utilizzare per di Ellman Assay (qui, gel 5 ml 'sottili' sono in genere uSED), sommando le masse dei singoli componenti PEG4SH, Pep1Alloc, e Pep2Alloc (M D = M PEG4SH + M + M Pep1Alloc Pep2Alloc). Ad esempio, un gel 5 ml contenente 10% in peso PEG4SH contiene circa 0,000,535 mila g PEG calcolato da M PEG4SH = 0.005 cm 3 x 1,07 g / cm 3 x 0,10. Pep1Alloc e Pep2Alloc masse possono essere calcolati in modo simile basato su wt% in soluzione (vedi il foglio per valori), assumendo ρ ≈ 1,0 g / cm 3 per queste soluzioni acquose.
NOTA: Gel anche può essere essiccato e pesato invece di calcolare la massa secca teorica. Tuttavia, può essere difficile per misurare costantemente la massa secca delle sottili, 5 microlitri gel. - Sulla base della massa secca previsto e il valore Q determinata dal gel "di spessore", calcolare la massa gonfia predetto M S per il gel 'sottile' (equazione al punto 3.1.2.1.1). Si supponga che ρ ≈ 1,0 g / cm 3, allora M S ≈ V S. Utilizzare questa V S calcolato per eseguire analisi quantitativa di Ellman.
NOTA: Si raccomanda il metodo di cui sopra per determinare V s per i gel gonfie come i gel 5 ml 'sottili' sono difficili da trasferire per la pesatura.
- Formare idrogel sottili per patterning come descritto nella sezione 2.2 (5 volumi mL). In particolare, rendere gel con tioli liberi in eccesso e 'modello' metà di questi campioni con Pep1Alloc utilizzando un coprioggetto chiaro inondare esporre l'intero gel di luce (ad esempio, 6 gel totali con eccesso tiolo: 3 non modificato non'patterned 'e 3' fantasia ').
NOTA: per questo saggio, 'modellato' gel sono inondazione esposte alla luce senza un fotomaschere. Questo metodo viene utilizzato per determinare il numero totale di tioli liberi consumati nell'intero campione gel e per dimostrare come efficientemente tioli liberi può essere modificato con peptide. Da queste informazioni,il numero di tioli liberi consumate durante patterning con una fotomaschera può essere prevista sulla base dello spessore gel e zona pattern (regioni esposte alla luce). - Inserire 'fantasia' e non'patterned 'gel in pozzetti di una piastra a 48 pozzetti e lavare 3 x 15 minuti con tampone di reazione di Ellman per consentire la diffusione di specie non reagiti dal gel ed equilibrio gonfiore a verificarsi.
- Aggiungere tampone di reazione supplementare di Ellman ai gel risciacquati in modo che V s con reazione buffer è un multiplo di 20 microlitri. Ad esempio, se il V S previsto è 15 microlitri, aggiungere tampone di reazione 5 microlitri (20 microlitri), e se il V S previsto è di 30 microlitri, aggiungere 10 microlitri tampone di reazione (40 microlitri).
- Pipettare norme cisteina in singoli pozzetti (contenenti gel) di una piastra a 96 pozzetti multipli di 20 microlitri seconda del volume utilizzato nel passaggio precedente (cioè, se il passo precedente aveva V S + extra reazione bUffer = 40 ml, aggiungere 40 ml di ogni standard per singoli pozzetti vuoti).
- Diluire il reagente di Ellman a tampone di reazione (multipli di 180 microlitri tampone di reazione + 3,6 ml di reagente di Ellman, ad esempio, 183,6 per 20 ml o 367,2 ml per 40 ml in fase 3.1.2.5).
- Aggiungere il reagente diluito di Ellman di pozzetti contenenti gli standard ed i campioni. Per 20 campioni microlitri, aggiungere 183,6 ml soluzione ad ogni pozzetto. Doppia questa quantità di reattivo diluito di Ellman per 40 campioni microlitri (o ridurre di conseguenza in base alla dimensione del campione).
- Incubare o posizionare su un agitatore per 1 ora e 30 min (a temperatura ambiente) o finché il colore della soluzione corrisponde al colore del gel mediante ispezione visiva per garantire una sufficiente diffusione del giallo dianione 2-nitro-5-thiobenzoate (TNB 2-), generato per reazione del reagente di Ellman con tioli liberi, dal gel.
- Prendere 100 ml di soluzione da campioni e standards e posto in pozzetti di una piastra da 96 pozzetti.
- Leggere l'assorbanza a 405 nm su un lettore di piastre.
- Per elaborare i dati, tracciare la curva standard (campioni dal punto 3.1.1.3) (assorbanza in funzione della concentrazione) e montare una funzione lineare. Utilizzando la funzione lineare, la concentrazione di tioli liberi nella soluzione 'gel diluito' (gel + tampone di reazione) può essere calcolata sulla base di letture di assorbanza. Infine, tenendo conto della 'diluizione' con tampone di reazione, determinare la concentrazione tiolo libero nei gel senza tampone di reazione. (Ad esempio, se il 15 gel microlitri è stato diluito con tampone di reazione 5 ml, moltiplicare per 20/15).
- Determinare il volume di gel gonfio di gel 'sottili' 5 ml (V S) sulla base del rapporto volumetrico gonfiore, Q.
- Visualizzazione di photopatterns con il reagente di Ellman (Figura 3A).
- Mettere a bagno idrogel sottili fantasia con Pep1Alloc nel tampone di reazione di Ellman per 1 ora.
- Rimuovere tampone di reazione eccesso strofinando delicatamente intorno ai bordi del idrogel con un tessuto.
- reagente di Ellman Pipettare direttamente sulla superficie del gel. Immediatamente immagine su un microscopio ottico a 10X o stereomicroscopio con una telecamera a colori.
Nota: I gel devono essere ripreso immediatamente, perché i modelli di visualizzazione saranno dissipare entro 5 minuti come il TNB giallo 2- ioni prodotto dalla scissione del reagente di Ellman per reazione con tioli nella regione non modellato diffonde in tutto il gel. regioni non fantasia appaiono debolmente giallo a occhio nudo; per una migliore risoluzione e modelli più piccoli, ingrandimento (ad esempio, l'uso di un microscopio) è obbligatorio.
- Preparare tampone di Ellman reazione, soluzione di lavoro cisteina, gli standard e il reagente di Ellman come descritto di seguito.
- Visualizzazione di Photopatterns con peptidi fluorescenti (Figura 3B).
- Per visualizzare modelli con una risoluzione maggiore o in tre dimensioni, photopattern un Pep1Alloc AF488-modificato (o simile peptide fluorescente) per i gel al passo 2.2.
- Immagine su un microscopio a fluorescenza. Un microscopio confocale può essere utilizzato qui per prendere z-stimmagini ACK del gel di modo che il modello può essere osservato nelle direzioni x, ye z-aerei.
NOTA: Con la fluorescenza, gel devono essere protetti dalla luce per assicurare la stabilità del fluoroforo AF488 e massima fluorescenza. I gel non hanno bisogno di essere immediatamente ripreso dal momento che il peptide fluorescente è abbastanza stabile se al riparo dalla luce (conservare in un contenitore avvolto in un foglio a 4 ° C).
4. incapsulamento delle cellule in idrogel e photopatterning
- La raccolta e la preparazione di cellule per l'incapsulamento.
- A seguito di procedure di colture cellulari di mammifero sterili standard trypsinize e raccogliere le cellule di interesse dalle piastre. Quench tripsina con mezzo di crescita dopo il verificarsi di distacco (per esempio, per un pallone T-75, 5 ml di tripsina, spegnere con 5 ml di mezzo, risciacquare piastra con 5 ml di mezzo per totale 15 ml).
NOTA: tripsinizzazione volte possono variare tra i tipi di cellule ma tipicamente verificarsi tra 5 e 15 min. detachmen cellulari alternativiagenti t (ad esempio, Versene) possono essere utilizzati per raccogliere le cellule, se desiderato. - Contare le cellule (un minimo di 100 o al protocollo del produttore) dal aliquote della sospensione cellulare trypsinized utilizzando un emocitometro o altro dispositivo di conteggio delle cellule mentre centrifugazione della sospensione cellulare bulk (90-110 xg, 5 min). Risospendere pellet cellulare dopo centrifugazione in un volume minimo di PBS o mezzo di crescita e ri-conteggio se la sospensione iniziale di cellule trypsinized è troppo diluito.
- Risospendere le cellule in un volume minimo di PBS e aliquote per ciascuna condizione gel in provette da microcentrifuga modo che ci saranno 5.000 cellule / microlitro quando miscelato con la soluzione di gel (prima della polimerizzazione).
NOTA: aliquote cellulari tipici contengono 300.000-500.000 cellule e sono abbastanza per fare 60-100 microlitri di sospensione di gel / cellulare che può essere utilizzato per 3-5 x 20 microlitri gel con 5.000 cellule / ml. densità di cellule superiori o inferiori possono essere utilizzati per l'incapsulamento, a seconda della quantità di cellula-cellulavs contatto cellula-matrice desiderato, rispettivamente, e deve essere determinata per ogni applicazione. - cell Centrifuga / aliquote PBS (90-110 xg, 5 min).
- Con attenzione aspirare PBS da pellet di cellule in provetta a destra prima di incapsulamento.
NOTA: Se le cellule sono sensibili alle forze di taglio, la seconda fase di centrifugazione può essere eliminato contando (ad esempio, emocitometro) e successivamente aliquotting la sospensione cellulare trypsinized (multimediali cellule tripsina + +) in porzioni necessarie per ogni condizione di gel. Queste aliquote vengono centrifugati una volta (90-110 xg, 5 min) e la tripsina + supporto viene aspirato, lasciando un pellet di cellule per l'incapsulamento.
- A seguito di procedure di colture cellulari di mammifero sterili standard trypsinize e raccogliere le cellule di interesse dalle piastre. Quench tripsina con mezzo di crescita dopo il verificarsi di distacco (per esempio, per un pallone T-75, 5 ml di tripsina, spegnere con 5 ml di mezzo, risciacquare piastra con 5 ml di mezzo per totale 15 ml).
- Le cellule incapsulamento in idrogel non-fantasia.
- Subito dopo aspirare PBS, sospendere le cellule in pellet in PEG4SH, Pep2Alloc, Pep1Alloc, LAP, e PBS + PS + FZ come calcolato nel foglio di calcolo ad una concentrazione finale di 5.000 cellule / microlitro.
- Muffa e polimerizzare idrogel come described in passi 2.1.2 a 2.1.6.
NOTA: Quando si incapsula le cellule in stampi vetrino, è necessario prestare attenzione quando si rimuove il top scorrevole post-polimerizzazione per impedire taglio il gel, che può provocare la morte delle cellule. Per facilitare la rimozione del gel dallo stampo, stampi scorrimento possono essere posti in PBS sterile o terreno di coltura dopo la polimerizzazione per bagnare la guarnizione e idrogel, rendendo più facile rimuovere la slitta superiore. Un metodo per evitare questo taglio complessivamente è attraverso l'utilizzo di stampi siringa. - gel di risciacquo 3 x 10 min in terreno di crescita per rimuovere le specie che non hanno reagito e l'eccesso LAP.
- Incubare gel nel mezzo di crescita a 37 ° C e 5% CO 2 fino al punto di tempo desiderato per ulteriori analisi. Rifornire media ogni 48 ore o come determinato per l'applicazione (ad esempio, intervallo di alimentazione tipico specifico tipo di cellula e medie).
- Incapsulando Cellule e photopatterning in presenza di cellule.
- Subito dopo aspirare PBS,sospendere le cellule in pellet in PEG4SH, Pep2Alloc, LAP, e PBS + PS + FZ come calcolato nel foglio di calcolo ad una concentrazione finale di 5.000 cellule / microlitro. Lasciare una concentrazione adeguata di tioli liberi (ad esempio, 2 mm) per la reazione dopo con Pep1Alloc.
- Mold, polimerizzare, e idrogeli modello come descritto nei punti 2.2.2 a 2.2.8.
- gel di risciacquo 3 x 10 min in terreno di crescita dopo il patterning per rimuovere le specie che non hanno reagito e l'eccesso LAP.
- Incubare gel nel mezzo di crescita a 37 ° C e 5% CO 2 fino al punto di tempo desiderato per ulteriori analisi. Rifornire media ogni 48 ore o come determinato per l'applicazione.
5. Determinazione della vitalità e metaboliche attività delle cellule incapsulate
- Eseguire Live / Morto citotossicità test per determinare Encapsulated vitalità cellulare (Figura 4A).
- Togliere terreno di crescita dal gel e risciacquare 3 x 15 min con PBS per consentire la diffusione del mezzo da gEls.
- Scongelare soluzioni Live / Dead test di citotossicità (etidio omodimero-1 e calceina AM).
- Aggiungere 2 ml di 2 mM etidio omodimero-1 e 0,5 ml delle soluzioni calceina AM 4 mm a 1 ml di PBS sterile. Vortex per garantire la completa miscelazione.
- Aggiungere 300 microlitri soluzione colorante per ciascun gel stampo siringa in piastre a 48 pozzetti, o abbastanza per coprire la superficie di gel su un vetrino in un piatto sterile e incubare per 45 min.
- Rimuovere soluzione colorante in eccesso e risciacquare per rimuovere il colorante in eccesso dai gel (3 x 15 minuti con PBS).
- Immagine su un microscopio confocale (immagini z-stack) o su un microscopio a fluorescenza con capacità di Z-stack a 10X e 488/525 nm Ex / Em. Quantificare il numero di cellule vitali proiettando i z-stack e contando il numero di live (verde in tutto il corpo cellulare) e morti (nuclei rossi) cellule con software di imaging.
- Eseguire saggio di attività metabolica per determinare l'attività delle cellule post-incapsulamento (Figure 4B).
- 24 ore prima del dosaggio, mangimi incapsulato cellule con terreno di coltura fresco.
NOTA: Aggiungere mezzo ad alcuni pozzi in più (che non contengono gel o gel e privo di celle) come controllo (letture di sfondo). - Al punto di tempo di interesse, scongelare soluzione di reagente MTS.
NOTA: Al fine di determinare l'attività metabolica nel tempo, un punto di tempo iniziale (12-24 hr post-incapsulamento) è raccomandato come riferimento per il confronto con tempi successivi. - Aggiungere MTS reagente in ogni pozzetto (20 l per 100 ml terreno di coltura).
- Incubare i campioni per 1-4 ore a 37 ° C e 5% di CO 2, secondo le istruzioni del produttore.
NOTA: tempi di incubazione dovrebbero essere sufficienti per le cellule di ridurre MTS e permettono la diffusione del prodotto formazan dal gel. Di conseguenza, i gel più spessi come gel punta della siringa possono richiedere lunghi tempi di incubazione (~ 4 ore) per la riduzione sufficiente MTS e diffusione. - Dispensare 100 microlitri ridotto MTS / Medianei pozzetti puliti di una piastra e registrare l'assorbanza 96 pozzetti a 490 nm su un lettore di piastre.
- Sottrarre l'assorbanza di fondo per pozzi senza cellule dai valori di assorbanza del campione per generare valori di assorbanza baselined.
- 24 ore prima del dosaggio, mangimi incapsulato cellule con terreno di coltura fresco.
Risultati
La messa a punto e la procedura per photoencapsulate cellule e gel successivamente photopattern contenenti cellule incapsulate è rappresentato in figura 1, e un esempio per la preparazione di soluzioni madre per formare una% gel 10 in peso è fornita in tabella 1. Utilizzando la tabella 1, la quantità di monomeri (PEG4SH , Pep2Alloc, ± Pep1Alloc) e fotoiniziatore (LAP) necessario per polimerizzare idrogel viene calcolato. In base a questi calcoli, soluzioni stock di PEG4SH, Pep1Alloc, Pep2Alloc, e LAP sono preparati e mescolati con e senza Pep1Alloc per la formazione e photopatterning gel, rispettivamente (Figura 1A). Successivamente, le cellule vengono raccolte dalle piastre, contati e centrifugati in quantità appropriate per incapsulamento (Figura 1B). Il pellet cellulare viene risospeso in soluzione gelificante (peptide / polimero / LAP in PBS), e miscele di cellule / monomero vengono trasferiti al vetro o una siringa molds. Le cellule sono incapsulati all'interno idrogel all'atto dell'applicazione della luce (1-5 minuti e 10 mW / cm 2 a 365 nm) (Figura 1C). Per photopatterning (Figura 1D), i gel sono impregnati con Pep1Alloc e LAP per 30 minuti a 1 ora e 30 min, permettendo la diffusione di peptide e iniziatore nella matrice polimerizzato. Questi gel peptide-carico sono coperti di fotomaschere con motivi desiderati ed esposto ad una seconda dose di luce (1 min) per coniugare i peptidi a tioli liberi all'interno della matrice. Cavezze pendente solo sono covalentemente legati al gel in regioni esposte alla luce, facilitando appropriate interazioni cellula-matrice e mimando principali proprietà meccaniche e biochimiche del microambiente cellule nativa verso tastatura funzione cellulare e destino in vitro.
dosaggio di Ellman fornisce un metodo facile e poco costoso da quantificare modifica gel e peptide incorporazione all'interno photopattesubstrati rned. Fantasia e gel non-fantasia (ad esempio, gel con o senza modifiche peptide) sono immersi in tampone di reazione post-polimerizzazione di Ellman. Successivamente, standard cisteina ei gel imbevuti in tampone sono poste in piastre da 48 pozzetti e incubate con il reagente di Ellman (Figura 2A, sinistra). Dopo 1 ora e 30 minuti, aliquote di campioni vengono posti in singoli pozzetti di una piastra a 96 pozzetti e l'assorbanza è registrata a 405 nm. Una curva di calibrazione (Figura 2A, destra) dagli standard cisteina è tracciata (assorbanza vs concentrazione, adattamento lineare), e la quantità di tioli liberi in gel può essere determinato in base al fattore di diluizione. Queste concentrazioni tioli liberi per vari polimerizzazione e photopatterning condizioni di un gel 10% in peso sono mostrati nella Figura 2B. Gel polimerizzati per 1 o 5 minuti senza Pep1Alloc (blu bar, I = 1 min e II = 5 min) hanno statisticamente simili concentrazioni tioli liberi, indicando tcappello una reazione rapida verifica e gelificazione è completata entro 1 minuto (a due code t-test, p> 0.05). Così, esposizione aggiuntiva alla luce (2-5 minuti) non provoca ulteriore conversione dei gruppi funzionali. Gel polimerizzati per 1 min senza Pep1Alloc erano intrisi di Pep1Alloc (3 mg / ml) e LAP (2,2 mm) per 30 e 90 min (barre verdi, II = 30 min e IV = 90 min) ed esposti a una seconda dose di luce per 1 min. La diminuzione tioli liberi (60-80% rispetto alla condizione 1 min) indica modifica efficiente di gel con stecche pendente in queste condizioni. Se modifica superiore è desiderato, aumento delle concentrazioni di soluzione Pep1Alloc possono essere usati come accessibilità Pep1Alloc di tioli liberi in soluzioni diluite peptidici possono limitare conversione; per esempio, abbiamo trovato che le concentrazioni fino a 20 mg / ml Pep1Alloc producono> conversione del 90% di tioli liberi.
Unicamente, modelli di peptidi aggiunti al idrogel puòessere rapidamente ripreso con il reagente di Ellman (Figura 3A, in 5 min). Tuttavia, la visualizzazione del modello è perso nel tempo (maggiore di 5 min) a causa della diffusione giallo TNB 2- dianione attraverso il gel. Per migliorare la risoluzione delle immagini e osservare i modelli in tre dimensioni (X, Y, e Z piani) e in presenza di cellule, peptide fluorescente addizione (AF488Pep1Alloc) può essere utilizzata. Nella Figura 3B X, Y e Z-proiezioni di pile di immagini scattate con un microscopio confocale sono mostrati, a dimostrazione risoluzione modello (scala micron).
Circa (94 ± 2)% e (94 ± 1)% di hMSCs incapsulati all'interno di gel degradabili (Pep2Alloc = GPQG ↓ WGQ) rimangono (corpi cellulari verdi) vitali 1 e 6 giorni dopo l'incapsulamento, rispettivamente, con poche cellule morte (nuclei rossi ) osservato (Figura 4A). Inoltre, hMSC diffusione è osservata a 6 giorni post-incapsulamento ( rong> Figura 4A, nel riquadro), che indica che le cellule possono rimodellare e interagire con queste matrici MMP-degradabili modificati con RGDS integrine vincolante. Saggi di attività metaboliche effettuati su cellule incapsulate in gel non degradabili (Pep2Alloc = RGKGRK) 1 e 3 giorni dopo l'incapsulamento (Figura 4B) di fornire una seconda misura della vitalità cellulare e dimostrano che le cellule rimangono attivi per le varie condizioni photoencapsulation e photopatterning testati con dosaggio di Ellman (Figura 2B). In particolare, non vi è alcuna differenza significativa dell'attività metabolica tra i 30 min e 90 min incubazione con Pep1Alloc + LAP (condizioni III e IV) e l'incapsulamento iniziale (condizioni di I e II), che indica che la procedura è appropriata per le applicazioni di photopatterning a la presenza di cellule incapsulate (due code t-test, p> 0.05).
2fig1.jpg "/>
Figura 1:. Installazione per incapsulare le celle all'interno di idrogel e successivamente photopatterning con l'indicazione biochimica (A) Le soluzioni madre di macromeri e fotoiniziatore sono preparati e misto (PEG4SH = spina dorsale, Pep2Alloc = reticolazione, Pep1Alloc = ciondolo parte adesiva (RGDS), LAP = fotoiniziatore ). (B) Le cellule sono raccolti per l'incapsulamento. (C) Le cellule sono mescolate con le soluzioni macromero senza o con peptidi integrine vincolante (PEG4SH / Pep2Alloc / LAP o PEG4SH / Pep2Alloc / Pep1Alloc / LAP, rispettivamente) e sono incapsulati in seguito all'esposizione alla luce. (D) gel contenenti gruppi tiolici in eccesso durante la formazione del gel (qui, PEG4SH / Pep2Alloc / LAP, formata con 2 mm in eccesso tioli) possono essere modellati con segnali biochimici dalla successiva aggiunta di peptidi funzionalizzati con un singolo gruppo alloc (Pep1Alloc, ad esempio, RGDS, IKVAV, etc.) per promuovere l'adesione delle celluleall'interno di specifiche regioni del gel. Qui, viene mostrato patterning di gel con RGDS fluorescenza marcata. Fai clic qui per vedere una versione più grande di questa figura.
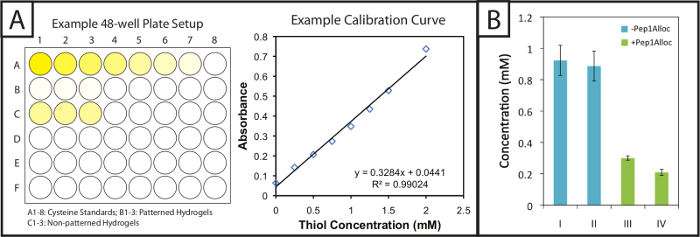
Figura 2:. Impostazione del test e risultati quantitativi di Ellman per valutare la modifica degli idrogel fantasia Gel (A) e gli standard di cisteina sono incubati in piastre a 48 pozzetti con il reagente di Ellman. Una curva standard lineare viene tracciata per determinare la concentrazione di cisteina nei campioni di gel. (B) tioli liberi in eccesso sono incorporati all'interno di idrogel durante formazione di gel e consumati su patterning con un ciondolo alloc-peptide (I = 1 min polimerizzazione; II = 5 min polimerizzazione; III = 30 min di incubazione con Pep1Alloc; IV = 90 min di incubazione wi esimo Pep1Alloc; sia III e IV polimerizzati e modellati con la luce per 1 min). I dati riportati illustrano la media (n = 3) con barre di errore che mostra l'errore standard. Cliccate qui per vedere una versione più grande di questa figura.
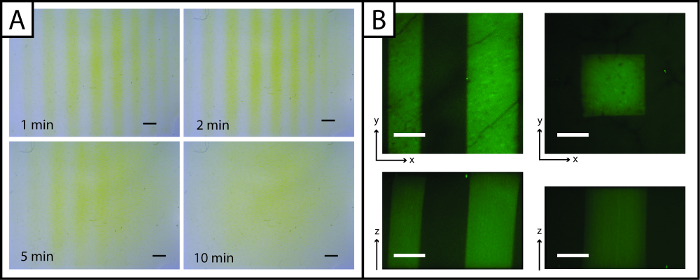
Figura 3:. Assay di Ellman e immagini fluorescenti di visualizzare idrogel photopatterned Reattivo (A) di Ellman può essere utilizzato per individuare rapidamente i modelli (linee) in X e Y-piani (giallo = regione non nanostrutturata, Barra di scala = 1 mm). (B) peptidi fluorescenti possono essere utilizzati per osservare i modelli nelle direzioni x, ye z-aerei (verde = regione fantasia; 200 bar scala micron; 10X obiettivo acqua-immersione; Ex / Em 488/525 nm).large.jpg "target =" _ blank "> Clicca qui per vedere una versione più grande di questa figura.
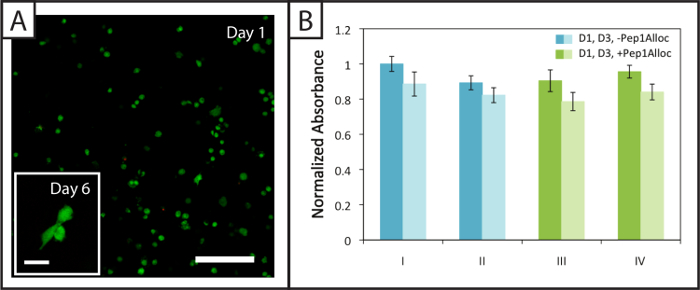
. Figura 4: La vitalità e l'attività metabolica delle cellule all'interno non degradabili idrogel photopatterned (A) Esempio confocale Z-stack (Z-proiezione; 10X obiettivo acqua-immersione) di vitali (verde; Ex / Em 488/525 nm) e morti hMSCs (rosso; Ex / Em 543/580 nm) incapsulato all'interno di idrogel 24 ore post-incapsulamento (Scala bar = 200 micron). Le cellule sparse all'interno di questi idrogel 6 giorni dopo l'incapsulamento (immagine inserto, Scala bar = 50 micron). (B) Le cellule sono metabolicamente attivo 1 e 3 giorni (barre chiare e scure, rispettivamente) post-incapsulamento per i vari polimerizzazione (I = 1 min polimerizzazione; II = 5 min di polimerizzazione) e le condizioni di patterning (III = 30 min di incubazione con Pep1Alloc ; IV = 90 min incubation con Pep1Alloc; sia polimerizzati e modellato con la luce per 1 min). I dati riportati illustrano la media (n = 3) con barre di errore che mostra l'errore standard. Cliccate qui per vedere una versione più grande di questa figura.
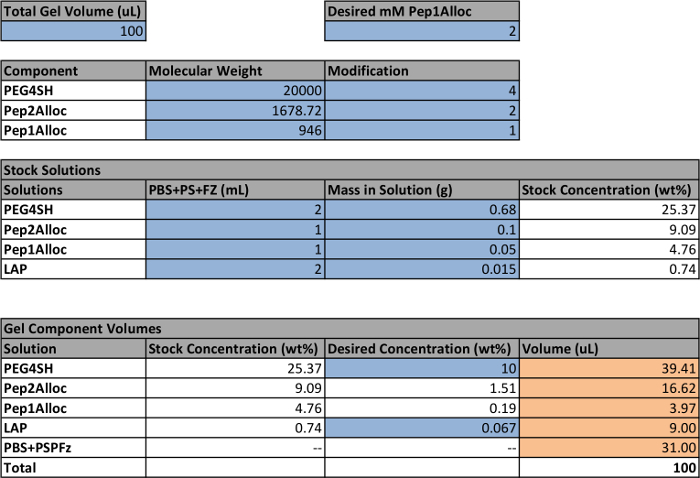
Tabella 1: configurazione di esempio per calcolare i volumi di soluzioni madre per fare idrogel cellule all'interno del foglio di calcolo che sono evidenziati blu indicano parametri definiti dall'utente;. le altre quantità sono calcolate sulla base di queste impostazioni. I volumi finali per ciascuna soluzione madre per fare un gel sono evidenziati arancione. I globuli bianchi contengono formule utilizzate per calcolare i volumi finali in base ai parametri definiti dall'utente. Si noti che una concentrazione di 2,2 mM LAP è equivalente a 0,067% in peso.
Discussione
La procedura qui presentata illustra le tecniche per photoencapsulate cellule all'interno idrogel formate da tiolo-ene clic chimica e successivamente photopattern i gel con segnali biochimici. L'uso della luce per formare inizialmente idrogel permette una miscelazione omogenea sospensione delle cellule all'interno della soluzione di polimero prima della polimerizzazione. polimerizzazione 'blocca' Rapid gel nella forma dello stampo definita e incapsula cellule all'interno della rete idrogel sospesi. I gel possono anche essere stampati in numerose forme diverse (ad esempio, vetrini o siringhe) a seconda dell'applicazione finale desiderato. Ad esempio, cellule incapsulate cultura 3D in idrogel allegati al vetrini sono particolarmente utili per applicazioni di imaging come attenuazione della luce è limitata all'interno di un campione sottile. stampi siringa può essere utilizzato per una rapida incapsulamento delle cellule, consentendo un maggior numero di campioni da preparati in breve tempo (rispetto al vetrinos) che può essere utilizzato per esperimenti che richiedono un gran numero di cellule, come la citometria a flusso o qPCR. Successivamente, questi gel quindi possono essere modellati con segnali biochimici per sollecitare risposte cellulari desiderati quali la differenziazione o l'invasione. 30,31
Saggi di redditività e attività metabolica indicano la sopravvivenza delle cellule del sistema materiale e condizioni patterning presentati. Si noti che l'attività metabolica è stata monitorata fino al giorno 3 in gel non degradabili (RGKGRK peptide reticolazione) per valutare gli effetti iniziali di condizioni di polimerizzazione e patterning sulla funzione cellulare. Inoltre, un test di integrità della membrana (Live / Dead vitalità / citotossicità colorazione) di hMSCs a 1 e 6 giorni post-incapsulamento in gel formulati con un peptide reticolazione degradabile (GPQGIWGQ) supporta che le cellule rimangono vitali e diffondere a 1 settimana in cultura. La vitalità di linee cellulari aggiuntive stato segnalato per le condizioni di photopatterning 32 simili a quelleusato qui e può essere valutato per il sistema idrogel descritto utilizzando vivo colorazione / morti e saggi di attività metabolica. Anche se non abbiamo osservato problemi con la vitalità delle cellule di utilizzare questo sistema di materiali e relative procedure (4.2 e 4.3), alcuni tipi di cellule possono essere sensibili a radicali liberi e / o esposizione alla luce. In questo caso, gli utenti potrebbero considerare l'utilizzo di sistemi di materiali non photoinitiated come l'azoturo-alchino, 12 FXIII, 31 o chimiche di formazione idrogel Diels Alder-based. 33
Facile tecniche per rilevare e quantificare patterning di segnali biochimici all'interno di gel sono anche presentati (3.1 e 3.2). Dosaggio di Ellman è di particolare interesse perché i reagenti sono commercialmente disponibili e non sono richieste fasi di lavorazione sintetica extra o reagenti più costosi (per esempio, peptide fluorescenza marcata). dosaggio di Ellman può essere utilizzato per determinare con precisione la modifica di tioli liberi con segnali biochimici sotto different photopatterning condizioni, nonché di visualizzare rapidamente modelli. Per quantificare incorporazione peptide, la concentrazione gruppo funzionale tiolo prima e dopo patterning, come misura quantitativa di peptide incorporazione, è direttamente valutata con test di Ellman. Mentre questo tipo di quantificazione può essere fatto con peptidi fluorescenza marcata, 34 quantificazione di imaging basata richiede più fasi di manipolazione e analisi in termini di tempo (ad esempio, la sintesi di un peptide fluorescenza marcata e la generazione di una curva di calibrazione per correlare fluorescenza concentrazione peptide utilizzando l'analisi delle immagini). Per l'imaging peptide incorporazione, il reagente di Ellman può essere applicato direttamente ai campioni ed immediatamente visualizzato. Mentre limitato alla xey piani per la visualizzazione del modello, la tecnica può essere usato come un semplice metodo di routine per determinare se sono state modellato matrici contenenti gruppi tiolici liberi. È importante notare che dosaggio di Ellman non è ccytocompatible onsidered, così mentre può essere usata per osservare e quantificare photopatterns, non può essere eseguita in presenza di cellule. Per l'imaging patterning in tre dimensioni e in presenza di cellule, la coniugazione di peptidi fluorescenti all'interno matrici di idrogel rimane un approccio potente e ampiamente utilizzato. Risoluzione dei modelli può essere valutata nelle direzioni x, ye z-aerei usando la microscopia confocale, e questo metodo è cytocompatible modo che le cellule all'interno delle regioni fantasia o regioni non-fantasia possono essere identificati. Nel loro insieme, le tecniche di analisi e di imaging-based di Ellman sono strumenti complementari per i ricercatori di valutare quantitativamente e qualitativamente la photopatterning di segnali biochimici all'interno del sistema materiali.
Photoclick, o più in generale photoinitiated, chimiche per la formazione e la modifica di idrogeli in presenza di cellule sono numerosi. Lo stampaggio, l'incapsulamento, e patterning tecniche presentate qui non sono limmitata al sistema materiale descritto e può essere applicata a chimiche a base di luce alternativi, come tiolo-alchino, 35 azide-alchino, 4 e altre chimiche tiolo-ene (ad esempio, tiolo-norbornene), 10,13 nonché con diversi fotoiniziatori, come Irgacure 2959, eosina Y, e canforochinone. Nota, gli utenti possono avere bisogno di regolare i parametri di procedura (ad esempio, tempi di incubazione, i tempi di polimerizzazione, densità cellulare) per garantire che le condizioni rimangano cytocompatible per questi altri sistemi. Poiché il processo di patterning richiede diffusione del peptide (s) alloc-modificato in idrogel (2.2.3-2.2.5), questo processo può rivelarsi più utile per l'aggiunta di porzioni integrine vincolante (ad esempio, peptidi o proteine della matrice extracellulare frammenti) al idrogel, dove è richiesta attacco del ligando alla rete per la generazione di forze di trazione dall'attivazione cellulare e completa integrina. 36 Note, per biomolecole che possonoessere altrettanto attivi in soluzione o su immobilizzazione (ad esempio, fattori di crescita o citochine), la fase di incubazione per porzione diffusione (~ 1 ora) nel idrogel potrebbe portare ad eventi che Convolute risultati patterning segnalazione. Altri metodi sono stati stabiliti per il fattore di crescita immobilizzazione o il sequestro del locale per il loro patterning. 37-39 Inoltre, la risoluzione modello è dettata dal controllo sulla esposizione alla luce. Qui, fotomaschere consentire la creazione di modelli attraverso la profondità di gel e in x e y aerei; tuttavia, una maggiore controllo spaziale sopra patterning di segnali biochimici all'interno gel può essere ottenuto con metodi alternativi di irradiazione come l'uso di due fotoni microscopio confocale per generare modelli nel assi X, Y e aerei z-. 34,40 Infine, è importante notare che, mentre il sistema materiale utilizzato in questa procedura è solo inizialmente modificato con segnali biochimici, chimiche Photoclick ortogonali potrebbero essere utilizzati per consentire alterazioni di proprietà della matrice nel tempo. 12 La procedura e le tecniche qui presentate aggiungono diversità delle attuali approcci per la creazione di matrici sintetiche con caratteristiche ben definite e spatiotemporally controllati. In particolare, la disponibilità commerciale dei reagenti e materiali utilizzati in questo procedimento sarà utile per una vasta gamma di ricercatori interessati all'uso di biomateriali idrogel a base per applicazioni in coltura cellulare controllata.
Divulgazioni
The authors have nothing to disclose.
Riconoscimenti
Questo lavoro è stato sostenuto dai programmi Delaware Cobre in Drug Discovery e in Biomateriali avanzata finanziati dallo sviluppo Premi Istituzionali presso l'Istituto Nazionale di generali scienze mediche presso il National Institutes of Health (P20GM104316 e P30 GM110758-01, rispettivamente), la Pew Charitable Trusts (00026178), un Science Foundation Premio nazionale Carriera (DMR-1.253.906), il Fondo di Burroughs Wellcome (1.006.787), e il programma National Science Foundation IGERT SBE2 presso l'Università di Delaware (borsa di studio di L. Sawicki). Gli autori ringraziano il Centro Bioimmagini del Delaware Biotechnology Institute presso l'Università di Delaware per la formazione e l'accesso alla microscopia confocale, la signora Katherine Wiley per l'assistenza durante le riprese video, il signor Matthew Rehmann per fornire generosamente hMSCs isolate dal midollo osseo, il Prof. Christopher J . Kloxin e il signor Stephen Ma per fornire generosamente fotomaschere, e il Prof. Wilfred Chen per l'utilizzo del lettore di piastre automatizzato.
Materiali
| Name | Company | Catalog Number | Comments |
| Custom Peptides | Various Vendors | ---- | Peptides may also be synthesized via standard SPPS techniques with materials from vendors including ChemImpex and ChemPep. |
| 4-arm PEG Thiol, MW 20k | JenKem USA | 4ARM-SH | Listed under Multi-arm Homofunctional PEGs. PEG4SH may also be synthesized as previously referenced. |
| Lithium Phenyl-2,4,6-trimethylbenzoylphosphinate | Colorado Photopolymer Solutions | Li-TPO | |
| Dimethyl Phenylphosphonite | Sigma Aldrich | 149470 | Caution, causes severe skin burns and eye damage. Wear protective gloves, clothing, and eye protection. |
| 2,4,6-Trimethylbenzoyl Chloride | Sigma Aldrich | 682519 | Caution, causes severe skin burns and eye damage. Wear protective gloves, clothing, and eye protection. |
| Lithium Bromide | Sigma Aldrich | 213225 | |
| 2-Butanone | Sigma Aldrich | 360473 | |
| Flask, Round Bottom, 100 ml | Chemglass | CG-1506-05 | |
| 80 ml Filter Funnel, Buchner, Medium Frit | Chemglass | CG-1402-L-02 | Filter paper inside a regular glass funnel may be used if desired. |
| Magnetic Stir Bars | Various Vendors | ---- | |
| Magnetic Stirring and Hot Plate | Various Vendors | ---- | |
| Vacuum Dessicator | Various Vendors | ---- | |
| Deuterium Oxide | Acros Organics | 16630 | |
| Dulbecco's Phosphate Buffered Saline | ThermoFisher Scientific | 14190-250 | |
| Penicillin Streptomycin | ThermoFisher Scientific | 15070-063 | |
| Fungizone | ThermoFisher Scientific | 15290-018 | |
| Trypsin-EDTA (0.5%), no phenol red | ThermoFisher Scientific | 15400-054 | Select appropriate medium and trypsin depending on cell type. |
| Microcentrifuge tubes | Various Vendors | ---- | 1.5 or 2 ml sizes, sterile. |
| BD Syringe with Slip (Luer) Tips (Without Needle) | Fisher Scientific | 14-823-16H | Product number listed here is for a 1 ml syringe (16H), Various sizes are available (14-823-XX). |
| Fisherfinest Premium Plain Glass Microscope Slides | Fisher Scientific | 12-544-1 | |
| High-Purity Silicone Rubber, 0.010" Thick, 6" x 8" Sheet, 55A Durometer (Gasket) | McMaster Carr | 87315K62 | |
| Ethanol, 200 Proof | Decon Labs | 2701 | |
| RainX, Original | Amazon | 800002243 | May be purchased from other vendors. |
| Sigmacote | Sigma Aldrich | SL2 | |
| Photomasks | Advance Reproductions Corporation | ---- | Photomask Division, different designs may be printed as desired. |
| DTNB; Ellman's Reagent; 5,5-dithio-bis(2-nitrobenzoic acid) | ThermoFisher Scientific | PI-22582 | |
| Sodium Phosphate Dibasic | Sigma Aldrich | S5136 | |
| Ethylenediaminetetraacetic acid | Sigma Aldrich | E6758 | |
| Sodium Hydroxide, Pellets/Certified ACS | Fisher Scientific | S318 | |
| Orthophosphoric Acid | Alfa Aesar | 33266 | |
| Cysteine Hydrochloride Monohydrate | Sigma Aldrich | C7880 | |
| LIVE/DEAD Viability/Cytotoxicity Kit, for mammalian cells | ThermoFisher Scientific | L-3224 | |
| CellTiter 96 Aqueous One Solution Assay | Promega | G3582 | |
| Centrifuge | Various Vendors | ---- | Capable of speeds at 90-110 x g. |
| Multiwell Plate Reader | Various Vendors | ---- | Capable of reading absorbance at 405 nm in a 96-well plate. |
| Epifluorescent or Confocal Microscope | Various Vendors | ---- | To visualize peptide patterns and cells within hydrogels. |
| Omnicure Exfo Series 2000 | Excelitas Technologies | ---- | Alternate light systems may be used to polymerize hydrogels. |
| Zeiss Zen Lite Software | Zeiss | ---- | Available at zeiss.com; compatible with images taken on Zeiss microscopes |
| ImageJ | NIH | ---- | Available at imagej.nih.gov; applicable for general image analysis |
Riferimenti
- Kolb, H. C., Finn, M. G., Sharpless, K. B. Click Chemistry: Diverse Chemical Function from a Few Good Reactions. Angew Chemie - Int Ed. 40 (11), 2004-2021 (2001).
- Xi, W., Scott, T. F., Kloxin, C. J., Bowman, C. N. Click Chemistry in Materials Science. Adv Funct Mater. 24 (18), 2572-2590 (2014).
- Azagarsamy, M. A., Anseth, K. S. Bioorthogonal click chemistry: An indispensable tool to create multifaceted cell culture scaffolds. ACS Macro Lett. 2 (1), 5-9 (2013).
- Adzima, B. J., Tao, Y., Kloxin, C. J., DeForest, C. A., Anseth, K. S., Bowman, C. N. Spatial and temporal control of the alkyne-azide cycloaddition by photoinitiated Cu(II) reduction. Nat Chem. 3 (3), 256-259 (2011).
- Hoyle, C. E., Bowman, C. N. Thiol-ene click chemistry. Angew Chemie - Int Ed. 49 (9), 1540-1573 (2010).
- Fan, Y., Deng, C., Cheng, R., Meng, F., Zhong, Z. In situ forming hydrogels via catalyst-free and bioorthogonal "tetrazole-Alkene" photo-click chemistry. Biomacromolecules. 14 (8), 2814-2821 (2013).
- Burdick, J. A., Murphy, W. L. Moving from static to dynamic complexity in hydrogel design. Nat Commun. 3, 1269 (2012).
- Rehmann, M. S., Kloxin, A. M. Tunable and dynamic soft materials for three-dimensional cell culture. Soft Matter. 9 (29), 6737-6746 (2013).
- Yang, T., Long, H., Malkoch, M., Gamstedt, K. E., Berglund, L., Hult, A. Characterization of well-defined poly(ethylene glycol) hydrogels prepared by thiol-ene chemistry. J Polym Sci Part A Polym Chem. 49 (18), 4044-4054 (2011).
- Fairbanks, B. D., et al. A versatile synthetic extracellular matrix mimic via thiol-norbornene photopolymerization. Adv Mater. 21 (48), 5005-5010 (2009).
- Roberts, J. J., Bryant, S. J. Comparison of photopolymerizable thiol-ene PEG and acrylate-based PEG hydrogels for cartilage development. Biomaterials. 34 (38), 9969-9979 (2013).
- DeForest, C. A., Polizzotti, B. D., Anseth, K. S. Sequential click reactions for synthesizing and patterning three-dimensional cell microenvironments. Nat Mater. 8 (8), 659-664 (2009).
- Lin, C. C., Ki, C. S., Shih, H. Thiol-norbornene photoclick hydrogels for tissue engineering applications. J Appl Polym Sci. 132 (8), (2015).
- Sawicki, L. A., Kloxin, A. M. Design of thiol-ene photoclick hydrogels using facile techniques for cell culture applications. Biomater Sci. 2 (11), 1612-1626 (2014).
- Patterson, J., Hubbell, J. A. Enhanced proteolytic degradation of molecularly engineered PEG hydrogels in response to MMP-1 and MMP-2. Biomaterials. 31 (30), 7836-7845 (2010).
- Fairbanks, B. D., Singh, S. P., Bowman, C. N., Anseth, K. S. Photodegradable, photoadaptable hydrogels via radical-mediated disulfide fragmentation reaction. Macromolecules. 44 (8), 2444-2450 (2011).
- Fairbanks, B. D., Schwartz, M. P., Bowman, C. N., Anseth, K. S. Photoinitiated polymerization of PEG-diacrylate with lithium phenyl-2,4,6-trimethylbenzoylphosphinate: polymerization rate and cytocompatibility. Biomaterials. 30 (35), 6702-6707 (2009).
- Yang, F., et al. The effect of incorporating RGD adhesive peptide in polyethylene glycol diacrylate hydrogel on osteogenesis of bone marrow stromal cells. Biomaterials. 26 (30), 5991-5998 (2005).
- Wacker, B. K., et al. Endothelial cell migration on RGD-peptide-containing PEG hydrogels in the presence of sphingosine 1-phosphate. Biophys J. 94 (1), 273-285 (2008).
- Wilson, M. J., Liliensiek, S. J., Murphy, C. J., Murphy, W. L., Nealey, P. F. Hydrogels with well-defined peptide-hydrogel spacing and concentration: impact on epithelial cell behavior. Soft Matter. 8 (2), 390-398 (2012).
- Qiong Liu, S., et al. Injectable biodegradable polyethylene glycol/ RGD peptide hybrid hydrogels for in vitro chondrogenesis of human mesenchymal stern cellsa. Macromol Rapid Commun. 31 (13), 1148-1154 (2010).
- Engler, A. J., Sen, S., Sweeney, H. L., Discher, D. E. Matrix Elasticity Directs Stem Cell Lineage Specification. Cell. 126 (4), 677-689 (2006).
- Levental, I., Georges, P. C., Janmey, P. A. Soft biological materials and their impact on cell function. Soft Matter. 3 (3), 299-306 (2007).
- Lin, C. C., Raza, A., Shih, H. PEG hydrogels formed by thiol-ene photo-click chemistry and their effect on the formation and recovery of insulin-secreting cell spheroids. Biomaterials. 32 (36), 9685-9695 (2011).
- Khetan, S., Burdick, J. Cellular encapsulation in 3D hydrogels for tissue engineering. J Vis Exp. (32), e1590 (2009).
- Bryant, S. J., Nuttelman, C. R., Anseth, K. S. Cytocompatibility of UV and visible light photoinitiating systems on cultured NIH/3T3 fibroblasts in vitro. J Biomater Sci Polym Ed. 11 (5), 439-457 (2000).
- Burdick, J. A., Chung, C., Jia, X., Randolph, M. A., Langer, R. Controlled Degradation and Mechanical Behavior of Photopolymerized Hyaluronic Acid Networks Controlled Degradation and Mechanical Behavior of Photopolymerized Hyaluronic Acid Networks. Society. 6 (1), 386-391 (2005).
- Marsano, E., Gagliardi, S., Ghioni, F., Bianchi, E. Behaviour of gels based on (hydroxypropyl) cellulose methacrylate. Polymer (Guildf). 41 (21), 7691-7698 (2000).
- Bryant, S. J., Anseth, K. S. Photopolymerization of Hydrogel Scaffolds. Scaffolding Tissue Eng. , 71-90 (2005).
- Khetan, S., Burdick, J. A. Patterning hydrogels in three dimensions towards controlling cellular interactions. Soft Matter. 7 (3), 830-838 (2011).
- Mosiewicz, K. A., et al. In situ cell manipulation through enzymatic hydrogel photopatterning. Nat Mater. 12 (11), 1072-1078 (2013).
- Williams, C. G., Malik, A. N., Kim, T. K., Manson, P. N., Elisseeff, J. H. Variable cytocompatibility of six cell lines with photoinitiators used for polymerizing hydrogels and cell encapsulation. Biomaterials. 26 (11), 1211-1218 (2005).
- Nimmo, C. M., Owen, S. C., Shoichet, M. S. . Diels - Alder Click Cross-Linked Hyaluronic Acid Hydrogels for Tissue Engineering. , 824-830 (2011).
- DeForest, C. A., Anseth, K. S. Cytocompatible click-based hydrogels with dynamically tunable properties through orthogonal photoconjugation and photocleavage reactions. Nat Chem. 3 (12), 925-931 (2011).
- Fairbanks, B. D., Sims, E. A., Anseth, K. S., Bowman, C. N. Reaction rates and mechanisms for radical, photoinitated addition of thiols to alkynes, and implications for thiol-yne photopolymerizations and click reactions. Macromolecules. 43 (9), 4113-4119 (2010).
- Tibbitt, M. W., Anseth, K. S. Hydrogels as extracellular matrix mimics for 3D cell culture. Biotechnol Bioeng. 103 (4), 655-663 (2009).
- Wylie, R. G., et al. Spatially controlled simultaneous patterning of multiple growth factors in three-dimensional hydrogels. Nat Mater. 10 (10), 799-806 (2011).
- Pompe, T., Salchert, K., Alberti, K., Zandstra, P., Werner, C. Immobilization of growth factors on solid supports for the modulation of stem cell fate. Nat Protoc. 5 (6), 1042-1050 (2010).
- Hudalla, G. A., Murphy, W. L. Biomaterials that regulate growth factor activity via bioinspired interactions. Adv Funct Mater. 21 (10), 1754-1768 (2011).
- Lee, S. H., Moon, J. J., West, J. L. Three-dimensional micropatterning of bioactive hydrogels via two-photon laser scanning photolithography for guided 3D cell migration. Biomaterials. 29 (20), 2962-2968 (2008).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon