È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Purificazione della cromatina del locus genico a copia singola in Saccharomyces cerevisiae
In questo articolo
Riepilogo
Questo protocollo presenta un metodo di isolamento della cromatina locus-specifico basato sulla ricombinazione sito-specifica per purificare un locus genico a singola copia di interesse nel suo contesto nativo della cromatina dal lievito in gemmazione, Saccharomyces cerevisiae.
Abstract
L'unità organizzativa di base della cromatina eucariotica è la particella del nucleo del nucleosoma (NCP), che comprende il DNA avvolto ~ 1,7 volte attorno a un ottamero istone. La cromatina è definita come l'entità degli NCP e di numerosi altri complessi proteici, compresi i fattori di trascrizione, il rimodellamento della cromatina e gli enzimi modificanti. Non è ancora chiaro come queste interazioni proteina-DNA siano orchestrate a livello di specifici loci genomici durante le diverse fasi del ciclo cellulare. Ciò è dovuto principalmente alle attuali limitazioni tecniche, che rendono difficile ottenere misurazioni precise di tali interazioni dinamiche. Qui, descriviamo un metodo migliorato che combina la ricombinazione sito-specifica con un efficiente protocollo di purificazione di affinità in un'unica fase per isolare un locus genico di interesse a singola copia nel suo stato nativo della cromatina. Il metodo consente l'arricchimento robusto del locus bersaglio sulla cromatina genomica, rendendo questa tecnica una strategia efficace per identificare e quantificare le interazioni proteiche in modo imparziale e sistematico, ad esempio mediante spettrometria di massa. A seguito di tali analisi composizionali, la cromatina nativa purificata con questo metodo riflette probabilmente la situazione in vivo per quanto riguarda il posizionamento dei nucleosomi e le modificazioni degli istoni ed è, quindi, suscettibile di ulteriori analisi strutturali e biochimiche della cromatina derivata praticamente da qualsiasi locus genomico nel lievito.
Introduzione
L'organizzazione dinamica dei genomi eucariotici in cromatina compatta il DNA per adattarsi ai confini del nucleo, garantendo al contempo una dinamica sufficiente per l'espressione genica e l'accessibilità per i fattori regolatori. In parte, questa versatilità è mediata dal nucleosoma, l'unità di base della cromatina, che comprende una particella centrale con 147 bp di DNA avvolto ~1,7 volte attorno all'ottameroistonico 1. Il nucleosoma è una struttura altamente dinamica per quanto riguarda la sua composizione, con numerose varianti istoniche e modificazioni post-traduzionali (PTM) sulle code istoniche N- e C-terminali. Inoltre, la cromatina eucariotica interagisce con una moltitudine di altri componenti essenziali, come i fattori di trascrizione, i macchinari per l'elaborazione del DNA e dell'RNA, le proteine architettoniche, gli enzimi coinvolti nel rimodellamento e nella modifica della cromatina e le molecole di RNA associate alla cromatina. Questi macchinari cruciali coinvolti nella trascrizione, nella replicazione e nella riparazione richiedono tutti l'accesso alla cromatina, che funge da substrato naturale per questi processi. Di conseguenza, la comprensione dei meccanismi molecolari alla base di queste transazioni del DNA richiede una definizione precisa delle alterazioni collettive nella struttura della cromatina nelle specifiche regioni genomiche in cui questi meccanismi convergono e facilitano le reazioni biologiche.
Nonostante l'identificazione di numerosi fattori della cromatina attraverso la genetica e gli studi di interazione proteina-proteina, l'esecuzione di analisi dirette, imparziali e complete delle interazioni della cromatina in particolari siti genomici è rimasta un ostacolo significativo 2,3. Inizialmente, solo regioni altamente abbondanti del genoma (cioè loci ripetitivi) o plasmidi multi-copia potevano essere isolati in quantità e purezza sufficienti per l'identificazione spettrometrica di massa delle proteine associate 4,5,6,7. Una serie di nuovi approcci basati sull'ibridazione diretta di sonde di cattura con DNA cromatinizzato, sulla biotinilazione di prossimità utilizzando il sistema CRISPR-dCas9 o sul legame di proteine adattatrici sequenza-specifiche al locus di interesse hanno iniziato a svelare il proteoma di loci a singola copia da genomi di lieviti e mammiferi 8,9,10. Tuttavia, tutti questi metodi richiedono la reticolazione della formaldeide per stabilizzare le interazioni proteina-DNA e la sonicazione per solubilizzare la cromatina per la successiva purificazione. Insieme, entrambe le manipolazioni escludono la possibilità di successivi studi strutturali e funzionali della cromatina purificata.
Per superare queste limitazioni, abbiamo precedentemente ideato una metodologia che impiega la ricombinazione sito-specifica per estrarre domini cromosomici mirati dal lievito11,12. In sostanza, la regione genomica di interesse è circondata da siti di riconoscimento (RS) per la R-ricombinasi sito-specifica di Zygosaccharomyces rouxi, incorporando contemporaneamente un gruppo di tre siti di legame al DNA per la proteina LexA repressore trascrizionale procariotica (LexA) all'interno della stessa regione. Le cellule di lievito contengono una cassetta di espressione per l'espressione simultanea di R-ricombinasi e una proteina LexA fusa a un tag di purificazione di affinità tandem (TAP). Dopo l'induzione della R-ricombinasi, l'enzima asporta in modo efficiente la regione bersaglio dal cromosoma sotto forma di un dominio cromatinico circolare. Questo dominio può essere purificato tramite la proteina adattatore LexA-TAP, che si lega ai siti di legame del DNA LexA, nonché a un supporto di affinità. Questo metodo è stato recentemente utilizzato per isolare domini cromatinici distinti contenenti origini di replicazione selezionate del cromosoma III13 del lievito.
Uno dei principali vantaggi di questo approccio ex vivo è che consente analisi funzionali del materiale isolato. Ad esempio, i domini di origine della replicazione purificati con questo metodo possono essere sottoposti a saggi di replicazione in vitro per valutare l'efficienza della cottura dell'origine in una provetta da modelli di cromatina assemblati nativi in vivo . In definitiva, la caratterizzazione biochimica e funzionale del materiale isolato può consentire la ricostituzione di processi nucleari utilizzando proteine purificate insieme al modello di cromatina nativa. In sintesi, questa metodologia apre una strada entusiasmante nella ricerca sulla cromatina, in quanto sarà possibile seguire i cambiamenti compositivi e strutturali della cromatina collettiva di una specifica regione genomica che subisce una certa transazione cromosomica.
Protocollo
Vedere la Tabella dei materiali per i dettagli relativi a tutti i materiali e gli strumenti utilizzati in questo protocollo. Vedere la Tabella 1 per un elenco delle soluzioni, dei buffer e dei supporti utilizzati.
1. Costruzione del ceppo di lievito ricombinante
- Per costruire un ceppo di lievito competente per la ricombinazione, trasformare il plasmide K238 digerito da SbfI in un ceppo di lievito con siti di legame LexA integrati e siti di ricombinazione RS nel locus di interesse13,14.
NOTA: Il frammento di restrizione SbfI trasformato contiene la cassetta di espressione richiesta per l'espressione costitutiva della proteina di fusione LexA-TAP e della R-ricombinasi insieme a sequenze omologhe del cromosoma I del lievito per l'integrazione genomica della cassetta di espressione mediante ricombinazione omologa (Figura 1). - Per costruire un ceppo di controllo, prendere un ceppo di lievito isogenico privo di siti di legame RS e LexA integrati e trasformarlo con plasmide K238 digerito da SbfI nelle stesse condizioni utilizzate per il ceppo competente per la ricombinazione.
- Selezionare le cellule di lievito competenti in base al marcatore di selezione LEU2 sulle piastre di agar SCD-LEU14.
2. Accoppiamento di anticorpi IgG a microsfere magnetiche attivate da resina epossidica
NOTA: Accoppiare gli anticorpi IgG alle microsfere magnetiche attivate dalla resina epossidica secondo il seguente protocollo pubblicato11.
- Sospendere 300 mg di perle attivate da resina epossidica in 10 mL di acetone al 50% (300 mg corrispondono a ~5,1 × 1010 perline) in una provetta conica da 50 mL. Agitare energicamente su un mixer a vortice.
- Centrifugare la provetta contenente le perle a 820 × g e 4 °C per 2 min. Rimuovere il surnatante.
- Lavare le perle 3 volte con 20 mL di tampone fosfato di sodio 0,1 M (pH 7,4). Rimuovere il surnatante dopo ogni fase di lavaggio mediante centrifugazione come descritto al punto 2.2.
- Sospendere le perle in 16 mL di tampone fosfato di sodio 0,1 M (pH 7,4) e ruotare delicatamente in forno di ibridazione per 5 minuti a temperatura ambiente.
- Sciogliere le IgG di coniglio (100 mg) in 7 mL di dH2O (concentrazione finale: 14 mg/mL).
- Centrifugare la sospensione IgG a 13.000 × g e 4 °C per 10 minuti per chiarire la sospensione.
- Trasferire 3,5 mL del surnatante (corrispondenti a 50 mg di IgG di coniglio) in una nuova provetta conica da 50 mL.
- Diluire la soluzione di IgG con 9,85 mL di tampone fosfato di sodio 0,1 M (pH 7,4), seguito dall'aggiunta goccia a goccia di 6,65 mL di solfato di ammonio 3 M in fosfato di sodio 0,1 M (pH 7,4) sotto miscelazione delicata.
NOTA: Evitare di aggiungere rapidamente solfato di ammonio alla soluzione poiché un'alta concentrazione locale del sale causerà la precipitazione delle IgG di coniglio. - Centrifugare la soluzione di IgG a 820 × g e 4 °C per 3 minuti e aggiungere il surnatante risultante alla sospensione di microsfere magnetiche.
- Incubare la provetta per una notte o almeno per 18 ore a 30 °C con una leggera rotazione in un forno di ibridazione.
- Rimuovere il surnatante come descritto al punto 2.2.
- Lavare le perle con 20 mL di glicina-HCl 100 mM (pH 2,5). Rimuovere rapidamente la soluzione come descritto al punto 2.2 per evitare la denaturazione dei polipeptidi IgG.
- Lavare le perle una volta con 20 mL di Tris-HCl 10 mM (pH 8,8). Aspirare il surnatante come descritto al punto 2.2.
- Aggiungere 20 mL di soluzione di trietilammina 0,1 M per 5-10 minuti con una leggera rotazione per inattivare i gruppi epossidici reattivi residui. Rimuovere il surnatante come descritto al punto 2.2.
- Lavare le perline 4 volte con 20 ml di PBS (pH 7,4) per 5 minuti con una rotazione delicata. Rimuovere il surnatante come descritto al punto 2.2 dopo ogni fase di lavaggio.
- Lavare le perle 2 volte con 20 mL di PBS (pH 7,4) con Triton X-100 allo 0,5% (p/v) per 5 minuti e 15 minuti ciascuna sotto una leggera rotazione in un forno di ibridazione. Rimuovere il surnatante come descritto al punto 2.2.
- Sospendere le perle in un volume finale di 16 mL di PBS (pH 7,4) con lo 0,02% di sodio azide (p/v). Conservare in aliquote da 1 mL a 4 °C fino al momento dell'uso.
3. Coltura e raccolta di cellule di lievito
- Inoculare ceppi di lievito competenti per il controllo e la ricombinazione da piastre YPD in 5 mL di terreno YPR e incubare per una notte a 30 °C e 200 giri/min.
- Inoculare 2 mL di questa coltura in 100 mL di terreno YPR e incubare per una notte a 30 °C e 200 rpm.
- Per ciascun ceppo, erogare 1.800 mL di terreno YP autoclavato e 200 mL di soluzione di raffinosio autoclavato (20% p/v) in ciascuno dei due palloni di Erlenmeyer da 5 L (4 L di terreno di coltura in totale per ciascun ceppo, divisi in due palloni).
- Inoculare le cellule di lievito in crescita a OD600 0,2 nel rispettivo terreno e incubare come descritto al punto 3.1 per circa 6 ore o fino a quando le cellule raggiungono l'OD600 desiderato di 1,0. Per garantire una crescita normale delle cellule, prive di qualsiasi contaminazione, controllare l'OD ad intervalli di 2 ore.
- Aggiungere 200 mL di galattosio (20% p/v) per indurre la ricombinazione sito-specifica.
- Aggiungere 110 μL (50 ng/mL) di YMFA (contemporaneamente al galattosio, fase 3.5) per arrestare le cellule nella fase G1 e incubare per 2 ore.
NOTA: L'aggiunta di YMFA alle cellule dipende dalle condizioni sperimentali e dal quesito biologico da affrontare. Precisamente, per questo esperimento, le cellule vengono arrestate in fase G1 per ottenere una popolazione cellulare omogenea con origini di replicazione autorizzate; in questo processo, il complesso pre-replicativo si lega alle origini nella fase G1 prima dell'inizio della replicazione del DNA nella fase S. - Trasferire la sospensione cellulare in secchi da centrifuga da 1 L e centrifugare a 6.000 × g e 4 °C per 10 minuti. Scartare il surnatante e risospendere i pellet cellulari in un volume totale di 10-15 mL di dH2O.
- Sigillare una siringa da 25 mL con un tappo Luer e posizionarla all'interno di una provetta conica da 50 mL riempita d'acqua. Trasferire la sospensione cellulare nel gruppo siringa e centrifugare a 2.397 × g per 10 minuti a temperatura ambiente. Scartare il surnatante.
- Rimuovere il tappo Luer dalla siringa ed estrudere le cellule in azoto liquido per formare "spaghetti" cellulari.
NOTA: L'uso di 4 L di terreno di coltura fornisce un peso umido di pellet cellulari finali di 7-10 g. - Trasferire gli spaghetti congelati in una provetta conica da 50 ml e conservare a −80 °C fino al nuovo utilizzo.
4. Purificazione del locus della cromatina
NOTA: Vedere la Figura 2 per una panoramica schematica dei passaggi coinvolti in questo protocollo di purificazione della cromatina specifico del locus.
- Raffreddare un macinacaffè commerciale macinando 30-50 g di ghiaccio secco scuotendo vigorosamente il macinacaffè 2 volte per 30 secondi ogni volta. Una volta raffreddato, scartare la polvere di ghiaccio secco.
- Mescolare 3 g di spaghetti congelati a cellule di lievito con ~30-50 g di ghiaccio secco nel macinacaffè preraffreddato.
- Sigillare la giunzione tra il tappo e il macinino con parafilm per evitare la perdita di polvere di cellule di lievito durante la macinazione.
- Macinare la miscela di ghiaccio secco e cellule di lievito 10 volte per 30 secondi ogni volta, con intervalli di 30 secondi tra ogni giro (tempo totale stimato: ~10 min). Per evitare che il ghiaccio secco e la polvere cellulare si attacchino alle pareti del macinacaffè, picchiettare continuamente i lati del macinacaffè durante la macinazione.
- Trasferire la polvere di ghiaccio secco di cellule di lievito risultante in un bicchiere di plastica utilizzando una spatola pulita e asciutta.
- Tenere i bicchieri a temperatura ambiente per far evaporare il ghiaccio secco.
- Una volta evaporato il ghiaccio secco, aggiungere 2,25 mL di tampone MB con 1x inibitori della proteasi e della fosfatasi (750 μL/g di cellule di lievito) alla polvere di cellule di lievito.
- Pipettare energicamente la miscela cellula-tampone per garantire la sospensione completa delle cellule con il tampone e trasferirla in una provetta conica da 15 mL.
- Prelevare campioni per l'analisi del DNA (0,1%) e delle proteine (0,05%) dalla sospensione cellulare risultante (estratti cellulari grezzi [CCE]). Conservare a −20 °C fino a nuova lavorazione (descritta al paragrafo 7).
- Trasferire la sospensione cellulare in provette di reazione da 2 mL a basso legame e centrifugare a 21.130 × g per 30 minuti a 4 °C per separare i detriti cellulari dal lisato cellulare grezzo.
- Raggruppare i surnatanti di tutte le provette in una provetta conica da 15 ml.
- Prelevare campioni dal surnatante (input [IN]) per l'analisi del DNA (0,1%) e delle proteine (0,05%). Conservare a −20 °C fino a nuova lavorazione (descritta al paragrafo 7).
- Equilibrare 500 μL di impasto a microsfere magnetiche accoppiate a IgG (per ciascun ceppo di lievito) lavando 2x con 500 μL di tampone MB freddo con 1x inibitori della proteasi e della fosfatasi per 5 minuti ciascuno a 4 °C in rotazione a 20 giri/min. Scartare il surnatante dalle perle utilizzando una rastrelliera magnetica dopo ogni fase di lavaggio.
- Incubare le microsfere magnetiche accoppiate a IgG in 500 μL di tampone MB freddo con 1x inibitori della proteasi e della fosfatasi per 1 ora a 4 °C in rotazione a 20 giri/min. Scartare il surnatante dalle perline utilizzando una rastrelliera magnetica.
- Miscelare l'impasto a microsfere magnetiche bilanciato con il lisato cellulare e incubare con rotazione a 20 giri/min per 2 ore a 4 °C.
- Trasferire l'intera sospensione di lisato di microsfere magnetiche in provette di reazione a basso legame.
- Separare le perle magnetiche, che ora trasportano gli anelli di cromatina di interesse, dal lisato cellulare utilizzando un rack magnetico.
- Trasferire il flusso rimanente (FT) da ciascuna provetta a una nuova provetta conica da 15 mL e prelevare campioni per l'analisi del DNA (0,1%) e delle proteine (0,05%). Conservare a −20 °C fino a nuova lavorazione (descritta al paragrafo 7).
- Sospendi le biglie magnetiche da ciascuna provetta in 300 μL di tampone MB freddo e raggruppa le perle in una provetta di reazione. Lavare 5 volte per 10 minuti ciascuna con 750 μL di tampone MB freddo con 1x inibitori della proteasi e della fosfatasi a 4 °C a rotazione a 20 giri/min. Eseguire il lavaggio finale con 750 μL di tampone MB a freddo senza inibitori della proteasi e della fosfatasi.
- Sospendere le microsfere in 40 μL di tampone MB freddo senza inibitori della proteasi e della fosfatasi.
NOTA: Il volume finale dell'eluato può essere regolato in base all'applicazione a valle prevista. L'eluizione TEV di solito funziona in modo efficiente nell'intervallo 100-300 μL.
5. Eluizione mediata da TEV proteasi
- Per rilasciare i complessi dell'anello di cromatina LexA-CBP dalle perle, incubare le perle con 2 μL di proteasi TEV ricombinante 6x His-tagged per una notte a 4 °C e 450 rpm in un termomiscelatore.
- Separare le perle dall'eluato finale utilizzando una rastrelliera magnetica. Trasferire l'eluato, contenente anelli di cromatina scissi, in una nuova provetta di reazione da 1,5 mL.
- Tenere nuovamente le provette su una griglia magnetica per separare eventuali perle residue dall'eluato finale.
- Risospendere le microsfere (TB) in 750 μL di tampone AC freddo e prelevare campioni per l'analisi del DNA (0,1%) e delle proteine (0,05%). Conservare a −20 °C fino a nuova lavorazione (descritta al paragrafo 7).
- Dall'eluato finale (TE), prelevare campioni per l'analisi del DNA (0,5%) e delle proteine (0,25%). Conservare a −20 °C fino a nuova lavorazione (descritta al paragrafo 7).
NOTA: A causa del basso volume dell'eluato finale, la percentuale dei campioni raccolti per l'analisi del DNA e delle proteine viene aumentata per ottenere una migliore rappresentazione del loro contenuto proteico e di DNA durante l'analisi.
6. Eluizione per denaturazione
- Lavare le perle 2 volte in 750 μL di tampone AC freddo per 20 minuti ogni volta a 4 °C a rotazione a 20 giri/min.
- Per estrarre i restanti complessi legati alla LexA-cromatina, eseguire l'eluizione per denaturazione aggiungendo 500 μL di 0,5 M NH4OH alle microsfere e incubare per 30 minuti a temperatura ambiente.
- Separare le perle dalla sospensione utilizzando un rack magnetico e trasferire l'eluato in una provetta di reazione a basso legame.
- Incubare nuovamente le perle come nel passaggio 6.2 per recuperare i loci massimi della cromatina nell'eluato.
- Separare le perle dalla sospensione utilizzando una rastrelliera magnetica e raggruppare l'eluato risultante nella stessa provetta contenente l'eluato del passaggio 6.3.
- Risospendere le microsfere (DB) in 750 μL di dH2O e prelevare campioni per l'analisi del DNA (0,1%) e delle proteine (0,05%).
- Dall'eluato finale (DE), prelevare campioni per l'analisi del DNA (0,5%) e delle proteine (0,25%).
7. Analisi del DNA e delle proteine
- Analisi del DNA
- Preparazione del campione
- Ai campioni di DNA, aggiungere 100 μL di tampone IRN e aumentare il volume con dH2O fino a un volume finale di 200 μL.
- Aggiungere 1 ng di DNA plasmidico spike-in K071.
- Aggiungere 1 μL di RNAsi A (10 mg/mL) e incubare a 37 °C per 1 ora.
- Aggiungere 5 μL di proteinasi K (10 mg/mL) e 10 μL di SDS (20%) e incubare per 1 ora a 56 °C.
- Aggiungere 200 μL di fenolo/cloroformio/alcol isopropilico (25:24:1) e vorticare accuratamente 2 volte per 10 secondi ogni volta.
- Centrifugare i campioni a 21.130 × g per 7 minuti per separare la fase organica da quella acquosa.
- Trasferire il surnatante in nuove provette da 1,5 mL contenenti 1,5 μL di glicogeno (5 mg/mL) e 2,5 volte etanolo al 100%.
- Incubare le provette a -20 °C per un minimo di 2 ore e un massimo di una notte per far precipitare il DNA.
- Centrifugare a 21.130 × g, 4 °C per 45 min. Scartare il surnatante.
- Aggiungere 150 μL di etanolo al 70% senza risospendere il pellet di DNA e centrifugare nuovamente a 21.130 × g a 4 °C per 10 min.
- Essiccare i pellet di DNA a temperatura ambiente per 10-15 minuti e risospendere in 40 μL di dH2O.
- Eseguire la digestione dell'enzima di restrizione per linearizzare il DNA isolato nel passaggio 7.1.1.11 con endonucleasi di restrizione HpaI. Per una miscela di reazione da 50 μL, incubare 40 μL di DNA isolato + 2 μL di enzima HpaI + 5 μL di tampone enzimatico di restrizione + 3 μL di dH2O per una notte a 37 °C.
- Analisi qPCR
- Diluire il DNA digerito con restrizione in un rapporto 1:5 (10 μL del DNA digerito con restrizione ottenuto dal passaggio 7.1.1.12 in 40 μL di dH2O).
- Utilizzare coppie di primer progettati per la regione ARS316, PDC1 e DNA plasmidico spike-in.
- Eseguire la qPCR utilizzando il programma indicato nella Tabella 2.
- Analizzare i risultati della qPCR mediante quantificazione relativa utilizzando la regione ARS316 e il DNA plasmidico spike-in come bersagli e PDC1 (o qualsiasi altro gene o regione genomica) come locus di riferimento.
- Valutare la percentuale di recupero del locus ARS316 rispetto a PDC1 normalizzando i valori di quantificazione relativi del primer ARS316 e PDC1 in base alla percentuale del volume della frazione prelevata per ciascun campione. Ad esempio, moltiplicare lo 0,1% per il flusso passante per un fattore di 1.000 e lo 0,5% per l'eluato TEV per un fattore di 200.
- Normalizzare le percentuali di recupero di ARS316 e PDC1 con i valori di quantificazione relativi del DNA plasmidico spike-in.
- Valutare l'arricchimento del locus ARS316 sulla cromatina totale valutando i valori target di quantificazione relativi ottenuti utilizzando l'equazione (1).
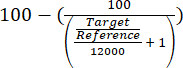 (1)
(1)
- Analisi Southern blot
- A 20 μL di campione di DNA digerito con enzima di restrizione, aggiungere 5 μL di colorante di carica gel.
- Eseguire i campioni in un gel di agarosio all'1% a 110 V per ~3 ore.
- Trasferire il gel in un vassoio e immergerlo in una soluzione di depurazione agitando delicatamente per 20 minuti.
- Sciacquare il gel con dH2O e immergerlo in una soluzione denaturante per 15 minuti agitando. Scartare la soluzione denaturante.
- Immergere il gel in una soluzione denaturante per 15 minuti agitando delicatamente.
- Risciacquare il gel con dH2O e lavarlo 2 volte per 15 minuti ogni volta con il tampone di trasferimento agitando delicatamente.
- Riempire un vassoio con 1-1,5 L di tampone di trasferimento e posizionarlo su una piattaforma stabile.
- Taglia un lungo pezzo di carta Whatman e posizionalo sulla piattaforma in modo tale che le due estremità della carta siano imbevute nel buffer di trasferimento.
- Tagliare una striscia di membrana di nylon positivo e quattro strisce di carta Whatman uguali alla dimensione del gel.
- Posiziona due pezzi di carta Whatman imbevuti nel buffer di trasferimento sulla piattaforma.
- Posiziona il gel a faccia in giù sopra i pezzi di carta Whatman.
- Sopra il gel, posizionare la membrana di nylon positiva, seguita dai restanti due pezzi di carta Whatman imbevuti di tampone di trasferimento. Assicurarsi di mantenere la pila bagnata con il buffer di trasferimento.
- Rimuovere eventuali bolle d'aria intrappolate facendole rotolare via con una bacchetta di vetro.
- Posiziona una pila di tovaglioli di carta sopra la pila assemblata, seguita da un oggetto di 0.5 kg (ad es. una bottiglia di vetro).
- Lasciare il gruppo per il trasferimento notturno a temperatura ambiente.
- Dopo il trasferimento, reticolare UV la membrana con un'energia totale di 1.200 J/cm2.
- Per la rilevazione del locus ARS316, eseguire l'ibridazione southern blot utilizzando sonde radioattive sintetizzate utilizzando il sistema di marcatura del DNA di riferimento.
NOTA: Eseguire tutti i passaggi di seguito sul ghiaccio fino a quando non viene indicato diversamente. - In una provetta di reazione a basso legame diluire 25-40 ng di frammento di PCR (sonda) in 19 μL di dH2O e incubare a 95 °C per 5 minuti. Raffreddare subito su ghiaccio.
- Aggiungere 1 μL ciascuno di 500 μM dCTP, 500 μM dGTP e 500 μM dTTP alla provetta.
- Aggiungere 20 μL del tampone contenente esameri nucleotidici casuali fornito con il kit.
- Aggiungere 5 μL del nucleotide marcato radioattivamente [α-32P] dATP alla provetta. Eseguire tutti i passaggi che coinvolgono materiale marcato radioattivamente in un ambiente protettivo approvato per la radioattività.
- Aggiungere 1 μL di frammento di Klenow e incubare a 37 °C su un termomiscelatore per 15 minuti per la sintesi del DNA a singolo filamento.
- Aggiungere 5 μL di tampone di arresto per arrestare la reazione.
- Centrifugare una colonna di esclusione dimensionale per 2 minuti a 1.500 × g per rimuovere il tampone di conservazione. Scartare il flusso e posizionare la colonna in un tubo nuovo.
- Far passare la miscela della sonda attraverso la colonna per rimuovere i nucleotidi radioattivi non incorporati. Centrifugare per 30 s a 1.500 × g per raccogliere la sonda.
- Aggiungere 150 μL di DNA spermatico di salmone (1:100) per bloccare il legame aspecifico della sonda alla membrana.
- Incubare la miscela della sonda a 95 °C per 5 minuti per denaturare il DNA a doppio filamento.
- Congelare a scatto su ghiaccio per alcuni secondi e centrifugare per alcuni secondi a 500 × g per far cadere le goccioline d'acqua condensate sul coperchio.
- Lavare brevemente la membrana southern blot con il tampone di ibridazione per 5-10 minuti a rotazione.
- Pre-ibridare la membrana con il tampone di ibridazione per 1 h a 55 °C con rotazione. Scartare il buffer di ibridazione.
- Aggiungere 15 mL di tampone di ibridazione fresco (preriscaldato a 55 °C) alla membrana insieme alla sonda preparata. Incubare la membrana per una notte a 55 °C con rotazione.
- Eseguire lavaggi post-ibridazione 2 volte per 15 minuti ciascuno con 0,3x SSC, 0,1% SDS a 55 °C con rotazione.
- Eseguire lavaggi post-ibridazione 2 volte per 15 minuti ciascuno con 0,1x SSC, 0,1% SDS a 55 °C con rotazione.
- Eseguire lavaggi post-ibridazione 2 volte per 15 minuti ciascuno con 0,1x SSC, 1,5% SDS a 55 °C con rotazione.
- Rimuovere la membrana dal tubo di ibridazione ed esporre la membrana a uno schermo fosforometrico per un massimo di 3 giorni per ottenere le impronte radioattive sulla pellicola.
- Acquisisci le immagini della pellicola utilizzando un sistema di scansione laser a fosforigrafia.
- Preparazione del campione
- Analisi delle proteine
- Preparazione del campione
- Regolare tutti i campioni proteici ai loro volumi finali (200 μL, 100 μL, 100 μL, 20 μL e 20 μL per l'estratto di cellule grezze, l'ingresso, il flusso, le perle e i campioni di eluato, rispettivamente) aggiungendo 1 μL di β-mercaptoetanolo, tampone campione PAGE LDS (1x) e dH2O.
- Denaturare i campioni a 95 °C per 5 min.
- Analisi Western blot
NOTA: Eseguire SDS-PAGE e western blotting utilizzando i protocolli standard15,16.- Caricare 15 μL di ciascun campione in ciascun pozzetto di un gel SDS-PAGE da 1,5 mm.
- Eseguire l'immunocolorazione del blot utilizzando gli anticorpi PAP (1:2.000) e LexA (1:1.000) con incubazione notturna a 4 °C. Diluire in una soluzione di latte secco al 5%.
NOTA: Dopo l'analisi PAP, il blot può essere rimosso utilizzando un protocollo di stripping delicato17 prima dell'immunocolorazione con il secondo anticorpo LexA.
- Preparazione del campione
Risultati
La purificazione del dominio della cromatina ARS316 di ~1,4 kb è stata mediata dalla proteina adattatore LexA-TAP espressa costitutivamente. Per fungere da controllo negativo, abbiamo condotto purificazioni utilizzando un ceppo isogenico che esprime LexA-TAP ma non contiene RS integrati e siti di legame LexA. La Figura 3 illustra il risultato dell'analisi del DNA di un esperimento di purificazione standard eseguito sia sul ceppo di controllo che su un ceppo competente per la ricombinazione ...
Discussione
L'identificazione dei fattori e del paesaggio cromatinico di una specifica regione genomica bersaglio continua a rappresentare una sfida importante nella ricerca sulla cromatina18. Questo protocollo descrive un sistema efficiente per asportare e purificare in modo specifico domini cromatinici distinti dai cromosomi del lievito. Per quanto ne sappiamo, la purezza e la resa di questa purificazione in un'unica fase superano molti dei limiti dei metodi di purificazione della cromatina locus-specifici,...
Divulgazioni
Gli autori non hanno conflitti di interesse da rivelare.
Riconoscimenti
Il lavoro nel laboratorio S.H. è stato sostenuto dal DFG attraverso SFB1064 (ID progetto 213249687), il Consiglio europeo della ricerca (ERC Starting Grant 852798 ConflictResolution) e la Helmholtz Gesellschaft.
Materiali
| Name | Company | Catalog Number | Comments |
| Yeast strains | |||
| Control Strain: MATa; ura3Δ0; leu2Δ0; his3Δ1; met15Δ0; bar1::kanMX4; Chr I 212kb::LEU2 pTEF2-LEXA-TAP pGAL1-10 RecR | Section 1, see references 13 and 14 | ||
| Recombination Strain: MATa; ura3Δ0; leu2Δ0; his3Δ1; met15Δ0; bar1::kanMX4; RS_LEXA_NS-3_ARS316_NS+3_RS; Chr I 212kb::LEU2 pTEF2-LEXA-TAP pGAL1-10 RecR | Section 1, see reference 13 and 14 | ||
| Plasmid | |||
| K238 plasmid | Section 1, see reference 13 Storage: Store at -20 °C | ||
| K071 Spike-in plasmid DNA | Section 7.1, see reference 13 Storage: Store at -20 °C | ||
| Reagents | |||
| Acetone | Carl Roth | 5025.1 | Section 2 Storage: Store at room temperature |
| Ammonium acetate (NH4Ac) | Sigma Aldrich | A7262 | Section 6 and 7.1 Storage: Store at room temperature |
| Ammonium solution (NH4OH) 25% | Merck Millipore | 533003 | Section 6 Storage: Store at room temperature |
| Ammonium sulfate | Santa Cruz | Sc-29085 | Section 2 Storage: Store at room temperature |
| Bacto agar | BD (VWR) | 90000-760 | Section 3 Storage: Store at room temperature |
| Bacto peptone | BD (VWR) | 211820 | Section 3 Storage: Store at room temperature |
| β-Mercaptoethanol | Sigma Aldrich | 07604 | Section 7.2 Storage: Store at 4 °C |
| Chemiluminescent substrate kit | ThermoFisher | 34580 | Section 7.2 Storage: Store at 4 °C |
| Di-Sodium Hydrogen phosphate dodecahydrate | Merck | 1.06579.1000 | Section 2 and 7.1 Storage: Store at room temperature |
| Dithiothreitol (DTT) | ThermoFisher | 15508013 | Section 4 Storage: Store at 4 °C |
| Ethanol | Merck | 100983 | Section 7.1 Storage: Store at room temperature |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma Aldrich | ED | Section 7.1 Storage: Store at room temperature |
| Galactose (20% (w/v) stock) | Sigma Aldrich | G0625-1KG / 5KG | Section 3 Storage: Store at room temperature |
| Gel loading dye (6x) | BioLabs | B7024A | Section 7.1 Storage: Store at -20 °C |
| Glusose | Sigma-Aldrich | G8270 | Section Storage: Store at room temperature |
| Glycine | Carl Roth | .0079.4 | Section 2 Storage: Store at room temperature |
| Glycogen (5 mg/mL) | Invitrogen | AM9510 | Section 7.1 Storage: Store at -20 °C |
| Hydrochloric acid (HCl) | PanReac AppliChem | 182109.1211 | Section 2, 4 and 7.1 Storage: Store at room temperature |
| Magnesium Acetate (MgAc) | Bernd Kraft | 15274.2600/C035 | Section 4 Storage: Store at room temperature |
| Magnesium chloride (MgCl2) | Sigma Aldrich | M8266 | Section 6 Storage: Store at room temperature |
| Nu PAGE LDS sample buffer (4x) | Invitrogen | 2399549 | Section 7.2 Storage: Store at room temperature |
| Phenol/Chloroform/Isoamyl alcohol (25:24:1 v/v) | Invitrogen | 15593-031 | Section 7.1 Storage: Store at 4 °C |
| Potassium chloride (KCl) | Sigma | P9541 | Section 4 Storage: Store at room temperature |
| Radioactively labeled α-32P dATP (3,000 Ci/mmol, 10 mCi/mL) | Hartmann Analytic | SRP-203 | Section 7.1 Storage: Store at 4 °C |
| RadPrime labeling system | ThermoFisher | 18428-011 | Section 7.1 Storage: Store at -20 °C |
| Raffinose (20% (w/v) stock) | SERVA | 34140.03 | Section 3 Storage: Store at room temperature |
| Sodium chloride (NaCl) | Merck | K53710504142 | Section 7.1 Storage: Store at room temperature |
| Sodium citrate (Na3C6H5O7) | Sigma-Aldrich | 71402 | Section 7.1 Storage: Store at room temperature |
| Sodium hydroxide (NaOH) | Sigma Aldrich | S5881 | Section 7.1 Storage: Store at room temperature |
| Sodium n-dodecyl sulfate (SDS) (5% stock (w/v) ) | Alfa Aesar | A11183 | Section 7.1 Storage: Store at room temperature |
| Sodium phosphate monobasic | Sigma-Aldrich | 71496 | Section 2 and 7.1 Storage: Store at room temperature |
| Sodium azide | Santa Cruz Biotechnology | sc-208393 | Section 2 Storage: Store at -20 °C |
| Triethylamine | Sigma Aldrich | 90340 | Section 2 Storage: Store at room temperature |
| Tris base | Chem Cruz | SC-3715B | Section 2 and 4 Storage: Store at room temperature |
| Triton X-100 | Sigma Aldrich | X100 | Section 2 and 4 Storage: Store at room temperature |
| Tween-20 | Bernd Kraft | 18014332 | Section 4 Storage: Store at room temperature |
| Yeast extract | BD (VWR) | 212720 | Section 3 Storage: Store at room temperature |
| Yeast mating factor alpha (1 µg/mL stock ) | Biomol | Y2016.5 | Section 3 Storage: Store at -20 °C |
| Yeast Synthetic Drop-out medium Supplements without LEUCINE | Sigma Aldrich | Y1376 | Section 1, see reference 14 |
| Enzymes | |||
| HpaI restriction enzyme (5,000 U/mL) | NEB | R0105S | Section 7.1 Storage: Store at -20 °C |
| Protease and Phosphatase Inhibitor Cocktail (100x) | ThermoFisher Scientific | 78446 | Section 4 Storage: Store at4 °C |
| Proteinase K (10 mg/mL) | SERVA | 33756 | Section 7.1 Storage: Store at -20 °C |
| RNase A (10 mg/mL) | ThermoFisher | EN0531 | Section 7.1 Storage: Store at -20 °C |
| TEV protease (10000 U/µL) | NEB | P8112S | Section 5 Storage: Store at -20 °C |
| Materials | |||
| BcMag Epoxy-Activated Magnetic Beads | Bioclone Inc. | FC-102 | Section 2 Storage: Store at 4 °C |
| Dry ice | Section 4 | ||
| Low-binding centrifuge tubes 2.0 mL | Eppendorf | 22431102 | Section 4 |
| Microspin G-25 Columns | Cytiva | 27-5325-01 | Section 7.1 Storage: Store at room temperature |
| Parafilm | Merck | P7793 | Section 4 |
| Positive nylon membrane | Biozol | 11MEMP0001 | Section 7.1 Storage: Store at room temperature |
| PVDF transfer membrane | Immobilon-Merck Millipore | IPVH00010 | Section 7.2 Storage: Store at room temperature |
| SDS-PAGE gel 4-12% bis-tris (15 well, 1.5 mm) | Invitrogen | NP0336BOX | Section 7.2 Storage: Store at 4 °C |
| Syringe (25 mL) with luer fitting | Henke Sass Wolf | 4200-000V0 | Section 3 |
| Whatman paper (Grade 3MM CHR Cellulose Western Blotting Paper Sheet) | Cytiva | 3030-917 | Section 7.1 Storage: Store at room temperature |
| Antibodies | |||
| Anti-LexA, rabbit polyclonal IgG, DNA binding region antibody | Merck Millipore | 06-719 | Section 7.2 Storage: Store at -20 °C |
| Goat Anti-Rabbit IgG (H+L), Horseradish peroxidase conjugate | Invitrogen | G21234 | Section 7.2 Storage: Store at -20 °C |
| Peroxidase Anti-Peroxidase (PAP) antibody produced in rabbit for the detection of TAP-tagged proteins | Sigma Aldrich | P1291-500UL | Section 7.2 Storage: Store at -20 °C |
| Rabbit IgG antibodies | Sigma | I5006-100MG | Section 2 Storage: Store at 4 °C |
| Primers (10 µM) | |||
| ARS316: fwd 5'- CGGCATTATCGTACACAACCT, rev 5'- GTTCTTCGTTGCCTACATTTTCT | Section 7.1 | ||
| K071 Spike-in plasmid DNA: fwd: 5'-TTTTCGCTGCTTGTCCTTTT, rev 5'- CATTTTCGTCCTCCCAACAT | Section 7.1 | ||
| PCR fragment from yeast genomic DNA as a template for ARS316 amplification (for southern blot): fwd 5’- AAATTCTGCCCTTGATTCGT rev 5’- TTTGTTTATCTCATCACTAAT | Section 7.1 | ||
| PDC1: fwd 5'- CATGATCAGATGGGGCTTCA, rev 5'-ACCGGTGGTAGCGACTCTGT | Section 7.1 | ||
| Equipment | |||
| Coffee grinder | Gastroback | 42601 | Section 4 |
| Dewar flask | NAL GENE | 4150-2000 | Section 3 |
| DynaMag TM-2 magnetic rack | Invitrogen | 12321D | Section 4, 5 and 6 |
| Hybridization oven | Hybaid Mini10 | Ri418 | Section 2 |
| Microcentrifuge | Eppendorf | 5424R | Section 4 and 7.1 |
| UV-crosslinker | Analytikjena | 95-0174-02 | Section 7.1 |
Riferimenti
- Kornberg, R. D., Lorch, Y. Twenty-five years of the nucleosome, fundamental particle of the eukaryote chromosome. Cell. 98 (3), 285-294 (1999).
- Gauchier, M., van Mierlo, G., Vermeulen, M., Déjardin, J. Purification and enrichment of specific chromatin loci. Nature Methods. 17 (4), 380-389 (2020).
- Korthout, T., et al. Decoding the chromatin proteome of a single genomic locus by DNA sequencing. PLoS Biology. 16 (7), e2005542 (2018).
- Antão, J. M., Mason, J. M., Déjardin, J., Kingston, R. E. Protein landscape at Drosophila melanogaster telomere-associated sequence repeats. Molecular and Cellular Biology. 32 (12), 2170-2182 (2012).
- Déjardin, J., Kingston, R. E. Purification of proteins associated with specific genomic loci. Cell. 136 (1), 175-186 (2009).
- Ide, S., Dejardin, J. End-targeting proteomics of isolated chromatin segments of a mammalian ribosomal RNA gene promoter. Nature Communications. 6, 6674 (2015).
- Unnikrishnan, A., Gafken, P. R., Tsukiyama, T. Dynamic changes in histone acetylation regulate origins of DNA replication. Nature Structural & Molecular Biology. 17 (4), 430 (2010).
- Buxton, K. E., et al. Elucidating protein-DNA interactions in human alphoid chromatin via hybridization capture and mass spectrometry. Journal of Proteome Research. 16 (9), 3433-3442 (2017).
- Kennedy-Darling, J., et al. Discovery of chromatin-associated proteins via sequence-specific capture and mass spectrometric protein identification in Saccharomyces cerevisiae. Journal of Proteome Research. 13 (8), 3810-3825 (2014).
- Liu, S. J., et al. CRISPRi-based genome-scale identification of functional long noncoding RNA loci in human cells. Science. 355, 7111 (2017).
- Hamperl, S., et al. Purification of specific chromatin domains from single-copy gene loci in Saccharomyces cerevisiae. Functional Analysis of DNA and Chromatin. 1094, 329-341 (2014).
- Hamperl, S., et al. Compositional and structural analysis of selected chromosomal domains from Saccharomyces cerevisiae. Nucleic Acids Research. 42 (1), 2 (2014).
- Weiβ, M. Single-copy locus proteomics of early- and late-firing DNA replication origins identifies a role of Ask1/DASH complex in replication timing control. Cell Reports. 42 (2), 112045 (2023).
- Gietz, R. D., Schiestl, R. H. High-efficiency yeast transformation using the LiAc/SS carrier DNA/PEG method. Nature Protocols. 2 (1), 31-34 (2007).
- Laemmli, U. K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 227 (5259), 680-685 (1970).
- Towbin, H., Staehelin, T., Gordon, J. Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets: procedure and some applications. Proceedings of the National Academy of Sciences of the United States of America. 76 (9), 4350-4354 (1979).
- Western blot membrane stripping for restaining protocol. Abcam Available from: https://www.abcam.com/protocols/western-blot-membrane-stripping-for-restaining-protocol (2023)
- Vermeulen, M., Déjardin, J. Locus-specific chromatin isolation. Nature Reviews. Molecular Cell Biology. 21 (5), 249-250 (2020).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon