Generazione di un sistema di coltura monostrato bidimensionale di derivazione enteroide primaria bovina per applicazioni nella ricerca biomedica traslazionale
In questo articolo
Riepilogo
Gli enteroidi stanno emergendo come un nuovo modello per lo studio della fisiologia e della fisiopatologia dei tessuti, dello sviluppo di farmaci e della medicina rigenerativa. Qui, descriviamo un sistema di coltura derivato da enteroidi 2D di cellule primarie bovine che consente la co-coltura con i tipi di cellule tissutali rilevanti. Questo modello offre un vantaggio traslazionale per la modellazione della ricerca gastrointestinale.
Abstract
I sistemi di coltura cellulare di organoidi possono ricapitolare la complessità osservata nei tessuti, rendendoli utili nello studio delle interazioni ospite-patogeno, nella valutazione dell'efficacia e della tossicità dei farmaci e nella bioingegneria tissutale. Tuttavia, l'applicazione di questi modelli per i motivi descritti può essere limitata a causa della natura tridimensionale (3D) di questi modelli. Ad esempio, l'utilizzo di sistemi di coltura di enteroidi 3D per studiare le malattie dell'apparato digerente è impegnativo a causa dell'inaccessibilità del lume intestinale e delle sue sostanze secrete. Infatti, la stimolazione di organoidi 3D con agenti patogeni richiede una microiniezione luminale, l'interruzione meccanica della struttura 3D o la generazione di enteroidi apicali. Inoltre, questi organoidi non possono essere co-coltivati con cellule immunitarie e stromali, limitando l'analisi meccanicistica approfondita alle dinamiche fisiopatologiche. Per aggirare questo problema, abbiamo ottimizzato un sistema di coltura monostrato bidimensionale (2D) di cellule primarie bovine, consentendo la co-coltura con altri tipi di cellule rilevanti. Le cripte ileali isolate da bovini adulti sani sono state coltivate per generare organoidi 3D che sono stati crioconservati per un uso futuro. È stato creato un monostrato 2D utilizzando enteroidi 3D rianimati che sono stati fatti passare e interrotti per produrre singole cellule, che sono state seminate su inserti di coltura cellulare transwell rivestiti di estratto di membrana basale, esponendo così la loro superficie apicale. La polarità del monostrato intestinale, la differenziazione cellulare e la funzione barriera sono state caratterizzate utilizzando la microscopia a immunofluorescenza e misurando la resistenza elettrica transepiteliale. La stimolazione della superficie apicale del monostrato ha rivelato la funzionalità attesa del monostrato, come dimostrato dalla secrezione di citochine sia dal compartimento apicale che da quello basale. Il modello monostrato 2D derivato da enteroidi descritto è molto promettente nello studio delle interazioni ospite-patogeno e della fisiologia intestinale, dello sviluppo di farmaci e della medicina rigenerativa.
Introduzione
I modelli animali nella ricerca svolgono un ruolo cruciale nel migliorare la nostra comprensione della fisiopatologia della malattia e delle dinamiche della risposta immunitaria dell'ospite durante l'infezione e supportano lo sviluppo di nuove strategie preventive e terapeutiche 1,2,3,4. Questi modelli supportano la ricerca, la scoperta e il progresso negli animali e sono fondamentali per il progresso della ricerca sulla salute umana. Per decenni, i modelli di roditori sono stati alla base dei progressi nei meccanismi immunitari e nella ricerca biologica fondamentale per le malattie umane 3,5,6,7. Mentre i modelli di roditori sono fondamentali nello screening e nella ricerca iniziale sullo sviluppo, i modelli animali di grandi dimensioni offrono un confronto più pertinente nella ricerca sulle malattie umane sia negli studi di scoperta precoce che in quelli di sviluppo successivo, compresi i test di efficacia terapeutica e di sicurezza 1,3,4,5. Il bestiame offre chiari vantaggi rispetto ai modelli di roditori per una traduzione più efficiente per applicazioni umane per alcune malattie, tra cui criptosporidiosi, salmonellosi, tubercolosi, virus respiratorio sincizialee brucellosi 1,7,8. In effetti, queste e altre malattie si sviluppano spontaneamente nei bovini, che condividono diverse patogenesi e processi immunitari analoghi a quelli umani, e come popolazione di razza esterna, i bovini imitano l'eterogeneità genetica e ambientale che influenza le risposte immunitarie umane 5,8,9,10 . I benefici dei modelli bovini per la ricerca sulle malattie infettive possono essere massimizzati impiegando prima un sofisticato sistema di coltura e poi implementando gradualmente gli studi in vivo. L'uso iniziale di un sistema di coltura di derivazione bovina altamente complesso può ridurre considerevolmente il numero di studi su animali vivi, migliorando al contempo le possibilità di successo della ricerca traslazionale e applicata. I modelli di coltura dovrebbero ricapitolare i processi patologici a livello di organo per una validità predittiva ottimale, mantenendo il microambiente tissutale nativo spazialmente e funzionalmente.
La risposta immunitaria della mucosa è un sistema multiforme composto da una barriera altamente efficiente formata da enterociti gastrointestinali e diverse popolazioni di cellule immunitarie situate al di sotto della superficie della mucosa11. Questo sistema altamente complesso è fondamentale durante l'infezione per mantenere l'omeostasi gastrointestinale e avviare le difese immunitarie contro i patogeni enterici11. La comunicazione tra gli enterociti e le cellule immunitarie innate sottostanti avvia lo sviluppo di risposte immunitarie protettive contro i microrganismi patogeni. Pertanto, i sistemi di coltura comparativi nel loro livello di complessità sono necessari per un'indagine ottimale sulle interazioni ospite-patogeno enterico e sono altamente efficaci nella comprensione della fisiologia enterica e della scoperta e dello sviluppo di farmaci12,13. Gli organoidi sono un robusto sistema di coltura che assomiglia all'architettura e alla funzione del tessuto di origine14,15. La multicellularità di questi modelli permette di studiare il ruolo di diverse popolazioni cellulari e le interazioni cellulari coinvolte nella salute e nella malattia enterica12,14. Tuttavia, i modelli di organoidi di derivazione umana nella ricerca sono attualmente limitati dalla difficoltà di ottenere una quantità sufficiente e una qualità costante di cellule epiteliali intestinali umane e dalla limitata vitalità cellulare in coltura. Le linee cellulari immortalizzate possono essere utilizzate per ottenere elevate rese di colture omologhe in questi modelli in modo coerente; Tuttavia, le cellule trasformate mancano intrinsecamente della diversità e della complessità funzionale delle cellule epiteliali non trasformate 16,17. I vantaggi dell'utilizzo di colture derivate da tessuto bovino come modello per lo studio delle malattie gastrointestinali e della fisiologia includono la facilità con cui i campioni di tessuto possono essere ottenuti in modo coerente da donatori sani, una migliore vitalità cellulare e una maggiore diversità cellulare ottenibile solo con tessuti non immortalizzati. La trascrittomica tissutale comparativa e la caratterizzazione degli organoidi intestinali rivelano somiglianze nei geni ortologhi conservati e nei potenziali cellulari tra l'uomo e il bestiame18. Pertanto, un sistema di coltura derivato da organoidi bovini può essere vantaggioso nello studio delle malattie intestinali umane, con risultati facilmente traducibili in medicina umana.
Il protocollo qui descritto descrive in dettaglio una piattaforma efficace per valutare le risposte dell'ospite a patogeni o composti enterici e la fisiologia intestinale utilizzando un sistema di coltura cellulare primaria 2D derivato da enteroidi bovini. A differenza degli organoidi 3D, i sistemi di coltura 2D generati su inserti transwell consentono una doppia coltura di cellule intestinali con cellule immunitarie o stromali, consentendo lo studio delle dinamiche a livello tissutale. Con applicazioni nella ricerca biomedica, nello sviluppo farmaceutico e nei test di efficacia, questo modello fisiologicamente rilevante può giovare alla salute e al progresso sia del bestiame che delle persone.
Protocollo
Tutti i protocolli sono stati eseguiti nel rispetto delle linee guida e dei regolamenti istituzionali e nazionali per il benessere animale.
1. Preparazione dei reagenti
NOTA: Le concentrazioni di base e finali dei reagenti utilizzati in questo studio sono elencate nella Tabella 1.
- Preparare il tampone per la raccolta del campione: Miscelare 1 L di soluzione salina congelata tamponata con fosfato (PBS) contenente penicillina (100 U/mL), streptomicina (100 μg/mL), gentamicina (25 μg/mL) e caspofungin (2,5 μg/mL). Conservare la soluzione madre a 4 °C.
- Preparare il reagente di dissociazione #1: Mescolare 18,55 mL di tampone per la raccolta del campione (come descritto al punto 1.1), 1,422 mL di acido etilendiamminotetraacetico (EDTA, 0,422 M/pH 7,4), 20 μL di soluzione 1 M di 1,4-ditiotreitolo (DTT), 4 μL di soluzione di Y-27632 (5000x/50 mM). Conservare la soluzione a 4 °C.
- Preparare il reagente di dissociazione #2: Mescolare 18,57 mL di tampone di raccolta (come descritto al punto 1.1), 1,422 mL di EDTA (0,422 M/pH 7,4), 4 μL di soluzione di Y-27632 (5000x/50 mM). Conservare la soluzione a 37 °C.
- Preparare la scorta di terreni di crescita enteroidi: mescolare 9,875 mL di terreno di crescita organoide più integratore, 100 μL di penicillina (100 U/mL), streptomicina (100 μg/mL), 5 μL di gentamicina (25 μg/mL) e 20 μL di caspofungin (2,5 μg/mL). Conservare la soluzione a 4 °C.
- Preparare il terreno di differenziazione degli enteroidi: mescolare 10 mL di terreno di differenziazione degli organoidi più un integratore, 100 μL di penicillina (100 U/mL), streptomicina (100 μg/mL), 5 μL di gentamicina (25 μg/mL) e 20 μL di caspofungin (2,5 μg/mL). Conservare la soluzione a -20 °C.
- Preparare il terreno di lavaggio: mescolare 48,45 mL di DMEM/F-12 1,1 medium (con L-glutammina, senza HEPES), 1 mL di integratore B-27 senza vitamina A (50x stock), 500 μL di penicillina (100 U/mL), streptomicina (100 μg/mL), 25 μL di gentamicina (50 mg/mL di riserva) e 25 μL di caspofungin (5 mg/mL di brodo). Conservare la soluzione a 4 °C.
- Preparare il tampone di rivestimento: Mescolare 25 mL di DMEM: terreno completo F12 senza inibitori e 25 mg di albumina sierica bovina (BSA). Conservare la soluzione a 4 °C.
2. Isolamento delle cripte intestinali da tessuto intero (Figura 1)
NOTA: Gli enteroidi dell'intestino tenue bovino sono stati generati da tessuto ileale ottenuto da manzi Holstein adulti sani (>2 anni di età) provenienti da un impianto locale di lavorazione della carne bovina. Un donatore è stato utilizzato per questa serie di esperimenti.
- Preparazione di campioni di tessuto intestinale
- Posizionare i campioni di tessuto intestinale raccolti di ~ 10 pollici (25 cm) in ~ 400 ml di tampone di raccolta ghiacciato (antibiotici/antimicotici PBS+) e sul ghiaccio per il trasporto in laboratorio.
- Utilizzando forbici chirurgiche (ad es. forbici a maionese) e pinze (ad es. pinze adson), rimuovere il grasso e il mesentere in eccesso dal campione di tessuto intestinale.
- Tagliare il fazzoletto in due pezzi uguali.
- Aprire il tessuto longitudinalmente con le forbici chirurgiche e sciacquare il tessuto in PBS sterile.
- Rimuovere delicatamente lo strato di muco del campione intestinale utilizzando il lato di un vetrino sterile per microscopio e risciacquare il tessuto con PBS fresco.
NOTA: Questo passaggio aiuta a rimuovere i villi e aiuta ad aumentare la purezza delle frazioni della cripta nei passaggi successivi. - Per ogni pezzo da 5 pollici (13 cm), tagliare il tessuto in due pezzi da 2,5 pollici (6,5 cm) e poi tagliare ogni pezzo in 4 piccoli pezzi approssimativamente uguali per facilitare la dissociazione del tessuto.
- Dissociazione del tessuto intestinale
- Preparare un volume di 20 mL del reagente di dissociazione tissutale #1 in una provetta conica sterile da 50 mL e depositare i piccoli campioni di tessuto nella provetta conica fino a quando lo spostamento di volume sposta il menisco dal segno di 20 mL al segno di 35 mL sulla provetta conica.
- Ripetere il passaggio precedente per i restanti campioni di tessuto dell'intestino tenue.
- Sigillare i tubi conici con parafilm e scuotere manualmente il tubo conico 10 volte.
NOTA: Durante tutto il protocollo, l'agitazione manuale deve essere eseguita in modo deliberato ma delicato. - Posizionare i tubi conici orizzontalmente sul ghiaccio in un contenitore su una piattaforma di agitazione orbitale.
- Agitare i tubi conici su ghiaccio nel contenitore per 30 minuti a 80 giri al minuto (giri/min). Ogni 10 minuti, agitare manualmente il tubo conico.
- Preparare un volume di 20 mL di reagente di dissociazione tissutale #2 preriscaldato (37 °C) (formulato come sopra, ma senza DTT) in una provetta conica da 50 mL. Depositare i campioni di tessuto dalle provette coniche contenenti il reagente di dissociazione #1 nelle provette coniche contenenti il reagente di dissociazione #2.
- Sigillare i tubi conici con parafilm e scuotere manualmente i tubi conici 10 volte.
- Mettere le provette coniche in un bagnomaria di agitazione preriscaldato (37 °C), inclinato di circa 60 °C, e agitare a 150 giri/min per 10 minuti, agitando manualmente dopo 5 minuti e di nuovo dopo l'incubazione totale di 10 minuti.
- Isolamento di frammenti di cripta
- Etichetta 10 provette coniche sterili #1 - #10. Aggiungere 20 ml di PBS sterile ghiacciato a ciascuna provetta conica etichettata.
- Trasferire i pezzi di tessuto dalle provette coniche contenenti il reagente di dissociazione #2 in una nuova provetta conica sterile da 50 mL contenente PBS #1 ghiacciato.
- Agitare manualmente i tubi conici 10 volte.
- Sigillare i tubi conici con parafilm e posizionarli orizzontalmente sul ghiaccio. Agitare i tubi conici su un agitatore orbitale per 10 minuti a 80 giri/min. Dopo 10 minuti, agitare manualmente il tubo conico #1 10 volte. Questo è considerato Wash #1.
- Trasferire delicatamente i campioni di tessuto utilizzando un paio di pinze chirurgiche sul tubo conico #2.
- Ripetere i passaggi 2.3.2 - 2.3.4, questo è considerato Lavaggio #2.
- Ripetere i lavaggi fino al lavaggio #10.
- I surnatanti di ogni lavaggio contengono le cripte che verranno utilizzate per la generazione di enteroidi. Mantenere le provette contenenti i surnatanti a 4 °C fino al completamento di tutti e 10 i lavaggi.
- Dopo aver completato il 10° lavaggio e scartata la sezione di tessuto, centrifugare i surnatanti delle provette coniche #6-#10 a 400 x g per 2 minuti a 4 °C per pellettizzare le cripte isolate.
NOTA: I lavaggi 6-10 contengono le frazioni più pulite di cripte intatte con detriti limitati e celle singole. Pertanto, si raccomanda di utilizzare solo queste frazioni per la generazione di enteroidi e di scartare i lavaggi precedenti (#2-#5) - Scartare il surnatante e aggiungere 4 mL di PBS fresco e ghiacciato alle cripte senza risospendere (questo aiuta a mantenere intatti i frammenti fino alla microscopia).
- Valutare la purezza delle cripte dissociate per ogni tubo conico #6-#10 mediante microscopia.
- Aggiungere 50 μL di PBS a una piastra da 384 pozzetti.
- Aggiungere 10 μL di sospensione della cripta al PBS e utilizzare un obiettivo con ingrandimento 40x per determinare la purezza, l'integrità e il numero della cripta.
NOTA: Disegnare una croce sul fondo del piatto facilita il conteggio.
3. Generazione e passaggio ex vivo di enteroidi ileali bovini (Figura 2)
NOTA: Le cripte delle provette coniche con le cripte intestinali più pure e intatte saranno utilizzate per i saggi a valle. Per tutte le fasi che coinvolgono cripte ed enteroidi, i puntali delle pipette, i raschietti per cellule e le provette devono essere pre-rivestiti con il tampone di rivestimento ed evitare le bolle per evitare la perdita di cripte. Salvo diversa indicazione, è necessario utilizzare un puntale per pipette da 1000 μL per evitare la rottura dei frammenti della cripta.
- Generazione di enteroidi da frammenti di cripta
- Combina le frazioni di cripta più pure (di solito #6-#10) in un tubo conico.
- Centrifugare la provetta conica contenente le cripte a 400 x g per 2 minuti a 4 °C.
- Scartare il surnatante aspirandolo con una pipetta e risospendere il pellet della cripta nei terreni di lavaggio.
- Centrifugare come al punto 3.1.2. Decantare il surnatante e aggiungere 2 mL di Wash Media al pellet della cripta.
- Contare il numero di cripte come descritto nel passaggio 2.3.11.1.
- Centrifugare come al punto 3.1.2 per pellettare le cripte, scartare il surnatante e risospendere in una matrice extracellulare (BME) della membrana basale con fattore di crescita ridotto al 100% per ottenere una concentrazione di circa 400 cripte/100 μL.
NOTA: è importante scongelare correttamente il BME a 4 °C poiché le variazioni di temperatura ne alterano la consistenza. È possibile evitare che il BME si solidifichi prematuramente utilizzando un blocco di raffreddamento e puntali per pipette pre-raffreddati.- L'uso di un'altra formulazione di matrice di membrana basale può richiedere la diluizione del BME durante la creazione di cupole. Fare riferimento alle istruzioni del produttore specifiche per il BME in uso.
- Pipettare su e giù per sospendere completamente le cripte nel BME.
- Realizzare cupole crypt-BME pipettando lentamente 50 μL di sospensione crypt-BME su una piastra di coltura tissutale a 6 pozzetti su una piastra riscaldante impostata a 37 °C con un massimo di 8 cupole/pozzetto.
NOTA: La piastra a 6 pozzetti deve essere preriscaldata in un incubatore a 37 °C per una notte prima della placcatura delle cupole. - Tenere la piastra a 6 pozzetti sulla piastra riscaldante per 1 minuto prima di spostare con cautela la piastra in un incubatore a 37 °C, 5% CO2 .
- Dopo 2 minuti, capovolgere la piastra a 6 pozzetti in modo che il coperchio sia rivolto verso il basso e incubare per altri 30 minuti per consentire alle cupole di polimerizzare.
- Dopo 30 minuti, aggiungere con cautela 3 mL di terreno di crescita enteroide a temperatura ambiente (RT) integrato con 10 μM SB202190, 0,5 μM LY2157299 e 10 μM Y-27632 ai pozzetti contenenti cupole.
- Incubare a 37 °C, 5% CO2.
- Rimuovere i terreni e sostituirli con nuovi terreni per la crescita degli enteroidi integrati con inibitori ogni 2-3 giorni.
- Passaggio di enteroidi
- Dopo 7-10 giorni, assicurarsi che le cripte abbiano formato enteroidi 3D con molte strutture in gemmazione, come nella Figura 2E, e siano pronte per essere attraversate.
- Scartare i supporti dai pozzetti contenenti le cupole.
- Per ogni 4 cupole per pozzetto, aggiungere 1 mL di soluzione ghiacciata di dissociazione cellulare non enzimatica integrata con 10 μM Y-27632 a ciascun pozzetto contenente cupole.
- Utilizzando un raschietto per cellule prerivestito, staccare delicatamente la cupola dalla piastra di coltura tissutale.
- Raccogliere gli enteroidi in una provetta conica da 15 mL e triturare pipettando su e giù 10 volte.
- Incubare la provetta conica contenente gli enteroidi frammentati a RT su un agitatore orbitale a 80 rpm per 10 min.
- Aggiungere 10 mL di terreno di lavaggio ghiacciato con 10 μM Y -27632 agli enteroidi.
- Centrifugare la provetta conica a 300 x g per 5 minuti a RT.
- Scartare il surnatante e risospendere il pellet in 10 mL di terreno di lavaggio fresco e trasferirlo in una nuova provetta conica da 15 mL.
- Centrifugare la provetta conica a 300 x g per 5 minuti a RT.
- Scartare il surnatante e risospendere il pellet in 1 mL di terreno di crescita enteroide in provetta da microcentrifuga da 1,5 mL.
- Centrifugare la provetta della microcentrifuga a 300 x g per 5 minuti a RT ed eliminare il surnatante.
- Risospendere il pellet enteroide in BME ghiacciato al 100% e seguire i passaggi 3.1.6-3.1.13.
- Enteroidi di ripassaggio ogni 7 giorni. I tempi di espansione possono variare a seconda della densità, della vitalità e dell'estensione della gemmazione. Più strutture in gemmazione che creano grandi strutture enteroididi sono indicative della necessità di passaggio degli enteroidi.
- Crioconservazione degli enteroidi
- Per la crioconservazione, assicurarsi che gli enteroidi vengano passati non più di cinque volte in coltura.
NOTA: Questo non è stato testato sperimentalmente e si basa sull'osservazione degli autori che i passaggi successivi hanno una vitalità ridotta e producono risultati variabili. - Per prelevare gli enteroidi, utilizzare il tampone di dissociazione come descritto nei passaggi 3.2.2-3.2.9.
NOTA: Dissociare meccanicamente gli enteroidi utilizzando una pipetta da 5 ml. - Contare il numero di frammenti di enteroidi come descritto al punto 2.3.11.1.
- Centrifugare la provetta conica a 300 x g per 5 minuti a RT.
- Scartare il surnatante e risospendere i frammenti enteroidi in terreni di crioconservazione integrati con 10 μM Y-27632 per ottenere una concentrazione di ~2000 frammenti enteroidei/mL e aliquota di 1 mL in crioviali pre-marcati.
- Mettere i crioviali in un contenitore a congelamento controllato e conservare a -80 °C per una notte.
- Trasferire i crioviali in azoto liquido in fase vapore per la conservazione a lungo termine.
- Per la crioconservazione, assicurarsi che gli enteroidi vengano passati non più di cinque volte in coltura.
- Rianimazione di frammenti di cripte intestinali
- Posizionare una piastra a 6 pozzetti per una notte all'interno dell'incubatrice.
- Pre-rivestire una provetta da 5 mL con 5 mL di terreno di rivestimento.
- Rimuovere i crioviali dallo stoccaggio di azoto liquido.
- Immediatamente, una volta scongelate, trasferire le cripte dalla provetta crioviale alla provetta da 5 mL pre-rivestita. Risciacquare il crioviale con il Wash Media e aggiungerlo alla provetta da 5 ml. Evita le bolle.
- Portare il volume a 5 mL con Wash Media e centrifugare a 400 x g per 5 min a 4 °C.
- Durante la centrifugazione, pre-rivestire una provetta da 1,5 mL con il terreno di rivestimento.
- Dopo la centrifugazione, versare il surnatante, risospendere il pellet nel terreno rimasto nella provetta e trasferirlo nella provetta prerivestita da 1,5 mL. Lavare la provetta da 5 mL con Wash Media e trasferirla in una provetta da 1,5 mL. Centrifugare a 400 x g per 5 minuti a 4 °C.
- Portare il volume a 1,5 mL con i terreni di crescita enteroidei.
- Centrifugare come sopra (passaggio 3.4.7) e aspirare accuratamente.
- Prelevare BME da 4 °C e posizionarlo su ghiaccio/blocco di ghiaccio.
- Risospendere il pellet enteroide in BME ghiacciato al 100% e seguire i passaggi 3.1.6- 3.1.12.
- Cambiare il supporto ogni 2-3 giorni.
4. Generazione e valutazione di monostrati 2D da enteroidi 3D
NOTA: Come sopra, per tutte le fasi che coinvolgono cripte ed enteroidi, i puntali delle pipette, i raschietti per cellule e le provette devono essere pre-rivestiti con il tampone di rivestimento e le bolle devono essere evitate per evitare la perdita di cripte.
- Preparazione di inserti transwell per la formazione di monostrati 2D
- Posizionare gli inserti in una piastra adattatrice per colture tissutali a 24 pozzetti e pre-rivestire il lato apicale degli inserti per colture cellulari PET a 24 pozzetti da 1 μm con 100 μL di diluizione 1:15 di BME nei terreni di crescita enteroidi. Rivestire sempre un inserto aggiuntivo che verrà utilizzato come controllo durante l'esecuzione di misurazioni dell'integrità della barriera.
- Posizionare l'inserto rivestito in una piastra adattatore per coltura tissutale a 24 pozzetti nell'incubatrice.
NOTA: Con gli inserti transwell è necessario utilizzare un adattatore specifico o una piastra di coltura tissutale complementare. - Incubare gli inserti di coltura a 37 °C, 5% CO2 per 1 ora per consentire la polimerizzazione.
NOTA: I pozzetti rivestiti con BME possono essere sigillati con parafilm e conservati a 4 °C per un massimo di 1 settimana se non utilizzati immediatamente. - Al termine dell'incubazione, aspirare il terreno di coltura enteroide 3D.
- Dissociazione degli enteroidi 3D
- Generare monostrati enteroidi 2D da frammenti enteroidi crioconservati che sono stati rianimati, placcati e coltivati come descritto sopra nella sezione 3.1 per formare enteroidi 3D. Far passare gli enteroidi scongelati almeno due volte, con l'ultimo passaggio coltivato per un minimo di 5 giorni prima della lavorazione per generare colture monostrato 2D.
- Prelevare gli enteroidi aggiungendo un terreno di lavaggio ghiacciato integrato con 10 μM Y-27632 alle cupole enteroididi (utilizzare circa 1 mL di tampone di dissociazione per 4 cupole)
- Staccare le cupole con un raschietto per celle e raccoglierle in una provetta conica da 15 ml.
- Triturare 30 volte utilizzando un puntale per pipette da 1 mL per generare frammenti enteroidei.
- Triturare 40 volte con un puntale di pipetta da 200 μL per rompere ulteriormente i frammenti enteroidei.
- Portare il volume della provetta conica da 15 mL con frammenti enteroididi a 10 mL con Wash Media ghiacciato.
- Centrifugare la provetta conica a 300 x g per 5 minuti a RT.
- Aspirare il surnatante, compreso lo strato BME, facendo attenzione a non disturbare il pellet enteroideo.
NOTA: Lo strato BME apparirà come uno strato gelatinoso torbido appena sopra il pellet. - Per ogni 4 cupole, risospendere il pellet in 1 mL di enzima TrypLE express preriscaldato integrato con 10 μM di Y-27632.
- Aggiungere la miscela enteroide-TrypLE a una piastra da 24 pozzetti e incubare a 37 °C, 5% CO2 per 10 minuti.
- Dopo 10 minuti, pipettare la miscela enteroide-tripLE 40 volte utilizzando una pipetta da 1 mL per frammentare ulteriormente gli enteroidi.
- Quindi, pipettare i frammenti 40 volte con una pipetta da 200 μL per rompere i frammenti in singole cellule.
- Utilizzando una siringa da 3 mL o 5 mL con un ago sterile da 22 G attaccato, aspirare ed erogare la sospensione cellulare 4 volte per ottenere una sospensione a singola cellula.
- Monitorare la dissociazione cellulare mediante microscopia come descritto al punto 2.3.11.1, fino a quando l'80% degli enteroidi non viene scomposto in singole cellule.
- Raccogliere la sospensione cellulare in una provetta conica da 15 mL e placare la reazione enzimatica aggiungendo 4x volume di Wash Media integrato con il 10% di FBS.
- Filtrare gli enteroidi attraverso un filtro cellulare pre-rivestito da 40 μm due volte in una provetta conica da 50 mL.
- Pellet le singole cellule centrifugando la provetta conica a 300 x g per 5 min.
- Semina monostrato 2D su inserti transwell.
- Decantare il surnatante e risospendere il pellet in un piccolo volume (~600 μL) di terreno di crescita organoide integrato con il 20% di siero fetale bovino (FBS) a RT.
- Determina la densità e la vitalità delle cellule enteroididi utilizzando il metodo di esclusione del colorante Trypan Blue, l'emocitometro o il contatore cellulare automatizzato. Si prevede una redditività media del 75%.
- Rimuovere con cautela la soluzione di rivestimento in eccesso applicata al punto 1.3 dall'inserto di coltura cellulare appena prima di seminare le cellule.
- Seminare le singole cellule a 1 x 105 cellule in un volume di 200 μL per inserto sulla superficie apicale di un inserto per coltura cellulare prerivestito.
- Aggiungere 700 μL di terreno completo integrato con FBS al 20% sul lato basolaterale dell'inserto per colture cellulari.
- Manovrare la piastra 10 volte nella forma del numero 8 per consentire alle celle di distribuirsi uniformemente sull'inserto.
- Tenere la piastra sullo scaldapiatti per 10 minuti nell'armadio di sicurezza biologica.
- Incubare la piastra a 37 °C e al 5% di CO2 .
- Dopo 48 ore, sostituire i terreni sui compartimenti apicale e basale con terreni di crescita enteroidei freschi integrati con FBS al 20% e inibitori.
- Il terzo giorno, rimuovere il terreno dai compartimenti apicale e basolaterale, lavare accuratamente l'inserto con 1x PBS e sostituirlo con terreno di differenziazione enteroide integrato solo con inibitori.
- Sostituire il supporto in entrambi gli scomparti ogni 2-3 giorni.
- Misurazione quantitativa dell'integrità della barriera epiteliale e della confluenza del monostrato
NOTA: L'integrità della barriera può essere valutata utilizzando un voltohmmetro epiteliale per misurare la resistenza elettrica transepiteliale (TEER).- Rimuovere la piastra di coltura transwell dall'incubatore e lasciarla equilibrare a RT per alcuni minuti nella cabina di biosicurezza.
- Assicurarsi che gli elettrodi STX2 siano stati precondizionati e che il voltohmmetro sia calibrato a 1000Ω secondo le istruzioni del produttore.
- Inserire il bastoncino lungo della sonda nel compartimento basolaterale e l'estremità corta nel compartimento apicale della coltura cellulare epiteliale transwell. Fare attenzione a non rompere il monostrato o danneggiare l'inserto.
- Una volta stabilizzato, registrare 3 misurazioni TEER per inserto transwell, incluso l'inserto senza celle. Effettuare una media delle misure per ogni inserto.
- Calcolare il valore TEER corretto sottraendo la misura media del pozzetto bianco dalle misure medie dei pozzetti sperimentali e quindi moltiplicandola per l'area superficiale dell'inserto per determinare la resistenza della barriera epiteliale (TEER [Ω.cm2] = [strato Rcell - Rblank] × Area).
Risultati
Il primo passo per generare monostrati di derivazione enteroide 2D consiste nel preparare la sezione di tessuto intestinale prelevata (Figura 1A) per la dissociazione tissutale. Questo viene fatto rimuovendo il grasso attaccato e il mesentere dal tessuto (Figura 1B), seguito dal taglio longitudinale del tessuto per esporre la superficie del lume in modo che lo strato mucoso dell'intestino possa essere rimosso raschiando delicatamente con un vetrino. La sezione intestinale prelevata viene quindi tagliata in sezioni di tessuto progressivamente più piccole (Figura 1C) per aumentare la facilità di dissociazione. Le cripte vengono quindi dissociate dal tessuto sottomucoso sottostante utilizzando una serie di lavaggi costituiti da tamponi chelanti (Figura 1D,E) e PBS. Le cripte intestinali isolate (Figura 1F) vengono quindi incorporate in cupole di matrice di membrana basale (Figura 2A) e coltivate per diversi giorni per generare enteroidi 3D. Da una sezione di 10 pollici di ileo bovino, circa 900.000 cripte possono essere isolate e utilizzate per la formazione di enteroidi. Dopo poche ore di coltura, le cripte placcate iniziano ad allungarsi e a svilupparsi in enterosfere (Figura 2B). Dopo 2 giorni, si può osservare un lume ben definito (Figura 2C), con strutture di gemmazione osservate già dal giorno 4 in coltura (Figura 2D). Entro il 7° giorno, gli enteroidi maturi si sono sviluppati (Figura 2E). La colorazione in immunofluorescenza dell'enteroide 3D di 7 giorni dimostra la presenza di diverse linee cellulari. La microscopia confocale degli enteroidi dimostra la localizzazione della colorazione nucleare DAPI, della proteina E-caderina alla giunzione aderente, della colorazione della cromogranina-A (Chr-A) che mostra la presenza di cellule enteroendocrine, del lisozima (LYZ) che mostra le cellule di Paneth e della citocheratina-18 (CK-18) che rappresenta le cellule enterocitarie nella Figura 3. Dopo 7-10 giorni di coltura, gli enteroidi devono essere sottoposti a passaggio per consentire un'ulteriore espansione e prevenire il sovraffollamento. Il tempo ottimale per il passaggio degli enteroidi è stato determinato in 7-10 giorni dopo l'isolamento iniziale della cripta primaria e dipende in ultima analisi dalla salute e dal tasso di crescita degli enteroidi in coltura. La densità di semina ottimale per ottenere la morfologia e la vitalità enteroide desiderate, come illustrato nella Figura 2E, è di 400 cripte per cupola. Gli enteroidi possono essere facilmente crioconservati e i frammenti di enteroidi scongelati si riprendono completamente per l'uso sperimentale dopo due passaggi dopo lo scongelamento. In particolare, si raccomandano almeno due passaggi della coltura primaria della cripta prima della crioconservazione.
Al fine di produrre un monostrato di derivazione enteroide 2D, gli enteroidi 3D vengono raccolti e, attraverso una serie di passaggi, vengono triturati meccanicamente in presenza di una soluzione di dissociazione (Figura 4A) in singole cellule. Queste singole cellule possono quindi essere seminate su un inserto transwell che è stato pre-rivestito con una soluzione di terreno di coltura a matrice di membrana basale. In media, quattro transwell possono essere seminati da quattro cupole enteroidi 3D. Il numero di enteroidi 3D processati dipende quindi dal numero di transwell necessari per l'esperimento. La placcatura di singole cellule con una densità di semina di 1 x 105 e la loro coltura iniziale in presenza del 20% di FBS (Figura 4B-D) possono generare un monostrato confluente in meno di 1 settimana. La progressiva confluenza del monostrato 2D in coltura può essere monitorata nel tempo utilizzando la microscopia ottica (Figura 4E,F). Le misurazioni della resistenza elettrica transepiteliale (TEER) possono confermare la confluenza e caratterizzare l'integrità della barriera epiteliale nel tempo e in risposta alla stimolazione sperimentale (Figura 5A). In media, dopo sette giorni di coltura, un monostrato confluente di circa il 100% avrà un valore TEER corrispondente di ~1500 Ω·cm2. Una valutazione longitudinale dei valori di TEER monostrato enteroideo 2D dimostra un aumento costante dei valori di TEER nell'arco di sette giorni, raggiungendo un valore medio massimo di 1546 Ω·cm2 prima di diminuire con il valore più basso di 11,5 Ω·cm2 ottenuto il giorno dodici (Figura 5B). La marcatura immunofluorescente di monostrati differenziati indica che foglietti epiteliali intestinali intatti, organizzati e polarizzati si formano utilizzando questo protocollo (Figura 6). La microscopia confocale del monostrato 2D colorato dimostra la localizzazione della colorazione nucleare DAPI, della E-caderina e della colorazione F-actina (Figura 6A-D). La microscopia a fluorescenza del monostrato 2D mostra segni distintivi di cellule epiteliali intestinali differenziate con colorazione della cromogranina-A (Chr-A) che mostra la presenza di cellule enteroendocrine, lisozima (LYZ) che mostra cellule di Paneth e citocheratina-18 (CK-18) che indica linee cellulari di enterociti (Figura 6E-L). La modellazione Z-stack mostra la polarizzazione attesa della coltura monostrato 2D con deposizione caratteristica di F-actina che si trova nei microvilli che coprono l'aspetto apicale degli enterociti differenziati e di E-caderina, una proteina situata nelle giunzioni aderenti interspaziate tra le cellule epiteliali (Figura 6M).
La funzionalità del monostrato può essere valutata mediante stimolazione apicale con vari componenti, tra cui ligandi o patogeni del recettore Toll-like (TLR), seguita dalla quantificazione delle citochine di surnatanti di colture cellulari prelevati dai compartimenti apicale e basale. Infatti, quando l'aspetto apicale del monostrato viene stimolato per 24 ore con l'agonista TLR 1/2 Pam3csk4 il giorno 4 della coltura, si osserva un aumento della produzione di citochine in entrambi i compartimenti rispetto ai monostrati non trattati (Figura 7A,B).
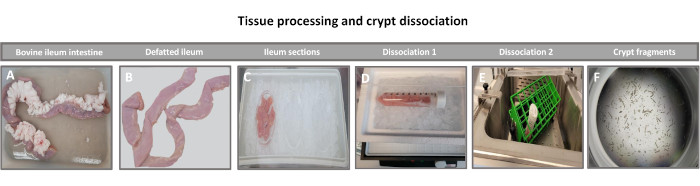
Figura 1: Isolamento della cripta intestinale bovina da bovini adulti sani. Immagini che illustrano l'elaborazione tissutale di (A) ileo intero di bovino adulto, (B) ileo sgrassato, (C) ileo sezionato in pezzi da 2,5 pollici (6,3 cm) in PBS su ghiaccio, (D) sezioni di tessuto ileale nel tampone di dissociazione #1 a 4 °C e (E) nel tampone di dissociazione 2 in un bagno d'acqua agitato a 37 °C e (F) frammenti isolati di cripta ileale. Fare clic qui per visualizzare una versione più grande di questa figura.
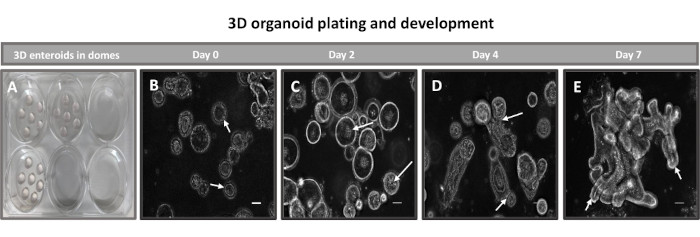
Figura 2: Sviluppo di enteroidi ileali primari 3D bovini nella matrice della membrana basale. Immagini rappresentative di (A) cupole enteroididi 3D create in una piastra di coltura tissutale a 6 pozzetti e sviluppo di enteroidi 3D (B-E) dai giorni 0, 2, 4 e 7 in coltura. Barra della scala = 50 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
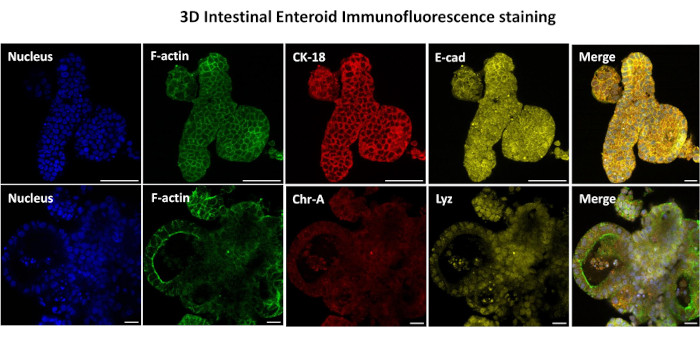
Figura 3: Gli enteroidi intestinali tridimensionali mostrano una colorazione della linea cellulare epiteliale. Immagini rappresentative di enteroidi 3D dopo 7 giorni di coltura dimostrano la presenza di colorazione nucleare, F-actina, citocheratina-18 (CK-18), Cromogranina-A (Chr-A), Ecaderina (E-cad), Lisozima (Lyz) e sovrapposizione di immagini (Merge). Barra graduata 50 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
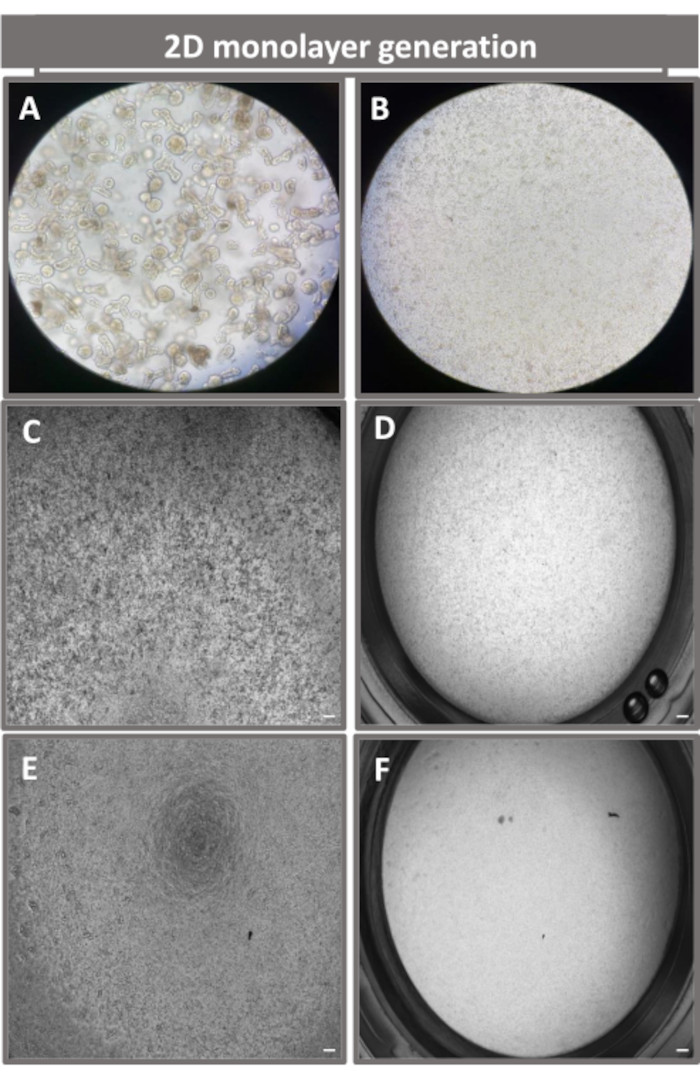
Figura 4: Creazione di un monostrato derivato da enteroidi enteroidi 2D. Immagini rappresentative di (A) frammenti enteroidi 3D in soluzione di dissociazione in preparazione per la semina monostrato, singole cellule piastrate su un inserto transwell con una densità di semina di 1 x 105 riprese il giorno 0 utilizzando (B) luce, (C) contrasto di fase e (D) microscopia in campo chiaro e sviluppo monostrato su inserti transwell ripresi il quinto giorno utilizzando (E) contrasto di fase e (F) Microscopia in campo chiaro. Ingrandimento 40x e barra graduata = 50 μm. Fare clic qui per visualizzare una versione ingrandita di questa figura.
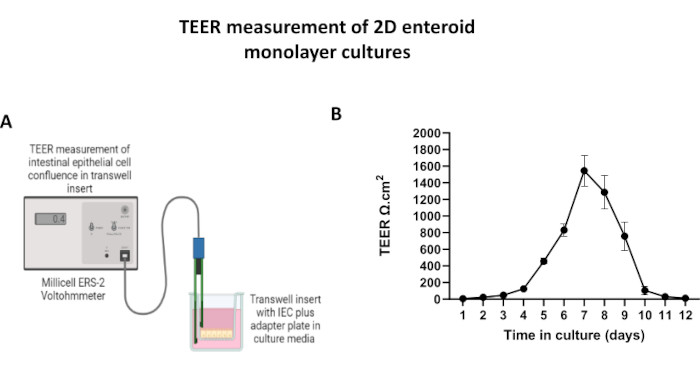
Figura 5: Misurazioni della resistenza elettrica transepiteliale (TEER) del monostrato derivato da enteroidi 2D su inserti transwell. (A) Diagramma schematico di come le misurazioni TEER del monostrato di cellule epiteliali intestinali (IEC) 2D sono ottenute utilizzando gli elettrodi STX2 di un voltohmmetro, (B) Monitoraggio longitudinale delle misurazioni TEER monostrato 2D per 12 giorni in coltura cellulare. Ogni punto dati rappresenta un valore medio di TEER e un errore standard di media (SEM) ottenuti da due repliche tecniche. Fare clic qui per visualizzare una versione più grande di questa figura.
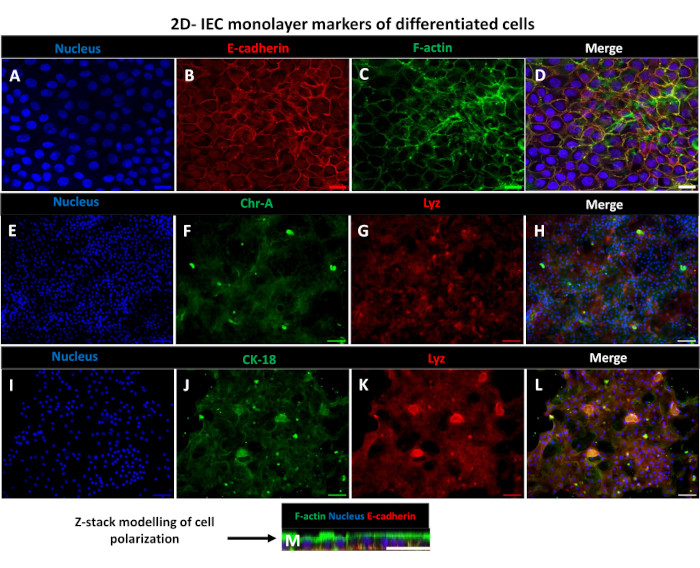
Figura 6: I monostrati differenziati di derivazione enteroide 2D su inserti transwell si sviluppano in foglietti epiteliali intestinali polarizzati. (A-M) Immagini immunofluorescenti rappresentative di un monostrato 2D derivato da enteroidi su inserto transwell dopo 5 giorni in coltura che mostrano la sovrapposizione del nucleo (A) (blu), (B) E-caderina (rosso), (C) F-actina (verde) e (D) delle 3 immagini (unione), (E,I) colorazione nucleare, (F) Cromogranina-A, (J) Citocheratina-18, (G,K) Lisozima e (H,L) Fusione di immagini. (M) Modellazione Z-stack che mostra la distribuzione delle stesse proteine marcatrici di cellule epiteliali del foglio monostrato 2D. Le immagini sono state ottenute da 2 repliche biologiche. Barra della scala = 50 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
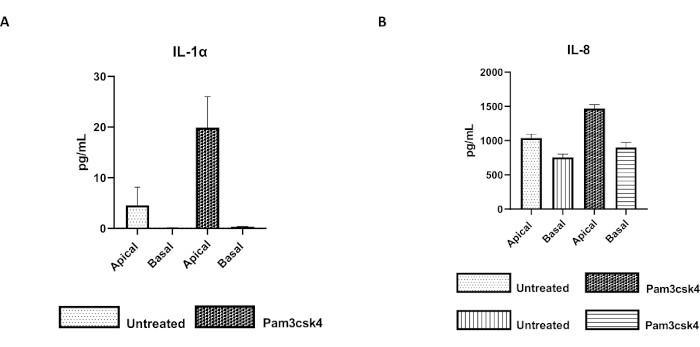
Figura 7: I monostrati primari 2D di derivazione enteroide bovina su inserti transwell sono funzionalmente attivi. Secrezione di citochine surnatanti in colture cellulari apicali e basali di (A) IL-1α e (B) IL-8 da monostrati 2D su inserti transwell dopo 5 giorni in coltura non trattati o stimolati con Pam3csk4 per 24 ore. I dati sono rappresentativi dei livelli medi di citochine e SEM da monostrati derivati da stock congelati di cripte di un animale e di tre esperimenti indipendenti. Le citochine sono state quantificate utilizzando il test multiplex basato su microsfere (Table of Materials) secondo le istruzioni del produttore e analizzate su un'unità di multiplexing compatta (Table of Materials) e su un software di adattamento della curva del test immunologico (Table of Materials). Fare clic qui per visualizzare una versione più grande di questa figura.
Tabella 1: Le concentrazioni di riserva e finali dei reagenti. Clicca qui per scaricare la tabella.
Discussione
Il protocollo qui presentato descrive un modello fisiologicamente rilevante per lo studio della fisiologia intestinale e dei disturbi enterici. Diversi gruppi di ricerca hanno descritto la generazione di colture enteroidi bovine, tra cui i monostrati 2D 16,19,20,21,22,23,24. Sebbene la generazione di monostrati non sia apertamente impegnativa dal punto di vista tecnico, i passaggi di alcuni minuti sono fondamentali per sviluppare culture di successo in modo coerente. Pertanto, la riproducibilità dei monostrati 2D utilizzando i metodi brevemente descritti nella letteratura pubblicata può essere impegnativa per un ricercatore alle prime armi nel campo degli organoidi. Il protocollo qui descritto è adattato da questi protocolli e da quelli pubblicati in altre specie, fornendo una guida passo-passo alla generazione di monostrato su inserti transwell che è altamente riproducibile.
Il protocollo qui delineato può essere facilmente modificato per adattarsi agli obiettivi specifici del disegno sperimentale o alla disponibilità di reagenti. Infatti, seguendo questo protocollo, le colture di successo possono essere ottenute seminando monostrati a una densità cellulare inferiore (ad esempio, 2,5 x 104) o in assenza di FBS, come descritto da altre pubblicazioni24. Tuttavia, l'alterazione di questi parametri può richiedere una coltura aumentata per stabilire un monostrato confluente. Pertanto, se altri fattori integranti nel disegno dello studio, tra cui la co-coltura con cellule immunitarie, dettano un corso temporale specifico per l'esperimento, la densità di semina può essere modificata secondo necessità. Mentre altre formulazioni di membrana basale possono essere sostituite da quella utilizzata in questo protocollo per generare enteroidi 3D e monostrati 2D, questi richiederanno alcune ottimizzazioni per determinare il rapporto ottimale tra membrana basale e media.
L'applicazione degli inserti transwell nella metodologia descritta presenta molti vantaggi rispetto alla crescita monostrato su plasticware convenzionali e colture di enteroidi 3D. Rispetto alle piastre di coltura tissutale standard, l'uso di transwell per colture monostrato promuove la differenziazione e l'organizzazione cellulare in modo da mantenere la somiglianza con le cripte intestinali14,25. La barriera epiteliale intestinale è fondamentale per prevenire la traslocazione di tossine e microrganismi nel corpo, facilitando contemporaneamente l'assorbimento dei nutrienti. Pertanto, è fondamentale capire come funziona l'integrità della barriera intestinale in modo sano e viene alterata durante i disturbi intestinali o in risposta ai composti. A differenza delle colture enteroididi 3D, la valutazione oggettiva dell'integrità della barriera intestinale è possibile quando si combinano monostrati su transwell e si misura il TEER, come dimostrato qui14,25. La generazione di monostrati 2D sui transpozzetti consente anche una doppia coltura con tipi di cellule pertinenti come le cellule immunitarie o stromali. Ciò consente di caratterizzare un crosstalk di fondamentale importanza tra le cellule intestinali e le cellule del microambiente tissutale, cosa che non può essere ottenuta con le colture 3D. L'esposizione della superficie apicale del monostrato non solo consente l'esposizione sperimentale a patogeni e composti e la raccolta di prodotti luminali, ma consente anche studi su altri aspetti della fisiologia e della malattia intestinale, tra cui lo studio del microbiota intestinale e della fisiologia dell'assorbimento molecolare o del trasporto13. Il controllo indipendente sulle superfici intestinali apicali e basali è un netto vantaggio rispetto ai modelli enteroidi 3D.
Attraverso diversi esperimenti di prova, abbiamo identificato i passaggi chiave che hanno contribuito al successo del protocollo. Mentre i campioni di tessuto intestinale intero possono essere refrigerati durante la notte e processati il giorno successivo, la dissociazione tissutale e l'isolamento dei passaggi dei frammenti di cripta devono essere eseguiti tempestivamente per prevenire la disintegrazione delle frazioni di cripta isolate. Dopo aver completato i lavaggi PBS, la centrifugazione delle cripte nei terreni di lavaggio può aiutare a prevenire la rottura della cripta, come descritto nel passaggio 2.3.10. Quando si fanno passare gli enteroidi o li si raccoglie per la formazione di monostrati, è essenziale separare gli enteroidi dalle cupole BME. Il supporto di lavaggio deve essere ghiacciato per facilitare la dissoluzione del BME. Al contrario, l'utilizzo di TrypLE preriscaldato e il filtraggio della sospensione cellulare due volte possono aiutare a formare le singole cellule necessarie per la generazione del monostrato. Infine, manovrare manualmente la piastra a forma di numero 8 può aiutare a disperdere uniformemente le singole celle sull'inserto del transwell.
Un'importante limitazione di questo protocollo è che i monostrati 2D sono stati prodotti da ceppi enteroidi generati da un manzo Holstein maturo (>2 anni di età). La maturazione del tratto gastrointestinale nei vitelli può richiedere piccole modifiche al protocollo descritto per ottenere risultati ottimali. In letteratura sono state descritte differenze specie-specifiche nella fisiologia intestinale delle razze bovine26. Anche se non è noto se queste differenze possano avere un impatto sulla generazione di enteroidi e sulla successiva generazione di monostrato, sospettiamo che eventuali differenze comporterebbero solo piccole modifiche al nostro protocollo. Inoltre, il modello di cultura 2D presenta alcuni svantaggi intrinseci. Rispetto ai modelli enteroidei 3D, le colture 2D possono mancare di alcuni aspetti dell'architettura del tessuto intestinale e della diversità cellulare e creare restrizioni e sfide associate alla propagazione della coltura 2D13. Tuttavia, gli studi dimostrano che alcuni monostrati possono emulare l'organizzazione prevista della cripta27 e alcune di queste limitazioni possono anche essere superate stabilendo colture 2D con un'interfaccia aria-liquido. Ciononostante, i limiti di questo modello dovrebbero essere pienamente considerati per determinare se la sua applicazione è adatta alla domanda sperimentale che viene posta.
Questo protocollo descrive un sistema di coltura ottimizzato che modella il tratto gastrointestinale bovino utilizzando enteroidi derivati dall'ileo bovino per formare monostrati su inserti transwell. Con un'ampia gamma di applicazioni, dalla ricerca sulle malattie infettive alla scoperta di farmaci e alla medicina rigenerativa, questo sistema di coltura ad alto rendimento potrebbe portare allo sviluppo senza precedenti di strategie preventive e terapeutiche che potrebbero essere reciprocamente vantaggiose per la salute animale e umana.
Divulgazioni
Gli autori dichiarano che la ricerca è stata condotta in assenza di qualsiasi relazione commerciale o finanziaria che possa essere interpretata come un potenziale conflitto di interessi.
Riconoscimenti
Riconosciamo l'uso della Cellular and Molecular Core Facility presso la Midwestern University.
Materiali
| Name | Company | Catalog Number | Comments |
| 0.2 mL pipette tip | MidSci | PR-200RK-S | |
| 1 µm PET 24-well cell culture inserts | Corning | 353104 | |
| 1000 mL pipette tip | MidSci | PR-1250RK-S | |
| 22 G needle | Becton, Dickinson and Company | 305156 | |
| 24-well culture vessel | Corning | 353504 | |
| 40 μm cell strainer | Corning | 431750 | |
| 50 mL centrifuge tube | Fisher scientific | 14-955-240 | |
| 5-mL pipet tip | Fisher scientific | 30075307 | |
| 5 mL syringe | Becton, Dickinson and Company | 309647 | |
| 5 mL tube | Eppendorf | 30119401 | |
| Anti-Cytokeratin -18 (C-04) | Abcam | AB668-1001 | |
| B-27 supplement without vitamin A | Gibco | 12-587-010 | |
| Belysa software | Luminex | 40-122 | Immunoassay curve fitting software |
| Bovine serum albumin (BSA) | Fisher bioreagents | BP9704-100 | |
| Caspofungin acetate | Selleckchem | S3073 | |
| Cell lifter | Fisher Scientific | 08-100-241 | |
| Chromogranin-A (E-5) | Santa Cruz Biotechnology | SC-271738 | |
| Coverslips | Fisher scientific | 12-540-C | |
| Cryovials | Neptune scientific | 3471.X | |
| Cultrex Ultimatrix RGF BME | R&D Systems | BME001-05 | |
| DAPI | MilliporeSigma | D9542-5MG | |
| Dissecting scissors | VWR | 82027-588 | |
| Dithiothreitol (DTT) solution | Thermo Scientific | FERR0861 | |
| DMEM/ F-12 1.1 medium (with L-glutamine, without HEPES) | Cytiva | SH30271.01 | |
| E-cadherin | Cell Signaling Technology | #3195 | |
| Ethylenediaminetetraacetic acid | Fisher Scientific | BP2482500 | |
| FBS | Corning | MT35070CV | |
| Gentamicin | Gibco | 15710064 | |
| Glass microscope slide | Fisher scientific | 12-550-07 | |
| Goat anti-mouse Alexa Fluor 488 | Invitrogen | A11001 | |
| Goat anti-mouse Alexa Fluor 647 | Invitrogen | A21235 | |
| Goat anti-rabbit Alexa Fluor 555 | Invitrogen | A21428 | |
| Hemacytometer | Bio-Rad | 1450015 | |
| IntestiCult organoid Differentiation medium (Human) | StemCell Technologies | 100-0214 | |
| IntestiCult organoid growth medium (Human) | StemCell Technologies | 0-6010 | |
| Keyence BZ-X700 | Keyence | BZ-X700 | |
| LY2157299 (Galunisertib) | Selleckchem | S2230 | |
| MAGPIX system | Luminex | Magpix system | Compact multiplexing unit |
| Microscope | Keyence | BZ-X700 | |
| MILLIPLEX Bovine Cytokine/Chemokine Magnetic Bead Panel | MilliporeSigma | BCYT1-33K | Bead-based multiplex assay |
| Mr. Frosty container | Nalgene | 5100-0001 | |
| Non-Enzymatic Cell Dissociation Solution | ATCC | 30-2103 | |
| NutriFreeze D10 Cryopreservation Media | Biological Industries | 05-713-1B | |
| Orbital shaking platform | Thermo Fisher | 88880021 | |
| Pam3Csk4 | invivogen | tlrl-pms | |
| Parafilm sealing film | dot scientific inc. | #HS234526C | |
| Paraformaldehyde 16% solution | Electron Microscopy Sciences | 15710 | |
| Phalloidin-FITC | R&D Systems | 5782/12U | |
| Phosphate buffered saline | Fisher Scientific | BP399-20 | |
| Prolong Glass Antifade | Invitrogen | P36982 | |
| Rabbit anti-human Lyzozyme (EC3.2.1.17) | Agilent technologies | A009902-2 | |
| SB202190 (FHPI) | Selleckchem | S1077 | |
| Shaking water bath | Thermo Fisher | MaxQ 7000 | |
| Sodium Azide | VWR | BDH7465-2 | |
| Streptomycin | Teknova | S6525 | |
| Trypan Blue dye | Gibco | 15250-061 | |
| TrypLE express enzyme | Life technologies | 12604013 | |
| Tween 20 | Fisher Scientific | BP337 | |
| Voltohmmeter | MilliporeSigma | Millicell ERS-2 | |
| Y-27632 | Selleckchem | S1049 |
Riferimenti
- Gerdts, V., et al. Large animal models for vaccine development and testing. ILAR Journal. 56 (1), 53-62 (2015).
- Reza Khorramizadeh, M., Saadat, F. Animal models for human disease. Animal Biotechnology. Chapter 8, 153-171 (2020).
- Meyerholz, D. K., Beck, A. P., Singh, B. Innovative use of animal models to advance scientific research. Cell and Tissue Research. 380 (2), 205-206 (2020).
- Hamernik, D. L. Farm animals are important biomedical models. Animal Frontiers. 9 (3), (2019).
- Ribitsch, I., et al. Large animal models in regenerative medicine and tissue engineering: To do or not to do. Frontiers in Bioengineering and Biotechnology. 8, 972 (2020).
- Wagar, L. E., DiFazio, R. M., Davis, M. M. Advanced model systems and tools for basic and translational human immunology. Genome Medicine. 10 (1), 73 (2018).
- Ziegler, A., Gonzalez, L., Blikslager, A. Large animal models: The key to translational discovery in digestive disease research. Cellular and Molecular Gastroenterology and Hepatology. 2 (6), 716-724 (2016).
- Roth, J. A., Tuggle, C. K. Livestock models in translational medicine. ILAR Journal. 56 (1), 1-6 (2015).
- Schultz, R. D., Dunne, H. W., Heist, C. E. Ontogeny of the bovine immune response. Infection and Immunity. 7 (6), 981-991 (1973).
- Potter, A. A., et al. Large animal models for vaccine development and testing. ILAR Journal. 56 (1), 53-62 (2015).
- Ahluwalia, B., Magnusson, M. K., Öhman, L. Mucosal immune system of the gastrointestinal tract: maintaining balance between the good and the bad. Scandinavian Journal of Gastroenterology. 52 (11), 1185-1193 (2017).
- Roodsant, T., et al. A human 2D primary organoid-derived epithelial monolayer model to Study host-pathogen interaction in the small intestine. Frontiers in Cellular and Infection Microbiology. 10, 272 (2020).
- Liu, Y., Chen, Y. G. 2D- and 3D-based intestinal stem cell cultures for personalized medicine. Cells. 7 (12), 225 (2018).
- Duque-Correa, M. A., Maizels, R. M., Grencis, R. K., Berriman, M. Organoids - New models for host-helminth interactions. Trends in Parasitology. 36 (2), 170-181 (2020).
- Kar, S. K., et al. Organoids: a promising new in vitro platform in livestock and veterinary research. Veterinary Research. 52 (1), 43 (2021).
- Hamilton, C. A., et al. Development of in vitro enteroids derived from bovine small intestinal crypts. Veterinary Research. 49 (1), 54 (2018).
- Beaumont, M., et al. Intestinal organoids in farm animals. Veterinary Research. 52 (1), 33 (2021).
- Lee, B. R., et al. Robust three-dimensional (3D) expansion of bovine intestinal organoids: An in vitro model as a potential alternative to an in vivo system. Animals (Basel). 11 (7), 2115 (2021).
- Töpfer, E., et al. Bovine colon organoids: From 3D bioprinting to cryopreserved multi-well screening platforms. Toxicology in Vitro. 61, 104606 (2019).
- Powell, R. H., Behnke, M. S. WRN conditioned media is sufficient for in vitro propagation of intestinal organoids from large farm and small companion animals. Biology Open. 6 (5), 698-705 (2017).
- Derricott, H., et al. Developing a 3D intestinal epithelium model for livestock species. Cell and Tissue Research. 375 (2), 409-424 (2019).
- Rusu, D., Loret, S., Peulen, O., Mainil, J., Dandrifosse, G. Immunochemical, biomolecular and biochemical characterization of bovine epithelial intestinal primocultures. BMC Cell Biology. 6, 42 (2005).
- Dibb-Fuller, M. P., Best, A., Stagg, D. A., Cooley, W. A., Woodward, M. J. An in-vitro model for studying the interaction of Escherichia coli O157:H7 and other enteropathogens with bovine primary cell cultures. Journal of Medical Microbiology. 50 (9), 759-769 (2001).
- Sutton, K. M., Orr, B., Hope, J., Jensen, S. R., Vervelde, L. Establishment of bovine 3D enteroid-derived 2D monolayers. Veterinary Research. 53 (1), 15 (2022).
- Barrila, J., et al. Modeling host-pathogen interactions in the context of the microenvironment: Three-dimensional cell culture comes of age. Infection and Immunity. 86 (11), e00282-e00318 (2018).
- Carvalho, P. H. V., Pinto, A. C. J., Millen, D. D., Felix, T. L. Effect of cattle breed and basal diet on digestibility, rumen bacterial communities, and eating and rumination activity. Journal of Animal Science. 98 (5), skaa114 (2020).
- Thorne, C. A., et al. Enteroid monolayers reveal an autonomous WNT and BMP circuit controlling intestinal epithelial growth and organization. Developmental Cell. 44 (5), 624-633 (2018).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon