Fenotipizzazione basata su immagini ad alta produttività per determinare le risposte morfologiche e fisiologiche a stress singoli e combinati nella patata
In questo articolo
Riepilogo
Abbiamo progettato un protocollo di fenotipizzazione basato su immagini per determinare le risposte morfologiche e fisiologiche a trattamenti singoli e combinati di calore, siccità e ristagno idrico. Questo approccio ha permesso di identificare le risposte precoci, tardive e di recupero a livello di intero impianto, in particolare le parti fuori terra, e ha evidenziato la necessità di utilizzare più sensori di imaging.
Abstract
La fenotipizzazione basata su immagini ad alto rendimento è uno strumento potente per determinare in modo non invasivo lo sviluppo e le prestazioni delle piante in condizioni specifiche nel tempo. Utilizzando più sensori di imaging, è possibile valutare molti tratti di interesse, tra cui la biomassa vegetale, l'efficienza fotosintetica, la temperatura della chioma e gli indici di riflettanza fogliare. Le piante sono spesso esposte a molteplici stress in condizioni di campo in cui forti ondate di calore, inondazioni ed eventi di siccità minacciano seriamente la produttività delle colture. Quando gli stress coincidono, gli effetti risultanti sulle piante possono essere distinti a causa di interazioni sinergiche o antagoniste. Per chiarire come le piante di patata rispondono a stress singoli e combinati che assomigliano a scenari di stress naturali, sono stati imposti cinque diversi trattamenti su una cultivar di patata selezionata (Solanum tuberosum L., cv. Lady Rosetta) all'inizio della tuberizzazione, ovvero controllo, siccità, calore, ristagno idrico e combinazioni di caldo, siccità e stress da ristagno idrico. La nostra analisi mostra che lo stress da ristagno idrico ha avuto l'effetto più dannoso sulle prestazioni delle piante, portando a risposte fisiologiche rapide e drastiche legate alla chiusura stomatica, tra cui una riduzione della resa quantica e dell'efficienza del fotosistema II e un aumento della temperatura della chioma e dell'indice dell'acqua. In condizioni di calore e trattamenti di stress combinati, il tasso di crescita relativo è stato ridotto nella fase iniziale dello stress. In condizioni di siccità e stress combinati, il volume delle piante e le prestazioni fotosintetiche sono diminuite con l'aumento della temperatura e la chiusura degli stomi nella fase tardiva dello stress. La combinazione di un trattamento ottimizzato dello stress in condizioni ambientali definite, insieme a protocolli di fenotipizzazione selezionati, ha permesso di rivelare la dinamica delle risposte morfologiche e fisiologiche a stress singoli e combinati. Qui, viene presentato uno strumento utile per i ricercatori sulle piante che cercano di identificare i tratti delle piante indicativi della resilienza a diversi stress legati al cambiamento climatico.
Introduzione
I potenziali effetti dei cambiamenti climatici, tra cui l'aumento dell'intensità e della frequenza delle ondate di calore, delle inondazioni e degli eventi di siccità, hanno un impatto negativo sulla coltivazione delle colture1. È importante comprendere l'influenza dei cambiamenti climatici sulla variabilità delle colture e le conseguenti fluttuazioni della produzione agricola annuale2. Con l'aumento della popolazione e della domanda di cibo, mantenere la resa delle piante coltivate è una sfida, quindi è urgentemente necessario trovare colture resilienti al clima per la riproduzione 3,4. La patata (Solanum tuberosum L.) è una delle colture alimentari essenziali che contribuisce alla sicurezza alimentare globale grazie al suo alto valore nutrizionale e alla maggiore efficienza nell'uso dell'acqua. Tuttavia, la riduzione della crescita e della resa in condizioni sfavorevoli è un problema principale, in particolare nelle varietà sensibili 5,6. Molti studi hanno evidenziato l'importanza di studiare approcci alternativi per mantenere la produttività delle colture di patate, comprese le pratiche agricole, la ricerca di genotipi tolleranti e la comprensione dell'impatto dello stress sullo sviluppo e sulla resa 7,8,9, che è anche molto richiesto dai coltivatori (o agricoltori) europei di patate10.
Le piattaforme automatizzate di fenotipizzazione, compresa la fenotipizzazione basata su immagini, consentono analisi quantitative della struttura e della funzione delle piante che sono essenziali per selezionare i tratti rilevanti di interesse11,12. La fenotipizzazione ad alto rendimento è una tecnica avanzata non invasiva per determinare vari caratteri morfologici e fisiologici di interesse in modo riproducibile e rapido 13. Sebbene il fenotipo rifletta le differenze genotipiche in relazione agli effetti ambientali, il confronto delle piante in condizioni controllate con stress consente di collegare le ampie informazioni sulla fenotipizzazione a una specifica condizione (stress)14. La fenotipizzazione basata su immagini è essenziale per descrivere la variabilità fenotipica ed è anche in grado di esaminare una serie di tratti nello sviluppo delle piante indipendentemente dalla dimensione della popolazione15. Ad esempio, la misurazione dei tratti morfologici, tra cui la forma, le dimensioni e l'indice di colore delle foglie utilizzando sensori di imaging rosso-verde-blu (RGB), viene utilizzata per determinare la crescita e lo sviluppo delle piante. Inoltre, le misurazioni dei tratti fisiologici, tra cui le prestazioni fotosintetiche, la temperatura della chioma e la riflettanza fogliare, vengono quantificate utilizzando diversi tipi di sensori, come la fluorescenza della clorofilla, l'infrarosso termico (IR) e l'imaging iperspettrale16. Recenti studi in ambienti controllati hanno mostrato il potenziale dell'utilizzo della fenotipizzazione basata su immagini nella valutazione di diversi meccanismi e risposte fisiologiche delle piante sottoposte a stress abiotici come il calore nella patata17, la siccità nell'orzo18, il riso19 e i trattamenti combinati di siccità e calore nel grano20. Anche se lo studio delle risposte delle piante a molteplici interazioni di stress è complesso, i risultati rivelano nuove intuizioni nella comprensione dei meccanismi delle piante per far fronte ai rapidi cambiamenti delle condizioni climatiche21.
Le risposte fisiologiche e morfologiche delle piante sono direttamente influenzate da condizioni di stress abiotico (alte temperature, deficit idrico e inondazioni), con conseguente riduzione della resa22. Anche se le patate hanno un'elevata efficienza nell'uso dell'acqua rispetto ad altre colture, il deficit idrico influisce negativamente sulla quantità e sulla qualità della resa a causa dell'architettura delle radici poco profonda5. A seconda dell'intensità e della durata del livello di siccità, l'indice dell'area fogliare è ridotto e il ritardo nella crescita della chioma con inibizione della formazione di nuove foglie è pronunciato durante le fasi successive dello stress, portando a una riduzione del tasso fotosintetico23. Il livello soglia dell'acqua è critico in caso di eccesso di acqua o periodi di siccità prolungati, con conseguente effetto negativo sulla crescita delle piante e sullo sviluppo dei tuberi a causa della limitazione dell'ossigeno, della diminuzione della conducibilità idraulica delle radici e della restrizione dello scambio gassoso24,25. Inoltre, le patate sono sensibili alle alte temperature, dove temperature superiori ai livelli ottimali provocano un ritardo nell'inizio, nella crescita e nei tassi di assimilazione dei tuberi26. Quando gli stress appaiono in combinazione, le regolazioni biochimiche e le risposte fisiologiche differiscono dalle risposte individuali allo stress, evidenziando la necessità di studiare le risposte delle piante alle combinazioni di stress27. Gli stress combinati possono portare a riduzioni (ancora più gravi) della crescita delle piante ed effetti determinanti sui caratteri riproduttivi28. L'impatto della combinazione di stress dipende dal predominio di ciascuno stress sugli altri, portando a una risposta delle piante potenziata o soppressa (ad esempio, la siccità di solito porta alla chiusura degli stomi mentre gli stomi sono aperti per consentire il raffreddamento della superficie fogliare sotto stress termico). Tuttavia, la ricerca combinata sullo stress sta ancora emergendo e sono necessarie ulteriori indagini per comprendere meglio la complessa regolazione che media le risposte delle piante in queste condizioni29. Pertanto, questo studio mira a evidenziare e raccomandare un protocollo di fenotipizzazione utilizzando più sensori di imaging che possono essere adatti per valutare le risposte morfo-fisiologiche e comprendere i meccanismi alla base delle prestazioni complessive della patata in trattamenti di stress singoli e combinati. Come ipotizzato, la combinazione di più sensori di imaging si è rivelata uno strumento prezioso per caratterizzare le strategie iniziali e successive durante la risposta allo stress delle piante. L'ottimizzazione del protocollo di fenotipizzazione basato su immagini sarà uno strumento interattivo per i ricercatori e i selezionatori di piante per trovare tratti di interesse per la tolleranza allo stress abiotico.
Protocollo
1. Preparazione del materiale vegetale e condizioni di crescita
- Trapiantare in vitro talee di patata (Solanum tuberosum L., cv. Lady Rosetta) da coltura tissutale in vasi da 250 mL.
- Riempi i vasi con il substrato Klasmman 2 completamente saturo e tienili nella camera di crescita in condizioni di scarsa illuminazione per 1 settimana.
- Regolare le condizioni di luce a livello della calotta a 160 μmol·m-2·s-1 con una combinazione di 25% di luce bianca e 35% di infrarossi utilizzando un esposimetro.
- Trapiantare le piante dopo 10 giorni dalla coltivazione delle talee in vitro nel terreno in vasi da 3 L (15,5 cm di diametro, 20,5 cm di altezza).
- Riempire il vaso da 3 L con 1850 g di 3:1 Klasmann Substrato 2: Sabbia.
- Posizionare le piante nella camera di crescita in condizioni di luce di 320 μmol·m-2·s-1 con una combinazione di 55% di luce bianca e 81% di infrarossi e impostarla su un regime di giorno lungo (fotoperiodo di 16 ore).
- Impostare la temperatura nella camera di crescita a 22 °C/19 °C per il giorno/notte e l'umidità relativa (RH) al 55% per l'intero esperimento.
- Mantenere il peso del vaso al 60% del contenuto di acqua relativa del suolo (SRWC) come livello di controllo adatto per mantenere la crescita e la resa30,31.
NOTA: Sulla base di prove precedenti, il mantenimento del contenuto volumetrico di acqua al di sopra del 60% ha promosso la crescita del muschio sulla superficie del suolo e ha aumentato il rischio di malattie delle piante. Inoltre, la presenza di muschio potrebbe generare segnali positivi fuorvianti dall'imaging a fluorescenza della clorofilla, che è difficile da filtrare. Usa la seguente equazione: SRWC% = (FW-DW)/(TW-DW) × 100, dove FW è il peso fresco del suolo, TW è il peso del turgore e DW è il peso secco32.- Selezionare i campioni di terreno (100 g) da tre diversi sacchi di miscela Klasmman Substrate 2 man mano che si replica e pesare il peso fresco del terreno.
- Saturare il terreno con acqua fino a quando i vasi non trattengono l'acqua senza gocciolare e pesare il peso del turgore del terreno.
- Mettere il campione in forno a 80 °C per 3 giorni fino a quando i campioni di terreno sono completamente asciutti e pesare il peso secco del terreno33.
- Posiziona i tappetini blu sulla superficie del vaso per ridurre l'evaporazione.
NOTA: Il colore blu è necessario per sottrarre lo sfondo del terreno dai pixel delle piante nella segmentazione dell'immagine. - Seleziona dieci repliche biologiche per trattamento.
- Randomizza i vasi durante l'irrigazione (in totale, 50 vasi).
- Aggiungi i supporti blu per sostenere le piante ed evitare danni meccanici quando le metti nel sistema di fenotipizzazione.
2. Applicazione dello stress
- Nella fase iniziale di tuberizzazione (28 giorni dopo il trapianto delle talee in vitro ), dividere le piante in cinque gruppi di trattamento e fenotipizzare dieci piante per trattamento (Figura 1).
- Indurre lo stress singolo e combinato a un livello che non sia dannoso come segue:
- Nella camera di crescita, tenere sotto controllo le piante, i trattamenti di siccità e ristagno idrico a 22 °C/19 °C giorno/notte (step 1.7), con diverse percentuali di SRWC:
Controllo (C) con 60% SRWC per l'intero esperimento.
Siccità (D) con 20% SRWC gradualmente per 7 giorni, seguita da 1 giorno di recupero.
Ristagno idrico (W) con 160% SRWC per 5 giorni, seguiti da 10 giorni di recupero. - Per mantenere il livello dell'acqua sopra la superficie del terreno nel trattamento del ristagno idrico, inserire un sacchetto di plastica nel vaso vuoto e poi posizionare il vaso principale con il terriccio nel secondo vaso preparato.
- Porre le piante in una capsula di crescita a 30/28 °C giorno/notte e 55% di umidità relativa per i trattamenti termici. Imporre sollecitazioni termiche singole e combinate come segue:
- Per il calore (H), mantenere la temperatura a 30-28 °C con il 60% di SRWC per 15 giorni.
- Per il triplo stress Caldo + Siccità + Ristagno Idrico (HDW), esporre le piante a trattamento termico a 30 °C/28 °C di temperatura giorno/notte per i primi 7 giorni (mantenendo il 60% di SRWC), seguito da un trattamento combinato siccità + calore per gli altri 7 giorni (20% SRWC e 30 °C/28 °C) e infine esporre le piante a stress da ristagno idrico per 1 giorno. Per quest'ultimo, rimetti le piante nella camera di crescita (vedi passaggio 1.7 per le condizioni) e induci il ristagno idrico al 160% di SRWC per 1 giorno.
NOTA: Le durate selezionate degli stress indotti si sono basate su un esperimento pilota che ha mostrato effetti di stress senza impatti dannosi con una sopravvivenza del 100% delle piante trattate. Nell'ambiente della camera di crescita, la variazione delle condizioni ambientali era nell'intervallo ± 0,2 °C per la temperatura e ± 3% per l'umidità.
- Nella camera di crescita, tenere sotto controllo le piante, i trattamenti di siccità e ristagno idrico a 22 °C/19 °C giorno/notte (step 1.7), con diverse percentuali di SRWC:
3. Preparazione delle piante per la fenotipizzazione
- Dopo che le luci sono state accese alle 6:00 del mattino nelle camere di crescita, lasciare che le piante si acclimatino in condizioni di luce di crescita costante (320 μmol·m-2·s-1) per almeno 2-3 ore prima dell'inizio del protocollo di fenotipizzazione. Ciò garantisce che la fotosintesi e la regolazione stomatica siano in uno stato stazionario34.
- Prima della misurazione, trasferire le piante dal loro luogo di coltivazione nell'area cuscinetto di crescita del sistema di fenotipizzazione utilizzato per il caricamento manuale delle piante nel sistema mentre il punteggio automatico è in modalità standby e posizionato all'interno della serra (Figura supplementare 1, Figura supplementare 2 e Figura supplementare 3).
NOTA: Le piante sono state mantenute nell'area cuscinetto di crescita durante il periodo di fenotipizzazione della durata di 3,5 ore. Nella serra, la variazione delle condizioni ambientali era nell'intervallo di ± 2 °C per la temperatura, ± 5% per l'umidità e il 20% di fluttuazione dell'intensità luminosa. Pertanto, considera che le misurazioni dovrebbero iniziare immediatamente ed essere brevi, evitando l'influenza delle condizioni della serra sulle piante. - Nella piattaforma di fenotipizzazione, posizionare i vasi nei dischi che si muovono automaticamente su un nastro trasportatore a intervalli prestabiliti dal sensore di imaging secondo i protocolli di misurazione specificati nella sezione 4.
- Etichettare ogni pianta/vassoio con un ID univoco per garantire che i dati misurati siano assegnati alla pianta corretta durante l'esperimento.
4. Protocollo di fenotipizzazione
- Ottimizzare il protocollo di fenotipizzazione utilizzando più sensori di imaging (fluorescenza della clorofilla, IR termico, RGB e imaging iperspettrale), consentendo così la misurazione simultanea dei parametri fisiologici e morfologici delle piante (Figura 2).
NOTA: Poiché le risposte delle piante riflettono le condizioni ambientali e gli effetti diurni, è importante considerare la randomizzazione dei vasi e l'esecuzione della fenotipizzazione nello stesso periodo della giornata. - Nella piattaforma di fenotipizzazione, assicurarsi che le piante entrino nel sistema attraverso un tunnel di adattamento (Figura 2A) in cui viene catturata prima l'altezza della pianta, quindi l'altezza di ciascun sensore viene regolata in base alla distanza di lavoro fissa.
- Eseguire le misurazioni in due turni come giustificato nel protocollo di misurazione utilizzando il software.
- Nel primo turno, comprendono le misurazioni delle risposte fisiologiche quantificate come "reazioni rapide" utilizzando la fluorescenza clorofilliana e l'imaging termico.
- Iniziare misurando i parametri fisiologici durante i trattamenti di stress termico e poi il resto dei trattamenti.
- Nel secondo turno, procedere con altre misurazioni per valutare le risposte più lente, tra cui l'RGB strutturale e l'imaging iperspettrale, seguite dalla valutazione del peso e dall'irrigazione.
- Durante la fase di pesatura e irrigazione, definire il peso di riferimento per ciascuna pianta per consentire l'irrigazione e la pesatura automatizzate in base al trattamento specificato.
- Assicurarsi che il peso totale di riferimento includa il peso del disco, dell'inserto situato sul nastro trasportatore, del supporto blu, del tappetino blu, del vaso, del terreno e della biomassa vegetale nel protocollo definito.
- Per una misurazione accurata dell'evapotraspirazione durante la fase di pesatura e irrigazione, preparare vasi vuoti come riferimento. Inoltre, prepara vasi aggiuntivi per correggere il peso della biomassa vegetale.
- Per misurare 50 piante, l'intera durata del protocollo di fenotipizzazione richiede 215 minuti (85 minuti nel 1° ciclo e 130 minuti nel 2° turno).
- Fenotipizzare quotidianamente tutte le piante in condizioni di controllo (1 giorno prima del trattamento) e quindi indurre i trattamenti di stress per monitorare le risposte dinamiche e valutare le fasi precoci e tardive dello stress indotto.
5. Regolazione delle impostazioni per ciascun sensore di immagine
- Imaging cinetico a fluorescenza clorofilliana
NOTA: La fluorescenza cinetica della clorofilla viene utilizzata per studiare la capacità fotosintetica delle piante in risposta a diverse condizioni ambientali, inclusi gli stress abiotici, e per fornire preziose informazioni sull'efficienza quantistica della fotochimica e sulla dissipazione del calore (processo non fotochimico).- Condurre la misurazione della fluorescenza della clorofilla su piante adattate alla luce utilizzando un breve protocollo di luce per discriminare le risposte delle piante sotto diversi trattamenti.
- Acclimatare35 piante per 5 minuti sotto la luce nel tunnel di adattamento dotato di LED bianchi freddi (6500 K) a 500 μmol·m-2·s-1.
NOTA: L'imaging a fluorescenza della clorofilla è la prima misurazione dopo l'adattamento alla luce utilizzata per monitorare i cambiamenti nelle capacità fotosintetiche delle piante. - Seleziona e ottimizza il protocollo predefinito in base alle dimensioni della pianta e alle intensità luminose richieste.
- Ottimizza le impostazioni di misurazione, comprese le impostazioni della fotocamera e dell'intensità della luce per garantire l'acquisizione di un segnale forte con un rapporto segnale/rumore ottimale.
- Regolare le impostazioni della fotocamera come l'otturatore (tempo di esposizione, durata dei flash di misurazione) e la sensibilità (guadagno elettrico della fotocamera). Utilizzare l'otturatore a 2 ms e la sensibilità al 12%.
NOTA: Questi valori vengono regolati in base alle dimensioni e alla forma delle foglie e alla distanza definita tra la parte superiore della chioma e il sensore di immagine. - Regolare l'intensità della luce attinica a 500 μmol·m-2·s-1 e impostare l'impulso di saturazione a 3200 μmol·m-2·s-1, che è almeno 6-7 volte superiore alla luce attinica.
- Regolare le impostazioni della fotocamera come l'otturatore (tempo di esposizione, durata dei flash di misurazione) e la sensibilità (guadagno elettrico della fotocamera). Utilizzare l'otturatore a 2 ms e la sensibilità al 12%.
- Per misurare i parametri in impianti di adattamento alla luce allo stato stazionario (Lss) (descritti di seguito) per 5 minuti prima delle misurazioni nel tunnel di adattamento alla luce.
- Per stimare la resa quantica del fotosistema II allo stato stazionario (PSII) delle piante adattate alla luce, selezionare il protocollo della luce corta (Figura 3) e impostare il protocollo come segue.
NOTA: La durata del protocollo è stata di 10 s per pianta.- Iniziare la misurazione accendendo la luce attinica bianca fredda a 500 μmol·m-2·s-1 per 3 s per misurare la fluorescenza allo stato stazionario nella luce (Ft_Lss aka. Ft')
- Applicare l'impulso di saturazione a 3200 μmol·m-2·s-1 per 800 ms per misurare la fluorescenza massima allo stato stazionario nella luce (Fm_Lss aka. Fm')
- Spegnere la luce attinica, quindi accendere la luce rossa lontana (735 nm) per consentire a PSII di rilassarsi al buio per 800 ms e misurare la fluorescenza minima allo stato stazionario nella luce (Fo_Lss ovvero . Fo').
- Per calcolare i parametri relativi, utilizzare un software di analisi dei dati che sottrae lo sfondo ed estrae i parametri rilevanti.
NOTA: I parametri estratti dal protocollo utilizzato sono: massima efficienza della fotochimica PSII del campione adattato alla luce in stato stazionario alla luce determinata come Fv/Fm_Lss aka. Fv'/Fm', resa quantica del fotosistema II o efficienza operativa del fotosistema II in stato stazionario leggero definito come QY_Lss aka. φPSII = Fq'/Fm', e la frazione di centri di reazione aperti in PSII (QA ossidato) è determinata come qL_Lss = (Fq'/Fv') x (F0'/Ft').
- Imaging termico a infrarossi (IR)
NOTA: L'imaging termico IR viene utilizzato per la misurazione non invasiva della temperatura effettiva della chioma, determinando così le diverse regolazioni stomatiche. Nell'unità di imaging termico IR, una termocamera è montata lateralmente sul braccio robotico per misurare la temperatura del tettuccio dalla vista laterale.- Per aumentare il contrasto della temperatura di sfondo rispetto alla temperatura dell'oggetto ripreso durante l'elaborazione dell'immagine, utilizzare una parete riscaldata controllata automaticamente sul lato opposto della termocamera per aumentare il contrasto. Regolare la temperatura della parete a 8 °C al di sopra della temperatura dell'aria nell'unità immagine.
NOTA: Le immagini termiche sono state acquisite al buio utilizzando la modalità di scansione lineare35. - Dopo l'acquisizione dell'immagine, generare una maschera di impianto basata sui dati RGB della vista laterale e utilizzarla per co-registrarsi con i dati termici nell'analisi dell'immagine. Ciò garantisce un'identificazione precisa dell'oggetto scansionato, eliminando al contempo le interferenze di sfondo come il portapiante.
- Per prevenire l'influenza delle condizioni ambientali fluttuanti durante l'intero esperimento, calcolare la differenza di temperatura del parametro (delta T o ΔT).
NOTA: Delta T (ΔT) è definito come la differenza tra la temperatura misurata della superficie fogliare (la media di tutti i pixel dell'intera superficie rilevata della pianta) e la temperatura dell'aria ambiente all'interno della scatola di imaging.
- Per aumentare il contrasto della temperatura di sfondo rispetto alla temperatura dell'oggetto ripreso durante l'elaborazione dell'immagine, utilizzare una parete riscaldata controllata automaticamente sul lato opposto della termocamera per aumentare il contrasto. Regolare la temperatura della parete a 8 °C al di sopra della temperatura dell'aria nell'unità immagine.
- Imaging RGB
NOTA: L'imaging RGB si basa su telecamere VIS (Visual Inertial System) che rilevano la luce nell'intervallo visibile da 400 a 700 nm, dove viene utilizzato per l'analisi approfondita della morfologia delle piante, dell'architettura e dell'estrazione delle caratteristiche dell'indice di colore.- L'unità di imaging contiene una tavola rotante per il posizionamento preciso del vassoio e contemporaneamente consente l'imaging multi-angolo per le viste laterali.
- Imposta l'imaging RGB in base all'imaging con vista laterale per catturare la pianta da tre angolazioni (0°, 120° e 240°), che viene scattata in modalità di scansione lineare (RGB1) e in modalità di imaging con vista dall'alto in modalità istantanea (RGB2).
- Entrambe le telecamere sono dotate di una sorgente luminosa a LED, che garantisce un'illuminazione omogenea della pianta ripresa e, quindi, determina con precisione le caratteristiche morfologiche e cromatiche.
- Estrai i parametri calcolati utilizzando il software di analisi dei dati.
- Per ulteriori parametri basati sulle viste laterali e dall'alto, calcolare il volume dell'impianto (biomassa digitale)36:
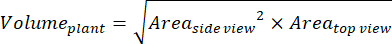
- Calcola il tasso di crescita relativo (RGR)37:
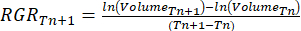
Dove Tn e Tn+1 indicano l'intervallo di tempo (giorni).
- Imaging iperspettrale
NOTA: L'imaging iperspettrale viene utilizzato per la visualizzazione della riflettanza spettrale delle piante. I cambiamenti nella riflettanza delle foglie sono indicatori del diverso stato fisiologico di una data pianta.- Utilizza il sensore di imaging iperspettrale per quantificare la riflettanza della chioma nella parte visibile degli spettri di luce, con una fotocamera iperspettrale nel visibile-vicino infrarosso (VNIR) nell'intervallo 380-900 nm e una fotocamera a infrarossi a lunghezza d'onda corta (SWIR) nell'intervallo 900-1700 nm.
- Le telecamere sono montate su un braccio robotico con una sorgente luminosa a tubo alogeno implementata (600 W) per un'illuminazione omogenea e spettralmente appropriata del campione durante l'acquisizione dell'immagine che si muove attraverso l'area XZ.
- Entrambe le telecamere funzionano in modalità di scansione lineare e sono collocate in una scatola di imaging isolata dalla luce.
- Prima di ogni ciclo di misurazione, eseguire due misurazioni di calibrazione (automaticamente): la calibrazione della corrente di buio e la calibrazione radiometrica utilizzando lo standard di riflettanza spettrale in teflon.
- L'immagine di calibrazione del buio viene sottratta dall'immagine di calibrazione grezza e del bianco per rimuovere il rumore della corrente di buio. Quindi, generare l'iperspettrale finale dividendo l'immagine grezza dopo la sottrazione per l'immagine di calibrazione del bianco.
6. Esportazione dei dati e analisi delle immagini
- Utilizzare il software di analisi dei dati per l'estrazione automatica, la sottrazione dello sfondo e la segmentazione Plant Mask della pipeline di elaborazione delle immagini (Figura 2B).
- Il software esegue un'analisi completamente automatizzata in cui l'applicazione della maschera, la sottrazione dello sfondo in cui le piante sono isolate dal loro sfondo e il calcolo dei parametri vengono elaborati come descritto per l'imaging RGB38 e l'imaging termico20.
- Estrai i parametri misurati e calcolati dai pixel specifici della pianta come definito dalla maschera per piante e dalla maschera vassoio generate dall'immagine RGB.
- Se le immagini non sono state selezionate completamente, il che può verificarsi a causa di cambiamenti nel verde della vegetazione durante le fasi di sviluppo successive o dell'effetto del trattamento dello stress, aprire la parte di analisi dei dati locali nel software e regolare nuovamente le impostazioni della maschera vegetale nel software dell'analizzatore di dati a seconda di ciascun sensore.
- Nell'elaborazione delle immagini a fluorescenza della clorofilla, regolare i parametri di analisi delle impostazioni della maschera per piante a fluorescenza della clorofilla (Figura 4 supplementare).
- Impostare la soglia su True, il che significa che la segmentazione delle piante viene eseguita automaticamente.
- Impostare l'indice del frame della maschera su False, il che significa che per il rilevamento della maschera vegetale , il frame tempo-visivo viene utilizzato come definito nel protocollo di fluorescenza della clorofilla.
- Nell'elaborazione delle immagini termiche, impostare i parametri per l'analisi della maschera vegetale (Figura 5 supplementare).
- Impostare la soglia automatica per la generazione della maschera dell'oggetto su False.
- Imposta la maschera dall'immagine laterale RGB su True da utilizzare per l'analisi.
- Nell'elaborazione delle immagini RGB, regolare i parametri di analisi delle impostazioni della maschera vegetale (Figura 6 e Figura 7 supplementare) a seconda della specie e dello stadio di sviluppo.
- Seleziona la formula 4*G-3*B-R, che è la definizione per la generazione della maschera oggetto e definisce il componente di colore utilizzato (componente Rosso, Verde, Blu).
NOTA: Questa formula standard e altre impostazioni possono cambiare a seconda del tipo di telecamera utilizzata (vista dall'alto o delle dimensioni), del trattamento applicato e delle diverse cultivar. - Regolare la soglia utilizzata per la conversione dell'immagine in scala di grigi con un canale verde migliorato in un'immagine binaria, determinando la superficie coperta dalla pianta.
- Regola la dimensione mediana del filtro utilizzata per ridurre il rumore e i pixel non validi e riempire quelli mancanti.
- Regolare la dimensione minima dell'oggetto in pixel da includere nell'analisi.
- Regolate la dimensione minima dei fori negli oggetti maschera in pixel, in genere decine di pixel. I fori più piccoli di questo valore vengono chiusi e inseriti nei pixel dell'oggetto.
- Impostate Usa riduzione riflessione su True per normalizzare i valori RGB in ogni pixel.
- Impostate l'opzione Salta Punti Esposti Errati su True per ritagliare i pixel sovra/sotto esposti dalla maschera della pianta (ad esempio, l'omissione dei riflessi superficiali o dei pixel scuri in cui il disturbo è maggiore del segnale).
- Seleziona la formula 4*G-3*B-R, che è la definizione per la generazione della maschera oggetto e definisce il componente di colore utilizzato (componente Rosso, Verde, Blu).
- Colora le impostazioni di segmentazione analizzate da RGB utilizzando il software di analisi dei dati per fornire informazioni sui cambiamenti di colore relativi alle risposte allo stress e alla senescenza delle piante.
NOTA: Il verde viene stimato utilizzando una gamma predefinita di colori che rappresentano tutte le fasi di sviluppo delle piante. L'intensità nei canali di colore di tutti i pixel corrispondenti alla superficie della pianta è stata raggruppata e raggruppata per essere utilizzata come mappa dei colori di origine per la segmentazione del colore.- Fornire l'immagine RGB elaborata (sfondo rimosso), la mappa dei colori - l'elenco delle tonalità per l'analisi specifica, come input nel software.
- Per ottenere risultati imparziali, eseguire la selezione delle tonalità utilizzando un set di dati di "addestramento" e selezionare diverse fasi di sviluppo e trattamenti.
NOTA: L'analisi salva i valori R, G e B di ogni pixel di ciascuna immagine da questo set di dati di addestramento. - Definisci il numero di tonalità (seleziona 6 tonalità) utilizzando il software per l'output della definizione del colore, che va da 0 a 255 per ogni canale.
- Fornire l'elenco delle tonalità generate nel software di analisi dei dati (Colori).
- Nell'elaborazione iperspettrale delle immagini, elaborare i dati iperspettrali acquisiti utilizzando l'analisi pixel per pixel implementata nel software dell'analizzatore iperspettrale, con calibrazione radiometrica e del rumore scuro, sottrazione di fondo e segmentazione della maschera vegetale. Utilizzare gli spettri medi e gli indici di vegetazione per ulteriori analisi.
- Creare la maschera per l'estrazione dei dati dall'immagine iperspettrale dall'immagine VNIR scattata dalla fotocamera iperspettrale VNIR. Per la scansione iperspettrale SWIR, generare una maschera vegetale basata sull'analisi SWIR.
- In VNIR Plant Mask, utilizzare la formula 1.2*(2.5*(R740-R672)-1.3*(R740-R556)) per visualizzare le immagini in cui R rappresenta il valore di riflettanza in una specifica lunghezza d'onda (Figura supplementare 8).
- In SWIR Plant Mask, utilizzare la formula (R960-R1450)-(R960-R1200) nell'elaborazione delle immagini per visualizzare le immagini (Figura 9 supplementare).
7. Pesatura e irrigazione
- Conservare il peso (prima) dell'irrigazione durante la procedura di pesatura e irrigazione. Quindi applicare l'irrigazione e mantenere il peso anche dopo l'irrigazione.
- Innaffia le vaschette nella modalità di riferimento: ogni vaschetta aveva un valore di riferimento memorizzato nel database, a cui veniva sempre annaffiata. Determinare il riferimento in base al trattamento.
8. Analisi dei dati
- Analizza i dati utilizzando l'ANOVA e il test di Shapiro.
- Esegui confronti a coppie tra diversi trattamenti mediante il test Wilcox a coppie in R studio (versione 4.2.3) utilizzando i pacchetti (dplyr), (tidyverse), (rstatix) e (ggpubr).
NOTA: L'analisi dell'immagine è stata eseguita automaticamente utilizzando il software di analisi dei dati. Per un'ulteriore analisi dell'acquisizione delle immagini, utilizzare un software di analisi dei dati specifico per il sensore.
Risultati Rappresentativi
In questo studio, la fenotipizzazione automatizzata basata su immagini è stata utilizzata per studiare le risposte morfologiche e fisiologiche della patata (cv. Lady Rosetta) sotto stress singolo e combinato. L'approccio applicato ha mostrato le risposte dinamiche delle piante ad alta risoluzione spazio-temporale quando lo stress è stato indotto nella fase di inizio del tubero. Per valutare le fasi precoci e tardive dello stress, i risultati sono stati presentati in 3 periodi di tempo ([0-5 giorni di fenotipizzazione (DOP)], [6-10 DOP] e [11-15 DOP]) (Figura 1). Fino a 0 DOP, tutte le piante sono state coltivate in condizioni di controllo (C), quindi da 1 a 5 DOP, dove sono stati applicati stress da ristagno idrico (W) e stress da calore (H). Pertanto, le risposte sono state osservate come segue: (i) in 0-5 DOP, indicava il calore iniziale e il ristagno idrico; (ii) in 6-10 DOP, ha rispecchiato la siccità precoce (D) e il calore e la siccità combinati (HD) sono stati osservati e (iii) in 11-15 DOP, hanno mostrato gli stress da caldo tardivo, siccità e calore combinato + siccità + ristagno idrico (HDW). Il recupero dal ristagno idrico è stato osservato in 6-10 DOP e 11-15 DOP.
Caratteri morfologici
L'imaging RGB è stato applicato per determinare l'effetto di diversi stress e combinazioni sulla crescita delle piante fuori terra. I risultati della Figura 4 mostrano che il trattamento termico e lo stress da ristagno idrico (0-5 DOP) causano già una riduzione del volume dell'impianto e dell'RGR rispetto al controllo. Durante il 6-10 DOP, il volume dell'impianto e l'RGR degli impianti di controllo sono aumentati continuamente, mentre in condizioni di calore, calore combinato, siccità e ristagni idrici, questo aumento del volume dell'impianto è stato chiaramente ridotto (Figura 4A). Poiché le piante sono molto suscettibili allo stress da ristagno idrico, è stata pronunciata una diminuzione dell'RGR (Figura 4B). Durante lo stress da siccità tardiva (11-15 DOP), dove la SRWC è stata mantenuta al 20%, è stata osservata una chiara riduzione della RGR rispetto al controllo. Tuttavia, nella fase avanzata dell'HDW combinata, l'applicazione del trattamento dei ristagni d'acqua ha causato un aumento dell'RGR nell'ultimo giorno di stress.
Tratti fisiologici
La combinazione di fenotipizzazione strutturale e fisiologica è stata applicata per rivelare ulteriori risposte allo stress. L'utilizzo di più sensori di imaging consente di determinare le risposte fisiologiche nella fase iniziale dello stress. Un'ulteriore analisi dei dati di fluorescenza della clorofilla ha mostrato che il ristagno idrico influenzava negativamente l'efficienza fotosintetica dove Fv'/Fm' (Fv/Fm_Lss) diminuiva drasticamente in 0-5 DOP e 6-10 DOP, ma una risposta in ripresa è stata osservata in 11-15 DOP dove Fv'/Fm' aumentava leggermente (Figura 5A). Durante la fase tardiva di stress (11-15 DOP), è stata osservata una riduzione di Fv'/Fm' in caso di siccità e di ciclo combinato di calore e siccità. Negli impianti allagati, l'efficienza operativa degli impianti (QY_Lss nota anche come φPSII) era significativamente inferiore rispetto ad altri trattamenti in 0-5 DOP e 6-10 DOP, ma un leggero aumento a 11-15 DOP, indicando così il recupero dell'impianto (Figura 5B). Inoltre, i diversi meccanismi di regolazione dell'efficienza che contribuiscono alla protezione del PSII sono stati determinati calcolando la frazione di centri di reazione aperti in PSII in uno stato stazionario leggero (qL_Lss) (Figura 5C). Solo in condizioni di siccità è stato osservato un aumento della qL, probabilmente dovuto alla fotoinibizione.
Questi risultati erano in accordo con i dati IR che riflettevano diversi meccanismi sottostanti sotto stress (Figura 6). Un aumento del deltaT (ΔT) è stato osservato nel ristagno idrico, riducendo il tasso di scambio gassoso. In condizioni di siccità tardiva e di stress da caldo e siccità combinati, un aumento del ΔT è dovuto alla chiusura degli stomi, considerata una delle risposte primarie per evitare un'eccessiva perdita d'acqua. D'altra parte, è stata osservata una riduzione del ΔT durante i trattamenti termici quando gli stomi si aprono per migliorare l'efficienza di traspirazione e raffreddare la superficie fogliare.
Studiando i dati iperspettrali, sono stati selezionati due parametri dai dati iperspettrali VNIR per valutare gli indici di riflettanza fogliare, tra cui NDVI come indicatore del contenuto di clorofilla e PRI come indicatore dell'efficienza della fotosintesi. I risultati hanno mostrato una diminuzione di NDVI e PRI solo in caso di ristagno idrico in relazione alla riduzione osservata nei caratteri morfologici (Figura 7A, B). Inoltre, dai dati iperspettrali SWIR utilizzati per valutare il contenuto d'acqua negli impianti, è stato osservato un aumento dell'indice dell'acqua nei ristagni d'acqua durante 0-5 DOP (Figura 7C). Tuttavia, durante i trattamenti termici, è stata osservata una risposta opposta in cui l'indice di acqua era inferiore al controllo. Questi risultati erano in accordo con un esame della vegetazione dalla segmentazione del colore della vista dall'alto RGB. I cambiamenti nella proporzione delle tonalità indicano le risposte allo stress nel tempo (Figura 8). L'indice di inverdimento ha mostrato una riduzione del contenuto di pigmenti in condizioni di siccità e ha combinato HDW nella fase di stress tardivo e recupero graduale dal trattamento dei ristagni idrici. Pertanto, l'utilizzo di sensori di imaging multipli ha riflesso la correlazione dei tratti morfo-fisiologici e ha permesso la valutazione delle prestazioni complessive della pianta in condizioni di stress abiotici.
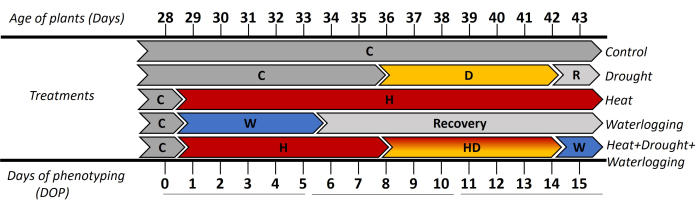
Figura 1: Cronologia dell'applicazione dei diversi trattamenti, compresa l'età delle piante nei giorni successivi al trapianto delle talee in vitro . Il giorno 0 di fenotipizzazione (DOP) è stato misurato in condizioni di controllo (C), quindi i diversi stress sono stati indotti con durate diverse. Da 1 a 5 DOP è stato applicato lo stress da ristagno (W) e la risposta iniziale del trattamento termico (H). I giorni successivi 6-10 DOP, dove sono state presentate le fasi iniziali dello stress da siccità (D) e dello stress da calore e siccità (HD). Durante l'11-15 DOP, si è riflessa la risposta delle piante alla fase tardiva della siccità e dei trattamenti termici e l'applicazione del ristagno idrico all'HD (HDW) per 1 giorno. Clicca qui per visualizzare una versione più grande di questa figura.
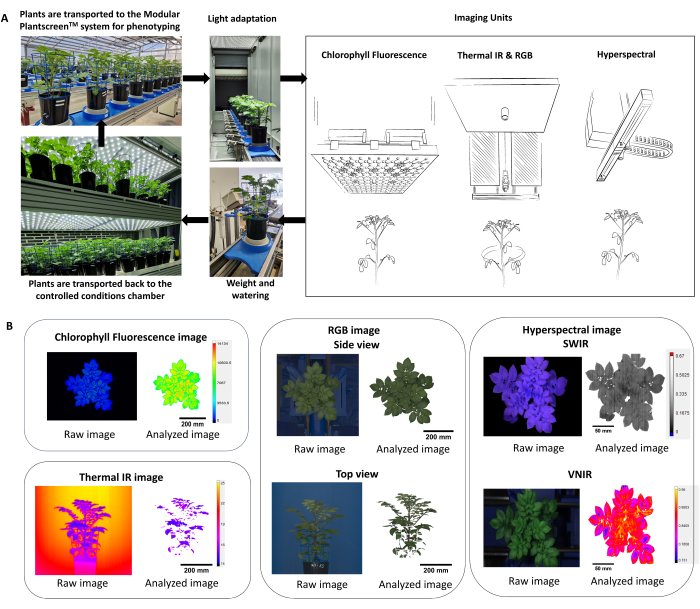
Figura 2: Schema riassuntivo del protocollo di fenotipizzazione e analisi dei dati. (A) Panoramica del protocollo di fenotipizzazione. Le piante vengono trasportate al sistema di fenotipizzazione dalle condizioni controllate nella camera di crescita FS-WI (PSI). Le piante sono state acclimatate alla luce nella camera di adattamento alla luce per 5 minuti a 500 μmol.m-2.s-1 prima delle misurazioni. Sono stati utilizzati più sensori di imaging per determinare i tratti morfologici e fisiologici, seguiti dalla stazione di pesatura e irrigazione. A seconda del trattamento, le piante sono state rimesse in condizioni controllate, a 22 °C/19 °C o 30 °C/28 °C. (B) Estrazione e segmentazione automatiche della pipeline di elaborazione delle immagini da ciascun sensore di immagine. Clicca qui per visualizzare una versione più grande di questa figura.
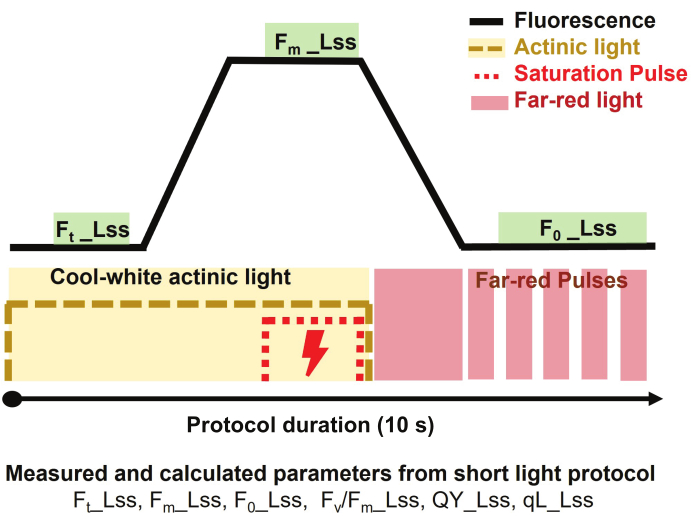
Figura 3: Panoramica del protocollo a luce breve per l'imaging a fluorescenza della clorofilla. Il protocollo di misurazione è iniziato attivando la luce attinica bianca fredda per misurare la fluorescenza allo stato stazionario nella luce (F,t_Lss) e quindi applicando un impulso di saturazione per misurare la fluorescenza massima alla luce allo stato stazionario (Fm_Lss). La luce attinica è stata spenta e la luce rosso lontana è stata accesa per determinare la fluorescenza minima della luce (Fo_Lss) allo stato stazionario. La durata del protocollo è stata di 10 secondi per pianta. Clicca qui per visualizzare una versione più grande di questa figura.
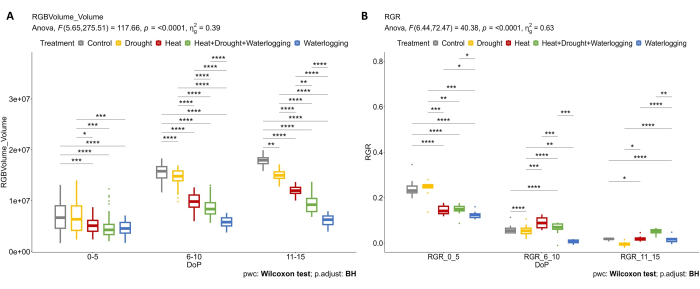
Figura 4: Imaging RGB utilizzato per la valutazione morfologica. (A) Volume della pianta calcolato dall'area delle viste RGB dall'alto e laterale. (B) Tasso di crescita relativo (RGR) durante la fase di iniziazione del tubero. I dati rappresentano i valori medi ± deviazione standard (n = 10). Clicca qui per visualizzare una versione più grande di questa figura.
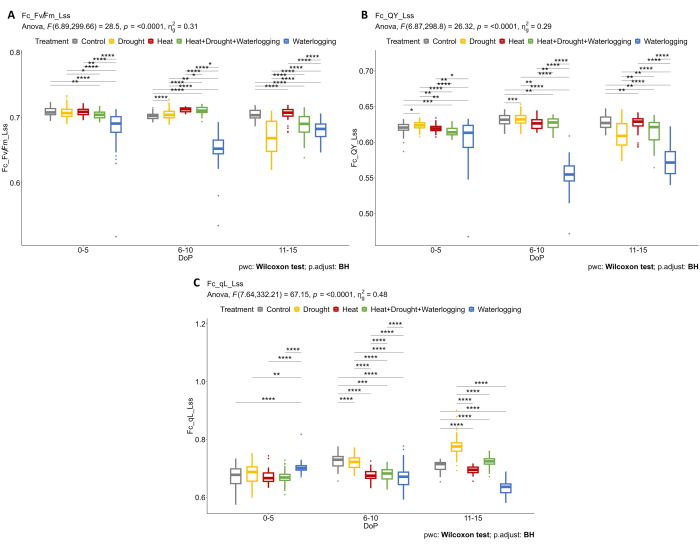
Figura 5: Imaging a fluorescenza della clorofilla su piante adattate alla luce. (A) Massima efficienza della fotochimica PSII di un campione adattato alla luce in stato stazionario alla luce (Fv/Fm_Lss). (B) Resa quantica del fotosistema II o efficienza operativa del fotosistema II in condizioni di luce stazionaria (QY_Lss). (C) Frazione di centri di reazione aperti in PSII in stato stazionario leggero (QA ossidato) (qL_Lss). I dati rappresentano i valori medi ± deviazione standard (n = 10). Clicca qui per visualizzare una versione più grande di questa figura.
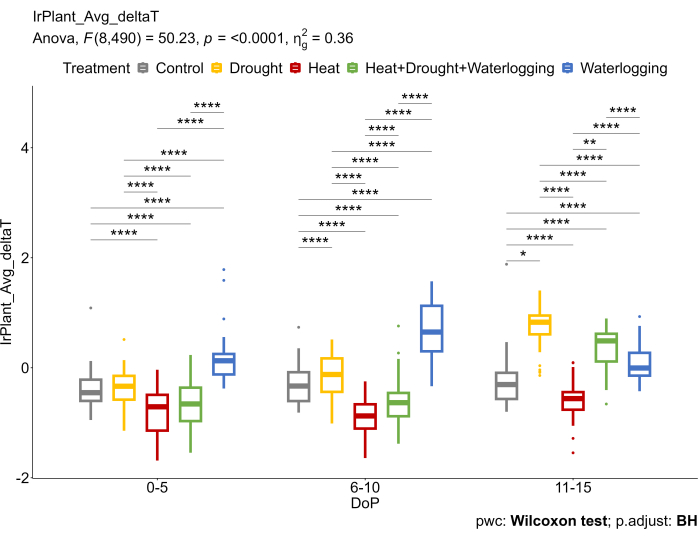
Figura 6: L'imaging termico IR è stato utilizzato per calcolare la differenza tra la temperatura media della chioma estratta dalle immagini termiche IR e la temperatura dell'aria (ΔT). I dati rappresentano i valori medi ± deviazione standard (n = 10). Clicca qui per visualizzare una versione più grande di questa figura.
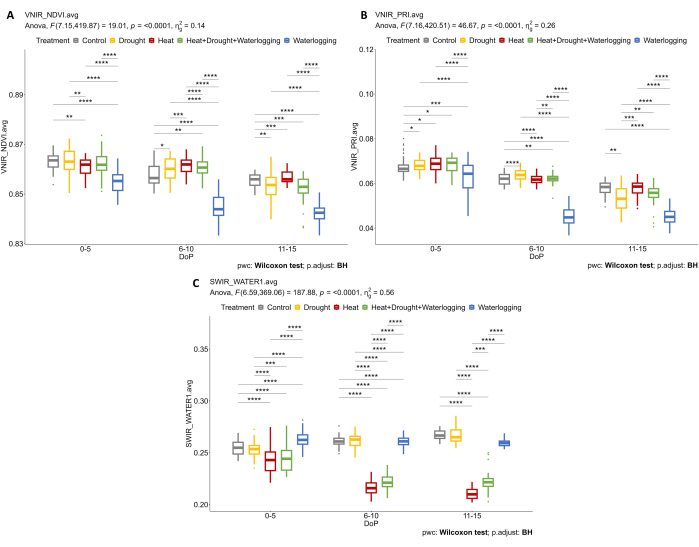
Figura 7: Imaging iperspettrale per la determinazione degli indici di vegetazione e del contenuto d'acqua. (a) Indice di vegetazione a differenza normalizzata (NDVI). (B) Indice di riflettanza fotochimica (PRI) calcolato dall'imaging VNIR. (C) Indice dell'acqua calcolato dall'imaging SWIR. I dati rappresentano i valori medi ± deviazione standard (n = 10). Clicca qui per visualizzare una versione più grande di questa figura.
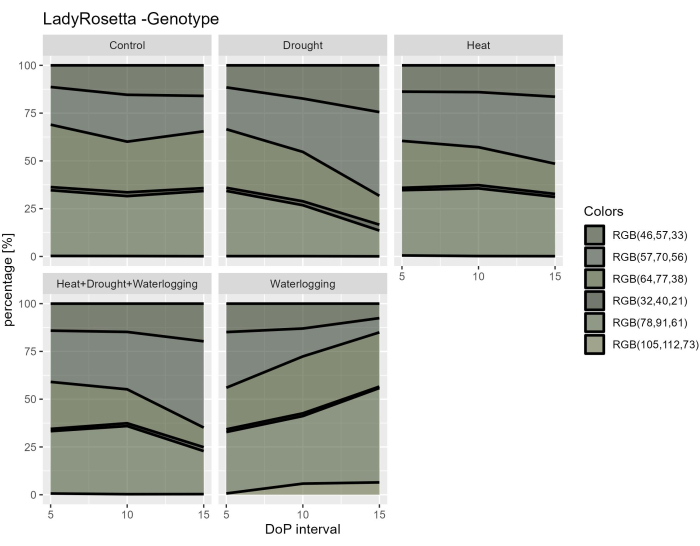
Figura 8: Indice di inverdimento per piante sottoposte a diversi trattamenti. L'elaborazione delle immagini si basa sulla trasformazione dell'immagine RGB originale in una mappa dei colori composta da 6 tonalità definite. I dati rappresentano i valori medi ± deviazione standard (n = 10). Clicca qui per visualizzare una versione più grande di questa figura.
Figura supplementare 1: Intensità luminosa misurata durante i giorni di fenotipizzazione (DOP). La durata delle misurazioni dalle 9:00 alle 12:35 si riferisce LI_Buff dati mediani provenienti da 5 sensori di luce distribuiti nella serra. Clicca qui per scaricare questo file.
Figura 2 supplementare: Umidità relativa (RH) misurata durante i giorni di fenotipizzazione (DOP). La durata delle misurazioni dalle 9:00 alle 12:35 si riferisce RH_Buff dati mediani provenienti da 5 sensori di umidità distribuiti nella serra. RH2 si riferisce all'umidità relativa nella camera di adattamento. Clicca qui per scaricare questo file.
Figura supplementare 3: Temperatura misurata durante i giorni di fenotipizzazione (DOP). La durata delle misurazioni dalle 9:00 alle 12:35 si riferisce T_Buff dati mediani provenienti da 5 sensori di temperatura distribuiti nella serra. T2 si riferisce alla temperatura nella camera di adattamento. T3 si riferisce alla temperatura della parete riscaldante. T4 si riferisce alla temperatura nell'unità di imaging termico IR. Clicca qui per scaricare questo file.
Figura 4 supplementare: Screenshot del software di analisi dei dati che mostra i parametri regolati per l'analisi della maschera vegetale nei sensori di imaging a fluorescenza della clorofilla. Clicca qui per scaricare questo file.
Figura supplementare 5: Screenshot del software di analisi dei dati che mostra i parametri regolati per l'analisi della maschera vegetale nei sensori di imaging termico a infrarossi. Clicca qui per scaricare questo file.
Figura 6 supplementare: Screenshot del software di analisi dei dati che mostra i parametri regolati per l'analisi della maschera vegetale nei sensori di imaging RGB con vista a 1 lato. Clicca qui per scaricare questo file.
Figura supplementare 7: Screenshot del software di analisi dei dati che mostra i parametri regolati per l'analisi della maschera vegetale nei sensori di imaging RGB2-top view. Clicca qui per scaricare questo file.
Figura supplementare 8: Screenshot del software di analisi dei dati che mostra i parametri regolati per l'analisi della maschera vegetale nei sensori di imaging VNIR. Clicca qui per scaricare questo file.
Figura supplementare 9: Screenshot del software di analisi dei dati che mostra i parametri regolati per l'analisi della maschera vegetale nei sensori di imaging SWIR. Clicca qui per scaricare questo file.
Discussione
Il miglioramento degli strumenti avanzati di imaging ad alta risoluzione e delle tecniche di visione artificiale ha consentito il rapido sviluppo della fenotipizzazione delle piante per ottenere dati quantitativi da immagini massive di piante in modo riproducibile39. Questo studio mirava ad adattare e ottimizzare la metodologia basata su immagini ad alto rendimento utilizzando una serie di sensori di imaging attualmente disponibili per monitorare le risposte dinamiche delle piante in condizioni di stress abiotici singoli e combinati. Alcune fasi critiche dell'approccio applicato richiedono aggiustamenti, tra cui l'applicazione dello stress e la selezione di un protocollo di imaging adatto per le misurazioni. L'utilizzo di più sensori per l'acquisizione delle immagini consente la quantificazione dei tratti fenotipici chiave (come la crescita delle piante, l'efficienza fotosintetica, le regolazioni stomatiche, la riflettanza fogliare, ecc.). Inoltre, migliora la comprensione di come le piante di patata rispondono a diversi stress abiotici. Questo è un prerequisito fondamentale per accelerare i progetti di selezione vegetale per sviluppare genotipi tolleranti al clima40. Le risposte morfologiche allo stress indotto dipendono dallo stadio di sviluppo. Ad esempio, indurre stress nella fase di inizio dello stolone o del tubero inibisce lo sviluppo delle foglie e delle piante e limita il numero di stoloni, riducendo così la resa finale41. Tuttavia, in condizioni sfavorevoli, le piante utilizzano le risposte allo stress come risposta adattativa per prevenire e riparare il danno cellulare indotto dallo stress42. Le piante hanno meccanismi adattativi per evitare e tollerare condizioni di stress a seconda del livello di gravità43.
Comprendere i meccanismi delle piante, indurre la durata e l'intensità appropriate dello stress e determinare le risposte delle piante allo stress utilizzando sensori di imaging è considerato uno dei passaggi critici. Quando più sollecitazioni coincidono, l'intensità di una sollecitazione può annullare l'effetto delle altre a seconda della combinazione, dell'intensità e della durata delle sollecitazioni. Pertanto, gli effetti dello stress possono sommarsi o le risposte opposte possono (parzialmente) annullarsi a vicenda, determinando in ultima analisi effetti positivi o negativi sulle piante. Il protocollo selezionato in questo studio si basava su esperienze precedenti per garantire che fossero applicati livelli di stress sufficienti. Ad esempio, l'applicazione dello stress da siccità è stata regolata a un livello moderato poiché in un esperimento precedente, la risposta non era diversa dai trattamenti di controllo in una fase iniziale dello stress basati sull'imaging a fluorescenza della clorofilla. Ciò è dovuto al verificarsi della fotorespirazione che funge da dissipatore alternativo per gli elettroni nella membrana tilacoide e da meccanismo di protezione per il fotosistema II44,45. Nell'ambito della risposta combinata allo stress, l'esposizione delle piante a un fattore di stress primario lieve potrebbe aumentare la tolleranza a un fattore di stress successivo, che può avere un impatto benefico o dannoso46. In questo studio, è stata osservata una risposta più forte in condizioni di stress combinato rispetto allo stress da siccità individuale. Studiando altre risposte fisiologiche, i risultati hanno mostrato un aumento del ΔT (deltaT) in condizioni di siccità quando gli stomi si avvicinano per evitare un'eccessiva perdita d'acqua. Al contrario, la risposta inversa è stata osservata in condizioni di stress da calore, dove il ΔT era inferiore rispetto al controllo che rifletteva l'apertura degli stomi per migliorare il raffreddamento delle foglie in conformità con i risultati nel grano in condizioni di stress combinato da calore e siccità20. Durante il ristagno idrico, l'aumento di ΔT dovuto alla chiusura stomatica è il risultato della carenza di ossigeno nel suolo e dell'interruzione dell'omeostasi dell'acqua radicale, abbassando così il flusso di traspirazione con un aumento dell'ABA, un ormone chiave nelle risposte allo stress idrico47.
Negli studi sullo stress delle piante, la durata dello stress e dei successivi trattamenti di recupero è direttamente proporzionale all'intensità dello stress. Ad esempio, uno stress da siccità moderato, come il mantenimento dell'umidità del suolo al 20% della capacità di campo (FC), induce cambiamenti fenotipici reversibili che in genere si riprendono dopo un solo giorno di reirrigazione. Al contrario, condizioni di stress gravi come il ristagno idrico provocano danni fenotipici estesi, richiedendo un periodo di recupero più lungo. Sebbene la standardizzazione della durata del trattamento sia l'ideale, la variabilità intrinseca delle intensità di stress deve essere presa in considerazione nel disegno sperimentale.
Il secondo passaggio critico consiste nella selezione di un protocollo appropriato e nell'ottimizzazione delle impostazioni per ciascun sensore. La fluorescenza della clorofilla è uno strumento potente per determinare le prestazioni dell'apparato fotosintetico sotto stress48. Diversi protocolli di misurazione della fluorescenza della clorofilla possono essere selezionati con piante adattate alla luce o al buio a seconda della domanda di ricerca e del disegno sperimentale49. In questo studio, il protocollo selezionato (risposta alla luce corta) consente la determinazione di vari caratteri, tra cui Fv'/Fm', φPSII e qL, che indicano le prestazioni della fotosintesi in diverse condizioni50. Studi precedenti hanno dimostrato che il protocollo utilizzato nella fenotipizzazione ad alto rendimento è efficace nello studio dell'efficienza fotosintetica delle piante in diverse applicazioni di trattamenti di stress e nella discriminazione tra piante sane e stressate14,20. Sulla base del disegno sperimentale, è molto importante considerare la durata del protocollo selezionato quando si misura in un sistema ad alto rendimento con un'elevata popolazione di piante. Pertanto, la misurazione della fluorescenza della clorofilla su piante adattate alla luce utilizzando un protocollo di breve durata è stata selezionata per discriminare le risposte in base a diversi trattamenti. Le interazioni genotipo-ambiente possono influenzare molti tratti fenotipici, il che è fondamentale durante la misurazione12. È essenziale considerare che la durata della misurazione dovrebbe essere completata in breve tempo per ridurre al minimo l'effetto diurno sulle limitazioni fotosintetiche51.
L'imaging termico IR è stato utilizzato per determinare la temperatura della chioma e comprendere la regolazione stomatica sotto diversi trattamenti52. Vale la pena ricordare che l'ottimizzazione tecnologica è stata utilizzata quando la parete riscaldante si trovava sul lato opposto della telecamera e la temperatura della parete era controllata e programmabile dinamicamente. Pertanto, la regolazione della parete riscaldata dello sfondo con sensori ambientali integrati è necessaria per selezionare correttamente le piante dallo sfondo aumentando il contrasto della temperatura dello sfondo rispetto alla temperatura dell'oggetto ripreso.
Anche se l'analisi delle immagini è automatizzata, la regolazione degli indici di soglia RGB è comunque necessaria per ottenere una maschera binaria adeguata nell'imaging RGB per selezionare con precisione le piante53. Inoltre, la scelta di più angolazioni è importante per stimare in modo appropriato i parametri quantitativi, tra cui la biomassa digitale e il tasso di crescita. In questo studio, sono stati selezionati e mediati tre angoli (0°, 120° e 240°) sulla vista laterale RGB per calcolare con precisione il volume della pianta e il tasso di crescita relativo.
A seconda della gamma spettrale, molti tratti fisiologici possono essere studiati utilizzando l'imaging iperspettrale54. È necessario determinare quale degli indici di riflettanza fornisce le informazioni necessarie e mostra la risposta delle piante in condizioni diverse14. È molto richiesto nello screening delle varietà tolleranti e nella fenotipizzazione delle piante per determinare la correlazione tra gli indici iperspettrali e altri caratteri fisiologici55. In questo studio, le piante sottoposte a trattamento di ristagno idrico hanno mostrato una risposta pronunciata nel contenuto di clorofilla e nell'efficienza fotosintetica dall'imaging VNIR. Inoltre, sono state osservate risposte diverse nell'indice dell'acqua calcolato dall'imaging SWIR sotto trattamenti termici e ristagni d'acqua a causa delle diverse regolazioni stomatiche e del contenuto d'acqua nelle foglie.
Pertanto, questi risultati evidenziano l'utilità di un tale approccio dopo l'ottimizzazione delle impostazioni e il potenziale dell'utilizzo di più sensori per trovare tratti di stress rilevanti per la tolleranza climatica. La valutazione della dinamica delle risposte utilizzando più sensori di imaging può essere utilizzata come uno dei potenti strumenti per migliorare i programmi di riproduzione.
Divulgazioni
Gli autori dichiarano di non avere interessi finanziari concorrenti noti o relazioni personali che possano aver influenzato il lavoro riportato in questo articolo.
Riconoscimenti
Questo progetto ADAPT (Accelerated Development of multiple-stress tolerant Potato) ha ricevuto finanziamenti dal programma di ricerca e innovazione Horizon 2020 dell'Unione Europea nell'ambito dell'accordo di sovvenzione n. GA 2020 862-858. Questo lavoro è stato parzialmente sostenuto dal Ministero dell'Istruzione, della Gioventù e dello Sport della Repubblica Ceca con il Fondo Europeo di Sviluppo Regionale-Progetto "SINGING PLANT" (n. CZ.02.1.01/0.0/0.0/16_026/0008446). Il Core Facility Plants Sciences di CEITEC MU è riconosciuto per il suo supporto agli impianti di coltivazione. Ringraziamo Meijer BV per aver fornito le talee in vitro utilizzate in questo studio. Ringraziamo Lenka Sochurkova per l'assistenza nella progettazione grafica della Figura 2 e Pavla Homolová per l'assistenza nella preparazione del materiale vegetale durante gli esperimenti presso il Centro di Ricerca Photon Systems Instruments (PSI) (Drásov, Repubblica Ceca).
Materiali
| Name | Company | Catalog Number | Comments |
| 1.1” CMOS Sensor with RGB camera | PSI, Drásov, Czech Republic | https://psi.cz/ | The sensor delivers a resolution of 4112 × 4168 pixels for side view and 2560 × 1920 pixels for top view. The sensor is extremely sensitive and is a real megapixel CCD replacement and produces sharp, low-noise images |
| FluorCam | PSI, Drásov, Czech Republic | FC1300/8080-15 | Pulse amplitude modulated (PAM) chlorophyll fluorometer |
| Fluorcam 10 software | PSI, Drásov, Czech Republic | Version 1.0.0.18106 | For Chlorophyll fluorescence images visualization and analysis |
| GigE PSI RGB – 12.36 Megapixels Camera | PSI, Drásov, Czech Republic | https://psi.cz/ | For the side view projections, line scan mode was used with a resolution of 4112 px/line, 200 lines per second. The imaged area from the side view was 1205 × 1005 mm (height × width), while the imaged area from the top view position was 800 × 800 mm. |
| Hyperspectral Analyzer software | PSI, Drásov, Czech Republic | Version 1.0.0.14 | For hyperspectral images visualization and analysis |
| Hyperspectral camera HC-900 Series | PSI, Drásov, Czech Republic | https://hyperspec.org/products/ | Visible-near-infrared (VNIR) camera 380-900 nm with a spectral resolution of 0.8 nm FWHM |
| Hyperspectral camera SWIR1700 | PSI, Drásov, Czech Republic | https://hyperspec.org/products/ | Short-wavelength infrared camera (SWIR) camera 900 - 1700 nm with a spectral resolution of 2 nm FWHM |
| InfraTec thermal camera (VarioCam HEAD 820(800)) | Flir, United States | https://www.infratec.eu/thermography/infrared-camera/variocam-hd-head-800/ | Resolution of 1024 × 768 pixels, thermal sensitivity of < 20 mK and thermal emissivity value set default to 0.95. with a scanning speed of 30 Hz and each line consisting of 768 pixels. The imaged area was 1205 × 1005 mm (height × width). |
| LED panel | PSI, Drásov, Czech Republic | https://led-growing-lights.com/products/ | Equipped with 4 × 240 red-orange (618 nm), 120 cool-white LEDs (6500 K) and 240 far-red LEDs (735 nm) distributed equally over an imaging area of 80 × 80 cm |
| Light, temperature and relative humidity sensors | PSI, Drásov, Czech Republic | https://psi.cz/ | Sensors used to monitor controlled conditions in greenhouse |
| MEGASTOP Blue mats | Friedola | 75831 | To cover soil surface |
| Morphoanalyzer software | PSI, Drásov, Czech Republic | Version 1.0.9.8 | For RGB images visualization and analysis and color segmentation analysis |
| PlantScreen Data Analyzer software (Version 3.3.17.0) | PSI, Drásov, Czech Republic | https://plantphenotyping.com/products/plantscreen-modular-system/ | To visualize and analyze the data from all imaging sensors, watering-weighing unit and environmental conditions in greenhouse |
| PlantScreen Modular system | PSI, Drásov, Czech Republic | https://plantphenotyping.com/products/plantscreen-modular-system/ | Type of phenotyping platform |
| Plantscreen Scheduler software | PSI, Drásov, Czech Republic | Version 2.6.8368.25987 | To plan the experiment and set the measuring protocol |
| SpectraPen MINI | PSI, Drásov, Czech Republic | https://handheld.psi.cz/products/spectrapen-mini/#details | Light meter to adjust light level on a canopy level |
| TOMI-2 high-resolution camera | PSI, Drásov, Czech Republic | https://fluorcams.psi.cz/products/handy-fluorcam/ | Resolution of 1360 × 1024 pixels, frame rate 20 fps and 16-bit depth) with a 7-position filter wheel is mounted on a robotic arm positioned in the middle of the multi-color LED light panel with dimensions of 1326 x 1586 mm. |
| Walk-in FytoScope growth chamber | PSI, Drásov, Czech Republic | https://growth-chambers.com/products/walk-in-fytoscope-fs-wi/ | Type of chambers used to grow the plant |
Riferimenti
- Climate Change 2021: The Physical Science Basis. IPCC Available from: https://www.ipcc.ch/report/ar6/wg1/ (2021)
- Ray, D. K., Gerber, J. S., Macdonald, G. K., West, P. C. Climate variation explains a third of global crop yield variability. Nat Commun. 6, 5989 (2015).
- Acevedo, M., et al. A scoping review of adoption of climate-resilient crops by small-scale producers in low- and middle-income countries. Nat Plants. 6 (10), 1231-1241 (2020).
- van Dijk, M., Morley, T., Rau, M. L., Saghai, Y. A meta-analysis of projected global food demand and population at risk of hunger for the period 2010-2050. Nat Food. 2 (7), 494-501 (2021).
- Handayani, T., Gilani, S. A., Watanabe, K. N. Climatic changes and potatoes: How can we cope with the abiotic stresses. Breed Sci. 69 (4), 545-563 (2019).
- Devaux, A., Goffart, J. P., Kromann, P., Andrade-Piedra, J., Polar, V., Hareau, G. The potato of the future: Opportunities and challenges in sustainable agri-food systems. Potato Res. 64 (4), 681-720 (2021).
- Dahal, K., Li, X. Q., Tai, H., Creelman, A., Bizimungu, B. Improving potato stress tolerance and tuber yield under a climate change scenario - a current overview. Front Plant Sci. 10, 563 (2019).
- Ahmad, U., Sharma, L. A review of best management practices for potato crop using precision agricultural technologies. Smart Agricultural Technology. 4, 100220 (2023).
- Cabello, R., Monneveux, P., De Mendiburu, F., Bonierbale, M. Comparison of yield based drought tolerance indices in improved varieties, genetic stocks and landraces of potato (Solanum tuberosum L). Euphytica. 193 (2), 147-156 (2013).
- von Gehren, P., et al. Farmers feel the climate change: Variety choice as an adaptation strategy of European potato farmers. Climate. 11 (9), 189 (2023).
- Fiorani, F., Schurr, U. Future scenarios for plant phenotyping. Annu Rev Plant Biol. 64, 267-291 (2013).
- Poorter, H., et al. Pitfalls and potential of high-throughput plant phenotyping platforms. Front Plant Sci. 14, 1233794 (2023).
- Berger, B., de Regt, B., Tester, M. High-throughput phenotyping of plant shoots. Methods Mol Biol. 918, 9-20 (2012).
- Humplík, J. F., Lazár, D., Husičková, A., Spíchal, L. Automated phenotyping of plant shoots using imaging methods for analysis of plant stress responses - a review. Plant Methods. 11, 29 (2015).
- Danilevicz, M. F., Bayer, P. E., Nestor, B. J., Bennamoun, M., Edwards, D. Resources for image-based high-throughput phenotyping in crops and data sharing challenges. Plant Physiol. 187 (2), 699-715 (2021).
- Abebe, A. M., Kim, Y., Kim, J., Kim, S. L., Baek, J. Image-based high-throughput phenotyping in horticultural crops. Plants. 12 (10), 2061 (2023).
- Lazarević, B., Carović-Stanko, K., Safner, T., Poljak, M. Study of high-temperature-induced morphological and physiological changes in potato using nondestructive plant phenotyping. Plants. 11 (24), 3534 (2022).
- Marchetti, C. F., et al. A novel image-based screening method to study water-deficit response and recovery of barley populations using canopy dynamics phenotyping and simple metabolite profiling. Front Plant Sci. 10, 1252 (2019).
- Kim, S. L., et al. High-throughput phenotyping platform for analyzing drought tolerance in rice. Planta. 252 (3), 38 (2020).
- Abdelhakim, L. O. A., Rosenqvist, E., Wollenweber, B., Spyroglou, I., Ottosen, C. O., Panzarová, K. Investigating combined drought- and heat stress effects in wheat under controlled conditions by dynamic image-based phenotyping. Agronomy. 11 (2), 364 (2021).
- Zandalinas, S. I., Sengupta, S., Fritschi, F. B., Azad, R. K., Nechushtai, R., Mittler, R. The impact of multifactorial stress combination on plant growth and survival. New Phytologist. 230 (3), 1034-1048 (2021).
- Raza, A., et al. Impact of climate change on crops adaptation and strategies to tackle its outcome: A review. Plants. 8 (2), 34 (2019).
- Nasir, M. W., Toth, Z. Effect of drought stress on potato production: A review. Agronomy. 12 (3), 635 (2022).
- Wagg, C., Hann, S., Kupriyanovich, Y., Li, S. Timing of short period water stress determines potato plant growth, yield and tuber quality. Agric Water Manag. 247, 106731 (2021).
- Yamauchi, T., Colmer, T. D., Pedersen, O., Nakazono, M. Regulation of root traits for internal aeration and tolerance to soil waterlogging-flooding stress. Plant Physiol. 176 (2), 1118-1130 (2018).
- Aien, A., Chaturvedi, A. K., Bahuguna, R. N., Pal, M. Phenological sensitivity to high temperature stress determines dry matter partitioning and yield in potato. Indian J Plant Physiol. 22 (1), 63-69 (2017).
- Zandalinas, S. I., Mittler, R., Balfagón, D., Arbona, V., Gómez-Cadenas, A. Plant adaptations to the combination of drought and high temperatures. Physiol Plant. 162 (1), 2-12 (2018).
- Suzuki, N., Rivero, R. M., Shulaev, V., Blumwald, E., Mittler, R. Abiotic and biotic stress combinations. New Phytologist. 203 (1), 32-43 (2014).
- Atkinson, N. J., Jain, R., Urwin, P. E. The Response of Plants to Simultaneous Biotic and Abiotic Stress. Combined Stresses in Plants. , (2015).
- Harris, P. M., Harris, P. M. . The Potato Crop. 2nd ed. , (1992).
- Weisz, R., Kaminski, J., Smilowitz, Z. Water deficit effects on potato leaf growth and transpiration: Utilizing fraction extractable soil water for comparison with other crops. Am Potato J. 71 (12), 829-840 (1994).
- Wang, X., Vignjevic, M., Jiang, D., Jacobsen, S., Wollenweber, B. Improved tolerance to drought stress after anthesis due to priming before anthesis in wheat (Triticum aestivum L.) var. Vinjett. J Exp Bot. 65 (22), 6441-6456 (2014).
- Junker, A., et al. Optimizing experimental procedures for quantitative evaluation of crop plant performance in high throughput phenotyping systems. Front Plant Sci. 5, 770 (2015).
- Smith, S. M., et al. Diurnal changes in the transcriptome encoding enzymes of starch metabolism provide evidence for both transcriptional and posttranscriptional regulation of starch metabolism in arabidopsis leaves. Plant Physiol. 136 (1), 2687-2699 (2004).
- Findurová, H., Veselá, B., Panzarová, K., Pytela, J., Trtílek, M., Klem, K. Phenotyping drought tolerance and yield performance of barley using a combination of imaging methods. Environ Exp Bot. 209, 105314 (2023).
- Klukas, C., Chen, D., Pape, J. M. Integrated analysis platform: an open-source information system for high-throughput plant phenotyping. Plant Physiol. 165 (2), 506-518 (2014).
- Paul, K., et al. Understanding the biostimulant action of vegetal-derived protein hydrolysates by high-throughput plant phenotyping and metabolomics: A case study on tomato. Front Plant Sci. 10, 47 (2019).
- Awlia, M., et al. High-throughput non-destructive phenotyping of traits that contribute to salinity tolerance in Arabidopsis thaliana. Front Plant Sci. 7, 1414 (2016).
- Li, Z., Guo, R., Li, M., Chen, Y., Li, G. A review of computer vision technologies for plant phenotyping. Comput Electron Agric. 176, 105672 (2020).
- Li, L., Zhang, Q., Huang, D. A review of imaging techniques for plant phenotyping. Sensors (Switzerland). 14 (11), 20078-20111 (2014).
- Obidiegwu, J. E., Bryan, G. J., Jones, H. G., Prashar, A. Coping with drought: Stress and adaptive responses in potato and perspectives for improvement. Front Plant Sci. 6, 542 (2015).
- Zhang, H., Zhao, Y., Zhu, J. K. Thriving under stress: How plants balance growth and the stress response. Dev Cell. 55 (5), 529-543 (2020).
- Bandurska, H. Drought stress responses: Coping strategy and resistance. Plants. 11 (7), 922 (2022).
- Wingler, A., Lea, P. J., Quick, W. P., Leegood, R. C. Photorespiration: metabolic pathways and their role in stress protection. Philos Trans R Soc Lond B Biol Sci. 355 (1402), 1517-1529 (2000).
- Baker, N. R., Rosenqvist, E. Applications of chlorophyll fluorescence can improve crop production strategies: an examination of future possibilities. J Exp Bot. 55 (403), 1607-1621 (2004).
- Georgieva, M., Vassileva, V. Stress management in plants: Examining Provisional and Unique Dose-Dependent Responses. Int J Mol Sci. 24 (6), 5105 (2023).
- Leeggangers, H. A. C. F., Rodriguez-Granados, N. Y., Macias-Honti, M. G., Sasidharan, R. A helping hand when drowning: The versatile role of ethylene in root flooding resilience. Environ Exp Bot. 213, 105422 (2023).
- Baker, N. R. Chlorophyll fluorescence: a probe of photosynthesis in vivo. Annu Rev Plant Biol. 59 (1), 89-113 (2008).
- Murchie, E. H., Lawson, T. Chlorophyll fluorescence analysis: a guide to good practice and understanding some new applications. J Exp Bot. 64 (13), 3983-3998 (2013).
- Maxwell, K., Johnson, G. N. Chlorophyll fluorescence-a practical guide. J Exp Bot. 51 (345), 659-668 (2000).
- Yokoyama, G., Ono, S., Yasutake, D., Hidaka, K., Hirota, T. Diurnal changes in the stomatal, mesophyll, and biochemical limitations of photosynthesis in well-watered greenhouse-grown strawberries. Photosynthetica. 61 (1), 1-12 (2023).
- Jones, H. G. Application of thermal imaging and infrared sensing in plant physiology and ecophysiology. Advances in Botanical Research. 41, 107-163 (2004).
- Brainard, S. H., Bustamante, J. A., Dawson, J. C., Spalding, E. P., Goldman, I. L. A digital image-based phenotyping platform for analyzing root shape attributes in carrot. Front Plant Sci. 12, 690031 (2021).
- Huber, S., Tagesson, T., Fensholt, R. An automated field spectrometer system for studying VIS, NIR and SWIR anisotropy for semi-arid savanna. Remote Sens Environ. 152, 547-556 (2014).
- Mertens, S., et al. Proximal hyperspectral imaging detects diurnal and drought-induced changes in maize physiology. Front Plant Sci. 12, 640914 (2021).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon