È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Una preparazione del modello modificata per la riperfusione dell'occlusione dell'arteria cerebrale media
In questo articolo
Riepilogo
Questo protocollo descrive il processo di preparazione alla riperfusione dell'occlusione dell'arteria cerebrale media attraverso l'arteria carotide comune.
Abstract
Il modello di riperfusione per occlusione dell'arteria cerebrale media (MCAO/R) è fondamentale per comprendere i meccanismi patologici dell'ictus e per lo sviluppo di farmaci. Tuttavia, tra i metodi di modellazione comunemente usati, il metodo Koizumi è spesso oggetto di esame a causa della sua legatura dell'arteria carotide comune (CCA) e della sua incapacità di ottenere un'adeguata riperfusione. Allo stesso modo, il metodo Longa è stato criticato per la disconnessione e la legatura dell'arteria carotide esterna (ECA). Questo studio mira a introdurre un metodo di preparazione del modello modificato che preservi l'integrità dell'ECA, che preveda l'inserimento di una sutura in nylon monofilamento attraverso il CCA, la riparazione dell'incisione CCA legata e il mantenimento della riperfusione dal CCA. La riperfusione del flusso sanguigno è stata confermata utilizzando l'imaging laser speckle flow. Metodi di valutazione come la scala Longa, il punteggio di gravità neurologica modificata, la colorazione con trifeniltetrazolio cloruro (TTC) e la marcatura in immunofluorescenza dei neuroni hanno dimostrato che questo approccio potrebbe indurre un danno stabile al nervo ischemico. Questo protocollo modello MCAO/R modificato è semplice e stabile e fornisce una guida preziosa per i professionisti nel campo dell'ischemia cerebrale.
Introduzione
Secondo l'Organizzazione Mondiale della Sanità, l'ictus è rimasto la seconda causa di morte in tutto il mondo nell'ultimo decennio, con un alto tasso di incidenza, un'elevata mortalità e un alto tasso di disabilità 1,2. Con l'invecchiamento della popolazione globale, si prevede che l'incidenza dell'ictus aumenterà nei paesi in via di sviluppo, diventando potenzialmente la principale causa di morte prematura e disabilità negli adulti. Inoltre, c'è una tendenza per gli ictus che si verificano a un'età più giovane di3 anni. La perdita di forza lavoro dopo un ictus pone anche un pesante fardello sulle famiglie e sulla società4. Pertanto, lo sviluppo di trattamenti sicuri ed efficaci rappresenta una sfida importante nella ricerca sull'ictus.
I modelli animali sono strumenti cruciali per lo studio della prevenzione e del trattamento delle malattie umane. La traduzione di successo delle strategie di trattamento dell'ictus si basa sulla riproducibilità e l'affidabilità dei modelli animali di ictus 5,6. L'arteria cerebrale media (MCA) è un sito comune per l'ictus clinico, rendendo il modello MCAO il modello più vicino all'ictus ischemico umano. Il modello MCAO, preparato con il metodo della sutura, è stato favorito dai ricercatori per vantaggi quali l'assenza di craniotomia e il facile controllo del tempo ischemico. È stato utilizzato in oltre il 40% degli esperimenti neuroprotettivi7. Tuttavia, nonostante i suoi numerosi vantaggi, i dettagli operativi di questo modello rimangono un argomento controverso per molti ricercatori.
Per il modello di occlusione dell'arteria cerebrale media indotta da sutura (MCAO), la riperfusione avviene ritirando la sutura. Attualmente, per l'inserimento della sutura vengono utilizzati due metodi principali: il metodo8 di Koizumi e il metodo9 di Longa. Nel metodo di Koizumi, la sutura entra nell'arteria carotide interna (ICA) principalmente attraverso l'incisione dell'arteria carotide comune (CCA), mentre nel metodo di Longa, passa attraverso l'arteria carotide esterna recisa (ECA) nell'ICA. Durante la riperfusione, il metodo Koizumi richiede la legatura permanente dell'incisione CCA e si basa sul cerchio di Willis per la riperfusione10. Tuttavia, alcuni studi suggeriscono che una riperfusione efficace non può essere raggiunta esclusivamente attraverso l'apporto compensatorio del cerchio di Willis dopo aver perso l'apporto di CCA. Inoltre, il circolo di Willis mostra un'elevata variabilità anatomica, specialmente nei topi C57Bl/6, aumentando la variabilità dell'infarto e riducendo l'affidabilità dei dati sperimentali. Di conseguenza, questo metodo è stato sempre più messo in discussione dai ricercatori11.
Il metodo di Longa prevede l'inserimento di una sutura attraverso l'ECA recisa e quindi la legatura permanente dell'arteria carotide interna (ICA) una volta che la sutura è stata ritirata. Ciò preserva la pervietà del CCA, consentendo la perfusione sanguigna fino al 100% dei valori basali. Tuttavia, questo metodo richiede la separazione dell'arteria carotide esterna e dei piccoli rami arteriosi, il loro taglio o l'elettrocoagulazione, rendendo la procedura impegnativa. Interrompe anche l'intera struttura del flusso sanguigno del cervello, che differisce dallo stato clinicodel paziente 12. È importante sottolineare che gli studi indicano che il taglio o la legatura dell'ECA può causare lesioni ischemiche nei muscoli che controllano la masticazione e la deglutizione, influenzando la dieta animale e portando alla morte postoperatoria dell'animale e a gravi danni sensoriali e motori nei ratti13,14.
Pertanto, è urgentemente necessario un metodo di preparazione del modello modificato per affrontare questi problemi. Questo studio introduce un metodo di modellazione MCAO modificato che ripara l'incisione di inserimento del CCA e raggiunge un'efficace riperfusione. La procedura è semplice, pratica e fattibile, induce danni neurologici significativi e lesioni infartuali replicabili e fornisce una guida preziosa per i ricercatori sull'ictus.
Protocollo
Il protocollo sperimentale è stato condotto in conformità con le linee guida del Comitato per l'uso e la cura e l'uso degli animali istituzionali presso l'Università di Medicina Tradizionale Cinese di Chengdu (Numero di registrazione: 2019-DL-002). Tutti i dati della ricerca sugli animali sono stati documentati seguendo le linee guida ARRIVE (Animal Research: Reporting In Vivo Experiments). Per questo studio sono stati utilizzati ratti maschi Sprague Dawley (SD) di peso compreso tra 250 g ± 20 g e di età compresa tra 6 e 8 settimane. Le specifiche relative agli animali, ai reagenti e alle attrezzature impiegate sono elencate nella Tabella dei materiali.
1. Preparazione degli animali
- Indurre e mantenere l'anestesia profonda nei ratti utilizzando Zoletil 50 (50 mg/kg, IM) e xilazina cloridrato (40 mg/kg, IP). Assicurarsi che la temperatura corporea sia mantenuta a 37 ± 0,5 °C utilizzando una sonda rettale collegata a un termoforo durante la procedura chirurgica. Applicare un unguento veterinario sugli occhi del ratto per evitare che si secchino.
- Radere i peli dalla testa e dal collo dei topi. Usa la crema depilatoria per rimuovere il pelo dalla testa e dal collo, quindi risciacqua la crema con soluzione fisiologica. Disinfettare la pelle nel sito chirurgico applicando etanolo e iodio povidone tre volte utilizzando batuffoli di cotone sterili.
- Praticare un'incisione di 2 cm al centro della testa del ratto lungo la direzione della sutura sagittale utilizzando un bisturi e rimuovere con cura i muscoli che coprono il cranio.
- Assottiglia il cranio sul lato ischemico del ratto usando un trapano per cranio. Utilizzare soluzione salina normale per raffreddare e rimuovere i detriti durante il processo di macinazione. Registrare il flusso sanguigno basale dei ratti utilizzando l'imaging a contrasto laser speckle (LSCI).
- Applicare etanolo e iodio povidone tre volte sulla pelle del collo utilizzando batuffoli di cotone sterili. Praticare un'incisione di 2 cm lungo la linea mediana del collo utilizzando una lama chirurgica. Utilizzare i divaricatori per tirare indietro lateralmente la pelle e le ghiandole salivari, esponendo i muscoli sternocleidomastoideo e cervicale.
- Separare i muscoli sternocleidomastoideo e cervicale per esporre il territorio carotideo. Identificare l'anatomia vascolare dell'arteria carotide comune (CCA), dell'arteria carotide interna (ICA) e dell'arteria carotide esterna (ECA). Sulla base dell'anatomia vascolare, separare il CCA, così come l'ECA derivato dal CCA e l'ICA15.
NOTA: La struttura anatomica del ratto indica che la regione CCA è principalmente ricoperta da muscoli sternocleidomastoideoi e cervicali, con l'ICA e l'ECA derivati dal CCA. Dopo che la separazione espone il CCA, una forcella a forma di Y può essere vista lungo il CCA, che rappresenta l'ICA e l'ECA. Fai attenzione a non danneggiare il nervo vago, che corre parallelo al CCA.
2. Occlusione dell'MCA
- Annodare facilmente l'arteria carotide esterna (ECA) e l'arteria carotide comune (CCA) utilizzando un filo di seta 3-0 per bloccare temporaneamente il flusso sanguigno. Posizionare una clip per recipiente sul CCA a circa 0,5 cm dal primo nodo.
- Tingere di nero l'ago di una siringa da 5 ml. Crea una piccola foratura nel CCA usando l'ago tinto di nero e segna i fori di spillo in nero.
- Inserire la sutura in nylon monofilamento nel CCA attraverso il segno nero. Aprire la clip vascolare e guidare il filo di nylon nell'arteria carotide interna (ICA) fino a quando non si ferma con una leggera resistenza. Stringere saldamente il secondo nodo per mantenere la sutura in nylon monofilamento in posizione all'interno dell'arteria, evitando lo spostamento dalla posizione di blocco.
- Annotare il tempo di ischemia a questo punto e misurare il valore del flusso sanguigno sul lato ischemico utilizzando LSCI. Somministrare gocce di bupivacaina sulla ferita del collo per l'analgesia e la chiusura della ferita. Rimuovere la maschera per anestesia e lasciare che il ratto si riprenda.
NOTA: Se la sutura in nylon monofilamento incontra difficoltà ad entrare nell'ICA, ritrarla leggermente e ritentare l'inserimento.
3. Riperfusione di MCAO
- Dopo 90 minuti di ischemia, anestetizzare nuovamente i ratti con isoflurano. Misurare il flusso sanguigno cerebrale dal lato ischemico utilizzando LSCI e assicurarsi che la sutura in nylon monofilamento non si sia spostata.
- Sciogliere i nodi sull'arteria carotide esterna (ECA) per consentire la riperfusione sanguigna. Rilasciare il nodo sull'arteria carotide comune (CCA), fissare la sutura monofilamento e ritirare la sutura. Applicare una clip vascolare prima della sutura fissa del monofilamento per prevenire il sanguinamento.
- Sostituire il primo nodo CCA con una clip vascolare. Utilizzare una pinzetta per ruotare lateralmente l'incisione del vaso (Figura 1). Bloccare l'incisione con una pinzetta e fissarla utilizzando un filo 6-0 per riparare l'incisione. Rimuovere la clip vascolare, verificare la presenza di perdite e confermare la riperfusione completa (Video 1).
NOTA: Eseguire la legatura per riparare l'incisione per evitare un eccessivo bloccaggio del vaso, che potrebbe portare alla stenosi CCA. - Registrare i valori del flusso sanguigno corticale cerebrale utilizzando LSCI dopo la legatura dell'incisione per confermare il successo della riperfusione. Chiudere l'incisione del collo con punti di sutura e somministrare 1.000.000 di unità di penicillina e 2 ml di soluzione salina per prevenire l'infezione e la disidratazione.
- Mantieni il calore fino a quando i ratti non riprendono conoscenza. Offrire cibo morbido dopo l'intervento chirurgico e monitorare i segni vitali degli animali.
4. Valutazione della funzione nervosa e del danno ischemico cerebrale
- Una volta che i ratti si saranno completamente risvegliati, la loro funzione neurale sarà valutata da ricercatori ignari del raggruppamento animale. Utilizzare la scala del punteggio Longa (Tabella 1) e la scala del punteggio di gravità neurologica modificata (mNSS) (Tabella 2) per valutare la funzione neurologica di tutti i ratti.
- Dopo 24 ore dall'intervento, sopprimere i ratti in anestesia indotta da isoflurano (isoflurano al 4% a 4 L/min di ossigeno) tramite lussazione cervicale16 (seguendo protocolli istituzionalmente approvati). Sciacquare il cervello con acqua ghiacciata per rimuovere il sangue rimasto.
- Dividi il tessuto cerebrale in 5 sezioni e colorale con TTC. Acquisisci immagini di entrambi i lati delle fette di tessuto cerebrale, misura l'area ischemica dei lati anteriore e posteriore utilizzando il software Image J e calcola il tasso di infarto utilizzando la seguente formula:
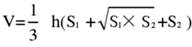
NOTA: S1 e S2 rappresentano l'area dell'infarto rispettivamente del proencefalo prossimale e dei lati prossimali del tronco encefalico delle fette di cervello. L'area dell'infarto di ogni fetta di cervello viene corretta utilizzando la formula di Swanson, dove h rappresenta lo spessore della fetta di cervello. Questa formula, precedentemente delineata dall'autore in una precedente ricerca17, consente un calcolo più accurato della dimensione della lesione infartuale. - Analizza i dati utilizzando software statistici e grafici per valutare il tasso di successo e la stabilità del modello.
- Utilizzare il metodo dell'immunofluorescenza per marcare i neuroni corticali nei ratti, convalidando ulteriormente il danno neuronale causato da questo metodo. Dopo 24 ore di ischemia-riperfusione nei ratti, è stata eseguita la perfusione cardiaca utilizzando PBS pre-raffreddato per ottenere tessuto cerebrale.
- Incorporare e congelare il tessuto cerebrale in sezioni. Utilizzare anticorpi neuronali come il marcatore neuronale immaturo Doublecortin (DCX)18, il marcatore del nucleo neuronale Neuronal Nuclei (NeuN)18 e il marcatore dendritico neuronale Microtubule-associated protein-2 (MAP-2)19. Osservare l'espressione dei neuroni ischemici utilizzando la microscopia confocale laser.
Risultati
L'imaging laser del flusso di speckle ha dimostrato che prima dell'occlusione della sutura in nylon monofilamento, c'era un abbondante flusso sanguigno nell'area dell'arteria cerebrale media (MCA) e sono stati registrati i valori di flusso sanguigno di base dei ratti. In seguito all'occlusione dell'MCA, il valore del flusso sanguigno sul lato ischemico del cervello è diminuito rapidamente. Prima di prelevare la sutura, i valori del flusso sanguigno sul lato ischemico sono stati ricontrollati per confermare se la sutura ...
Discussione
Il modello di occlusione dell'arteria cerebrale media (MCAO) indotta da una sutura in nylon monofilamento è il metodo più comune utilizzato per la preparazione di modelli MCAO. Questo approccio è ampiamente adottato negli studi preclinici e ha ottenuto il riconoscimento di molti professionisti grazie alla sua semplicità, alla mancanza di necessità di craniotomia, al trauma chirurgico minimo e alla capacità di ottenere la riperfusione.
Esistono due tecniche chirurgiche classiche per il fi...
Divulgazioni
Nessuno.
Riconoscimenti
Questo lavoro è stato sostenuto dalla National Natural Science Foundation of China (82173781 e 82373835), dal progetto di ricerca post-dottorato (BKS212055), dal progetto di innovazione scientifica e tecnologica del Foshan Science and Technology Bureau (2320001007331), dalla Guangdong Basic and Applied Basic Research Foundation (2019A1515010806), dai progetti chiave sul campo (produzione intelligente) delle università generali nella provincia del Guangdong (2020ZDZX2057) e dai progetti di ricerca scientifica (innovazione caratteristica) del generale Università nella provincia del Guangdong (2019KTSCX195).
Materiali
| Name | Company | Catalog Number | Comments |
| Animal anesthesia system | Rayward Life Technology Co., Ltd | R500IE | |
| Animal temperature maintainer | Rayward Life Technology Co., Ltd | 69020 | |
| Cy3 secondary antibody | Wuhan Saiweier Biotechnology Co., Ltd | GB21303 | |
| DAP1 antibody | Wuhan Saiweier Biotechnology Co., Ltd | G1012 | |
| DCX antibody | Wuhan Saiweier Biotechnology Co., Ltd | GB13434 | |
| Goat serum | Beyotime Biotechnology Co., LTD | C0265 | |
| GraphPad Prism | GraphPad Software | GraphPad Prism 8.0 | |
| ImageJ | National Institutes of Health | ImageJ software | |
| Isofluran | Rayward Life Technology Co., Ltd | R510-22 | |
| Laser speckle blood flow imaging system | Rayward Life Technology Co., Ltd | PeriCam PSI NR | |
| MAP-2 antibody | Wuhan Saiweier Biotechnology Co., Ltd | GB11128 | |
| Miniature hand-held skull drill | Rayward Life Technology Co., Ltd | 87001 | |
| monofilament suture | Rayward Life Technology Co., Ltd | 250-280g | |
| NeuN antibody | Wuhan Saiweier Biotechnology Co., Ltd | GB11138 | |
| OCT embedding agent | BIOSHARP | BL557A | |
| Penicillin sodium | Chengdu Kelong Chemical Co., Ltd. | 17121709-2 | |
| Quick Antigen Retrieval Solution for Frozen Sections | Beyotime Biotechnology Co., LTD | P0090 | |
| SD rats | SPF ( Beijing ) Biotechnology Co.,Ltd. | 250-280g | |
| Triton X-100 | Beyotime Biotechnology Co., LTD | ST795 | |
| TTC | Chengdu Kelong Chemical Co., Ltd. | 2019030101 |
Riferimenti
- Paul, S., Candelario-Jalil, E. Emerging neuroprotective strategies for the treatment of ischemic stroke: An overview of clinical and preclinical studies. Exp Neurol. 335, 113518 (2021).
- Feigin, V. L., Owolabi, M. O. Pragmatic solutions to reduce the global burden of stroke: a World Stroke Organization-Lancet Neurology Commission. Lancet Neurol. 22 (12), 1160-1206 (2023).
- Putaala, J. Ischemic Stroke in Young Adults. Continuum (Minneapolis, Minn). 26 (2), 386-414 (2020).
- Girotra, T., Lekoubou, A., Bishu, K. G., Ovbiagele, B. A contemporary and comprehensive analysis of the costs of stroke in the United States. J Neurol Sci. 410, 116643 (2020).
- Howells, D. W., et al. Different strokes for different folks: The rich diversity of animal models of focal cerebral ischemia. JCBFM. 30 (8), 1412-1431 (2010).
- Matur, A. V., et al. Translating animal models of ischemic stroke to the human condition. Transl Stroke Res. 14 (6), 842-853 (2023).
- O'Collins, V. E., et al. 1,026 experimental treatments in acute stroke. Ann Neurol. 59 (3), 467-477 (2006).
- Koizumi, J., Yoshida, Y., Nakazawa, T., Ooneda, G. Experimental studies of ischemic brain edema 1. A new experimental model of cerebral embolism in rats in which recirculation can be introduced in the ischemic area. Nosotchu. , 1-7 (1986).
- Longa, E. Z., Weinstein, P. R., Carlson, S., Cummins, R. Reversible middle cerebral artery occlusion without craniectomy in rats. Stroke. 20 (1), 84-91 (1989).
- Faber, J. E., Moore, S. M., Lucitti, J. L., Aghajanian, A., Zhang, H. Sex differences in the cerebral collateral circulation. Transl Stroke Res. 8 (3), 273-283 (2017).
- Justić, H., et al. Redefining the Koizumi model of mouse cerebral ischemia: A comparative longitudinal study of cerebral and retinal ischemia in the Koizumi and Longa middle cerebral artery occlusion models. J Cereb Blood Flow Metab. 42 (11), 2080-2094 (2022).
- Li, Y., et al. Comparison of cerebral microcirculation perfusion in rat models of middle cerebral artery occlusion prepared through common carotid artery insertion and external carotid artery insertion. CJTER. 27 (11), 1683-1691 (2023).
- Dittmar, M., Spruss, T., Schuierer, G., Horn, M. External carotid artery territory ischemia impairs outcome in the endovascular filament model of middle cerebral artery occlusion in rats. Stroke. 34 (9), 2252-2257 (2003).
- Trueman, R. C., et al. A critical re-examination of the intraluminal filament MCAO model: impact of external carotid artery transection. Transl Stroke Res. 2 (4), 651-661 (2011).
- Ziegler, K. A., et al. Local sympathetic denervation attenuates myocardial inflammation and improves cardiac function after myocardial infarction in mice. Cardiovasc Res. 114 (2), 291-299 (2018).
- Pitoulis, F. G., et al. Remodelling of adult cardiac tissue subjected to physiological and pathological mechanical load in vitro. Cardiovasc Res. 118 (3), 814-827 (2022).
- Ma, R., et al. Animal models of cerebral ischemia: A review. Biomed Pharmacother. 131, 110686 (2020).
- Belayev, L., et al. Docosanoids promote neurogenesis and angiogenesis, blood-brain barrier integrity, penumbra protection, and neurobehavioral recovery after experimental ischemic stroke. Mol Neurobiol. 55 (8), 7090-7106 (2018).
- Guo, H., et al. Carthamin yellow improves cerebral ischemia-reperfusion injury by attenuating inflammation and ferroptosis in rats. Int J Mol Med. 47 (4), 52 (2021).
- Chia, N. H., et al. Determining the number of ischemic strokes potentially eligible for endovascular thrombectomy: a population-based study. Stroke. 47 (5), 1377-1380 (2016).
- Henninger, N., Fisher, M. Extending the time window for endovascular and pharmacological reperfusion. Transl Stroke Res. 7 (4), 284-293 (2016).
- Zhang, P. L., et al. Use of Intravenous thrombolytic therapy in acute ischemic stroke patients: evaluation of clinical outcomes. Cell Biochem Biophys. 72 (1), 11-17 (2015).
- Morris, G. P., et al. A comparative study of variables influencing ischemic injury in the Longa and Koizumi methods of intraluminal filament middle cerebral artery occlusion in mice. PLOS One. 11 (2), e0148503 (2016).
- Smith, H. K., Russell, J. M., Granger, D. N., Gavins, F. N. Critical differences between two classical surgical approaches for middle cerebral artery occlusion-induced stroke in mice. J Neurosci Methods. 249, 99-105 (2015).
- Dittmar, M. S., et al. The role of ECA transection in the development of masticatory lesions in the MCAO filament model. Exp Neurol. 195 (2), 372-378 (2005).
- Lourbopoulos, A., et al. Inadequate food and water intake determine mortality following stroke in mice. J Cereb Blood Flow Metab. 37 (6), 2084-2097 (2017).
- Ogishima, H., et al. Ligation of the pterygopalatine and external carotid arteries induces ischemic damage in the murine retina. Invest Ophth Vis Sci. 52 (13), 9710-9720 (2011).
- Irvine, H. J., et al. Reperfusion after ischemic stroke is associated with reduced brain edema. J Cereb Blood Flow Metab. 38 (10), 1807-1817 (2018).
- Carmichael, S. T. Rodent models of focal stroke: Size, mechanism, and purpose. NeuroRx. 2 (3), 396-409 (2005).
- Dirnagl, U., Dirnagl, U. Bench to bedside: The quest for quality in experimental stroke research. J Cereb Blood Flow Metab. 26 (12), 1465-1478 (2006).
- Ingberg, E., Dock, H., Theodorsson, E., Theodorsson, A., Ström, J. O. Method parameters' impact on mortality and variability in mouse stroke experiments: A meta-analysis. Sci Rep. 6, 21086 (2016).
- McColl, B. W., Carswell, H. V., McCulloch, J., Horsburgh, K. Extension of cerebral hypoperfusion and ischaemic pathology beyond MCA territory after intraluminal filament occlusion in C57Bl/6J mice. Brain Res. 997 (1), 15-23 (2004).
- Kitagawa, K., et al. Cerebral ischemia after bilateral carotid artery occlusion and intraluminal suture occlusion in mice: Evaluation of the patency of the posterior communicating artery. J Cereb Blood Flow Metab. 18 (5), 570-579 (1998).
- Trotman-Lucas, M., Kelly, M. E., Janus, J., Fern, R., Gibson, C. L. An alternative surgical approach reduces variability following filament induction of experimental stroke in mice. Dis Model Mech. 10 (7), 931-938 (2017).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon