このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
全反射顕微鏡による網膜双極細胞におけるイメージングのエキソサイトーシス
要約
このビデオでは、我々は内部全反射蛍光(全反射)顕微鏡を使用して金魚網膜双極細胞における単一シナプス小胞のエキソサイトーシスと人身売買にラベルを付けたり、視覚化する方法を示しています。
要約
全内部反射蛍光(全反射)顕微鏡は、ガラスなどの高屈折率物質に最も近い蛍光分子の選択的なイメージングによって、細胞膜で発生するイベントの調査を可能にする技術です。
プロトコル
パート1:解剖と双極細胞の分離
- 表2に記載されているソリューションを準備し、着信音"(外部)溶液のpHはNaOHで7.4に調整する必要があると内部の溶液のpHをCsOHを7.2に調整する必要があります。アルミ箔で光から内部ソリューションを保護し、4℃に保管してください° Cを使用するまで。
- 解剖前に少なくとも30分間金魚を暗適応;
- (;シグマ、セントルイス、MO低Ca 2 +リンゲルのV型ヒアルロニダーゼ、1100単位/ mL)とL -システイン(0.5 mg / mLと10 mLの動物は、暗順応しながら、ヒアルロニダーゼの5 mLを準備する低いのCa 2 +リンゲル)ソリューションとパパイン(凍結乾燥粉末、40単位/ mL秤量、消化液の5mLのためのシグマ、セントルイス、MO);
- 手術用はさみで素早く斬首によって金魚を安楽死させると#11手術用メスの刃を持つ脳と脊髄を破壊する。
- #7湾曲デュモンの鉗子の助けを借りて、余分な眼の筋肉を破壊し、アイリスハサミで視神経を切断することにより目を削除します。
- ろ紙と穿刺#11手術用メスの刃の先端と強膜の縁の部分の上に置いて片方の目の電球。
- パンクした全体の内部vannasのはさみの刃を紹介し、離れて全体の前眼部をカット。
- 残りの眼杯の上にろ紙の小片を置き、紙の硝子体液を浴びてもらうために、いくつかの圧力を発揮する。
- それに接続されている網膜でろ紙を持ち上げ、vannasはさみのパーで視神経を切断。
- #7デュモンピンセットの助けを借りて、ろ紙から網膜オフヒアルロニダーゼ溶液と皮付きの35mmのプラスチック製の培養皿で網膜を含むろ紙を置きます。
- 工業用炭素鋼一枚刃の半分で4〜6の部分に網膜を切り取って、それが20分間ヒアルロニダーゼ溶液中に放置します。
- を有効にするヒアルロニダーゼを待っている間、パパインにL -システイン溶液5 mLを加え、液が透明になるまでは(約5〜10分)放置します。
- 低Ca 2 +リンゲル液で3倍の網膜の部分を洗うと、それらが30〜35分のために、パパイン溶液中に放置します。
- 低Ca 2 +リンゲル液で3倍の網膜の部分を洗浄し、4℃で使用時まで保管°低カルシウムを含む35mmプラスチック培養皿でのC +リンゲル液;
- セルの関連付けを解除するには、低Ca 2 +リンゲル液500 mLを含むマイクロ遠心チューブに網膜の一部を入れてゆっくりと気泡を生成しないように慎重に、ガラス解離ピペットでそれを上下にピペッティングすることにより網膜をひいて粉にする。解離のピペットは、ブンゼンバーナーでガラスパスツールピペットの先端を加熱するとわずかに解剖学的鉗子の助けを借りてそれを曲げることによって作製されています。
- 以前に低Ca 2 +リンガーの2 mLで満たされたホームメイドの録音室に網膜の懸濁液滴を追加することによって、プレート分離細胞を。チャンバーは、中央の円形の全体と35mmのプラスチック培養皿とシリコンエラストマー(Sylgard 184底部に接着1.78屈折率ガラス(PlanOptik、ドイツ)の円形のカバースリップの下半分で構成されています。ダウコーニング、ミッドランド、MI)。
パート2:双極細胞のロードとウォッシュアウト
シナプス小胞の全反射イメージングは、最高の非常に高NAの対物と高感度カメラで客観的な型TIRFM顕微鏡を用いて行われる。私たちの実験のために、我々はEMCCD(カスケード512B、ローパーサイエンティフィック、ツーソン、アリゾナ州)で1.65 NAの対物(アポX100 O HR、NA 1.65、オリンパス、日本)を使用するかを選択。非常に高NA対物レンズの使用は、高屈折率のガラス製カバースリップと液浸液(硫黄とジ - ヨードメタン)の使用を必要とする。私たちの条件の下で、励起光は、50nm程度の一定長さに指数関数的に減衰するフィールドに制限されています。
- 顕微鏡対物に高屈折率液体(Mシリーズ、屈折率= 1.7800、Cargille Labsは、シーダーグローブ、ニュージャージー州)のドロップを追加します。
- 顕微鏡対物の上に慎重に録音室を置き、慎重にチャンバーに接地電極と灌流出口パイプにマウント。
- チャンバーは細胞が沈むと底に付着できるように、10〜20分のために顕微鏡の上に座ってみましょう。
- その間に、1mMのトロロックス® ((±)- 6 -ヒドロキシ-2クロマン- tetramethylchromane -2 -カルボン酸5 mLを準備し、シグマ、セントルイス、MO)高K +リンゲルのソリューションを。溶解するまで超音波で分解する。
- 低Ca 2 +リンガーの中の1mM ADVASEP - 7(シグマ、セントルイス、MO):ADVASEP - 7洗浄溶液15mLを準備します。 ADVASEP - 7の使用はオプションであり、必要に応じて省略することができることに注意してください。
- 灌流liをパージNESと追加ADVASEP - 7洗浄液、低Ca 2 +リンゲルと制御呼び出し音が灌流システムにです。
- 薄肉ホウケイ酸ガラス(; WPI、サラソタ、フロリダ州クイック- FIL ® TW150 - 3)からロードするピペットを引き出します。フグピペットの抵抗は、1.5から2.5MΩの範囲内にあります。
- ソリューション、FM1 - 43 ®(Invitrogen社、カールスバッド、カリフォルニア州 - - (4(ジブチルアミノ)スチリル)ピリジニウムブロミド、"特別な包装を"N -(3 - triethylammoniumpropyl)-4)の準備。最初に、FM1 - 43 ®の1バイアル(100mg)を、160μLの蒸留水を加えて1mMのストックを作る。このストックは最大1週間までは4 ° Cに保つことができる。その後、FM1 - 43の5μLを加える® 1 mLの高濃度K +リンゲル+ 1mMのトロロックス®に。アルミ箔で光からソリューションを保護し、4℃に保管してください° Cを使用するまで。
- 顕微鏡、明視野光をオンにして無傷の双極細胞を検索する。若干のニューロンがしっかりとチャンバーの底部に接続されていることを確認するために顕微鏡をタップします。
- 近くに目的の細胞への灌流のペンを置き、継続的に低Ca 2 +リンゲル液で準備を灌流。
- 部屋の照明をオフにすると赤ロングパスフィルタ(すなわち、RG630、Schott社、ドイツ)を追加するFM色素の励起を最小限に抑えるために光路に。
- FM色素溶液10μLとローディングピペットを埋める、マニピュレータにピペットをマウントし、それは、ロードする双極細胞と同じ焦点面になるまで過することなく準備にピペットを下げます。あなたは、少なくとも2つの電極ホルダーを持っていることを確認します:FM色素のために使用されるものは、それが細胞内液を汚染する可能性のある他のパッチクランプのために使用、またはすることはできません。
- ポジション軸索ターミナルから約10μmの距離にあるフグのオープニング、灌流システムをオフにし、上ピペットの過圧を回して10秒間、色素溶液をふかす。
- 過度の圧力をオフにすると、ピペットを移動することなく、30秒待つ。
- 灌流をオンにして5分間ADVASEP - 7溶液中で室浴びる。その間に、お風呂からフグのピペットを取り外します。
- 5分後、低Ca 2 +リンゲル液に切り替えて、余分な染料の除去を可能にするために25〜30分のためのチャンバーを灌流。
パート3:パッチクランプとTIRFMイメージング
- 準備は、洗い出している間は、肉厚のホウケイ酸ガラス(B150 - 86 - 10;サター器械公司、ノヴァト、カリフォルニア州)からパッチピペットを引き出します。パッチピペットの抵抗は8-10MΩの範囲内にあります。
- 洗い流しが完了すると、視野の中央に軸索の端末を配置します。
- コート、気泡を取り除くためにピペットをタップし、内部の溶液を7μLで溶融歯科用ワックス(スティッキーワックス、カーコーポレーション、オレンジ、カリフォルニア州)とピペットをパッチピペットを記入し、マイクロマニピュレータでそれをマウントします。
- 上のピペットの過圧を回して、準備にゆっくりとピペットを下げます。アンプのピペットの抵抗と、それぞれのアンプのコントロールで正しいピペットのオフセットと容量を確認してください。
- リンゲルを制御するための灌流を切り替えます。ピペットと細胞の間にgigasealを作成するには、わずかに細胞体に対して電極の先端に触れ、ゆっくりと電極への負圧をかけながらピペットの過圧をオフにする。
- 密閉しながら、アンプの"全セル"モードを選択し、-60 mVにセル保持電位を設定します。
- 、全体の軸索の端末を網羅するイメージングソフトウェアとの関心領域を選択して明るい場光をオフにすると、簡単に488 nmのレーザーに(30ミリ)の端末を公開することにより、全反射イメージングのための右の焦点面を見つける;
- ピペットにわずかに負圧をかけながら、アンプの"ZAP"コマンドを使用して細胞に侵入。
- イメージングシナプス小胞の動きをしながら興味の電圧プロトコルを適用し、セルの静電容量と直列抵抗のために訂正し、そして。それはカメラのフレームレートに同期した電圧プロトコルを持っているこの段階で重要です。私たちのケースでは、各フレームは30ミリ長い、電圧変化がこの値の倍数(すなわち、すべての300ミリ秒または10フレーム)で発生するので;
- 回復を可能にするために試験の間に少なくとも40秒待ちます。
- で561 nmのレーザーを回している間シナプスリボンの位置を確認するには、写真を撮る。
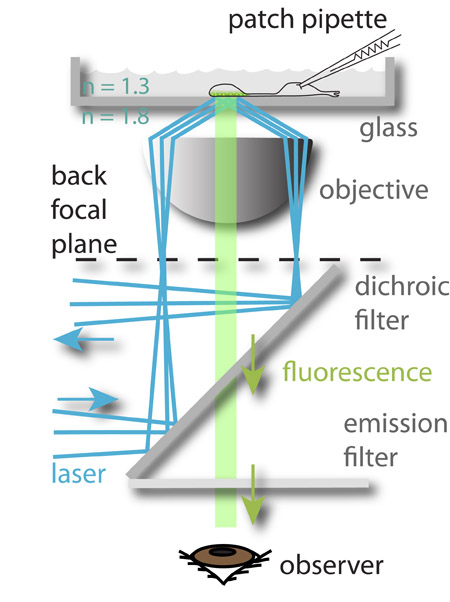
図1:実験のセットアップ。 488 nmのレーザー(青)は目的の後焦点面の周辺部に集中し、それがガラス水性媒体のインタフェースに到達したときに全反射を受けるている。反射されたビームによって発生する電磁界は、ボットに最も近いシナプス小胞にロードされた蛍光体を励起その後、(緑)蛍光ガラスチャンバーのOM、。蛍光灯は、観察者の眼(図示)するか、CCDカメラに導かれる。画像化された細胞の膜電位は、それらをパッチクランプにより同時に制御されます。このアプローチでは、着信信号(膜電位)とニューロンの出力(エキソサイトーシス)との関係の研究が可能になります。

図2:典型的な結果。左:分離された金魚の双極細胞の明視野像。右上:双極細胞軸索の端末にシナプス小胞の全反射像は、FM 1から43でロード®および488nmのレーザー(FM色素)で撮像。右下:561 nmのレーザーでパッチ適用後に同じ端末の画像セルとイメージング軸索端末。シナプスリボンは、ローダミンベースのリブアイ-結合ペプチド(Rpep_rhod)によって標識されています。
表1:特定の試薬 および器具。
の名前 | タイプ | メーカー | カタログ | コメント |
| - | 空気の表 | ニューポートコーポレーション | - | - |
| IX70 | 倒立顕微鏡 | オリンポス | - | 明視野と全反射のための側面開口部のポート用タングステンランプを装備 |
| TH4 - 100 | ランプの電源 | オリンポス | - | - |
| FF498_581 - DI01 | 干渉フィルター | Semrock | - | - |
| NF01 - 405_488_568 | エミッションフィルター | Semrock | - | - |
| アポX100 O HR | 客観的な | オリンポス | - | NA 1.65 |
| RG630 | レッドグラスフィルター | ショット | - | - |
| - | 488 nmのレーザー | コヒーレント | - | 最小の電力で使用 |
| - | シャッター | Uniblitz | - | - |
| VMM - D1 | シャッタードライバ | Uniblitz | - | - |
| - | 561 nmのレーザー | メレスグリオ | - | - |
| - | シャッター | Uniblitz | - | - |
| VMM - D3 | シャッタードライバ | Uniblitz | - | - |
| 灌流圧キット | 灌流システム | サイエンティフィック自動化 | 9月4日 | - |
| 血流ペン | 灌流システム | サイエンティフィック自動化 | - | - |
| Valvelink 8 | 灌流のシステムコントローラ | サイエンティフィック自動化 | - | - |
| カスケード512B | EM CCDカメラ | ローパーサイエンティフィック | - | - |
| Metamorph 7.1 | イメージングソフトウェア | 分子デバイス | - | - |
| EPC - 9 | パッチクランプアンプ | HEKA Elektronik社 | - | - |
| パルス | アンプのソフトウェア | HEKA Elektronik社 | - | - |
| MP - 285 | マニピュレーター | サターのインストゥルメント | - | - |
| - | 電極ホルダー | HEKA Elektronik社 | - | 1.5ミリメートルODガラス、2台用 |
| クイック- FIL ® TW150 - 3 | ホウケイ酸ガラスキャピラリー | WPI | - | フィラメントのない |
| B150 - 86から10 | ホウケイ酸ガラスキャピラリー | サターのインストゥルメント | - | フィラメントと |
| P - 97 | 微小電極プラー | サターのインストゥルメント | - | 3x3のボックスのフィラメントと環境チャンバーを装備 |
| - | 圧力の真空エアーポンプ | トーマスサイエンティフィック | 7893B05 | ピペット用チャンバーと過剰圧力から液体を取り除くために真空を作成します。 |
| MatLabのR2008a | 解析ソフトウェア | サイバネットシステム | - | - |
| 353001 | 35mmプラスチック培養皿 | ファルコン | - | - |
| - | 高屈折率ガラス | PlanOptik | - | 屈折率は488 nm = 1.78 |
| シリーズM | 高屈折率液体 | Cargille研究所 | - | 屈折率= 1.78 |
| Sylgard 184 | シリコンエラストマーキット | ダウコーニング | - | - |
| グルタチオン | トリペプチド | EMDケミカルズ | 無料radicalのスカベンジャー | |
| ヒアルロニダーゼ | 酵素 | シグマ | H6254 | タイプV |
| L -システイン | アミノ酸 | フルカ | 30090 | パパインをアクティブに |
| パパイン | 酵素 | フルカ | 76220 | カリカパパイヤから |
| トロロックス® | 水溶性ビタミンE | シグマ | 56510 | フリーラジカルスカベンジャー |
| ADVASEP - 7 | スルホン酸化した B -シクロデキストリン誘導体 | シグマ | A3723 | FM 1から43を軽減®バックグラウンド蛍光 |
| FM 1から43 ® | 蛍光染料 | インビトロジェン | T35356 | "特殊包装" |
| スティッキーワックス | ピペットコーティング剤 | カーコーポレーション | - | ピペット容量は減少する |
表2:本研究で使用した生理的溶液。
物質 | 低Ca 2 +リンゲル液 | コントロールリンゲル | 高K +リンゲル | 内部ソリューション |
| NaClの | 120mMの | 120mMの | 97.5 mMの | - |
| 塩化カリウム | 2.5mMの | 2.5mMの | 25 mMの | - |
| MgCl 2の | 1mMの | 1mMの | 1mMの | 4mMの |
| CaCl 2の | 0.5mMの | 2.5mMの | 2.5mMの | - |
| HEPES | 10 mMの | 10 mMの | 10 mMの | 10 mMの |
| EGTA | 0.75mmの | - | - | 0.5mMの |
| グルコース | 10 mMの | 10 mMの | - | - |
| グルタチオン | 2mMの | 2mMの | - | 1mMの |
| CH 3 CSO 3 S * | - | - | - | 100mMの |
| TEACl | - | - | - | 10 mMの |
| ATP - Mgの | - | - | - | 10 mMの |
| GTP - Liの | - | - | - | 1mMの |
| Rpep - rhod ** | - | - | - | 5mMの |
| ボリューム | 200 mLの | 100mLの | 5μL | 100μL |
*セシウムメタン。
**リブアイ結合ペプチド:ローダミン+ EQTVPVDLSVARDR - COOH(MW 1997.75)。
ディスカッション
客観型全反射顕微鏡の利点は、1)それはそれによって焦点のずれた光を最小限に抑え、目的の焦点面内に狭い領域に励起光を制限することにより、優れた光学セクショニングを提供することであり、2)光が距離と共に指数関数的に低下するので、 、垂直方向の移動は、蛍光強度の変化としてモニターすることができる、高開口数の対物1,5〜3)効率的な集光。
技法の主な欠点は、それが電子?...
謝辞
この作品は、NIHのグラントEY 14990によってサポートされていました。
参考文献
- Axelrod, D. Total internal reflection fluorescence microscopy in cell biology. Traffic. 2, 764-774 (2001).
- Zenisek, D., Steyer, J. A., Almers, W. Transport, capture and exocytosis of single synaptic vesicles at active zones. Nature. 406, 849-854 (2000).
- Zenisek, D. Vesicle association and exocytosis at ribbon and extraribbon sites in retinal bipolar cell presynaptic terminals. Proc. Natl. Acad. Sci. U. S. A. 105, 4922-4927 (2008).
- Zenisek, D., Horst, N. K., Merrifield, C., Sterling, P., Matthews, G. Visualizing synaptic ribbons in the living cell. J. Neurosci. 24, 9752-9759 (2004).
- Axelrod, D. Selective imaging of surface fluorescence with very high aperture microscope objectives. J. Biomed. Opt. 6, 6-13 (2001).
- Rouze, N. C., Schwartz, E. A. Continous and transient vesicle cycling at a ribbon synapse. J. Neurosci. 18, 8614-8624 (1998).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved