このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
の蛍光標識ショウジョウバエハートの構造
要約
ここでは、幼虫および成体から心臓管の様々な要素の蛍光標識するための基本的なプロトコルを記述するキイロショウジョウバエ。これらの標本は、蛍光または共焦点顕微鏡を介して画像処理に適しています。この手法は、強力なモデル生物からの心の機能の詳細な構造解析を可能にします。
要約
市販
プロトコル
あなたが始める前に
- 以下のソリューションを準備します。
- リラックスバッファー(10 mM EGTAを含む人工的なショウジョウバエの体液(ADH)(" ショウジョウバエの心臓の鼓動を可視化する"を参照))
- 固定液(1 × PBS中4%ホルムアルデヒド)
- PBSTx(PBS、0.1%トリトン- X - 100を含む)
- PBSTxで適切に希釈した一次および種特異的蛍光標識二次抗体
- 心臓の管(大人ハエおよび/ または幼虫の)次のことを公開するショウジョウバエを解剖する
- " ショウジョウバエの心臓の鼓動を可視化"のセミ無傷ショウジョウバエの心臓標本のプロトコル、または
- 次の変更とショウジョウバエの幼虫NMJ解剖プロトコル 1:使用すると、幼虫の解剖時にADHを酸素化し、腹側正中線から少し後ピンに置き換える。幼虫は腹側正中線に沿って切断されています。固定前に任意の組織を削除しないでください。
蛍光染色
- すべての心がリズミカルに酸素ADHに拍動していることを確認してください。すぐにリラックスできるバッファとADHを交換してください。収縮が抑制されるようにそれぞれの心臓のチューブを調べます。
- 固定液でリラックスしたバッファを置き換えることによって、心を修正。穏やかに振盪しながら室温で20分間インキュベートする。 (幼虫の準備の揺れには任意のステップで必要ではない、と心臓組織の整合性に悪影響を及ぼすと考えられる)。
- 継続的に振とうしながら室温で試料をPBSTxで10分間3回洗浄する。
- 大人のための、慎重に戻ってどのような残っていることがより楕円と少ない丸みになるような腹部のクチクラの腹側縁をトリミング。さらに、腹部と胸部の間にシングルカット、慎重にそしてきれいに別体のセグメントの両方とで心臓の前方領域に最小限のダメージを確認してください。幼虫の心のために、慎重に微細な鉗子を用いて体脂肪を取り除く。幼虫の心臓が特に壊れやすいので、他の筋肉や結合組織からはほとんどサポートしているので、脂肪除去は、細心の注意を払って実行する必要があります。これは心臓に損傷を与える可能性があるとして、気管枝を削除しないでください。
- PBSTxで希釈した一次抗体の50〜100μlを含むウェルの96ウェルプレートに、中心部に位置する心臓のチューブとの接触を避け、エッジで腹部クチクラのトリミング背部を転送します。ウェルあたり12以上の試料を置きます。継続的に攪拌しながら2時間室温でインキュベートする。インキュベーションをさらに4℃で一晩行うことができます℃の
- 一次抗体溶液を除去します。継続的に撹拌しながら室温で100μlのPBSTxで10分のために心を3回洗浄する。
- 最後の洗浄緩衝液の除去に続いて、Alexa594 -ファロイジン(1:1000)を添加したPBSTxの二次抗体を100μlを、追加してください。室温で継続的に振とうしながら一時間インキュベートする。漂白蛍光団を防ぐためにカバーのサンプルを保管してください。
- 二次インキュベーションに続いて、継続的に振とうしながら室温でPBSTx 100μlの10分のために心を3回洗浄する。洗浄ステップを通してカバーのサンプルを保管してください。
- トリトン- X - 100の除去については、10分間PBSを100μlの心の最後の時間をすすいでください。標本は、マウントする前に数日間、4℃で暗所に保存することができます。
アダルトハーツのために取り付け
- Vectashieldマウンティング培地の10μlを、顕微鏡のスライドに2つの18 × 18 mmのカバーガラスを付着する。カバースリップは〜10〜15ミリメートル離れて配置されるべきである。で、間に2つのカバースリップメディアをマウントするの小規模な3番目のドロップを置きます。
- 第三カバーの中央にVectashield20μlを置きます。
- 注意深くクチクラの極端な端をPBSの洗浄溶液から心のそれぞれを削除し、ゆっくりと第三カバースリップで封入剤のドロップにドラッグ心臓側を下に置きます。カバースリップ上のドロップあたり5つまで心を置きます。
- すべての心が下向きにしていることを確認するために顕微鏡下で確認してください。
- 慎重に心を含んでいるカバーを反転し、すぐにそのようなカバーガラスのペアの間にVectashieldの液滴と心臓の管が付いている液滴は、ヒューズそのカバースリップのペアを含むスライドの上に置きます。 "ブリッジは"カバースリップによって形成されるべきである。心は、カバースリップと顕微鏡用スライドの間で中断されます。
- 心は今上向きに直面していることを保証するために顕微鏡下で確認してください。
- マニキュアとの縁でカバーグラスを修正。
- 心は今蛍光または共焦点顕微鏡を介してイメージを作成する準備が整いました。
幼虫ハーツのために取付
- 顕微鏡スライド上にドロップ(〜20μl)のVectashieldを置きます。
- 慎重にタングステン針を使用してダウンVectashieldと向きそれらの背側に2つの幼生の標本まで転送する。
- 個別に封入剤から標本をドラッグし、並行してそれぞれの位置を合わせます。
- 試料の両側にカバースリップを配置。鉗子を使用して、後部カバースリップ上の1つの側面を敷設し、そのためのブリッジを形成する前カバースリップにそれを下に下げることによって、最初にトップのサードカバースリップを配置。毛管力は、幼虫の心臓の適切な配置を支援する後方から前方へVectashieldの流れが発生します。
- マニキュアで、その縁で、場所にすべてのカバースリップを修正し、慎重に20から30μlをVectashieldとカバーグラスの間にスペースを埋める。
- 4でマニキュアとストアを持つシール° C、または-20℃で長期保存のための
代表的な結果
正しく実行されると、背脈管のすべてのコンポーネントと関連付けられている組織はそのまま残り、容易に可視化する必要があります。バックグラウンド蛍光は最小限に抑えてください。大人、非常によく腹側縦筋層の汚れのため、実質的な信号(図1および図2)を生成します。根底にある円形の心筋細胞は、しかし、上を覆う腹側層と強烈な信号として生成することではない傾向がある。成人の心臓の前"円錐室"の心筋細胞は収縮物質の相当量が含まれており、その結果、この地域は、心臓の管の残りの部分に最も堅牢な相対として表示されます。幼虫の心臓は大人の収縮心筋細胞(図3)と同様のスパイラル筋原繊維の配置を示しています。
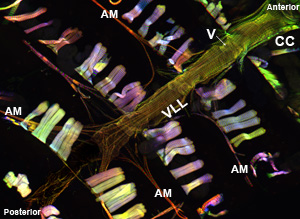
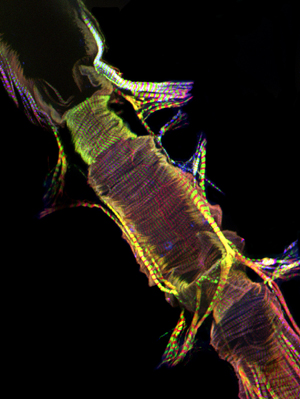
図1:トップ。ミオシン- GFPを発現し、成人キイロショウジョウバエの全心臓のチューブを示す蛍光顕微鏡写真。イメージが余線分スライドモジュールを搭載したツァイスイメージャZ1蛍光顕微鏡で撮影されました。ミオシン- GFPは緑色で示され、アクチンがAlexaFluor ® 594ファロイジン(赤色)とα-アクチニンで染色され、抗α-アクチニン抗体(青)で標識されている。調製手順がよく保存された構造を持つ心臓サンプルの回収を可能に注意してください。 CC =円錐形の容器、AM =翼の筋肉、V =内部バルブ、VLL =腹側縦筋層。ボトム。ちょうど収縮心筋のスパイラル筋原線維の構成を示す腹側長手方向の層の下にある心臓の3番目の腹部のセグメントを介してCCから成人の心臓管の領域。してくださいここをクリックして 、図1aの拡大版のため、およびここで 、図1bの拡大のために
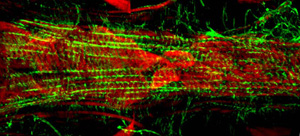
図2:AlexaFluor ® 594ファロイジン(赤色)と抗Pericardin(コラーゲンタイプIV)(緑)抗体で染色された成人の心臓の前方部分の代表的な共焦点スタック。 Pericardinはおそらく腹側筋層の長手方向に指向筋原線維に由来する、腹側表面に沿って心臓に関連付けられています。してくださいここをクリックして図2の拡大バージョンのために。

図3:三段階ショウジョウバエの幼虫の適切な心のセグメントA7の蛍光顕微鏡写真。イメージが余線分スライドモジュールを搭載したツァイスイメージャZ1蛍光顕微鏡で撮影されました。アクチンがAlexaFluor ® 594ファロイジン(緑色)とα-アクチニンで標識され、抗α-アクチニン抗体(赤)で染色される。してくださいここをクリックして図3の拡大バージョンのために。
ディスカッション
ここでは、 キイロショウジョウバエの背の容器と蛍光または共焦点顕微鏡を介してイメージングのための関連する組織を準備し、染色のための有用なプロトコルを提示。私達はによって洗練されたと一般的に幼虫と成体ショウジョウバエの心臓管の in situイメージングでよく解決を可能にする効果的な染色のために私たちの研究室で用いられる手順の簡潔なアカウ?...
謝辞
著者は、この原稿の準備に関する重要な読書と有益な提案のためにSIバーンスタイン(サンディエゴ州立大学)を感謝。この作品は、SIバーンスタイン、SDSU、へとR. Bodmer、BIMRにNIHの補助金によって支えられて、とアメリカ心臓協会の西部米国アフィリエイトからG.フォーグラーへとA. Cammaratoにポストドクトラルフェローシップによる。
資料
| Name | Company | Catalog Number | Comments | |
| Ethylene glycol-bis (2-amino-ethylether) -N,N,N’,N’-tetra-acetic acid (EGTA) | Reagent | Sigma-Aldrich | E4378 | |
| Formaldehyde, 10%, methanol free, Ultra Pure | Reagent | Polysciences, Inc. | 50-00-0 | |
| Triton-X-100 | Reagent | Sigma-Aldrich | 9002-93-1 | |
| Alexa Fluor® 594 phalloidin | Reagent | Invitrogen | A12381 | |
| Vectashield® Mounting Medium for Fluorescence with DAPI | Reagent | Vector Laboratories | H-1200 | |
| Tungsten pins | Reagent | Fine Science Tools | 26002-10 | |
| Pin holder | Reagent | Fine Science Tools | 26018-17 |
参考文献
- Brent, J. R., Werner, K. M., McCabe, B. D. Drosophila larval NMJ dissection. J Vis Exp. , (2009).
- Molina, M. R., Cripps, R. M. Ostia, the inflow tracts of the Drosophila heart, develop from a genetically distinct subset of cardial cells. Mech Dev. 1, 51-59 (2001).
- Dulcis, D., Levine, R. B. Glutamatergic innervation of the heart initiates retrograde contractions in adult Drosophila melanogaster. J Neurosci. 2, 271-280 (2005).
- Zeitouni, B. Signalling pathways involved in adult heart formation revealed by gene expression profiling in Drosophila. PLoS Genet. 10, 1907-1921 (2007).
- Robertson, C. W. The metamorphosis of Drosophila melanogaster, including an accurately timed account of the principal morphological change. J. Morphol. 2, 351-399 (1936).
- Miller, A. . The internal anatomy and histology of the imago of Drosophila melanogaster. , (1950).
- Rizki, T. M. The circulatory system and associated cells and tissues. , (1978).
- Cammarato, A. Myosin transducer mutations differentially affect motor function, myofibril structure, and the performance of skeletal and cardiac muscles. Mol Biol Cell. 2, 553-562 (2008).
- Taghli-Lamallem, O. Dystrophin deficiency in Drosophila reduces lifespan and causes a dilated cardiomyopathy phenotype. Aging Cell. 2, 237-249 (2008).
- Kelso, R. J. a database documenting a GFP protein-trap insertion screen in Drosophila melanogaster. Nucleic Acids Res. 32, D418-D420 (2004).
- Dietzl, G. A genome-wide transgenic RNAi library for conditional gene inactivation in Drosophila. Nature. 7150, 151-156 (2007).
- Mery, A. The Drosophila muscle LIM protein, Mlp84B, is essential for cardiac function. J Exp Biol. 211, 15-23 (2008).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved