このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
閉塞性気道疾患の発生研究のモデルとして使用されるマウスにおける異所性と同所性気管移植
要約
このビデオでは、マウスでは閉塞性気道疾患(OAD)の開発を研究するには、2つの実験モデル、異所および同所性気管移植モデルを示し、比較します。
要約
閉塞性気道疾患(OAD)が長期生存(1-7)を制限する肺移植後の主要な合併症である。
病態生理学を研究するために、げっ歯類における気管移植のOAD、さまざまな動物モデルの治療と予防は、(1-7)が開発されている。ここで、我々は気管移植、異所性と同所性モデルの確立された2つのモデルを使用し、その利点と限界を示しています。
異所性モデルの場合は、気管が受信者の大網にラップされているドナーは、ドナーに対し、気管は、同所性モデルにおけるエンドツーエンドの吻合によって吻合される。
両方のモデルでは、臨床OADに似た組織学的閉塞性病変の発生は、(1-7)実証されている。
このビデオは両方を実行する方法を示し、異所性だけでなく、同所性気管移植のテクニックマウスで、とは、組織を使用して、両方のモデルでOAD開発の時間経過を比較します。
プロトコル
- 雄BALB / cマウス(8-12週)はチャールズリバー研究所(Sulzfeld、ドイツ)から購入されています。マウスは通常の条件、飼育、標準のマウスの食物と水を自由の下に収容されています。
- 2%のIsofluranは麻酔に使用されます。
ドナーの調製
- 腹部の毛を剃るとbetaisodonaを使用して領域を消毒する。
- 顕微鏡視野の下で、喉頭のレベルから胸骨に正中頸部切開を行います。
- 気管のクリアな視界を得るために皮下脂肪とストラップの筋肉を取り外します。
- 食道、神経、動脈、及び結合組織のように、あらゆる周囲の組織から気管を細かく分析。
- 全体気管を(喉頭から分岐まで)を取り外します。
- 冷たい生理食塩水で移植をフラッシュし、4でグラフト℃にて保存してください。
- ドナーは、気管の収穫後の頚椎脱臼により安楽死されています。
RECIPIENT:異種移植
- 切開部位周辺の広いマージンで腹部の毛を剃るとbetaisodona(betadine)を用いて3回はアルコールが続くエリアを消毒する。目が乾燥から角膜を防ぐために、眼軟膏の製品で潤滑する必要があります。
- 中央開腹を行い、滅菌、moistured手袋の中に腸を置きます。
- 慎重に大網を広げる。中央に移植片を置き、8から0(Prolene、エチコン、ドイツ)を使用して単一の縫合糸でそれを凝視する。
- 完全に大網を移植をカバーし、一つの縫合8から0(Prolene、エチコン、ドイツ)と移植片を修正。
- 腹部に戻して腸を再配置し、閉鎖する前に暖かい、滅菌生理食塩水で洗い流してください。
- 2層でクローズアップ - 筋肉と皮膚のための7から0 Vicrylための7から0 Proleneを使用して連続的なパターンと腹壁と皮膚の層。
RECIPIENT:同所移植
- 切開部位周辺の広いマージンで腹部の毛を剃るとbetaisodona(betadine)を用いて3回はアルコールが続くエリアを消毒する。目が乾燥から角膜を防ぐために、眼軟膏の製品で潤滑する必要があります。
- 全体喉頭複雑を視覚化するためにストラップの筋肉を分ける。
- 慎重に、周囲の組織から気管を解剖反回神経を維持するように注意してください。
- 輪状軟骨から尾側気管3つのリングを分ける。動物は気管切開を介して生理的な呼吸を維持します。
- 受信者のほか、移植片のクリーン気管エッジを確認してください。
- 移植片は、解剖学的極性を維持するために欠陥気管と志向受信者との間に介在している。
- 吻合する遠位(縦隔)気管とドナーの移植片は(Prolene、エチコン、ドイツ)8から0を使用する。吻合の後面は、連続運転方式で実行されます。前面は中断ステッチを使用して完了します。
- 気道からの分泌物を除去する。
- 近位吻合は、遠位のものと同じ方法で完了します。
- 気道と十分な、自発呼吸の整合性を確認してください。
- ストラップの筋肉を再配置し、連続的なパターンで6から0縫合(Vicryl、エチコン、ドイツ)を使用して皮下組織と皮膚の層を閉じます。
- 受信者のために注射麻酔を使用して、そのため動物は気管を介して生理的な呼吸を保持します。それぞれプロポフォール、メデトミジンとフェンタニルの75/1/0.2 mg / kgの組み合わせは、、マウスでIP麻酔に使用されます。
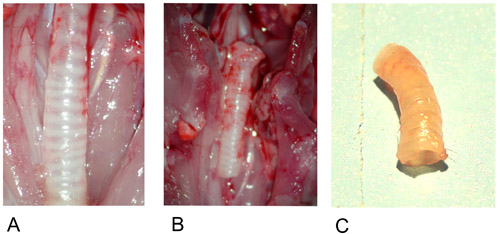
図1:ドナー気管。
1A:調製後のin situドナー気管。
1B:摘出ドナー気管。
1C:植後のドナー気管。
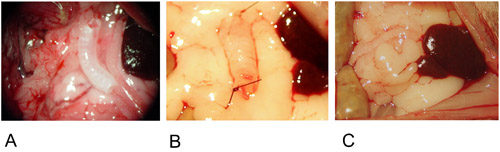
図2:異所性モデル。
2A:移植片は、大網の中心に位置しています。
2B:移植片は、単一の縫合糸の両端に固定されている。
2C:移植片を大網に包まれ、一針の縫合で固定されている。
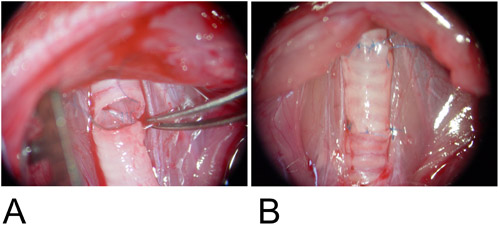
図3:同所性モデル。
3A:移植片がレシピエント気管欠陥と後壁との間に介在され、連続的な実行方法で吻合される。
3B:前壁が単一の縫合糸を使用して完了する。
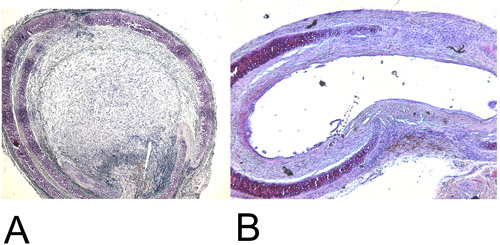
図4:組織学。
4A:H + E STAで28日後に回収された異所性移植気管ining(15倍)。 100パーセント内腔の閉塞に注意してください。
4Bは:H + E染色(15倍)で60日後に同所性移植気管を回復した。最大達成管腔閉塞は約45%です。
| 異所性気管移植モデル | 同所性気管移植モデル | |
| 利点 | 実行するには+が簡単 28日後に完全な気道閉塞と+腔内閉塞 OADによる動物の+は物理的な愛情なし | 移植片の+物理換気 可能+吸入薬の投与 このようなalloreactive IgM抗体の産生など、+強力な免疫反応 +生理胸部環境 +気管 - 気管吻合は、臨床の現場を模したもの |
| 欠点 | - 移植気管のない換気 - 吸入病原体のない評価が可能 - 粘液線毛クリアランスや保持分泌の阻害 - 腹膜微小環境の代わりに胸部環境 | - 必要な外科研修 - 管腔の閉塞アプリと腔内閉塞。 60日後の45パーセント - 動物は、OADの症状を発症することが |
表1:異所性と同所性気管移植の長所と短所。
ディスカッション
マウスは別のtransgeneicとノックアウトモデルで提供され、OAD(4)に関連する機械的な問題を研究することが適しています。
このビデオに示されている気管移植の両方のモデルは、OADの開発を研究するための信頼性の高いモデルとして使用することができます。
しかし、各モデルには長所と限界を示しています。
異所性気管移植が容易に実行できま...
開示事項
ソーニャSchrepferは、ドイツ学術振興協会(DFG)(SCHR992/3-1)から研究助成を受けています。]
すべての動物は、動物実験は医学研究とによって公開実験動物の管理と利用のためのガイドのための国立協会が定めるガイドラインおよび規制に準拠して行われた、実験動物のケアの原則に準拠して人間のケアを受け国立衛生研究所(厚生出版物85から23の国立研究所、1985年改訂)。
すべての動物は、チャールズリバーラボラトリーズ(Sulzfeld、ドイツ)から入手し、大学病院ハンブルクエッペンドルフの動物医療施設で維持した。動物は、標準の固形飼料と水を自由に摂取を受けた。
謝辞
著者らは、クリスティPahrmannを(Lab Managerの)感謝。
参考文献
- Adams, B., Berry, G., Huang, X., Shorthouse, R., Brazelton, T., Morris, R. Immunosuppressive therapies for the prevention and treatment of obliterative airway disease in heterotopic rat trachea allografts. Transplantation. 69, 2260-2266 .
- Adams, B., Brazelton, T., Berry, G., Morris, R. The role of respiratory epithelium in a rat model of obliterative airway disease. Transplantation. 69, 661-665 .
- Deuse, T., Schrepfer, S., Reichenspurner, H., Hoyt, G., Fischbein, M., Robbins, R., Pelletier, M. Techniques for experimental heterotopic and orthotopic tracheal transplantations – when to use which model; Transplant Immunology 17. , 255-261 (2007).
- Hele, D., Yacoub, M., Belvisi, M. The heterotopic tracheal allograft as an animal model of obliterative bronchiolitis. Respiratory Research. 2, 169-183 .
- Hertz, M., Jessurun, J., King, M., Savic, S., Murray, J. Reproduction of the obliterative bronchiolitis lesion after heterotopic transplantation of mouse airways. American Journal of Pathology. 142, (1993).
- McDyer, J. Human and murine obliterative bronchiolitis in transplant. Proceedings of the American Thoracic Society. 4, 37-43 .
- Schrepfer, S., Deuse, T., Hoyt, G., Sheikh, A., Hoffmann, J., Reichenspurner, H., Robbins, R., Pelletier, M. Experimental orthotopic tracheal transplantation: the stanford technique. Microsurgery. 27, 187-189 (2007).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved