このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
生体のような器官型マウス網膜Wholemountの文化で
要約
このビデオの記事では、器官型網膜wholemount文化や外因性誘導効果の分析のためのサイトスピン手順の確立を示しています。器官型網膜wholemount文化模倣体 in vivoで状況と古典的なマウスの動物モデルの欠点を回避しながら大幅に実験操作のためのマウス網膜のアクセシビリティを促進する。
要約
動物モデルの遺伝子と分析の対象とアブレーションは、入学する特定の網膜遺伝子機能のための古典的な戦略です。しかしながら、トランスジェニックは、網膜特異的またはコンディショナルノックアウトマウスモデルは、しばしば早期致死を表示したり、胎児や出生後早期の段階を超えて解析を防止する、深刻な奇形に苦しんでいます。
初代培養細胞は、外因的に適用される組換え因子、制御された環境での遺伝子やsiRNAによる遺伝子ノックダウンの過剰発現の影響を調べるための代替です。解離細胞の培養は、それによって薬理学的操作の後に外生的にトリガーの効果の識別を容易に、標的細胞に到達する内因性信号が低下するという利点があります。しかし、重要な細胞間相互作用は、最初に再集計されたretinospheroid文化1が使用されている場合でも、酵素消化または機械的な解離によって破壊されています。
これとは対照的に、器官型網膜wholemount文化が神経細胞の相互作用との接続はまだ保持さ2〜5で生体状況に近い生理的にシステムを提供しています。
このビデオの記事では、胚、生後および成体マウスの目の解剖の特殊性と神経の分析のため(2)解離とサイトスピン手順を含む器官網膜wholemountの文化のようなin vivoでの(1)設立のステップのデモンストレーションでステップを提供するアポトーシスと外因的に適用される組換え因子の存在下で培養した後、例えば器官wholemountsにおける網膜細胞の増殖、。
プロトコル
すべての機器および試薬は、滅菌購入する必要がありますまたは熱または蒸気滅菌または70%エタノールで滅菌する必要があります。
動物実験は動物実験で定められている実験的な手続きと規制のための動物の管理と使用に関するNIHのガイドラインに従って、欧州共同体理事会指令(86/609/EEC)に準拠して行われたという著者らの状態ケアとデュースブルク - エッセン大学(ドイツ)での委員会(IACUC)を使用してください。
パート1:異なる発達段階のマウスの目の核出術
胚の眼の摘出
- 時間妊娠交配が設定され、膣栓が女性の交配で検出される日の朝は、妊娠0日を指定されます。
- とワックス基板6上に固定されて:胚の開発が必要な段階(日胚(E)15ここでの)に達したときに妊娠した女性は、頸椎脱臼により屠殺された。
- 腹壁を正中線に沿って切断し、皮膚フラップはピン6で横方向に固定され、70%エタノールで湿らされています。
- uterussesは切り離さと冷PBS 6のビーカーに移し、腹部から削除されます。
- 胚を分離し、ペトリ皿と子宮の壁に転送し、胚の膜を鉗子6の使用で慎重に除去されています。
- 胚は、斬首によって殺される。
- 眼は眼窩から目を"剥離"、罰金、湾曲鉗子の使用となる摘出されています。
出生後と大人の目の摘出
- 若い仔は、頚椎脱臼により斬首、古い子犬や大人に殺されている。
- 最大出生後の段階P15に、マウスは、彼らの目を開く時のポイント、目のスリットは、機械的に鉗子を使用して開かれ、春のはさみとまぶたの二つ横カットを拡大する必要があります。
- 目が軌道に圧力をかけて、湾曲鉗子の助けによって摘出されています。
注:、軌道の骨はまだ軟骨な生後2日目の時点で、それは目を削除しようとしたときに過剰な圧力を適用しないことが重要である。
これとは対照的に、成体マウスでは、軌道骨は会社です。このように、目を摘出するためには、事前に目のスリットを大きくすることなく軌道への圧力を適用するのに十分です。
パート2:胚、生後および成体マウスの網膜の解剖
網膜の解剖
- 目は、滅菌PBSと周囲の目の層を持つ小型のペトリ皿に置かれている解剖顕微鏡下で除去されています。
- 外側の目のレイヤーを削除するには、出生後の段階と大人の目には視神経はできるだけ基礎の近くに鉗子で春のハサミやピンチオフの助けによって切断する必要があります。
- 視神経が最初に格納されていた穴の裏面が手前になるように、目を回す。視神経が目の層を貫通サイトから2つの非常に微細な鉗子の先端と網膜と色素上皮の間に網膜下腔を入力してください。
注:通常、色素上皮が容易にその暗い色によって識別することができます。一部のマウス変異株では - 特にアルビノの動物で - この色素層はしかし、着色ができない場合がありますので、容易に検出することがあります。 - 慎重に、両方の鉗子でいずれかの側に切断すると、添付脈絡膜と強膜と色素上皮を削除します。
- 他の鉗子で、残りの網膜のカップを保持しながら、アップ角膜のレベルまでの層を剥がし、その後、レンズ側にアイカップをオンにし、色素上皮、脈絡膜と強膜と一緒に角膜を削除します。
- 小さなレンズと一緒に硝子体をつかみ、ピンセットで涙ながら、第二鉗子と場所で網膜wholemountを保つ。
注:胚の目を解剖すると、完全に硝子体と一緒に硝子体の下三角、テントのような毛細血管叢を除去することを確認してください。
大人の目では、硝子体は、側面で把握する必要があるとケアは、その内容がその削除を妨げ、鉗子の粘性とムチそのまま鉗子の先端ではなくピアス硝子体に取られる必要があります。 - 器官wholemount文化のために網膜のカップは、200μlのダルベッコ改変イーグル培地(下記参照)を含む96ウェルプレートに収集されます。
注:個々の網膜の解剖の間に、培地のpHは炭酸系を介してCO 2によってトリガされるようにインキュベーター中の培地を含む96ウェルコレクションプレートを維持する。
パート3:マウス器官網膜wholemount文化
- 重み7.8グラムダルベッコ改変イーグル培地/栄養混合物F - 12 HAM(DMEM)と0.6グラムのNaHCO 3とMiIliQ水の両方を溶解して500mlの文化を準備します。 7.15にpHを調整する。ボンネットの下、および2.5ミリリットルgentamicine(200 mM)を、50μlの亜セレン酸ナトリウム(株式::52μg/ml)、プロゲステロン(60μg/ml株式):50mgのアポtransferin、50μlのputrescin(60mg/mlストック)を追加します。ボトルトップフィルタを介して混在させるとフィルタ。使い方は、ml培養液あたり10μlをグルタミン(200mMの)を追加する直前。
注:インスリンが効果を打ち消すので、これ血清およびインスリンを含まない培地は2週間までに4℃で保存し、アポトーシス誘導の実験に使用することができます。 24時間よりも長いためwholemountsのインキュベーションが望まれると細胞死の率が評価されない場合、血清インスリン(例えばウシ胎児血清、FCS)やサプリメントは、生存率を改善するために追加する必要があります。 - 文化を開始する前に、網膜wholemountsは37℃で15分間プレインキュベートされている-10 M llerのグリア細胞の内側と外側の境界膜を含むヒアルロニダーゼを事前に消化するために0.5mg/mlヒアルロニダーゼを含む200μlの暖かい、pHのバランスDMEMとCセル、外生的に適用される物質の促進浸透。
- 網膜は、2ミリリットル化学的に定義されたダルベッコ改変イーグル培地中の可能性や器官wholemountsとして培養と同様にいくつかのヒアルロニダーゼで24穴プレートに転送されます。
注:網膜を転送するには、1ミリリットルピペットを使用し、開口部を広げるためにピペットの先端を数ミリを切る。胚の眼の場合は、200μlのピペットチップで十分です。刃第二ピペットチップの挿入やねじれによって平滑化されるべきである。
24〜48時間の短期培養のため、すべての手順がベンチで行うことができますが、文化の汚染が問題であることが判明した場合、一つはフードの下で動作するはずです。 - 37 5%CO 2雰囲気における° Cで48時間、組換えの要因と薬理学的処理を施して例えば-の文化は24のために維持されます。
第4部:培養網膜wholemountsの解離
- 希望の培養時間の後、網膜を850μlのPBSと50μlのウシ血清アルブミン(、30 mg / mlのBSA)を含む丸底で2ミリリットルのエッペンドルフチューブに回収されています。
- 37℃まで加熱加熱ブロック、℃に網膜をエッペンドルフチューブをセット
- 各エッペンドルフチューブに25μlのコラゲナーゼ(200 U / ml)および25μlのヒアルロニダーゼ(20mg/ml)を追加し、シリコナイズパスツールピペットを介して3つのパスで単一の細胞懸濁液中に網膜を解離開始。
- 10μlのトリプシン(1mg/ml)を追加し、3〜5分間待ってから、徐々に機械的に組織を解離するためにシリコン処理パスツールピペットで上下に3-5回ピペッティング。
- 10μlのDNase Iを(5mg/ml)を追加し、もう一度ゆっくりシリコナイズパスツールピペットで上下に3-5回ピペッティング、3〜5分間待ちます。
注:酵素的解離のためのインキュベーション時間は様々で、それぞれ、目の大きさや発達段階に依存します。優しく上下にピペッティングして組織の酵素消化の段階を確認してください。 - 細胞懸濁液は今では均質ではないが、依然として大きな細胞凝集体が含まれている場合は、追加の10μlのトリプシンおよび10μlのDNase Iを加える
- 細胞懸濁液が均質である場合、組織の消化が10μlのEDTA(0.5 M)の添加により停止されている、エッペンドルフチューブをヒーターから削除され、細胞懸濁液1ミリリットル新鮮な、氷冷8%パラホルムアルデヒドを添加することによって1時間は固定されている(PFA)回転シェーカー上で室温で。
パート5:解離細胞懸濁液の洗浄
- 細胞懸濁液は、° Cと0.2 rcfで冷却遠心機で4℃で5分間遠心分離されています。
- 上清を捨て、ペレットを1ミリリットルを含むPBS 3mg/ml BSAに再懸濁されている。
- 回これらの洗浄工程を繰り返した後、ペレットを最終的に3mg/ml BSA、5mMのEDTAおよび0.1%アジ化ナトリウムを含む500μlのPBSに再懸濁されている。
注:ナトリウムの酸の添加は、4で数日間℃で細胞懸濁液の貯蔵を可能にするしかし、免疫細胞化学的染色が続く場合、染色質の損失でこの結果として、再懸濁バッファーにナトリウムの酸を追加しないでください。
パート6:定量的なアポトーシスと増殖の解析のための細胞懸濁液のサイトスピン
- 1つまたは2つの穴とサイトスピン漏斗付きつや消しエンドの顕微鏡スライド、サイトスピンフィルタがサイトスピンスライドクリップに挿入されます。スライドクリップが閉じられ、サイトスピンのローターに配置される。
- 解離細胞懸濁液を穏やかにピペッティングでホモジナイズする。
注:網膜の発達段階に応じて、解離の手順から細胞懸濁液が必要になる場合があります細胞の可算数を取得するためにPBSで希釈する。 - 細胞懸濁液のアリコート(100μl)をサイトスピン漏斗に適用されます。
注:漏斗に細胞懸濁液をピペッティングする際、ピペットの先端は漏斗の底にすべての方法を下に到達する必要があります。これはサイトスピンした後、セルスポットに見えるように空気の泡を、作成し、細胞数を妨げるようピペットの第2の圧力ポイントを介してプッシュすることが重要です。 - 細胞懸濁液は、7分間、700 rpmでスライド上にスポットされています。
- 蛍光マウンティング培地でマウントされて、、アポトーシスレベルの外因的に適用される要因の効果の判定のために細胞を4'、6 - ジアミジノ-2 - フェニル(2μg/mlDAPI)で染色することができます。細胞のアポトーシスの変化は、サイトスピン細胞のスポットで、少なくとも1000個の細胞を(少なくとも10 pycnotic核を含む)カウントし、細胞の死亡率は全細胞の割合として計算される3,4を数えることによって決定することができます。
注 :別の方法として、アポトーシス核の分布はTDT -媒介dUTPニック末端標識(TUNEL)により培養網膜wholemountsのflatmounts 3またはクライオスタットsections4で評価することができます。 - 文化とBrdUの取り込みの終了は、抗BrdU抗体(例えば、発達研究ハイブリドーマバンク、アイオワ州、米国)を用いて免疫組織化学的染色により、細胞ホモジネートのcytospinsで視覚化する前に細胞増殖の検出のために、BrdUは(5μM)6H追加することができます。
- 異なる網膜細胞型に対する治療の効果はBrn3a(神経節細胞のマーカー)またはオプシン(視細胞マーカー)およびDAPIで対比染色のようなニューロンに特異的な抗体によってcytospinsで可視化することができる。
パート7:代表的な結果
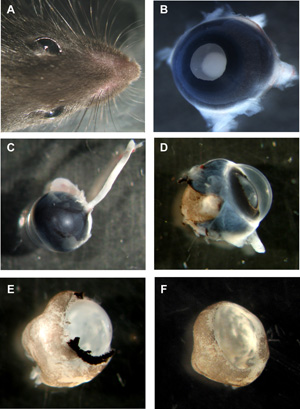
図1:マウスの器官型網膜wholemountsの準備のステップ
と両眼を持つマウスの頭部。アップレンズ面とBネズミ目、まだ場所ですべてのレイヤー。視神経と裏面からCマウスの目はまだ接続されている。強膜と色素上皮部分的に削除されたとDネズミの目が。Eマウス網膜角膜、強膜と色素上皮は完全に削除されますが、まだ場所でのレンズと硝子体は、レンズと硝子体とFマウス網膜wholemountカップ除去。してくださいここをクリックして図1の拡大バージョンを参照すること。
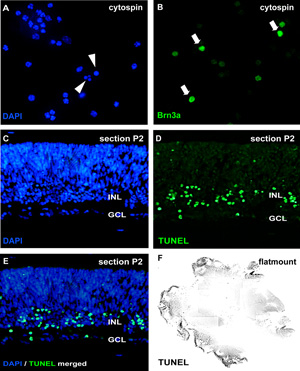
図2:サイトスピンやセクションによって器官網膜wholemount文化の分析
アポトーシスの分析については、解離細胞懸濁液のcytospinsはDAPIとpycnotic核で染色される核の断片化やクロマチンの凝縮(の矢印 )で区別することができます。また、wholemountセクション(CE;マウス網膜生後(P)2)や網膜flatmount(F)は、TUNELアッセイに供し、DAPI(E)で対比染色することができます。異なる網膜細胞型に対する治療の効果は、神経節細胞マーカーBrn3a(Bの矢印 )のようなニューロンに特異的な抗体によってcytospinsで可視化することができるGCL、神経節細胞層;。INL、将来の内顆粒層。してくださいここをクリックして図2の拡大バージョンを参照すること。
ディスカッション
解離、単分子層以上のマウス器官網膜wholemount文化2-5、retinospheroidまたは再集計された3D回転楕円体の培養神経細胞の相互作用との接続の保全1嘘、の利点は 、in vivo の状況で模倣した。旧レポート2〜比較して、私たちのビデオの記事では、網膜を損傷することなく、マウスの目とレンズと硝子体の除去を含む、さまざまな発育段階の網膜の解剖摘出...
謝辞
著者は、技術支援のための器官培養およびU. LaubとU.ゲルスターの設立と初期支援のためにE.デラロサとAI Valencianoに感謝します。
資料
| Name | Company | Catalog Number | Comments | |
| Mice | Animal | Charles River Laboratories | ||
| Dissection microscope | Tool | Carl Zeiss, Inc. | ||
| PBS | Reagent | Sigma-Aldrich | PBS should be cold (> 4°C) and sterile | |
| Dulbecco`s modified eagle`s medium / nutrient mixture F-12 Ham | Reagent | Sigma-Aldrich | D 8900 | DMEM / F-12 |
| Apo-transferin | Reagent | Sigma-Aldrich | T 1147 | |
| Putrescin | Reagent | Sigma-Aldrich | P 5780 | |
| Sodium selenite | Reagent | Sigma-Aldrich | S 9133 | |
| Progesterone | Reagent | Sigma-Aldrich | P 6149 | |
| Gentamicine | Reagent | Invitrogen | ||
| L-Glutamine | Reagent | Invitrogen | 25030-024 | 200 mM (100X), liquid |
| Bovine serum albumine (BSA) | Reagent | Carl Roth Gmbh | 8076.3 | 30 mg/ml |
| Collagenase | Reagent | Sigma-Aldrich | C 0773 | 200 U/ml |
| Trypsin | Reagent | Sigma-Aldrich | T4799 | From porcine pancreas; 1 mg/ml |
| Hyaluronidase | Reagent | Sigma-Aldrich | H 3884 | 200 mg/ml |
| DNase I | Reagent | Roche Group | 1 284 932 | 10 mg/ml |
| EDTA | Reagent | Sigma-Aldrich | E 6511 | |
| Silicone solution | Reagent | SERVA Electrophoresis | 35130 | |
| Paraformaldehyde (PFA) | Reagent | Sigma-Aldrich | P6148 | 8% PFA in 0.1M phosphate buffer (pH 7.4). |
| 4’,6-diamidino-2-phenylindole dihydrochloride | Reagent | Sigma-Aldrich | D 0542 | DAPI |
| Fluorescent Mounting Medium | Reagent | Dako | S3023 | |
| BrDU | Reagent | Sigma-Aldrich | B 9285 | |
| 96-well plates | Tool | Falcon BD | 3072 | |
| 24-well plates | Tool | Falcon BD | 3047 | |
| Pasteur pipettes | Tool | Brand GmbH | 747720 | |
| Forceps DUMONT #5 | Tool | Fine Science Tools | 11252-30 | bevelled very fine shanks (0.05 mm x 0.02 mm tip) |
| Forceps DUMONT #7 | Tool | Fine Science Tools | 11271-30 | curved shanks (0.07 mm x 0.10 mm tip) |
| Spring scissors,straight, 8cm | Tool | Fine Science Tools | 15000-00 | fine, small straight blades |
| Standard scissors, straight, sharp/blunt | Tool | Fine Science Tools | 14007-14 | Use for decapitation or cervical dislocation |
| Eppendorf tubes | Tool | Eppendorf | 2ml; round bottom for better precipitation of pellet during centrifugation /cytospin | |
| Cooling centrifuge | Tool | Eppendorf | ||
| Rotation shaker | Tool | CAT | ||
| Cytospin | Tool | Thermo Fisher Scientific, Inc. |
参考文献
- Rieke, M., Gottwald, E., Weibezahn, K. -. F., Layer, P. G. Tissue reconstruction in 3D-spheroids from rodent retina in a motion-free, bioreactor-based microstructure. Lab. Chip. 8, 2006-2213 (2008).
- Donovan, S. L., Dyer, M. A. Preparation and square wave electroporation of retinal explant cultures. Nature Protocols. 1, 2710-2718 (2006).
- Duenker, N., Valenciano, A. I., Franke, A., Hernandez-Sanchez, C., Dressel, R., Behrendt, M., de Pablo, F., Krieglstein, K., de la Rosa, E. J. Balance of pro-apoptotic transforming growth factor-beta and anti-apoptotic insulin effects in the control of cell death in the postnatal mouse retina. Eur. J. Neurosci. 22, 28-38 (2005).
- Franke, A. G., Gubbe, C., Beier, M., Duenker, N. Transforming growth factors beta and Bone morphogenetic proteins: Cooperative players in chick and murine programmed retinal cell death. J. Comp. Neurol. 495, 263-278 (2005).
- de la Rosa, E. J., Díaz, B., De Pablo, F. Organoculture of the chick embryonic neuroretina. Curr. Top. Dev. Biol. 36, 133-144 (1998).
- Dohle, D. S., Pasa, S. D., Gustmann, S., Laub, M., Wissler, J. H., Jennissen, H. P., Duenker, N. Chick ex ovo culture and ex ovo CAM assay: How it really works. J Vis Exp. 32, (2009).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved