このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
プラスミドDNAの組換えインフルエンザウイルスの生成
要約
プラスミドDNAからのインフルエンザウイルスの救助は、インフルエンザの研究者がインフルエンザウイルスの生物学のさまざまな側面を研究するために組換えウイルスを生成するために、そして潜在的なベクトルまたはワクチンとして使用することを可能にする基本的かつ本質的な実験的な手法です。
要約
インフルエンザ研究グループの数による努力はインフルエンザウイルスの逆遺伝学の発展と向上に極めて重要なされている。もともと1999年に設立さ
プロトコル
1。インフルエンザウイルスの救助のトランスフェクション
インフルエンザウイルスは、負の鎖RNAエンベロープウイルスのオルトミクソウイルス科のファミリーに属する。インフルエンザは、ウイルスゲノムは、少なくとも、11のウイルスタンパク質(図1)4をエンコードする負極性の8種類のRNAの遺伝子で構成されています。我々は(8インフルエンザA/PR/8/34ウイルスのセグメントを含むambisenseプラスミド(PDZ)を使用して最も一般的な実験室株、インフルエンザA/PR/8/34、5のうちの1つの救助に、このレポートでは、焦点を当てる図2)。
プラスミドDNAから組換えインフルエンザウイルスの救助のために、我々は、それぞれの組換えウイルスごとに3つの独立したトランスフェクションをお勧めします。複数の組換えウイルスの救助が試みられると、救出されるウイルスの数に一致して、次の手順を拡張する。以下のトランスフェクションと感染のプロトコルは、6ウェルプレートのために確立されます。プロトコルの概略図を図3に示します。
- OPTIMEM -リポフェクタミン2000(LPF2000)混合:OPTIMEMのメディアとトランスフェクションあたりLPF2000の6-8μlを250μlを準備。室温(RT)で5〜10分間インキュベートする。一方、プラスミドトランスフェクション混合物を準備する。
- プラスミドのトランスフェクション混合物:OPTIMEMメディアの50μlのプラスミドトランスフェクションのカクテルを準備。我々は通常、救助あたりのプラスミドを各インフルエンザのDNAの1μgを使用してください。 OPTIMEMメディア50μlを含むチューブに1 PDZプラスミドの溶液(1μg/μLの時)PB2、PB1、PA、HA、NP、NA、M、およびNSを追加。
- OPTIMEM - LPF2000 - DNAプラスミド混合物:インフルエンザのDNAプラスミドのトランスフェクション混合液(ステップ1.2)に、ステップ1.1から250μlを追加する。室温で20-30分のためにこの混合物をインキュベートする。一方、トランスフェクションのための293TとMDCK細胞の懸濁液を準備する。
- 293T/MDCK共培養の準備:開始する前に、37にPBS 1X、DMEM 10%FBS 1パーセントPSメディア、およびEDTA -トリプシンの混合物をもたらす℃に細胞の密度は80〜90%コンフルエントでトランスフェクションの日でなければなりません。通常は、293TとMDCK細胞の一つコンフルエント100 mmディッシュの一つコンフルエントな100 mmディッシュは、救助10月12日に使用することができます。私たちは、ウェルあたりの細胞の250μlを使用するつもりです。両方の細胞株をDMEM 10%FBS 1パーセントPSの3mlの合計に再懸濁される。
- 慎重に15 mlの遠心チューブでDMEM 10%FBS 1パーセントPSの10mlにそれぞれの細胞株を懸濁します。あなたは、293T細胞およびMDCK細胞用のチューブ用の管を持つことになります。
- DMEM 10%FBS 1パーセントPS 3mlに293T細胞を再懸濁し、再懸とき、それらの細胞を再懸濁するために、MDCK細胞に3 mlを実現。これは、あなたの共培養に使用される293TとMDCK細胞の混合物を与える。
- ウェルあたり293T/MDCK細胞(10-12 6ウェルウェル)250μlを添加する。
- RTのインキュベーション(ステップ1.3)20〜30分後、OPTIMEM - LPF2000 -インフルエンザのDNAプラスミド混合液にDMEM 10%FBS 1パーセントPSの1 mlを加える。
- 293T/MDCK細胞を250μl(ステップ1.4)でウェルに1.3ミリリットル(ステップ1.5)を追加します。
- 穏やかに6ウェルプレートを振とうし、℃、5%CO 2で37インキュベーターで一晩トランスフェクションインキュベートする(ON)ができます。
- 翌日、約16-24時間後にトランスフェクションは、トランスフェクションのメディアを変更し、48時間TPCK -トリプシンのの1μg/ mlを含むPS DMEM 0.3%BAに1%をトランスフェクションされた細胞をインキュベートする。
- メディアを変えるの48時間後に、マイクロ遠心チューブにトランスフェクションした細胞の上清を移す。
- 1〜2分、13,000 rpmの遠心で組織培養上清を遠心してください。
- 6ウェルプレート(前日に播種)またはステップ1.10〜遠心組織培養上清の200μlの10日齢の鶏孵化卵に新鮮なMDCK細胞に感染。 2〜3日で37細胞および/または卵° Cをインキュベートする。
- 10日齢の鶏孵化卵の感染:鶏孵化卵に感染するすべての手順は、無菌条件下で行われる。
- 気嚢と尿膜腔の間のインタフェースを確認するためにライトキャンドルボックスを使用して、10日齢の卵キャンドル。インタフェースの境界上で鉛筆のマークを付けます。
- 5 mlの注射針で卵殻に穴を開ける。
- 1mlのシリンジで、ステップ1.10〜組織培養上清の200μlで各卵に感染する。
- 綿棒を使用して、溶けたワックスと卵殻に穴をカバーする。
- 2〜3日間37οCで感染した卵をインキュベートする。
- 新鮮なMDCK細胞の感染:通過前日293T/MDCK共培養から組織培養上清、事前に皮をむくMDCK細胞を6ウェルプレートの料理翌日80-90%コンフルエントに到達する。通常、コンフルエントな100 mm組織培養プレートは6〜8ウェルに分割することができます。細胞を洗浄、二回、PBS 1Xで、トリプシン処理し、6ウェルプレートを準備。静かに細胞の均一な分布を持つために手でプレートを振る。文化のセル、ON、37℃インキュベーター、5%CO 2。感染する前に、単分子層を確認するために顕微鏡下で細胞をオンにし、感染を続行して下さい:
- PBS 1X 1mlで、二回、細胞を洗浄。
- 室温で1時間遠心分離した組織培養上清の200μlで感染する。細胞は乾燥させないでください。 6ウェルプレート10分ごとに揺らし。
- ウイルス性吸収の1時間後、MDCK細胞から感染の媒体を削除し、TPCK -トリプシンのの1μg/ mlを含むPS DMEM 0.3%BA 1%2 mlを加える。
- 通過後48〜72時間で、トランスフェクション効率とウイルスの負荷に応じて、細胞変性効果(CPE)はMDCK感染細胞で観察される。 CPEは、成功した救助を示唆している。しかし、HAアッセイ(セクション2)が依然として組織培養上清中のウイルスの存在を確認するために実行する必要があります。
- 10日齢の鶏孵化卵の感染:鶏孵化卵に感染するすべての手順は、無菌条件下で行われる。
- 感染した鶏の孵化卵から収穫尿膜液:感染した卵から尿膜液を採取するすべての手順は、無菌条件下で行われる。尿膜腔液の約8〜12ミリリットルは、それぞれの10日齢に感染した卵から収穫することができる。尿膜液を採取する前に、℃でニワトリ胚を殺すと血液を凝固するために4で2時間(またはON)のために鶏の卵をインキュベートする。
- 無菌状態を確立するために70%エタノールで卵の殻を洗ってください。
- スプーンで軽くたたくことによって空気の空洞を介して、慎重に、卵を開きます。鉗子の助けを借りて、壊れた卵の殻を外します。
- 1mlの針で、卵の黄身を壊すことなく、尿膜を取り除く。
- あなたが尿膜液に10 mlのピペットをガイドとしてスパチュラでニワトリ胚を安定させます。壊したり、卵の卵黄のいずれかを収集せずに、氷のバケツに氷の上に15 mlの遠心管に、できるだけ多くの尿膜液として収集する。それぞれの卵のための15 ml遠心チューブを使用してください。
- 4℃で5分間遠心し℃、新鮮な15 ml遠心管に尿膜腔液を(ペレット化赤血球を服用せずに)転送する。
- それらは赤血球凝集(HA)アッセイによる救出、ウイルスの有無をチェックされるまで、4℃で遠心分離した尿膜液を含むチューブ℃で保管してください。
2。組換えインフルエンザウイルスの救助を確認するために、HAアッセイ
赤血球凝集アッセイ(HA)は、日常的にMDCK細胞培養上清及び/または収穫卵の尿膜腔液の救出、ウイルスの存在を検出するために使用されます。また、免疫蛍光アッセイ(IFA)も行うことができます。アッセイは、救出のウイルスの存在を識別する一度、ウイルスをプラーク精製されるべきであり、ウイルスの遺伝的組成は、RT - PCRおよび配列決定によって確認されます。
MDCK細胞の培養上清及び/または感染した卵から尿膜液中のウイルスの存在は、肉眼的に鶏のHA(または別のソース)赤血球(RBC)を用いて決定することができる。ウイルスの不在は、ウェルの底に赤ペレット(図4)の形成を可能にしながら、ウイルスの存在は、RBCの赤血球凝集を誘導する。インフルエンザウイルスの場合には、それは約10 3 -10 4プラーク形成単位(PFU)は、HAのアッセイで陽性信号を与えるために必要とされると考えられているので、IFAは、確認のため、HAアッセイと並行して行うことができます。真の陰性結果。未満103から104のウイルスはこの手法で検出できるので、一次抗インフルエンザ抗体を用いたIFAは、HAアッセイよりも感度が高いです。それはIFAで陽性のHA陰性である上清あるいは尿液より可能です。この場合、ウイルスはMDCK細胞で、卵で、再び、継代によって増幅されるべきである。第2流路から尿膜液および/または組織培養上清は、現在、HAアッセイで明らかな陽性でなければなりません。
HAアッセイは、V底96ウェルプレートで実施されています。負(例えば、PBS 1X)と正(組織培養上清及び/またはインフルエンザウイルスの感染から尿膜腔液)コントロールのサンプルは、常にそれを検証するために、任意のHAアッセイに含まれるべきです。
- V底96ウェルプレートの各ウェルにPBS 1Xの50μlを分注する。
- 50μlを加え感染した最初のウェルに卵と、からMDCK細胞の培養上清および/または尿膜液は、以下の井戸を2倍希釈系列を作る。最後のウェルからの余分な50μlを捨てる。
- 各ウェルに0.5%-1.0%ニワトリ赤血球(PBS 1Xで調製)を50μlを追加。
- 氷上で30-45分(赤い点は、陰性コントロールのPBS試料の底部に見えるようになるまで)のためのV底96ウェルプレートをインキュベートします。図4に示される結果を読んで、interpretate。
3。組織培養上清のパッセージ
HAアッセイで陰性の結果は、組織培養上清および/または尿膜液中のウイルスという存在の低水準と低いトランスフェクション効率の結果である可能性があります。新鮮なMDCKおよび/または孵化卵におけるこれらのサンプルの通過は、感染症は、以前は次のセクション1.11.2で説明したように実行されます(図3に示される)ウイルスの増幅が可能になります。
4。代表的な結果
成功したインフルエンザウイルスの救助は、正のHAアッセイ(図4)の存在によって確認される。さらに、組織培養上清、または卵から尿膜液と感染細胞におけるCPEの存在は肯定的なウイルスの救助を提案します。
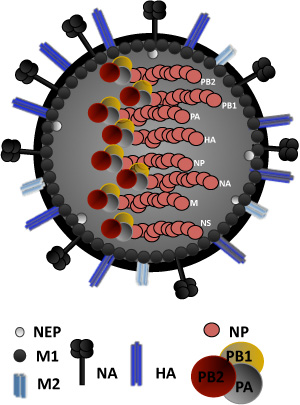
図1。インフルエンザウイルスの構造:インフルエンザウイルスは、2つのウイルス糖タンパク質(HA、NA)と、また、イオンチャネル蛋白質、M2を含む脂質二重層に囲まれています。 HAは、シアル酸含有受容体に結合することの責任のウイルス付着タンパク質、です。 NAは、宿主細胞からのウイルスのリリースを担当しています。脂質二重層の下、ビリオンアセンブリと出芽およびウイルスribonucleocapsidsの核外輸送に必要な核輸出タンパク質(NEP)、の役割を果たしている内面のエンベロープのマトリックスタンパク質1、M1、から構成される蛋白質の層です。ウイルスのコアは、ウイルスの核タンパク質、NPでcapsidに包まれた8つのシングル鎖陰性RNAウイルスの遺伝子で構成される、リボ核タンパク質(RNP)複合体で作られています。 RNP複合体に関連付けられているウイルスRNA依存性RNAポリメラーゼサブユニットPA、PB1、PB2となります。非構造タンパク質NS1およびRNAのセグメントNSとPB1にコードされるPB1 - F2は、それぞれ、ビリオンの構造の一部ではありません。
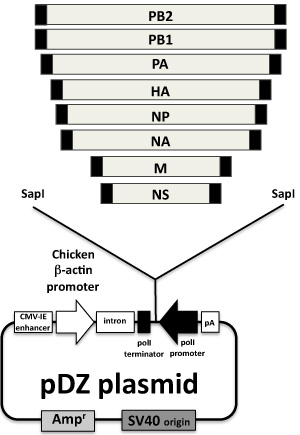
図2。インフルエンザウイルスのレスキュープラスミド:8インフルエンザウイルスの遺伝子ambisenseプラスミドPDZにクローニングされたが示されている。 pCAGGs 7プラスミドタンパク質の発現から得られるプラスミドPDZ 6は 、ヒトのRNAポリメラーゼIはプロモーターと負のセンスのゲノムRNAをコードするマウスターミネーター配列との双方向のプラスミドベクターであり、逆方向に私が団結ポリメラーゼに、ポリメラーゼII転写カセット(ニワトリβ-アクチンプロモーターとポリA)は、同じウイルスの遺伝子からウイルスタンパク質をコードしている。各ウイルスのセグメントからのcDNAは、SAPIの制限エンドヌクレアーゼ部位と各セグメントの非翻訳領域を含むフォワードプライマーとリバースプライマーを用いたRT - PCR(ウイルス遺伝子の端にある黒色のボックス)によって生成されます。 PCR産物は、SAP - Iで消化PDZにクローニングされています。
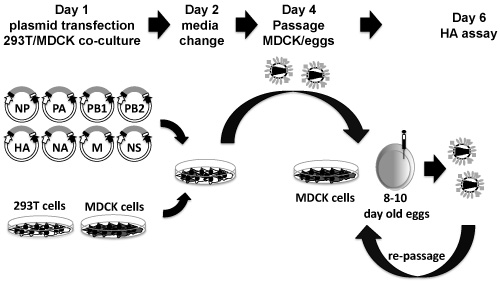
図3。八プラスミドベースのインフルエンザのレ スキューシステム:8インフルエンザウイルスの遺伝子を含むPDZプラスミドを293T - MDCK細胞共培養(1日目)で、懸濁液に、同時トランスフェクトされています。二十四時間トランスフェクション後、FBSのないメディアがTPCK /トリプシンを含むが(2日目)に置き換えられます。四十八時間のメディアを変更した後、組織培養上清を回収し、MDCKまたは10日齢発育鶏卵を(4日目)に感染するために使用されます。 48〜72時間後の増幅、卵からMDCK感染細胞や尿膜腔液から組織培養上清は、HA(6日)で採取し、ウイルスの存在についてアッセイする。ウイルスが検出されない場合は、同じ上清および/または尿液は、新鮮なMDCK細胞および/または孵化卵に再継代することができます。
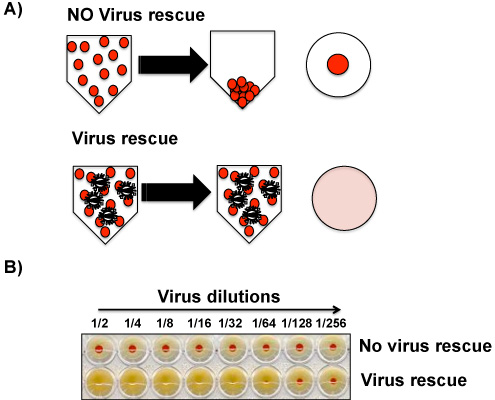
図4。赤血球凝集素分析(HA):ウイルス粒子によるRBCの凝集は、肉眼で見えるであり、組織培養上清または/および尿液にウイルス粒子を検出するための基礎です。 HAアッセイは、ウイルス感染性粒子と劣化したと細胞に感染することはもはやできる粒子を区別しませんが、アッセイは、サンプル中のウイルスの存在の良い指標です。 A)生物学的サンプル中のウイルスの存在の不在(上)(下)は、プレートの底部におけるRBCの存在や彼らの不在、RESPによって決定されます。ectively。 B)HAのウイルスの検出可能なレベルの分析(上)またはウイルスの存在(下)から代表的な結果が示されています。
ディスカッション
プラスミドDNAから組換えインフルエンザウイルスの救助は、プロトコルが日常的に実験室で実施されると、シンプルかつ簡単なプロセスですが、初めに、複数の物事が間違って行くことができます。それは、ウイルスを生成するために適切なプラスミド調製を持つことが不可欠です。細胞株(293TとMDCK)の適切な維持管理が成功したウイルスの救助のための非常に重要です。伝統的に、遺伝?...
開示事項
謝辞
著者らは、インフルエンザの逆遺伝学技術とプラスミドの開発のためのアドルフォガルシア、サストレとピーターPaleseの研究室で過去と現在のメンバーに感謝したいと思います。 AG - Sの研究室で研究の一部は手足の不自由な人、インフルエンザの研究と監視のための優秀NIAID資金によるセンター(HHSN266200700010C)によっておよび大学評価学位授与機構の助成金R01AI046954、U01AI070469とP01AI058113によって賄われています。 LM - Sのラボの研究は、部分的にNIAIDの助成金RO1AI077719によって運営されている。
資料
細胞株
293T(カタログ番号CRL - 11268)およびMDCK(カタログ番号CCL - 34)の細胞株をDMEM 10%FBS、1%PSで、5%CO 2で37℃のインキュベーター中で維持されます。細胞は、アメリカンタイプカルチャーコレクション(ATCC、10801ユニバーシティブールバード、マナッサス、バージニア州。20110〜2209、アメリカ)利用可能なフォームです。
孵化鶏卵
孵化10日齢の鶏の卵は、チャールズリバー研究所、特定の病原体手数料鳥サプライ(SPAFAS)鳥製品とサービスから得ることができる。フランクリンコモンズ、106ルート32、ノースフランクリン、CT 06254、米国。卵は、° C前後のウイルス感染後に37℃でインキュベートする。ウイルス感染前と後、卵は、胚の生存性を決定するためにcandledされています。それは、ウイルス感染前と後に死んだ卵を探すことが非常に重要です。感染する前に死んだ卵は、簡単に血管の欠如だけでなく、胚の移動性の欠如を見破ることができます。 candledときは、ライブ胚が移動する。ウイルス感染後に死んだ卵は、(おそらくインフルエンザウイルスの感染に関係する)簡単に尿膜腔液の小さい方と流血の量によって見られるように卵の外観不良が発見されます。感染の卵は、二重オートクレーブバッグに破棄され、標準的な手順は、次のオートクレーブ処理されています。
ニワトリ赤血球(RBC)
ニワトリ赤血球はTruslowファーム、201バレーロード、チェスター、MD 21620から購入することができます。 4℃で保存します。 HAアッセイのために、50 ml遠心チューブにPBS 1X 45mlのチキンRBC 5 mlを洗う。 1000年のrpm、室温で5分間、遠心します。注意深く上清を捨て、PBS 1Xでペレット化RBC(0.5-1.0%RBCの最終濃度)の1:1000希釈を使用してください。
組織培養上清や尿液
、組織培養上清や尿液の両方を4℃で短期間保存することができる。ウイルスの救助を確認した後、細胞上清や尿膜液からのウイルスは、-80℃で保存されています
プラスミド
すべてのプラスミドは、メーカーの推奨に従ってプラスミドマキシキットを用いて調製されています。すべてのプラスミドは、のddH 2 Oで1μg/ mlの濃度で分注しており、-20℃で保存短期記憶のために、プラスミドは4で維持することができます℃を精製プラスミドDNAの濃度は純度が260:280 nmの比を用いて推定されていると、260 nmでの分光光度法により決定されます。 1.8から2.0 260:280 nmの比率を持つ準備がウイルスの救助の目的のために充当とみなされます。さらに、プラスミド濃度および純度は、アガロースゲルクロマトグラフィーで確認してください。 Ambisense PDZプラスミド(6)8つのインフルエンザA/PR/8/34ウイルス遺伝子(7)を含む、図2に示します。
ウイルス
インフルエンザA/PR/8/34を救出するために記述されているプロトコルは、バイオセーフティーレベル(BSL)2の条件下で行うことができます。組織培養上清および孵化卵を含む汚染物質は、廃棄前に滅菌する必要があります。他のインフルエンザウイルスの救助は、より高いBSL条件を必要とし、従って、特別な条件/セキュリティ測定が続いする必要があります。
組織培養培地およびソリューション
DMEM 10%FBS 1パーセントPS:445ミリリットルダルベッコ改変イーグル培地(DMEM)、ウシ胎児血清(FBS)を50ml、および100Xペニシリン/ストレプトマイシン(PS)5mlの。 4℃で保存します。このメディアは、トランスフェクションのためだけでなく、293TとMDCK細胞を維持するために使用されます。 DMEM 0.3%BA 1パーセントPS:DMEMの495.7ミリリットル、35%ウシアルブミン(BA)の4.3ミリリットル。 4℃で保存します。使用直前に、1μg/ mlの終濃度にTPCK処理されたトリプシンを追加する。感染媒体。
塩化ナトリウム80gの、塩化カリウム2gを、のNa 2 HPO 4 · 7H 2 O、KH 2 2gのPO 4の11.5グラム:10Xリン酸緩衝食塩水(PBS)。最大1リットルのddH 2 Oを追加。 7.3にpHを調整する。オートクレーブで滅菌。室温で保管してください。
1X PBS:のddH 2 Oで希釈し、10 × PBS午前1時10分室温でオートクレーブや店舗によって滅菌する。
参考文献
- Neumann, G., Watanabe, T., Ito, H., Watanabe, S., Goto, H., Gao, P., Hughes, M., Perez, D. R., Donis, R., Hoffmann, E., Hobom, G., Kawaoka, Y. Generation of influenza A viruses entirely from cloned cDNAs. Proc Natl Acad Sci U S A. 96, 9345-9350 (1999).
- Fodor, E., Devenish, L., Engelhardt, O. G., Palese, P., Brownlee, G. G., Garcia-Sastre, A. Rescue of influenza A virus from recombinant DNA. J Virol. 73, 9679-9682 (1999).
- Martinez-Sobrido, L., Garcia-Sastre, A. Recombinant influenza virus vectors. Future Virology. 2, 401-416 (2007).
- Palese, P., Shaw, M. L., Knipe, D. M., Howley, P. H. Orthomyxoviridae. The viruses and their replication. Fields Virology. , 1647-1689 (2006).
- Schickli, J. H., Flandorfer, A., Nakaya, T., Martinez-Sobrido, L., Garcia-Sastre, A., Palese, P. Plasmid-only rescue of influenza A virus vaccine candidates. Philos Trans R Soc Lond B Biol Sci. 356, 1965-1973 (2001).
- Quinlivan, M., Zamarin, D., Garcia-Sastre, A., Cullinane, A., Chambers, T., Palese, P. Attenuation of equine influenza viruses through truncations of the NS1 protein. J Virol. 79, 8431-8439 (2005).
- Niwa, H., Yamamura, K., Miyazaki, J. Efficient selection for high-expression transfectants with a novel eukaryotic vector. Gene. 108, 193-199 (1991).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved