このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
髄芽腫の幹細胞の単離、濃縮、およびメンテナンス
要約
このプロトコルは、分離、濃縮、および異所性ソニックヘッジホッグ経路の活性をもつ変異マウス由来の髄芽腫の腫瘍幹細胞の維持を説明します。
要約
脳腫瘍は、腫瘍形成の根本原因である幹細胞の小集団を持つことが示唆されている。ニューロスフェアのアッセイは、一般的に、正常および腫瘍組織由来のものを含む神経幹細胞の性質を研究するために採用されています。しかし、分化と細胞死のかなりの量は、培地への球の集合内のすべてのセルのアクセシビリティなど次善の状態に可能性が高いため、培養ニューロスフェアでは一般的です。
髄芽腫、最も一般的な小児中枢神経系の腫瘍は、その急速な進行や全体の脳脊髄陰気な臨床転帰との軸に沿って広がる傾向によって特徴づけられる。髄芽腫は、それぞれ小脳の神経上皮腫瘍、20%を占めると小児期の頭蓋内および後頭蓋窩腫瘍の40%、1です。それは今もソニックヘッジホッグシグナル伝達が小脳発達2月4日中に小脳顆粒神経前駆細胞(CGNPs)の増殖を刺激することが確立されている。マウスモデルを用いて多くの研究では、Shhの経路が構成的に活性化されている、髄芽腫5月9日とソニックヘッジホッグシグナル伝達をリンクされています。
最近の報告では、Patched1 のLacZ / +マウス由来の髄芽腫細胞のサブセットは、腫瘍の10を開始し、伝播することが可能ながん幹細胞が、あることが示されている。ここでは、平滑化の変異(11、ここに至ってはSmoM2と呼ばれる)のために構成的に活性化さShhの経路で、Shhのために重要なGPCRの髄芽腫のいくつかのモデルマウス由来の腫瘍幹細胞を、分離豊かにし、維持するために効率的な方法を記述する経路の活性化。すべての孤立した髄芽腫の組織では、我々は数々の高度に増殖したコロニーを確立することができた。確実にネスチンとSox2などのいくつかの神経幹細胞マーカーを発現するこれらの細胞は、連続継代を経て(20以上)とクローン原性であったこともできます。これらの培養腫瘍幹細胞は、幹細胞の増殖に有利な条件下で培養すると細胞質比が高いの核としばしばbipoar比較的小規模でしたが、彼らは劇的に、その形態を変化させた複数の細胞プロセスを拡張し、平らにし、セルへの切り替え時に細胞周期から撤退培地は10%ウシ胎児血清を補充した。さらに重要なことは、これらの腫瘍幹細胞は、このように、そのマルチ効力を強調、Tuj1 +またはNeuN +の神経細胞、GFAP +アストロサイトとCNPase +オリゴデンドロサイトに分化した。さらに、これらの細胞は、同所宿主マウスに移植すると、二次髄芽腫を伝播することができた。
プロトコル
1。担癌小脳の微小解剖、腫瘍組織及びめっきの解離
- 腫瘍組織の検索
- 病気のマウスのベアリングの髄芽腫は、しばしばruntedされ、水頭症と後部麻痺と覆さときに姿勢を取り戻すために、障害を含む典型的な神経学的症状は、表示されます。腫瘍組織を取得するには、二酸化炭素の吸入によりマウスを安楽死させる。頸椎脱臼、後頭骨に圧力を発生し、腫瘍組織の整合性が損なわれる可能性が手順を実行しないことが重要です。
- 断頭は、頭蓋骨の良い可視化のために髪と筋肉組織を可能な限り除去し、はさみを使って死の直後に実行されます。 95%エタノールを浸したキムワイプで頭蓋骨の表面を清掃してください。
- 担癌小脳を含む脳全体が露出している時点で、頭蓋骨の正中線に沿って開口部をカットし、細かいピンセットを使って頭蓋骨の組織を除去するために微細なハサミを使用してください。
- 健康な成人の小脳は、明確に定義された半球と虫部を表示しながら、担癌マウスの小脳では、多くの場合、滑らかな表面と顕著な血管を持つアモルファス拡大です。無菌技術を用いて、氷冷PBSでピンセットと場所を使用して小脳の腫瘍を取り出すのMg2せずに+とCa 2 +。
注:すべての楽器が使用前に95%エタノールで滅菌されています。 - 腫瘍組織の解離
- PBSから腫瘍組織の約4倍の体積が50%のAccutase(PBSで希釈)に腫瘍組織を転送、37℃でインキュベーションに続いて、室温で3分間細かいハサミで組織をミンチ℃で4分間、そのあと組織は、さらに3分間1 mLのPipetmanで反復的なペッティングを受ける。このメソッドは、単一細胞と小さな細胞の集合体の混合物を生成する必要があります。
- PBSとペレットに1000gで5分間遠心し、細胞と細胞懸濁液3倍に希釈する。ゼラチン60 mmのPrimariaの組織培養皿に新鮮な神経幹細胞培養培地とプレートで細胞ペレットを再懸濁します。我々は、第1のめっきで強化された添付ファイルのPrimaria皿を使用して、その後の継代は、通常の組織培養皿上に播種されることがあります。
注:少なくとも30分間、0.1%ゼラチンでコーティング培養皿。グルタミン、ペン球菌、N2、B27、ヒトEGF(25 ng / ml)および塩基性FGF(25ng / mL)でNeurobasal媒質で構成された新鮮な神経幹細胞培養の培地を準備します。
2。連続継代による濃縮、メンテナンスおよび髄芽腫の腫瘍細胞の増殖
我々は通常、初期メッキの1週間(図1)の後に多くのコロニーを得る。これらのコロニーは解離し、腫瘍細胞集団の濃縮のための新たな糊皿の上に色を保ち続けることができます。新しい培地への最初の変更は、その後、単に機械的に細胞懸濁液(不要Accutase)を得た4分間反復ペッティングに続いてコロニーを分離するために、1 mLのPipetmanを使用してください。大きな細胞塊が解離されていることを確認するために顕微鏡下で確認してください。その後、さらに培養するための新たな糊化ディッシュに細胞懸濁液を分注し、追加の通路のための同じ手順を通過。アタッチされていない腫瘍細胞、血液細胞や他の細胞型は、接続されている腫瘍細胞が急速に拡大して残して、再めっきシリアルによって除去されています。文化の最初のシードに続く二日目の培地、及びその後一日おきに変更します。
3。免疫蛍光染色と培養細胞の検討
1。ガラス製カバースリップ上で腫瘍細胞を成長させる
1日目、6ウェルプレートの各々の場所のガラスカバースリップ上で、その後37℃で30分間、0.1%ゼラチンを加える℃にmL当たりの種子は約2 - 4X 10 5腫瘍細胞。細胞は一晩固定してくださいと神経幹細胞培地は3日目に変更。染色は4日目に行われます。
2免疫蛍光染色
氷冷したPBSで2回培養液および洗浄細胞を取り除く。 15分間たての4%PFAで細胞を固定してください。簡潔にPBSで細胞を2回洗浄し、5分間、0.3%トリトン(PBS中)でpermeablize。簡単に言うと40分間10%ヤギ血清を含むPBSとブロックで細胞を2回洗浄する。 90分間一次抗体で細胞をインキュベートし、各5分間、PBSで細胞を3回洗浄する。 PBS、5分ごとで3回洗浄し、60分間二次抗体で細胞をインキュベートします。水性マウンティング培地5mLを持つスライドにカバースリップをマウントし、共焦点顕微鏡を行います。
4。腫瘍細胞の分化
nを削除するeural幹細胞の培地と簡単に二回PBSで細胞を洗浄する。 1日目の分化培地を追加し、4日目に培地を変更し、7日目に免疫蛍光染色により分化のレベルを決定します。分化培地は、DMEM、ペン球菌および10%ウシ胎児血清で構成されています。
5。代表的な結果
形態の結果
Accutaseの治療と穏やかな反復ペッティングした後、腫瘍組織は、小さな細胞凝集と単一細胞に主に解離してください。多くのかなりのコロニーは、図1で示すように、初期のめっき後の5日には早くも観察することができます。高度に増殖性の腫瘍細胞はしばしば高い核/細胞質比の二極です。これらの細胞は通常、ゼラチン表面に付着した小さな細胞の集合体から放射状に見られている。小さいと丸い血液細胞は、通常、その後のメディアの変化とシリアルめっきによって削除されます。いくつかの継代後、1つは他の細胞タイプ(図2)で均一に分布し、増殖Ki67 +腫瘍細胞と少し汚れを観察することができます。
神経幹細胞マーカー、クローン解析し、複数の系統への分化の発現
増殖細胞は、腫瘍幹細胞の解離小脳腫瘍の組織のショー特性に由来するかどうかを判断するために、我々は、幹細胞マーカーの発現、クローン解析と分化能によりさらに特性評価を実施。我々は、これらの孤立した腫瘍細胞が高度にSox2、及びネスチン(図3)などの神経幹細胞マーカーを発現することを発見。我々はSmoM2 - YFP腫瘍から組織を取得したとして、すべての腫瘍細胞はYFP。一次繊毛は、ソニックヘッジホッグ経路に依存する髄芽腫12の開発のために重要であることを報告する最近の研究と一致し、SmoM2 - YFPの発現は明らかにSox2のの繊毛+腫瘍細胞(図3)に局在していた。培養液のmL当たり300個の細胞のクローン密度で播種したとき、我々は単一の腫瘍細胞からかなりのコロニー(図4)にクローン増殖を観察した。さらに、これらの細胞はプロ分化の条件(図5)で培養したとき、様々な神経細胞およびグリア細胞型に分化することができた。
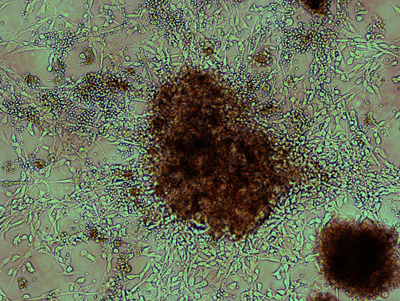
図1。解離髄芽腫の組織の第1のめっき後の高度の増殖性コロニーの形態 。解離腫瘍組織の初期播種後5日以内にコロニーの形態一般的に、かなり大きな、そして代表的な1つは、明視野でここに示されています。高密度コアのセルの集合体からバイポーラ、細長い細胞が放射状に。徐々にシリアルめっきによって枯渇している小さな、丸い赤の血液細胞は、ある腫瘍細胞に添付。

図2。 3継代を超えて確立された髄芽腫細胞の形態 。この明視野像には、いくつかの継代後に確立された髄芽腫細胞の典型的な外観を示しています。細胞は主に高い核/細胞質比の二極のまま。我々は強いKi67の発現によって示されるようにサイクリングしているそのほとんどが腫瘍細胞のアセチル化チューブリンの染色を示す。
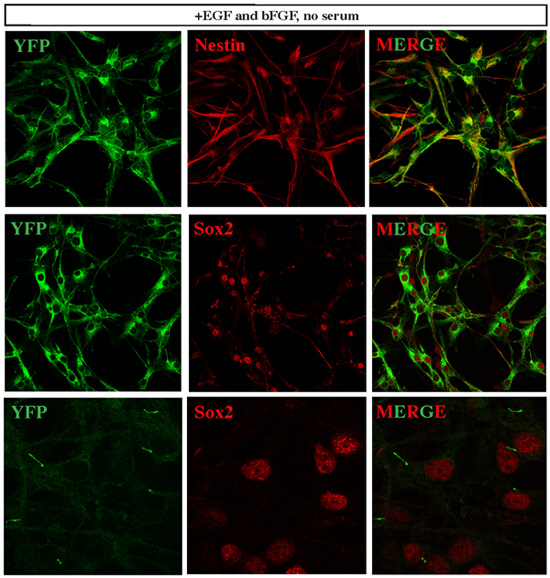
図3。確立された髄芽腫細胞は神経幹細胞マーカーを発現する 。 SmoM2 - YFPは、構成的に活性なSmoと、それ故にShhの経路活性を発現する細胞をマーク。確立された髄芽腫細胞株のすべてのセルは、YFPを発現しており、それらのほとんどがそのようなネスチンとSox2などの様々な神経幹細胞マーカー、高レベルの同時発現。興味深いことに、我々は共焦点顕微鏡の間に最小限のレーザパワーとYFPのシグナルの検出を実行したときに、我々はSox2の+細胞の繊毛の集中YFPのシグナルを検出しました。この観察は、ソニックヘッジホッグ経路に依存する髄芽腫の開発に繊毛の重要な役割を説明する最近の報告書12と整合的である。
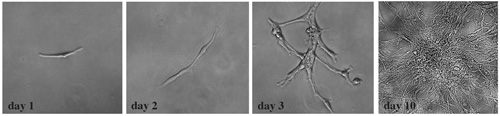
図4。確立された腫瘍細胞がクローン性増殖を受ける 。解離した後、単一の細胞懸濁液に、腫瘍細胞は、培養液のmL当たり300個の細胞のクローン密度で24ウェルプレート上に播いた。各ウェルでは、クローン拡大コロニーを観察した。明視野画像のこのシリーズは、文化の10日間で典型的な変化を示しています。

図5。確立された髄芽腫細胞の分化の解析 。腫瘍細胞は、EGF / bFGFがDMEM/10%FBS、YFP +腫瘍細胞は有意にその形態を変え、様々な細胞型、株式会社に分化する無血清培地を含むからスイッチングされたときTuj1瀘定+またはNeuN +の神経細胞、GFAP +アストログリア細胞またはCNPase +オリゴデンドロサイト。
ディスカッション
我々は、構成的に活性なヘッジホッグシグナル伝達と変異マウスから取得した原発腫瘍組織からの髄芽腫の幹細胞を、分離豊かにし、維持するための効率的な方法を説明します。私たちは正常に健康な腫瘍の幹細胞株を確立する上でひとつの重要なステップは、原発腫瘍の組織の解離の際に使用Accutase治療法であることがわかった。我々の経験では、ときに小脳からの最初の解離腫瘍組織、37...
開示事項
謝辞
この研究は、ヴァンダービルト - イングラムがんセンターサポート助成金(P30 CA068485)、小児脳腫瘍財団と米国立衛生研究所(NS042205)からの補助金によって支えられている。
資料
| Name | Company | Catalog Number | Comments |
| Neurobasal medium | Invitrogen | 21103049 | |
| hEGF | Invitrogen | PHG0311 | 25ng/ml |
| bFGF | Invitrogen | PHG0023 | 25ng/ml |
| N2 | Invitrogen | 17502048 | 1X |
| B27(-RA) | Invitrogen | 12587010 | 1X |
| Accutase | Invitrogen | A1110501 | 50% |
| Gelatin | Sigma-Aldrich | G1393 | 0.1% |
| Glutamine | Invitrogen | 25030081 | 2mM |
| Primaria dishes | Fisher Scientific | 087724C | |
| Sox2 antibody | EMD Millipore | MAB4343 | Mouse, 1:1000 |
| Nestin antibody | DSHB | rat401 | Mouse, 1:200 |
| YFP antibody | Molecular Probes, Life Technologies | A11122 | Rabbit, 1:2000 |
| GFAP antibody | Neuromics | CH22102 | Chicken, 1:1000 |
| Tuj1 antibody | Sigma-Aldrich | T5076 | Mouse, 1:2000 |
| NeuN antibody | EMD Millipore | MAB377 | Mouse, 1:2000 |
| CNPase antibody | EMD Millipore | MAB326 | Mouse, 1:1000 |
参考文献
- Rossi, A., Caracciolo, V., Russo, G. Medulloblastoma: From Molecular Pathology to Therapy. Clin Cancer Res. 14 (4), 971-971 (2008).
- Wechsler-Reya, R. J., Scott, M. Control of Neuronal Precursor Proliferation in the Cerebellum by Sonic Hedgehog. P. Neuron. 22 (1), 103-103 (1999).
- Dahmane, N., Ruiz, A., Altaba, I. Sonic hedgehog regulates the growth and patterning of the cerebellum. Development. 126 (14), 3089-3089 (1999).
- Wallace, V. A. Purkinje-cell-derived Sonic hedgehog regulates granule neuron precursor cell proliferation in the developing mouse cerebellum. Curr Biol. 9 (8), 445-445 (1999).
- Fan, X., Eberhart, C. G. Medullablastoma Stem Cells. J Clin Oncol. 26 (17), 2821-2821 (2008).
- Yoon, J. W., Gilbertson, R., Iannaccone, S. Defining a Role for Hedgehog Pathway Activation in Desmoplastic Medulloblastoma by Identifying GLI1 Target Genes. International journal of cancer. 124 (1), 109-109 (2009).
- O'Dorisio, M. S., Khanna, G., Bushnell, D. Combining anatomic and molecularly targeted imaging in the diagnosis and surveillance of embryonal tumors of the nervous and endocrine systems in children. Review. Cancer metastasis reviews. 27 (4), 665-665 (2008).
- Corcoran, R. B., Bachar Raveh, T., Barakat, M. T. Insulin-like Growth Factor 2 Is Required for Progression to Advanced Medulloblastoma in patched1 Heterozygous Mice. Cancer research. 68 (21), 8788-8788 (2008).
- Gilbertson, R. J., Ellison, D. W. The Origins of Medulloblastoma Subtypes. Annual review of pathology. 3, 341-341 (2008).
- Ward, R. J., Lee, L., Graham, K. Multipotent CD15+ Cancer Stem Cells in Patched-1 Deficient Mouse Medulloblastoma. Cancer research. 69 (11), 4682-4682 (2009).
- Mao, J., Ligon, K. L., Rakhlin, E. Y. A Novel Somatic Mouse Model to Survey Tumorigenic Potential Applied to the Hedgehog Pathway. Cancer research. 66, 10171-10171 (2006).
- Han, Y. G., Kim, H. J., Dlugosz, A. A. Dual and opposing roles of primary cilia in medulloblastoma development. Nature medicine. 15 (9), 1062-1062 (2009).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved