Method Article
トランスジェニックゼブラフィッシュの多色タイムラプスイメージング:標的神経細胞のアブレーションによって活性化を可視化網膜幹細胞
要約
このビデオでは、多色共焦点タイムラプスイメージングと標的細胞のアブレーションのための技術が提供される。タイムラプスイメージングは、関心の複数の細胞型の動作を監視するために使用されます in vivoで。標的細胞のアブレーションでは、研究神経回路の機能および細胞特異的神経再生のパラダイムを容易にします。
要約
生きているゼブラフィッシュの幼虫の高解像度のタイムラプスイメージングは、生物学的プロセスは、(レビュー用の1を参照)展開を視覚的に利用することができます。隣接セルの種類に異なる蛍光レポーターを表現する化合物トランスジェニック魚は時間をかけて実験操作する細胞間相互作用2および/ または組織レベルの応答を以下の手段を提供します。このビデオでは、我々は数日間に数分からまたがることができる時間のコース上の個々の魚に連載イメージング複数の遺伝子導入によって標識された細胞のタイプに使用できるメソッドを示しています。 )を分離するための簡略化のアプローチ1)シリアル"キャッチ&リリース"イメージングのための方法を連続する日、2以上の魚の数が多い:記載された技術は含めて、時間をかけて隣接セルのタイプの"振る舞い"を関連付けるために求めるあらゆる試験に適用可能である重複する励起/発光プロファイル(例えば、GFPおよびYFP)と蛍光体、3)開発の後期幼生の段階に高分解能イメージングのための利用できる時間のウィンドウを拡張するために脱色素の突然変異系統の利用、4)明らかにするために膜を対象と蛍光レポーターの使用個々の細胞だけでなく、細胞の大きな集団での携帯電話の詳細、およびトランスジェニック標的細胞型の化学的に誘導アブレーションのための5)前述の方法の細かい形態学的な詳細、などメトロニダゾールとして、すなわち、プロドラッグ基質のニトロレダクターゼ(NTR)を介した変換、 (MTZ)、細胞傷害性誘導体の3,5へ。
これらのアプローチの例として、我々は数日間にわたって個々の魚内網膜双極ニューロンのサブタイプのアブレーションと再生を見ることができます。同時に我々は、隣接する非標的双極細胞や潜在的な変性刺激による網膜幹細胞(すなわち、Mϋllerのグリア)を含むいくつかの他の網膜細胞の種類を、監視します。この戦略は、標的神経細胞の種類の選択的喪失と再生するために、細胞や組織レベル(例えば、幹細胞ニッチ)の応答を特徴づけるために私たちの研究室で応用されている。
プロトコル
1。トランスジェニックと変異系統
- 差蛍光レポーターの亜種で標識した目的の細胞型を持つトランスジェニックゼブラフィッシュのラインを確立する/取得する。最適に、選択された記者の励起/発光プロファイルは、最小限の重複(例えば、ECFPとEYFP)、しかしこれは絶対に必要とされていないが必要です。我々の目的のために、膜の使用は、大規模comingledグループ内の個々の細胞数および/または形態を解決するために、このような神経突起のプロセスのような細かい細胞の細部、のイメージングを容易にし、次のような高膜のコンテンツの領域を、"強調表示"に蛍光レポーターをつながシナプスneuropils。
- 後期幼虫段階でのイメージングのために、それが派生/色素沈着を減少させる変異体背景にトランスジェニックラインを交差させる有用である[例えば、ロイオービソン(ロイ)やロイオービソン、(; ALBロイ)、アルビノ4]。我々の経験では、iridiphoresの減少(例えば、ロイは)最も重要な問題である、メラニン形成は、化学的に1 - フェニル-2 - チオ尿素(PTU)または色素胞を欠く"アルビノ"変異体とを用いて対処することができます。漣ら 4は 、視覚障害とmelanaphoresを欠いている魚の網膜のささやかな形態学的変化を実証していることに注意してください、そしてその強烈な光は"アルビノ"変異体では光受容体の死を誘発することができます。従って、これらの問題は、イメージング実験及び/または解釈データを設計する際に考慮する必要があります。
- このデモでは、使用されるトランスジェニックおよび変異魚の行は次のとおりだった:
- TG(NYX:GAL4 - VP16)q16a / +; TG(UAS:GAP43 - YFP)q16b / +; TG(UAS - E1B:NfsB - mCherry)c264 / +; TG(pax6 - DF4:GAP43 - CFP)Q01 / +;ロイa9/a9
- 注:年魚"1"、NYX -プロモーターの亜集団が定義されている網膜双極細胞は、(ほとんどのExpressの両方)膜タグ付きYFPおよび/またはNTR - mCherry融合レポーターを発現し、ほぼすべての網膜細胞は、膜タグ付きCFPを発現する。魚の"2"ミュラーグリア細胞は細胞質GFPを発現し、グローバルな網膜CFPの発現が排除されている場合を除き、上記のようです。 NTR - mCherry融合の発現は、プロドラッグ誘起アブレーション3,5への影響を受けやすいNYXに定義された双極細胞をレンダリングします。
2。ライブイメージングのために胚/幼虫の選択と準備
- メイトトランスジェニック/関心の突然変異系統は、28.5で卵を収集し、インキュベート/保守° 0.3X Danieauの溶液中でのC(または任意の"胚の培地")。
- "アルビノ"バックグラウンドでいない場合は、PTUは前に興味のある組織(例えば、目のための〜16 HPF、最終的に200μM)の色素沈着の証拠にチロシナーゼ活性を阻害するために追加する必要があります。 75μMを超える濃度でPTUによる治療は毒性および/または催奇形性を引き起こす可能性があることに注意してください。目は色素なのでしかし、、200μM以下の治療法は、高分解能共焦点イメージングには不十分であり、これらの条件の下では、イメージングのための健康な魚を選択することが重要です。イメージング他の組織の場合は、75μMPTUは望ましいかもしれない。また、上述のように、"アルビノ"の突然変異系統の使用は、PTUと胚を治療するために必要性を無くしますし、後期幼生段階でのイメージングに適した戦略です。
- 一度蛍光レポーターは蛍光ステレオズーム顕微鏡または同様のを使用して表現し、一般的な健康を導入遺伝子によれば明らかなように、ソートの魚です。
- イメージングの前の最初の日に、最終濃度0.5%に胚の培地に溶液中に得るために熱とミックスを低融点アガロース(LMA)を溶解、40℃で保存します。
- イメージングの初日には、マウントソリューションの準備:胚の培地には0.5%LMAに追加tricaine(756μM最後の麻酔薬、)とPTUを(必要に応じて)、穏やかに混合し、40℃に戻す
- PTU及び/またはtricaineを含む胚の培地に移すことによって魚を麻酔、(〜3分)非応答になるために魚のために時間が触れないように。
- それが再利用できるようにアガロースを希釈しないように注意しながら、マウントソリューションに個々の魚を移す。私たちは、転送のためのトリミングの先端でマイクロピペットを使用して、これはまた、制御量(〜30μL)を維持するのに役立ちます。取得後、ピペットを反転してマウントソリューションに先端に触れることは必要なく、重力の転送は、任意の液体を払拭することができるように魚が底に沈殿ができます。
- 転送後、マイクロピペットから麻酔液を排出し、ペトリ皿にマウントソリューションの〜30μLの液滴の魚を転送するために使用します。
注:この実装方法は、長い作動距離の水浸対物が使用される直立顕微鏡のためにのみ関連している。私のためにカバーガラスが必要とされる倒立顕微鏡、に関連するthods、アンデルセンらを参照して 、2010年;。O'Brien ら 、2009;。GraedenとSive、2009。 - マウントソリューション〜40 ° Cの加熱ブロックを返します。
- まつげのブラシまたは類似を使用すると、静かに所望の向きと位置アガロースの液滴の中心への関心の領域に魚を回転させる。
- 皿あたりの胚の数をマウントする手順6〜10を繰り返します。シリアルタイムラプス実験のために(下記参照)私たちは通常、一度に6魚をマウントし、グループあたり1時間にイメージングセッションを制限してみてください。
- 他の魚のマウント中には、以前の被験者はアガロース固化(〜3分)までに、望ましい方向を維持することを確認するために戻って確認してください。
- アガロースが固化した後、共焦点顕微鏡のステージに魚を輸送し、すべての魚が完全に水没するまで静かに皿にPTU及び/またはtricaineを含む胚の培地を加える。
3。 生体共焦点イメージングの "マルチカラー"
注:我々は、他の顕微鏡の構成に関連する情報を提供するよう、以下のプロトコルを一般化しようとしました。オリンパスとImageJのソフトウェアアプリケーションへの固有の参照は、引用符で囲まれています。私たちの撮像システムは、405、440、488、515、559、および635 nmのレーザー、2つの可変バリアフィルタの検出チャンネル(発光波長の設定が1 nm刻みで調整できるように)、一つの標準のバリアを装備したオリンパスFV1000直立共焦点顕微鏡です。フィルタは、チャネル(赤と遠赤イメージングのための)、もう一つは、光チャネルを送信。
- イメージングソフトウェアを開き("FV10 - ASW")と関心領域を見つけるためにどちらかの送信や蛍光灯の光源を使用してください。最適な携帯電話の画像処理および/または分子の詳細は、高NA(例えば、60X、1.2NA)と長い作動距離の目標を使用してください。
- 透過光の画像を収集する場合、ケーラー照明用の視野絞りを置いています。
- "染料リスト"から適切なfluorphoresを選択するか、以前に保存したイメージファイルからの取り込みパラメータをロードする。レポーター信号および/またはノイズ比に対する最大信号の明確な分離のための排出の範囲に調整("スペクトルの設定")必要に応じて行います。これらの設定は、経験的にクロストークを最小限に抑え、信号を最大化するために各実験のために定義する必要があります。ここに提供された例の設定は以下のとおりです。
Flourphores レーザー(波長) 障壁の設定/エミッションフィルター(ナノメートル) 1)ECFP、EYFP、mCherry * 440、515、559 * 460から500、530から545、575から675 2)EGFP **、EYFP **、mCherry 488、515、559 500から515、530から545、575から675
mCherryの*イメージングは、より高い波長のレーザー(例えば、568または594 nm)を使用して改善することができます
**ダイクロイックミラーとバリアフィルタの変更を("仮想チャネル")できるように連続イメージングモードは、GFPとYFP間の発光/励起の重複が原因で要求される。 GFPとmCherryは別々のチャンネルに1チャンネル、YFPに割り当てることができます。注:GFPとYFP画像間のクロストークは、前の画像減算(その6)には明らかであろう。 - 使用されている目的が定義されているプリセットが正しく調整されているすべてのソフトウェアを確実にするためにドロップダウンメニューで選択されていることを確認します。
- レーザーを当てるとパワーレベルを設定するには、各チャネルのピクセル飽和を("ハイロー")明らかにルックアップテーブル(LUT)を選択します。目的のイメージ品質と一貫性のある値に検出器の感度("HV"、PMT電圧を)(経験的に定義されている)に設定し、徐々に画像の輝度は、ピクセルの飽和を避けるために受け入れられるまで、レーザーの出力を上げる。
- チャンネル間のクロストークをチェックする;各レーザーラインはすべての画像のチャネルをモニタしながら手動でレーザーのオンとオフの切り替えによってのみ、適切なチャネルで検出可能なシグナルを生成することを確認してください。クロストークを除去するためにレーザーパワーを減少させる。はクロストークが明らかでない場合、すべてのチャンネルが同時に大幅な時間短縮を提供取得することができます。
- 避けられないクロストークのイベントでは、個別にレーザー/チャンネル間の切り替え"シーケンシャル"イメージングモードを使用してください。極端な場合は(例えば、イメージングGFPおよびYFP)また、ダイクロイックミラー及び/またはバリアフィルタ("仮想チャネル")に切り替えるシーケンシャルモードを使用する必要があります。注意:このオプションは、画像取得プロセスにかなりの時間的な遅延を紹介し、APができない場合があります非常に動的なプロセスを捕捉するためにpropriate。
- "ズーム"と"回転"機能は、さらに関心の領域をフレームに使用することができます。 http://corefacilities.systemsbiology.net/imaging/documents/app_note_image_res、これらの問題が確認の詳細については、ズームも(例えば、512 × 512を使用目的とスキャンフォーマットの限界に、画像の解像度を向上させるために、最大使用できます。 PDFファイル)。
- 高速なスキャン速度(例えば、2μ/ピクセル)と低いレーザ出力、一般的に、とタイムラプスイメージングのための特に重要なのin vivoイメージング、光毒性の問題(すなわち、フリーラジカルの蓄積が)強調する必要のある最小限のテクニックインのレベル(例えば、1%)、可能な限り使用されるべきである、と同様に顕著な情報をキャプチャするための十分な最小の解像度のスキャン形式。
- 画像の解像度を向上させるために、スキャン平均が("カルマン")買収時に使用することができます。遅いスキャン速度も解像度を向上させることが増加のレーザーは、光毒性と漂白の問題を悪化させる時間を、ドウェル。これらの方法はいずれも、Zシリーズ、我々は"時間のぼかし"と呼ぶ現象を介して迅速な変更を取得できない可能性があるため、時間経過に理想的ではないことに注意してください。ラインによる対フレームで平均化、単一平面内ではなく、Z -深さで"時間のぼかし"の問題を排除するために助けることができることに注意してください。
- シグナル強度が低いと最大画像解像度は共焦点絞り(ピンホール径)を増やす、(例えば、単に細胞数を数えて)不要な場合は、信号をブーストするために使用することができます。しかし、これは1より大きい風通しの良いユニットは、画像品質の急速な損失につながる値に絞りを調整し、光毒性を低減し、漂白、レーザー強度を低く保つのに役立ちます。
- 迅速なスキャンモードを("フォーカスX4")を使用してZ深度の寸法を定義します。信号強度は、一般的にZ深度とともに減少するので、それが最も表面的で最低の深さと最後にZスタックの取得を開始するには最適です、これが発生する漂白重要な前に取得するより難しい信号が可能になります。
- イメージの深さ全体に十分な信号検出を確認してください。必要に応じて、z次元の明るさの補正機能は、("ブライトZ")指定された深さで画像取得のパラメータを調整するために使用することができます。
- 実験的なニーズに応じてz次元のステップサイズを設定します。例えば、私たちの最初の例で(図1)我々は単にこのように我々は15ミクロンにzデプスを設定し、網膜当たり五から七までのイメージを取り、連続した日間で個々の網膜における"細胞の国勢調査"を取っていた。この戦略は、私たちは、画像間に携帯電話を重複させながら、それぞれの網膜をサンプリングすることができました。 2番目の例(図2)においては、我々は空間的に相関するために必要なのGFPとmCherry信号迅速な4Dタイムラプスムービーを実行する、従って我々は理論的な横方向の解像度を3倍にするZスタック画像を許可されて妥協をステップサイズを設定します。ごとに5分から10分をとって、それでも個々の細胞の細部を解決するために提供される。
- 画像を取り込む("XYLZt")して保存する。シリアルタイムラプス実験を(下の#4を参照)を行う場合、次の魚に移ります。迅速なタイムラプスイメージングのための下記の#5を参照してください。
4。シリアル"キャッチ&リリース"イメージング:連続日間に個々の魚の細胞の変化を追跡する手法
- "キャッチ&リリース"プロトコルは、時間の魚の量を最小限に抑えるために使用されて固定されると、実験ごとに結像さの魚の数を増やすために。この手法の有用性(例えば、マムら 2006 2)日間にわたって展開生物学的過程に限定されます。このアプローチの利点の1つは、内部的に制御することが観測されるすべての変更を可能にすることです。むしろ集団全体ではなく、個々の異なる状態の間、すなわち、比較。例えば、特定の組織に存在する標識細胞の数の変更の追跡は、最初に標識された細胞の数は個々の魚の間に大きく変化しても正確に行うことができます。プロドラッグ誘導される細胞のアブレーションアッセイ3,5のコンテキスト内でこのプロトコルを使用するための方法はここに提供されています。
- 時間をかけて個々の魚の標的細胞型のアブレーションと再生を視覚化するために、共焦点画像はすぐに回復期間(リカバリイメージ)中のプロドラッグの除去(後処理)と続く、プロドラッグの投与(前処理)する前に買収されています。
- 前処理のイメージング:魚がマウントされており、上記のように撮像されています。いったん魚がそれらが胚の培地中に放出(+ドラッグ)、28.5でインキュベートされるイメージングされている° C治療後のイメージングセッションまで。二つのチームで働いて、1本の取り付けや魚をリリースする、他のイメージングは、日ごとに画像化することができる魚の数を最大にする良い方法です。
- イメージング後、単一の皿にすべての魚は、胚培地のみ( - PTU + /)でtricaineを含む胚の培地を交換してください。
- 魚をリリースするには、幼虫の両側にアガロースを切って、魚の胚の培地中で自由に浮かぶまで、静かにアガロースをいじめるために宝石屋鉗子を使用してください。
- プロドラッグ誘起アブレーション:胚の培地(+ / - PTU)を含むマルチウェルプレートのウェル個々に転送幼虫+プロドラッグ(例えば10mMのメトロニダゾール、MTZ)を。正確な最終的なプロドラッグの濃度を確保するために我々一般的に分注し胚媒体の指定された量(+ / - PTU)を各ウェルにドラッグの2X濃度(例えば、20 mM)を含む。 1Xに最終的なプロドラッグの濃度をもたらすために - 魚は、胚の培地の等量(PTU + /)でウェルに添加されています。
- 標的細胞のアブレーションを確認できるまで28.5 ° Cでインキュベートする。
注:成功したアブレーションを達成するために必要なプロドラッグの治療法は、標的細胞の種類に応じて異なります。プロドラッグ濃度と治療期間は、> 10mMのMTZ、高濃度は一般毒性、などの原因となることに注意して、経験的に決定する必要があります。さらに、断片化されたレポーターシグナルのperduranceは、共焦点顕微鏡を十分に細胞の損失を視覚化するために必要とされるいくつかの例では、アブレーションの成功の評価を複雑にすることができます。 - 治療後の画像:魚が同じ組織に最適な指向と上記のように結像されるようにマウントされている。与えられたプレート上のすべての魚を撮影したら、それらが胚の培地(+ / - PTU)に放出されている個々のウェル(上記のような)に、28.5℃でインキュベートアブレーション細胞型の再生を可能にする。
- リカバリに必要な魚と時間の年齢にもよりますが、アッセイのこの段階で魚を供給する必要があります。我々は、最適な生存を確保するようなゾウリムシやワムシなどのライブ食品を使用してください。それは魚が低ボリューム(例えば、96ウェルプレート)で維持されている場合は特に、また、毎日新鮮な培地を提供することをお勧めします。
- 回復のイメージング:細胞置換の速度を記録するために、魚が回復期間中は日常的にイメージングすることができます。動力学が確立されたらアッセイは、興味のある時点(例えば、完全回復)でリカバリイメージを取得することによって簡素化されます。図1は、網膜細胞の再生の我々の研究から、このアプローチの例を示します。
- 実験魚の終了時に氷上で20倍tricaine(15.3μM)溶液への浸漬により安楽死されるべきである。
5。迅速なタイムラプスイメージング。
- 複数fluorphoresの急速なタイムラプスイメージング(すなわち、"ムービー")の場合は、光毒性の問題を最小限に抑える技術が(上記参照)重要です。前述のように、このテクニックは、イメージング、最高同時ではなく、シーケンシャル可能fluorphoresに最適です
- 28.5で魚を維持℃の加熱段階、ITOガラス発熱体、または同様のを使用して。
- (例えば、倒立顕微鏡用O -リングシールされたカバースリップ)温度及び浸透圧を安定化するための蒸発を減らすための方法を使用してください。
- 延長回以上、自動取得を使用している場合は、z次元における成長および/またはドリフトを可能にするためにスタックサイズを設定してください。
- 時間間隔とスキャンの数を("TimeScan"または"TimeController")に設定します。取得率は、イメージングおよび/または興味の細胞集団の光毒性感度特性により適宜増減生物学的プロセスのダイナミクスに応じて経験的に確立する必要があります。
- 画像を取り込む("XYLZt"ボタン)して保存する。
- "ムービー"を構築するために、関心のある分野は、x、y、zの次元で定義して整列する必要があります。完全なプロセスは、このプロトコルの見直しの範囲を超えていますが、いくつかのソフトウェアプログラムはまた、4D画像アセンブリ(Volocity、アミラ、など)中にズーム、回転、パン機能を容易にする利用可能です。
6。 ImageJのフリーウェアを使って、スペクトルの分離の画像処理
- 最適に、マルチレポーターのイメージング実験を行うときにはよくスペクトル分離されているfluorphoresを使用するのが最適です。しかし、これはいつも実用的および/またはことはできません。ここでは、このケースのGFPとYFPで、励起および発光プロファイルが重複しているfluorphoresを分離する処理の方法における簡便な方法を提供する。提供される例では、我々は、タイムラプスイメージング技術は、YFPとNTR - mCherryで標識された網膜双極細胞の標的アブレーションと再生中に、GFPで標識された網膜"幹細胞"、ミュラーグリア細胞の挙動を追跡するために、上記の使用している(図2)。
- 連続イメージングモードとオーバーラップする蛍光体が独立して取得し、部分的に(GFP / YFPの設定の例については上記参照)、それぞれ、分離することができる可変バリアフィルタを使用して画像を収集する。クロストークを除去するために、我々はから別のチャンネルの信号を除去する単純なイメージ減算の戦略を使用してください。
- 画像減算処理:インストールリットルImageJの最新バージョン(http://rsb.info.nih.gov/ij/notes.html)、遺伝子座は、バイオフォーマットツール(http://www.loci.wisc.edu/bio-formats/imagej) 、およびスタックプラグイン(http://www.med.harvard.edu/JPNM/ij/plugins/Align3TP.html)を合わせます。
- 画像ファイルを開くために遺伝子座バイオフォーマットのインポートプラグインを使用して、単純に、ImageJのウィンドウに対象のファイルをドラッグすると、インポートツールを起動します。ロード後、"チャンネルのツール"(+ Ctrl + Zをシフト)の下に"分割チャネル"のインポート]ウィンドウのチェックボックスまたは"分割チャネル"タブを使用して、個々のスタックにチャネルを分割する。
- 3 TPのプラグイン(プラグインは、>スタックが> 3 TPを揃えるALIGN)ALIGNによって整列を開始します。スタックは、適切な減算を確保するために整列する必要があります。第二の最初のドロップダウンボックスや調整不良のスタック内の参照のスタックを選択します。 "使用するXY相対原点"と"USE Z相対的起源"のチェックボックスをオンにし、"OK"をクリックします。
- アライメントプロセスを開始するには、"ボリューム登録"ボタンをクリックしてください。新しいウィンドウが整列のパラメータを含むことが表示されます。このセクションはプラグインのディストリビューターによって最適化されている、何も修正は必要ありません、単に"OK"をクリックします。
- 終了したら、"配向スタック"ウィンドウが表示されます。整列ウィンドウから"出力"を選択し、[出力]ウィンドウが表示されます。このウィンドウは、最適化されず、修正を必要とされていません。 "OK"をクリックします。新しいスタックは、ファイルのタイトルの末尾に"配向"を使用してワークスペースに表示されます。
- クロストークは、"画像の電卓を"(プロセス>画像の電卓)を使用して削除されます。 Image1のドロップダウンボックスとimage2ドロップダウンボックスで減算に使用されるスタックで減算されるスタックを選択します。操作]ドロップダウンボックスで"減算"を選択し、"OK"をクリックします。 ImageJは、"はい"を選択、スタックを処理するために要求されます。新しいスタックがオーバーラップするチャネル間のクロストークを除去しているどの表示されます。
- アライメントと減算スタックがマージする必要がある前に、同じ画像の構造を再作成する。チャンネルのツールウィンドウの"マージチャンネル"を選択します。ツールを使用すると、hyperstackされる4つのスタックをマージすることができます。
注:連結ツール(画像>スタック>ツール>連結)を使用して、希望の順序で4つ以上のスタック、連結スタックをマージする。 hyperstack(hyperstackの画像> hyperstack>スタック)に連結されたスタックを変換する。スタックの連結深さ、時間、チャンネル(ZCT)の順序を変更する、このニーズが表示されるドロップダウンボックス内でリセットされる。xyztcに"注文"を設定し、設定した"チャンネル"、"スライス"と"フレーム"によるとスタックの数、スタックの深さ、および時間点の数、それぞれ.. - 最後に、すべてのチャンネルは、カラー表示の明るさとコントラストを調整、およびTIFFファイルとして保存する必要があります。ここからは、RGB、モンタージュ、z軸投影、または時系列への変換は、元のファイルと同じプロセスです。
7。代表的な結果
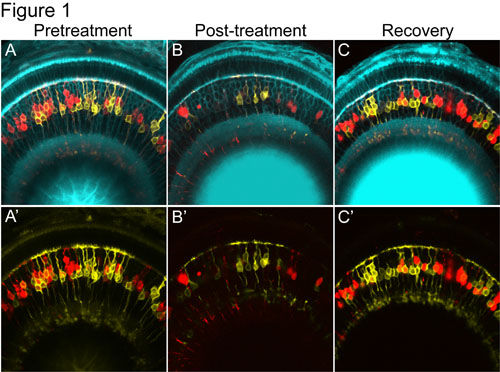
図1網膜双極細胞(赤血球)を発現するNTR - mCherryの標的喪失と再生を示す共焦点画像のタイムラプスシリーズ。治療前に&')黄色に示すように"制御"双極細胞、および赤で示されている"標的"バイポーラのニトロ-チェリー融合タンパク質の膜タグYFPレポーターのモザイクの表現があります。 B&B')黄色の"制御"双極細胞は、免れるされている間メトロニダゾールで治療後、赤ニトロレダクターゼを発現する双極細胞は、失われます。これは、このアブレーションの方法論の高度に特異的な性質を示します。メトロニダゾールが削除されるC&C')、NTR発現(赤色)のセルのリターン。

図2。GFPとYFPがきれいに、次の買収を分離することを可能にする画像減算処理の例を示します。減算、GFP(緑色)とYFP(疑似カラー紫)の画像が並んでいるの前に&')。 B&B')減算処理では、GFPで標識したミュラーグリアがより容易に検出できるように、YFP標識双極細胞はGFPの画像から削除することができます。 C&C")GFPの共発現(緑)とmCherry(赤色)は矢印で示されている細胞で明らかである。ミュラーグリア細胞のマーカーと双極細胞のマーカーの共発現が示すので、その双極細胞のアブレーションでは、失われた細胞を置き換えるためにミュラーグリアがトリガされます。この解釈は、哺乳類や魚類の両方に損傷誘発性"幹細胞"とミュラーグリア細胞を巻き込む網膜再生の最近の研究に沿ったものです。
ディスカッション
このビデオでは、我々は多色共焦点タイムラプスイメージングと標的細胞のアブレーションのために使用するテクニックの概要が提供されています。標的細胞のアブレーションが神経回路の機能および細胞特異的神経再生のパラダイムを研究するために使用されている間我々は、 生体内での関心の複数の細胞型の動作を監視するためのタイムラプスイメージング法を用いています。の例では、これらのアプローチから収集することができますいくつかの利点を強調示した。おそらく最も重要なのは、タイムラプスイメージングは、内部で制御パラダイムを提供し、観察されたとすべての現象は、以前の状態に戻って関連付けることができます。これは直接ではなく、推測の比較は定量化が容易に相対的な変更を加えると、集団内のばらつきに関連する実験的な"ノイズ"を減らし、実験的なタイムポイント間を行うことができます。多色イメージングの利点は、相互作用および/または隣接する細胞の種類の変化を視覚化する機能です。例えば、ミュラーグリアにラベルを付けるトランスジェニックラインを使用して、我々は今、離散網膜細胞の亜集団の損失にこれらの潜在的な損傷によって誘発された幹細胞の応答を予想されています。我々はまた、神経回路形成2の新たなメカニズムを定義するには、このアプローチを使用している。最後に、細胞再生の研究に加えて、我々は最近、様々な行動パラダイムと電気生理学的アッセイを用いて神経細胞サブタイプこのように離散的な神経回路の機能的役割を調査するためにNTRベースのアブレーションシステムを使用し始めている。このような研究にゼブラフィッシュを用いてのユニークな利点は、彼らの再生能力のために、誘導の赤字は一時的なもの、ということです。このように、タイムラプスイメージングアッセイと相関させることによって我々は、神経再支配につながるメカニズム、ならびに、機能回復のために必要な神経再生の程度を象徴化することができます。
提供されるメソッドは、多くの異なる質問に適合させることができます。例えば、アブレーションと再生の同様の分析は、どのトランスジェニック定義可能な細胞のサブタイプに適用することができます。総称して、このような研究は、個々の細胞型のレベルと離散的幹細胞のニッチ内の再生の我々の理解を拡大する可能性があります。
開示事項
謝辞
我々は、博士に感謝します。原稿上で有益なコメントをメーラセナとジョナサンマティアス。我々は、博士に感謝する。トランスジェニック系統を提供するためのマイケルパーソンズ、パメラレイモンド、そしてレイチェルウォン。動物実験はプロトコル07-12-003を承認MCG IACUCによって定められたガイドラインおよび規制に準拠して行った* B.この作品は、JSMにNIH R21 MH083614とダイムバジルOコナースターターScholarの賞の月によってサポートされていました
資料
1。試薬:
Danieauのソリューション:
- 塩化ナトリウム(フィッシャー、S271 1)
- 塩化カリウム(フィッシャー、P217 500)
- HEPES(フィッシャー、BP310500)
- 硫酸マグネシウム(フィッシャー、M65 500)
- 硝酸カルシウム(フィッシャー、C109500)
- ペニシリン - ストレプトマイシン(フィッシャー、ICN1670049)
その他の試薬:
- 低融点アガロース(フィッシャー、BP165 - 25)
- Tricaneメタン(フィッシャー、NC9435281)
- N -フェニルチオ尿素(フィッシャー、NC9968868)
- メトロニダゾール(フィッシャー、AC21034 - 1000)
2。消耗品:
- 深いペトリ皿(フィッシャーサイエンティフィック/コーニング、08-772-32)
- デュモン#5微細な鉗子(フィッシャー、NC9404145)
3。設備:
- ズームステレオスコープ(オリンパス、SZ51)
- 蛍光のズームステレオスコープ(オリンパス、SZX16)
- 共焦点顕微鏡(オリンパスFV1000)
- デジタルブロックヒーター - Isotemp(フィッシャー、11 - 715 - 125DQ)
- バーンズテッド/ Thermolyneベンチトップインキュベータ(フィッシャー、11-702-4)。
参考文献
- Köster, R. W., Fraser, S. E. Time-lapse microscopy of brain development. Methods Cell Biol. 76, 207-235 (2004).
- Mumm, J. S., Williams, P. R., Godinho, L., Koerber, A., Pittman, A. J., Roeser, T., Chien, C. B., Baier, H., Wong, R. O. In vivo imaging reveals dendritic targeting of laminated afferents by zebrafish retinal ganglion cells. Neuron. 52, 609-621 (2006).
- Curado, S., Anderson, R. M., Jungblut, B., Mumm, J., Schroeter, E., Stainier, D. Y. Conditional targeted cell ablation in zebrafish: a new tool for regeneration studies. Dev Dyn. 236, 1025-1035 (2007).
- Ren, J. Q., McCarthy, W. R., Zhang, H., Adolph, A. R., Li, L. Behavioral visual responses of wild-type and hypopigmented zebrafish. Vision Res. 42, 293-299 (2002).
- Pisharath, H., Rhee, J. M., Swanson, M. A., Leach, S. D., Parsons, M. J. Targeted ablation of beta cells in the embryonic zebrafish pancreas using E. Coli nitroreductase. Mech Dev. 124, 218-229 (2007).
- Andersen, E., Asuri, N., Clay, M., Halloran, M. . J Vis Exp. , (2010).
- O'Brien, G. S., Rieger, S., Martin, S. M., Cavanaugh, A. M., Portera-Cailliau, C., Sagasti, A. Two-photon axotomy and time-lapse confocal imaging in live zebrafish embryos. J Vis Exp. , (2009).
- Graeden, E., Sive, H. . J Vis Exp. , (2009).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved