このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
アデノ随伴ウイルスベクターの頭蓋内注射
要約
ここでは、視覚野の神経細胞とグリア細胞の蛍光標識用AAVベクターの頭蓋内注射を提示する。
要約
蛍光タンパク質を発現するように設計ウイルスベクターの頭蓋内注射は、 インビボおよび脳切片の両方で異なる脳領域での細胞の特定のサブセットの可視化のための多目的な標識法です。 、蛍光色素の注入とは異なり、ウイルスのラベリングは、個々の細胞型を標的とトランスジェニックマウス系統を確立するよりも安価で時間がかかりますいます。この手法では、アデノ随伴ウイルス(AAV)ベクターは、定位座標、マイクロピペットと周囲の組織に与えるダメージを最小限にと希望する領域にAAVの正確な配達のための自動化されたポンプを用いて頭蓋内に注入されます。注入パラメータは、注射の注射、注入位置、注入量、速度、AAV血清型および遺伝子発現を駆動するプロモーターで動物の年齢を調整することによって、個々の実験に合わせて調整することができます。選択された条件に応じて、ウイルス誘発性遺伝子の発現がダウンして樹状突起棘のレベルまで、細胞を、個々の細胞や微細な細胞プロセスのグループの可視化を許可することができます。ここに示されている実験は、マウス一次視覚野の神経細胞とグリア細胞の標識のために緑色蛍光タンパク質を発現する二本鎖AAVの注入を示しています。
プロトコル
1。ウイルスの取り扱いと保管
- 適切な保護と取り扱い技術が使用されるウイルスの生物学的安全性レベルに基づいて選択する必要があります。これらの慣行は、CDCのウェブサイト上で利用可能な微生物学的および生物医学研究所第 5版、のバイオセーフティで見つけることができます。
( http://www.cdc.gov/od/OHS/biosfty/bmbl5/bmbl5toc.htm )。 AAVベクターの使用は、バイオセーフティレベル1(BSL - 1)が承認されています。ウイルスを処理する際にここに示されている実験では、白衣や手袋はBSL - 1のエージェントを処理するための手順に従って、着用されます。 - ウイルスの活動を維持するには、繰り返しの凍結融解を避けるために少量のアリコートに分割することをお勧めします。
- 不要なオブジェクトのBSCをクリアし、70%エタノールで表面を殺菌することによってウイルスを小分けするためバイオセーフティキャビネット(BSC)クラスIIを準備します。 AAV -汚染された廃棄物を収集するためのフードに10%漂白剤溶液の入ったビーカーを置きます。また、BSCに入れ滅菌0.5mLを試験管とドライアイスの容器です。
- BSC外部の氷の上にウイルスストックを解凍。
- 渦のウイルスとBSCの内部にチューブを開きます。
- 、0.5mLをチューブに必要な一定量の体積(例えば5μL)をピペットでチューブを閉じ、に急速冷凍ウイルスドライアイスに入れてください。
- すべてのウイルスが小分けされている場合、ウイルスのチューブと10%の漂白剤を含む廃棄物の容器にピペットチップを処分。
- フードから廃棄物のコンテナを削除し、さらに10%の漂白剤を追加してから、シンク下の漂白剤を注ぐ。あなたの研究所のバイオセーフティの役員の指示に従い、バイオハザード容器にプラスチック廃棄物を処分してください。
- 10%漂白剤で、ウイルスと接触したすべての機器または表面を清掃してください。手袋を捨てる。
- -80 ° Cの冷凍庫に保管してアリコート。
2。手術
- 吸収実験台の紙と外科領域をカバー。手術器具は、所属機関のバイオセーフティおよび動物使用のガイドラインに従い、無菌条件下で滅菌し、手術が行われる必要があります。
- ウイルスにマイクロピペットをロードするために専用される外科領域に隣接するエリアを選択し、吸収実験台の紙をかぶせます。このエリアの氷の容器にウイルスのアリコートを置き、そして手術が行われているとして、ウイルスは氷上で解凍することができます。
- ウイルスと接触すること等、ピペットチップの処分のために専用のウイルスの処理の領域で10%の漂白剤の廃棄物コンテナを設定します。
- 約20ミクロンの先端の直径にガラスWiretrolのマイクロピペットを引き出します。マイクロピペットの平滑末端での鉱物油の小滴を置き、マイクロピペットで提供されるワイヤーのプランジャーを挿入します。
- マイクロポンプのアームのクランプでマイクロピペットを固定します。
- は0.5 mg / kgの用量におけるブプレノルフィン皮下マウスを注入する。 200 mg / kgの用量で腹腔内注射によりAVERTINとマウスを麻酔し、切開を入力してから毛を防ぐために十分な大きさの余白を残すことを確認しながら、外科はさみで頭の上から毛を取り除く。
- 手術中C 37℃の体温を維持するためにstereotaxのベースに加熱毛布を添付しstereotaxにマウスを固定します。
- エリアを殺菌するためにエタノールとbetadineの三交互スクラブで頭を浸す。
- 手術中に目の潤いを保つために各眼でTobradexの眼軟膏のドロップを置きます。
- 頭の正中線の下切開を行い、頭蓋骨を露出させる背部皮膚を引っ張る。
- 慎重に先の細いピンセットを用いて頭蓋骨から筋を取り除く。
- 定位座標を用いて注入する領域を見つけ、外科ペンで頭蓋骨をマーク。
- 、頭蓋骨の亀裂まで1.4ミリメートルバリ、頭蓋骨の薄い領域に直径約2mmと歯科用ドリルを使用するいくつかのセグメントに薄くなった領域を分割する。
- この手順では、滅菌生理食塩水のアプリケーションと頭蓋骨の潤いを保つ。
- 優しく極細先端鉗子を使用して間伐頭蓋骨セグメントを削除することにより、開頭術を行います。
3。注射の準備
- 蓋の上に配置キムワイプで、パラフィルムの小片の上にウイルスのウイルスとピペット1.5uL(1UL注射用)のチューブを開きます。
- ウイルスストックにマイクロピペットの先端を配置し、手動でプランジャーを撤回。難易度はマイクロピペットへのウイルスストックを描く経験している場合、先端はわずかにガラスの小さな部分を分割するマイクロピペットでキムワイプを貫通することが拡大することができます。
- ウイルスの少量まで、プランジャーの上に下マイクロポンプのアームは、マイクロピペットの先端から払拭される。綿の先端のアプリケーターを持つこの小さなドロップを削除し、WASTのアプリケーターを捨てるeのコンテナ。
- マイクロピペットは、脳に低くなるように目詰まりを防ぐために、マイクロピペットの先端に鉱物油の滴を適用します。
4。ウイルスのインジェクション
- XとYの定位座標を用いて、注入される領域の上にマイクロピペットを置きます。この実験では、一次視覚野を特定するために使用される定位座標はブレグマに2.7ミリメートル後部と正中線に2.5ミリメートル外側です。非常にゆっくりと適切なZ位置に(1mm/1minuteのおおよその速度で)マイクロピペットを下げます。
- SYS Micro4マイクロポンプのコントローラのボックスに希望する注入パラメータを入力し、注入を開始する。この実験では、10分にわたって1マイクロリットルを注入の速度として使用されます。
- 注入が終了すると、削除の際にウイルスの流出を防ぐために一から二分間休息するピペットを残す。この期間の後、非常にゆっくりと脳(上記と同じ率)からマイクロピペットを取り外します。
- 頭皮を縫合し、組織の接着剤でそれを封印。は0.1 mg / kgの用量次の72時間にわたって毎に8〜12時間でブプレノルフィンの皮下動物を注入、または動物が痛みの兆候を展示している限り。それはambulatingとそのケージに戻される準備がされるまで、動物は熱ランプの下で回復することができます。イメージングの実験は、目的のインキュベーション時間(ウイルス注射後数日から数週間)の後に開始することができます。
5。クリーン
- 10%漂白剤でマイクロピペットをすすぎ、鋭利物容器に捨てる。
- セクション1と同様に廃棄物容器に廃棄してください。
- バイオハザードビンに実験台の紙を捨て、10%の漂白剤とウイルスと接触している可能性がありますすべての表面や楽器を拭う。
- 未使用のウイルスは、凍結/解凍サイクルは、ウイルスの劣化を引き起こすことを念頭に置いて、再び凍結されることがあります。
6。代表的な結果
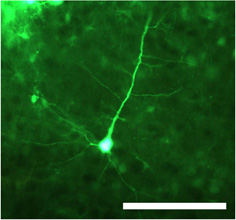
図1は、。CMVプロモーターの制御下に緑色蛍光タンパク質(GFP)を運ぶ二本鎖アデノ随伴ウイルス血清型1(dsAAV S1)の注入後にニューロンを導入した。細胞体だけでなく、近位と遠位樹状突起は、落射蛍光顕微鏡を用いて画像の固定のセクションにはっきりと見える。スケールバー= 100μmの。
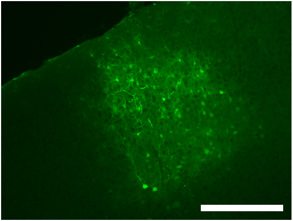
図2。ウイルスの拡散の程度だけでなく、標識された神経細胞、グリア細胞およびプロセスを示すdsAAV S1を使用して一次視覚野における頭蓋内ウイルスの注射の典型的な標識。スケールバー= 250μmの。
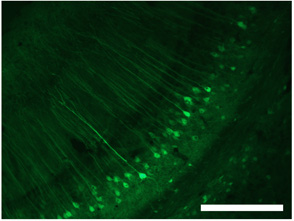
図3。dsAAVのS1を使用して海馬の細胞の標識。スケールバー= 250μmの。これらの数字はロウリーらを適合させたもの。2009 1
ディスカッション
ウイルスを介した遺伝子デリバリーは、神経学的プロセスと脳疾患1,2,3の治療の研究のための大きな可能性を秘めている。この技術の偉大な多様性は、蛍光in vitroおよび in vivo 4 の両方のイメージングのための細胞を標識するために悪用される可能性があります。ここでは、神経細胞と強化された緑色蛍光タンパク質を発現する二本鎖アデノ関連ウイルスを用いた...
開示事項
謝辞
この作品は、NIH(EY012977)、バローズウェルカムファンド、ホワイトホール財団、スローン財団(AKM)から医歯薬学総合研究でのキャリア賞からの補助金によって可能となった。
資料
| Name | Company | Catalog Number | Comments |
| St–lting Mouse and Neonatal Rat Adaptor | Stoelting Co. | 51625 | Regular stereotax for securing animals for surgery may be substituted |
| Extra Fine Bonn Scissors, 8.5cm, straight tip, cutting edge 13mm | Fine Science Tools | 14084-08 | |
| Eye Dressing Forceps, 10cm, tip width 0.5mm, curved | Fine Science Tools | 11152-10 | |
| Dumont #5/45 Forceps- Dumoxel Standard Tip, 11cm, angled | Fine Science Tools | 11251-35 | Extra-fine tipped forceps for performing craniotomy |
| Standard Pattern Forceps, straight, 2.5mmx1.35mmtip, 12cm | Fine Science Tools | 11000-12 | |
| Microtorque Control Box and Tech2000 handpiece | Ram Products, Inc. | TECH2000ON/OFF | Dental drill |
| Micro Drill Stainless Steel Burrs 1.4mm tip diameter | Fine Science Tools | 19008-14 | |
| Wiretrol micropipettes, to deliver 1-5 Ul | VWR international | 5-000-1001 or 53480-287 | |
| Mineral oil | VWR international | 29447-338 | |
| Manual Micromanipulator and Tilting Base (right-handed) | World Precision Instruments, Inc. | M3301-M3-R | Used for determining stereotaxic co-ordinates |
| UltraMicroPump (UMP3) (one) with SYS-Micro4 Controller | World Precision Instruments, Inc. | UMP3-1 | |
| Sutures | VWR international | 95056-952 | |
| P-97 Flaming/Brown Micropipette Puller | Sutter Instrument Co. | P-97 | |
| Tobradex | Available from your institution’s veterinary services |
参考文献
- Kaplitt, M. G., Leone, P., Samulski, R. J., Xiao, X., Pfaff, D. W., O'Malley, K. L., During, M. J. Long-term gene expression and phenotypic correction using adeno-associated virus vectors in the mammalian brain. Nat Genet. 8, 148-154 (1994).
- Harding, T. C., Dickinson, P. J., Roberts, B. N., Yendluri, S., Gonzalez-Edick, M., Lecouteur, R. A., Jooss, K. U. Enhanced gene transfer efficiency in the murine striatum and an orthotopic glioblastoma tumor model, using AAV-7- and AAV-8-pseudotyped vectors. Hum Gene Ther. 17, 807-820 (2006).
- Lo, W. D., Qu, G., Sferra, T. J., Clark, R., Chen, R., Johnson, P. R. Adeno-associated virus-mediated gene transfer to the brain: duration and modulation of expression. Hum Gene Ther. 10, 201-213 (1999).
- Lowery, R. L., Zhang, Y., Kelly, E. A., Lamantia, C. E., Harvey, B. K., Majewska, A. K. Rapid long-term labeling of cells in the developing and adult rodent visual cortex using double-stranded adeno-associated viral vectors. Dev Neurobiol. 69, 674-688 (2009).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved