このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
弁内皮細胞の単離
要約
我々は、心臓弁内皮細胞(VEC)の純粋な集団を分離して培養する方法を提供する。 VECがカスプやリーフレットのいずれかの側から分離し、直ちに以下のことができる、基本的な間質細胞(VIC)の分離は簡単です。
要約
心臓弁は、心臓血管系を介して単方向の血流を維持する責任を持つことになります。彼らは寿命にわたって数十億回も開いたり閉じたりするように、これらの薄い、繊維状の組織が重要な機械的ストレスにさらされる。これらの組織の驚くべき耐久性は、内皮常駐弁膜(VEC)と間質細胞によるものである(VIC)は、常に地元の機械的および生物学的信号に応答して、修理および改造。ごく最近我々 は in vitro の実験において重要な役割を果たしているため、これらの細胞のユニークな行動を、理解し始めている。特に困難は、VECの分離と文化です。特別な注意を払ってその組織が、最終的なメッキを介してホストから削除された瞬間から使用する必要があります。ここでは直接分離、側面の特定のアイソレーション、文化、およびVECの純粋な集団の検証のためのプロトコルを提示する。我々は表面の細胞を取り除くために穏やかな綿棒スクレイピング技術に続いて酵素消化を使用してください。これらの細胞をチューブに回収し、ペレットに遠心分離されています。ペレットを再懸濁し、コラーゲンI、マトリックスをプレコート培養フラスコに播種しています。 VECの表現型は、接触によって確認され成長し、血管内皮特異的などPECAM1(CD31)のようなマーカー、フォンヴィレブランド因子(vWF)、及びα-平滑筋アクチン(α- SMA)の負の発現の発現を阻害した。 VECの機能的特性は、アセチル化LDLの高レベルに関連付けられています。血管内皮細胞とは異なり、VECは通常、胚弁形成1の間に発生する間充織、に変換するユニークな能力を持っている。これはまた、in vitro培養における有意に延長後の合流時に発生する可能性がありますので、注意が合流点付近で通過するためになされるべきである。 VECの単離後、VICの純粋な集団は、簡単に取得することができます。
プロトコル
1。準備
- 対象となる機器のトレイに以下の項目をオートクレーブ:
- 鋸歯状の組織鉗子 - リーフレットの組織の処理について
- 組織のはさみ(8センチ) - リーフレットの組織と尖をトリミングする
- 綿棒 - リーフレットまたはカスプから内皮層を分離するための
- 無菌コラゲナーゼ溶液を作る
- 18MΩ250mlの水に粉末DMEMの4.0グラムを追加。
- 重炭酸ナトリウムの1.11グラムを追加。
- (600 U / mL)をコラゲナーゼの18万台を追加。
- 1%(3ML)ペニシリン/ストレプトマイシンを追加。
- 7.2〜溶液のpHを調整します。
- 270 mLに解決策を持ち出す。
- 0.2μmのフィルターを通過することで解決策を滅菌する。
- 滅菌ウシ胎児血清の10%(30ml)を追加。
- 滅菌内皮細胞の培地を作る
- 18MΩ水400mlに粉DMEMの6.7グラムを追加します。
- 重炭酸ナトリウムの1.85グラムを追加。
- (50 U / mL)をヘパリンの25,000台を追加。
- 1%(5ml)をペニシリン/ストレプトマイシンを追加。
- 7.2〜溶液のpHを調整します。
- 450ml中に解決策を持ち出す。
- 0.2μmのフィルターを通過することで解決策を滅菌する。
- 滅菌ウシ胎児血清10%(50mLの)を追加します。
- 無菌の間質細胞の培地を作る
- 18MΩ水800mlに粉DMEMの13.37グラムを追加。
- 重炭酸ナトリウムの3.7グラムを追加。
- 1%(10ml)をペニシリン/ストレプトマイシンを追加。
- 7.2〜溶液のpHを調整します。
- 900mLのためのソリューションを立ち上げます。
- 0.2μmのフィルターを通過することで解決策を滅菌する。
- 滅菌ウシ血清の10%(100mLの)を追加します。
2。心臓弁尖の分離
- 消費税の犠牲の後に心臓から直ちに無菌的大動脈根。
- 徹底的に冷滅菌DPBSで血液の大動脈根を洗う。それは、VECの死と細菌汚染を制限するために、できるだけ早くすべての血液成分を除去することが不可欠です。彼らはVECに潜在的に有害であるため、抗生物質と抗真菌薬は、この段階でお勧めされていません。
- 12 mLの冷DPBSで満たされた無菌の15 mLコニカルチューブのルートと場所から直接(3バルブあたり)弁尖を分離します。新鮮なDPBSで破片とリフィルを削除するには、数回振る。
- 氷の上で研究室に戻って輸送する。
- 実験室に到着すると、無菌フードの下で組織を持つコンテナを配置します。
3。内皮層の分離
- バルブごとに寒さコラゲナーゼ溶液(3リーフレット)の3mlの滅菌35mmディッシュを埋める。
- コラゲナーゼ溶液で満たされた皿に15 mLの試験管からすべての3つのリーフレットを置きます。
- 37℃で5〜10分間組織をインキュベート℃に
- ゆっくりとリーフレットの表面に乾いた滅菌綿棒を回転させることにより内皮層を取り除く。せん断応用の回転と量の方向は、試料の純度が非常に重要です。綿棒の回転が制御されたせん断を作成するあなたの手の直線運動に反対方向にする必要があります。このせん断は、組織から内皮細胞を持ち上げるものです。力の適用量は、組織の抵抗を感じるのですが、基底膜を貫通しないように十分なはずです。
- 時折、軽く先端繊維から細胞を取り除くために、コラゲナーゼ溶液内に綿棒。スワブが完了すると、内皮層の質感は以前より少しスムーズに感じるはず。
- 細胞懸濁液/コラゲナーゼを収集し、新しい滅菌15mlのチューブに移す。
- ペレットへ5分の任意の単離された細胞を1000 rpmでチューブを遠心し、上清を吸引除去する。同様に間質細胞を単離する場合、これらの細胞を遠心分離されている間に、そのプロトコルを実行します。
- 、15 mLの試験管に内皮ブタの培地3 mlを添加し、もう一度遠心し、吸引メディア。この第二の遠心分離は、そのような先端繊維などの不要な物質のいくつかをフィルタするのに役立ちます。
- コラーゲンをプレコートT - 25フラスコ(遠心分離管あたり1フラスコを使用)で内皮ブタの培地とプレートの細胞を5mLで遠心分離した内皮細胞を再懸濁する。
- 細胞は内皮培地を変更する前に、少なくとも2〜3日に成長しましょう。これは、細胞が回復し、分離プロセスはかなり厳しいですし、細胞の収率が低くなる可能性があるので分割するのに役立ちます。接触阻害が細胞形質転換につながる可能性があるので、それは合流の近くに継代細胞にとって非常に重要です。
4。サイド特定のアイソレーション用の60 mmの培養皿の準備
- アルミ箔(leafleあたり2ガラスの皿とライン60 mmのガラスシャーレをt)を。アルミ箔は、ガラスシャーレのが、他のアイソレーションのために再利用できるように、パラフィンを除去するのに役立ちます。
- 半分程度、料理中にパラフィンのビーズを配置し、オートクレーブ用カバー。
- オートクレーブが完了するとパラフィンは溶融になると、クールな平らな面に皿のアンサンブルを移動する。パラフィンは冷えると、それは硬くなりますし、針穿刺をサポートするレイヤーを作成します。
- 30分後、滅菌シャーレは、リーフレットの組織を固定するために隔離室として使用することができます。
5。サイド特定の内皮層の分離
- 側の特定の分離のための準備60ミリメートル培養皿上で15mlのチューブと場所からチラシを取り外します。
- ventricularis側が露出線維の側を離れるパラフィンの表面上に下向きになるようにリーフレットを操作する。内皮層を露出するリーフレットの端を固定。
- 各(上向きに面した)内皮表面に冷たいコラゲナーゼの数滴を置き、37℃で5〜10分のための組織をインキュベート℃を
- 前と同じように、静かにリーフレットの表面に乾いた滅菌綿棒を回転させることで内皮層を取り除く。せん断応用の回転と量の方向は、試料の純度が非常に重要です。綿棒の回転が制御されたせん断を作成するあなたの手の直線運動に反対方向にする必要があります。このせん断は、組織と他には何から内皮細胞を持ち上げるものです。力の適用量は、組織の抵抗を感じるのではなく、組織内に浸透していない十分なはずです。
- 時折、軽く先端繊維から細胞を取り除くために、コラゲナーゼ溶液内に綿棒。スワブが完了すると、内皮層の質感は以前より少しスムーズに感じるはず。
- 細胞懸濁液/コラゲナーゼを収集し、新しい滅菌15mlのチューブに移す。ラベルのサイド特異性を示している(同じバルブからチラシを一緒にプールすることができます)。
- ventricularis側は現在公開され、繰り返し行ってください(5.3から5.6まで)されるように、新しい培養皿にリーフレットを転送する。
- 一度にすべての細胞懸濁液/コラゲナーゼが収集され、任意の単離された細胞ペレットに5分間、1000 rpmでチューブを遠心し、上清を吸引除去する。同様に間質細胞を単離する場合、これらの細胞を遠心分離されている間に、そのプロトコルを実行します。
- 、チューブに内皮ブタの培地3 mlを添加し、もう一度遠心し、培地を吸引除去する。この第二の遠心分離は、そのような先端繊維などの不要な物質のいくつかをフィルタするのに役立ちます。
- コラージュをプレコートT - 25フラスコ(遠心分離管あたり1フラスコを使用)で内皮ブタの培地とプレートの細胞を5mLで遠心分離した内皮細胞を再懸濁する。
- 細胞は内皮培地を変更する前に、少なくとも2〜3日に成長しましょう。これは、細胞が回復し、分離プロセスはかなり厳しいですので、分割するのに役立ちます。あなたが収率が極めて低いことに気付いた場合、細胞間接着は、細胞増殖を促進するので、小さなフラスコやプレートに移行することを検討。接触阻害が細胞形質転換につながる可能性があるため合流点近くに通過することを忘れないでください。
6。間質細胞の単離
- バルブあたりのコラゲナーゼ溶液(3リーフレット)10mLで滅菌15 ml遠心チューブを埋める。
- 内皮細胞のリーフレットを拭き取り後、すぐにコラゲナーゼ溶液を用いて適切な15mlのチューブに配置します。
- (必要に応じて軽く攪拌)約12〜18時間インキュベートする。
- 細胞懸濁液/コラゲナーゼが均質化になるまで血清ピペットで軽く劣化した組織を混在させる。この均質化は、組織を分割し、間質細胞を放出するのに役立ちます。
- 1000 rpmで5分間消化組織を遠心し、上清を吸引除去する。
- 15mlの試験管に5 mLの間ブタの培地を追加し、もう一度遠心し、上清を吸引除去する。
- 間質ブタ媒体と板T - 75フラスコ中の細胞(遠心分離管あたり1フラスコを使用する)5mLに遠心分離した内皮細胞を再懸濁する。
- 細胞が間質細胞の培地を変更する前に少なくとも1〜2日に成長しましょう。期待されている内皮細胞が、よりもはるかに組織破片が存在します。細胞はまた、より高速なので、細胞収量とその性質の内皮細胞よりも合流して成長してください。
7。代表的な画像

図1 2〜3日の後の分離で単離された細胞の形態。 (A)VECは、典型的な内皮細胞形態とフォームの成長を促進するためのクラスタを示す。 (B)VICの形態は、一般に紡錘形、フラスコ全体に均等に分散している筋線維芽細胞に似ています。
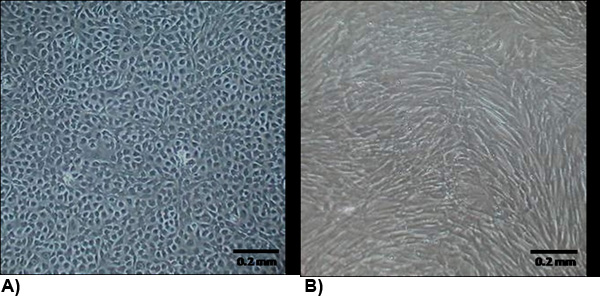
図2。コンフルエントで単離された細胞の形態。 (A)VECは、一般的に石畳と成長の接触禁止されている典型的な内皮細胞形態を示す。 (B)VICの形態は、一般に紡錘形としない成長の接触禁止されている筋線維芽細胞に似ています。
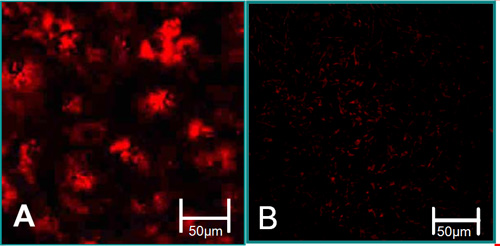
図3。単離された細胞の機能特性6。 ()VECは、アセチル化LDLの取り込みの高いレベル(赤)に関連付けられています。 (B)VICは、アセチル化LDLの取り込みの低レベルに関連付けられています。
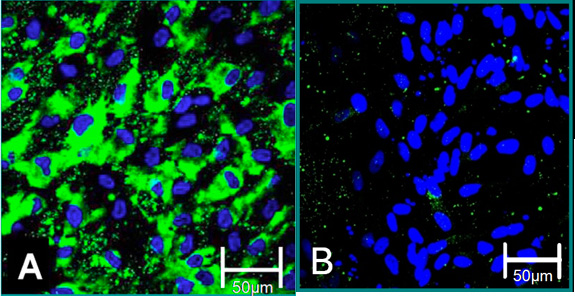
図4。単離された細胞の細胞マーカー6。 (A)VECの表現型は、von Willebrand因子(緑)、青(核)のための陽性染色に貢献しています。 (B)VICの表現型は、von Willebrand因子の負の染色に貢献しています。
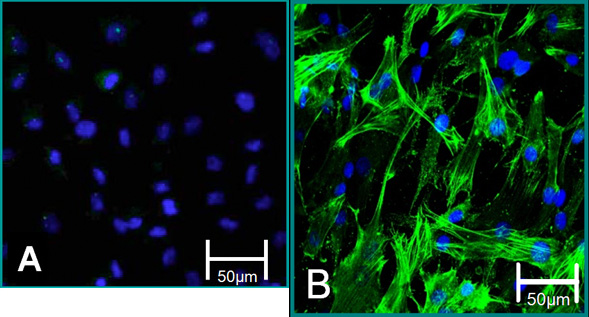
図5。単離された細胞の細胞マーカー。 (A)VECの表現型は、αSMA(緑)、青(核)のためのネガティブ染色に貢献しています。 (B)VICの表現型は、アルファSMA陽性の染色に貢献しています。
| 解離エージェント | 解離テクニック | 細胞コレクション | セルの数量 | セル 純度 | 汚染 |
| のCaCl 2のないEDTA(3MM) | 5、20、60分。 CaCl 2の添加前に | 20、60、120分。コレクションの前に | - | + / - | + + + |
| のCaCl 2のないEDTA(6MM) | 5、20、60分。 CaCl 2の添加前に | 20、60、120分。コレクションの前に | + / - | + | + + + |
| トリプシン- EDTA(0.5グラム/ L) | 5、10、15分。 非活性化の前に | 培地は、直ちに収集 | + | + | + + |
| コラゲナーゼII(300 U / mL)を | 5、10、15分。 非活性化の前に | 培地は、直ちに収集 | - 、+、+ + | - 、+ +、+ | + |
| コラゲナーゼII(600 U / mL)を | 5、10、15分。 非活性化の前に | 培地は、直ちに収集 | +、+ +、+ + + | + +、+ +、 - | - |
表1。予備弁膜内皮細胞の分離プロトコルの結果。
ディスカッション
弁膜生物学の理解は、弁内皮細胞の純粋な集団を分離して培養する技術的な問題によって損なわれている。典型的な分離方法は、基礎となる基礎行列または内皮接着剤の結合2,3の化学的解離の酵素消化を伴う。予備分離実験を定性的に解離剤と潜伏期間を変化させることによって評価した。これらの実験の結果は、最大60分の場合とEDTA(またはトリプシン- EDTA)インキュベーション?...
開示事項
謝辞
この研究は、NSFのキャリア賞、ハートウェル財団、米国心臓協会(#0830384N)によってサポートされています。
資料
| Name | Company | Catalog Number | Comments |
| Dulbecco’s Modified Eagle Medium | Mediatech, Inc. | 50-103-PB | |
| Fetal Bovine Serum | GIBCO, by Life Technologies | 26140 | |
| Penicillin Streptomycin | GIBCO, by Life Technologies | 15140-122 | |
| 0.25% Trypsin-EDTA | GIBCO, by Life Technologies | 25200 | |
| Heparin Sodium Salt | Sigma-Aldrich | H4784-1G | |
| Collagenase Type 2 | Worthington Biochemical | LS004176 | |
| DPBS | GIBCO, by Life Technologies | 21300-058 | |
| Rat Tail Collagen | BD Biosciences | 354236 | |
| Critical Swabs | VWR international | 89031-270 | |
| Sodium Bicarbonate | Sigma-Aldrich | 55761 | |
| T25 Flasks | BD Biosciences | 353018 | |
| T75 Flasks | BD Biosciences | 353136 | |
| 24 Well Plate | Falcon BD | 353047 | |
| 60x15 mm Dishes | VWR international | 25384-092 | |
| 60x15 Glass Dishes | VWR international | 89000-310 | |
| Paraffin Embedding Wax | Electron Microscopy Sciences | 19304-01 | |
| Precision Glide Needles | BD Biosciences | 305165 | |
| 500 mL Nalgene Filters | VWR international | 73520-985 | |
| 1L Nalgene Filters | VWR international | 73520-986 | |
| Tissue Forceps | Fine Science Tools | 11023-15 | |
| FSC Tweezers #5 | Fine Science Tools | 11295-00 |
参考文献
- Thompson, R. P., Fitzharris, T. P. Morphogenesis of the truncus arteriosus of the chick embryo heart: the formation and migration of mesenchymal tissue. Am J Anat. 154, 545-556 (1979).
- Johnson, C. M., Fass, D. N. Porcine cardiac valvular endothelial cells in culture: A relative deficiency of fibronectin synthesis in vitro. Lab Invest. 49 (5), 589-598 (1983).
- Manduteanu, I., Popov, D., Radu, A., Simionescu, M. Calf cardiac valvular endothelial cells in culture: production of glycosaminoglycans, prostacyclin and fibronectin. J Mol Cell Cardiol. 20 (2), 103-118 (1988).
- Cheunyg, W. Techniques for isolating and purifying porcine aortic valve endothelial cells. JHVD. 17 (6), 674-681 (2008).
- Paranya, G., Vineberg, S., Dvorin, E., Kaushal, S., Roth, S. J., Rabkin, E., Schoen, F. J., Bischoff, J. Aortic valve endothelial cells undergo transforming growth factor-beta-mediated and non-transforming growth factor-beta-mediated transdifferentiation in vitro. Am J Pathol. 159 (4), 1335-1343 (2001).
- Butcher, J. T., Penrod, A., Garcia, A. J. M., Nerem, R. M. Unique morphology and focal adhesion development of valvular endothelial cells in static and fluid flow environments. Arterioscler Thromb Vasc Bio. 24 (1), 1429-1434 (2004).
- Simmons, C. A., Grant, G. R., Manduchi, E., Davies, P. F. Spatial heterogeneity of endothelial phenotypes correlates with side-specific vulnerability to calcification in normal porcine aortic valves. Circ Res. 96, 792-799 (2005).
- Butcher, J. T., Tressel, S., Johnson, T., Turner, D., Sorescu, G., Jo, H., Nerem, R. M. Transcriptional Profiles of Valvular and Vascular Endothelial Cells Reveal Phenotypic Differences: Influence of Shear Stress. Arterioscler Thromb Vasc Biol. 26, 69-69 (2006).
- Parachuri, S., Yang, J. H., Aikawa, E., Melero-Martin, J. M., Khan, Z. A., Loukogeorgakis, S., Schoen, F. J., Bischoff, J. Human Pulmonary Valve Progenitor Cells Exhibit Endothelial/Mesenchymal Plasticity in Response to Vascular Endothelial Growth Factor-A and Transforming Growth Factor-β2. Circ Res. 99 (8), 861-869 (2006).
- Shi, Q. Evidence for circulating bone marrow-derived endothelial cells. Blood. 92, 362-367 (1998).
- Rehman, J., Li, J., Orschell, C. M., March, K. L. Peripheral blood endothelial progenitor cells are derived from monocyte/macrophages and secrete angiogenic growth factors. Circulation. 107, 1164-1169 (2003).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved