このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
B細胞の組換えレトロウイルスの生産と感染症
要約
の遺伝子の構造と機能解析の効率的なシステム生体外で文化が説明されています。このメソッドは、ヘルパーフリー、ecotrophicパッケージング細胞株における組換えレトロウイルスの生産の利点を取ります。安定した、クラススイッチ組み換えを受けたB細胞上の表面の抗体の産生につながる達成される一次リンパ球内で目的遺伝子の発現を遺伝。
要約
真核細胞における遺伝子のトランスジェニック発現は、目的の遺伝子が生じる表現型の解析を容易にするために異種発現系の制御下で発現されている強力な逆遺伝学的アプローチです。このアプローチは、遺伝子産物の変異型を表現するために、または遺伝子産物のドミナントネガティブ型を過剰発現するように、通常の生物で発見されていない遺伝子を発現させることができる。それは転写調節が2-4でレビューB細胞1の分化における主要な制御機構である造血系の研究では特に便利です。
マウス遺伝学は、人間の遺伝子と疾病の研究のための強力なツールです。マウスとヒトのゲノムの比較解析は、ゲノム5の90%以上のシンテニーの保全を明らかにする。また、多くのマウスモデルで使用されている技術のは、例えば、遺伝子の混乱と対立遺伝子交換6ヒト遺伝子の研究にも適用可能であるただし 、トランスジェニックマウスの作成 は、財政的、技術的性質の両方のリソースが大量に必要になります。いくつかのプロジェクトでは、ノックアウトマウス系統(KOMP、EUCOMM、NorCOMM)または大規模な努力とコラボレーション7を必要とする特異的変異誘発株(理研)、のライブラリをコンパイルし始めている。したがって、それは最初のマウスモデルに進行する前に、初代培養細胞の細胞培養モデルにおける所望の遺伝子の表現型を検討することが望ましい。
レトロウイルスDNAは安定した結果、好ましくは転写単位またはCpGアイランド内、または近くに、宿主のDNAに統合されており、転写サイレンシング8 9を避けながら、関心のパッケージ化遺伝子の発現を遺伝。遺伝子は、転写とタンパク質生産の高効率で、その結果、高効率レトロウイルスプロモーターの制御下に転写されます。このため、レトロウイルス発現はトランスフェクションが困難な細胞に使用することができる、細胞が有糸分裂中にアクティブな状態で提供される。ウイルスの構造遺伝子をパッケージング細胞株内に含まれているため、目的の遺伝子をクローニングするために用いられる発現ベクターは、両方のウイルスの復帰の可能性を排除し、ウイルス上清での作業の安全性を高めるウイルス、のない構造遺伝子が含まれていないは感染性ビリオンは10を生成されませんように。
ここでは、組換えレトロウイルスの生産と脾臓B細胞のその後の感染のためのプロトコルを提示する。単離後、培養脾臓細胞はB細胞の増殖と分化11のバーストを誘導するのTh由来のリンホカイ ンと抗CD40で刺激される。このプロトコルは、B細胞は形質細胞分化を誘導するが、前の抗原刺激に対する初期造血のイベントに続いて脾臓から分離されているとして、後期B細胞の発達と分化に発生するイベントの研究に最適です。
プロトコル
1。脾臓B -リンパ球の単離と刺激
- 年齢の2〜3ヶ月の間にAID欠損マウスから脾臓を12を回収する。脾臓の単離は無菌条件下で行われ、臓器が一時的に15パーセントウシ胎児血清(FBS)を含む冷リン酸緩衝生理食塩水(PBS)に保存されています。
- 脾臓を無菌組織培養フードに移し、2.5%FBSを添加したPBS 5mLにホモジナイズする。 15 mLのファルコンチューブにホモジネートを移す。
- 4℃で10分間1000rpmでホモジナイズした脾臓組織のサンプルを遠心° Cの細胞をペレット化する。
- 遠心分離後の上清をデカント。赤血球の混入を避けるために、10 mLの赤血球の細胞ペレット(RBC)、7分間室温で溶解バッファーを再懸濁します。
- 遠心分離機は、10分間1000rpmでサンプルし、上清をデカントし、2.5%FBSを含有する10mLのPBSで細胞を懸濁します。
- 100μL分注しを取り出して、死細胞を除外するためにトリパンブルーを使用して、標準血球計を使用して1:1000希釈で細胞をカウント。約20〜30万個の細胞は、脾臓当たり得ることができます。
- 10分間1000rpmでサンプルを遠心し、上清をデカントする。
- 0.5パーセント90μLあたり10 7個の細胞の濃度でBSA / PBSを含む2mMのEDTAでペレットを再懸濁する。
- 特に非B細胞をバインドするために細胞に抗CD43抗体被覆磁性ビーズを追加。 90μLあたり10μLビーズ(10 7細胞)を使用してください。よく混和して、4℃でインキュベート℃で20分間。
- 細胞が標識されていると、チューブの上部には、2.5%FBS / PBSを添加し、それらを洗う。 10分間、1000rpmでサンプルを遠心分離します。
- 上清をデカント。 mlあたり10 × 10 7細胞の濃度で0.1%BSA / PBSで細胞を再懸濁します。
- マグネット分離装置に磁気ソート列をマウントします。直接フロースルーを収集し、プライムと洗浄する3ML 0.5%BSA / PBSでカラムをロードする列の下に位置コニカルチューブを。
- 洗浄流体が流れると、新しいコレクションチューブに交換してください。サンプルは1 mLの未満の場合、0.5%BSA / PBS / EDTAで1 mLにサンプルの音量を調整し、カラムにサンプルをロードする。列あたりのセル数だけを1 mLの最大値をロードし、必要に応じて複数の列を使用してください。
- 細胞が受動的にカラムに流すと列の下のコニカルチューブに未結合の細胞を収集することができます。スルーフロー収集を継続しながら、3 mLの0.5%BSA / PBSでカラムを4回洗浄する。
- すべてのCD43陰性休止B細胞を濃縮されるのフロースルーを収集する。列を捨てる。フロースルー、1000rpmで10分間の遠心分離します。
- 上清を排出し、10 mLの培地(15%FCS / +グルタミン、ペン/球菌、非必須アミノ酸、50μMΒ- ME)を追加する
- mlあたり10 6細胞での細胞と文化を数える。
- B細胞の成長および増殖を刺激するためには、それぞれ、最終濃度が20μg/ mLの、1μg/ mLとなるような組換えIL - 4と抗CD40抗体を用いて培地を補足し、培養フラスコに細胞を移す。
- 一晩培養細胞を。細胞をカウントし、必要に応じてIL - 4とCD40を追加し、mlあたり10 6個の細胞に希釈する。
- ウイルス感染前に72時間の培養細胞。
2。プロデューサー細胞のトランスフェクション
カチオン性脂質またはリン酸カルシウムのいずれかを使用してトランスフェクションするための確立されたプロトコルを使用してください。プレート当たり100μgのプラスミドDNAを用いたDNA構築物ごとにトランスフェ10cmの3プレート、。我々は定期的にリン酸カルシウムトランスフェクション法13、14を使用し、クロロキンを添加したときに高いウイルス力価に注意してください。
- トランスフェクトされるプロデューサー細胞のような60%-70%コンフルエントフェニックスの細胞を使用してください。この合流の細胞数で10cmのプレートあたり5万セルでなければなりません。
- トランスフェクションの1時間前には、フェニックスの細胞増殖のための新鮮な完全培地と培地を交換してください。
- 滅菌eppendorpfチューブで、、包装構造のDNAの100μgを組み合わせる0.5M CaCl 2を250μL、および滅菌水を用いて500μLに最終的な音量を調節
- 1 mLのピペットを使用して、精力的に15mlのポリプロピレンチューブに500μL2X HNPでこのソリューションを混在させる
- この混合物が8〜10分間室温で休ませることができます。この時間の間に沈殿物が形成されます。
- トランスフェクション混合物を均一に全体に混合物を配布する媒体を旋回しながら細胞に滴下を追加。
- 37細胞をインキュベート℃で12時間を。
- 12時間トランスフェクション後は、8ミリリットル完全なB細胞の増殖培地で培地を交換し、37℃のインキュベーターにセルを返します。
3。刺激脾臓B細胞の感染
- ポストtransfe 48hrフェニックスの細胞から上清を除去ctionとあらゆる細胞破片を除去するために0.2ミクロンフィルターを介して上清を渡します。
- プレ活性化B細胞(ステップ1のように)3mlでウイルスを含む上清を3 mLを混ぜる。ウイルスの細胞への吸着性を高めるために、液あたり16μgの最終濃度でポリブレンを追加。
- 30℃で90分間2500rpmで遠心して細胞に感染℃に
- 37℃でさらに48〜72時間インキュベートスピン、° Cは、細胞の成長と増殖を可能にした直後に。
4。フローサイトメトリー分析
- フローサイトメーターを使用して、B220と表面IgG1の表面発現のため細胞を分析する。細胞の表面でのIgG1の存在は、クラススイッチ組み換えがAID遺伝子のレトロウイルス相補経由して成功した救助の結果として発生したことを示します。
5。代表的な結果
私たちは正常(AID - / - )AID欠損からタンパク質因子の活性化誘導シチジンデアミナーゼ(AID)の欠乏を救出しているレトロウイルス導入を用いてB -リンパ球。簡単に言えば、我々は、PMX - MAID - GFP 15から18でフェニックス細胞をトランスフェクトすることにより、マウスのAID(MAID)タンパク質を発現する組換えレトロウイルスを生成。収穫されたウイルスは、 生体外でのクラススイッチ組み換え(CSR)刺激の条件19でAID欠損マウスから得られたAID欠損B細胞に感染させた。感染したB細胞は、フローサイトメトリー分析を用いて培養中の72時間後にCSRへのIgG1のために分析した。図2は、CSRは、AIDの発現の救助の結果として発生したことを示す、AIDによるB細胞の表面におけるIgG1の検出ではなく、空の構造を示しています。
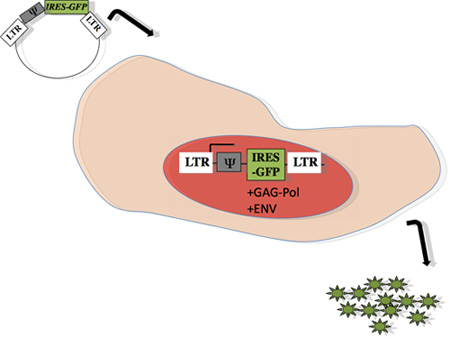
図1:プロデューサー細胞内でレト ロウイルスパッケージングのスキーム:以前は15を説明するようにΨで表される目的の遺伝子が、、、PMX - IRES - GFPへサブクローニングした。プラスミドは、リン酸カルシウム法13、14を使用して、ギャグ、polおよびエンベロープタンパク質(フェニックス、Orbigen)を作り出すことができるエコトロピックウイルスパッケージング細胞株にトランスフェクトした。トランスフェクション48時間後、上清を含有するウイルス粒子は、マウスから得られたターゲットのプライマリのB細胞への感染のために採取した。

図2:AID欠損B細胞は、抗CD40で刺激し、IL - 4は、PMX - MAID - GFPまたは単独でGFPを発現するレトロウイルスを含むレトロウイルスを感染させた。 IgG1のへのCSRのレベルは、FACS分析により評価した。
ディスカッション
ここで説明すると、 図1に示すように、脾臓B細胞のレトロウイルス導入はlymphopoesisの発達のイベントの多くは転写制御1、2によって制御されるため、B -リンパ球の研究に有用な遺伝学的ア プローチです。 B細胞の成熟の後の段階では、CD40Lを介してトリガするB細胞増殖、細胞周期への参入、および増殖11、20の誘導に必須である。 図2に示すように...
開示事項
謝辞
CKは、コロンビア大学大学院のプログラムによってサポートされています。 UBは、アメリカの白血病とリンパ腫協会、白血病研究基金からの新しい研究者賞の受信者のフェローであり、コロンビア大学新学部スタートアップ資金によってサポートされています。
資料
| Name | Company | Catalog Number | Comments |
| FCS | Atlanta Biologicals | S11550 | |
| RPMI | Invitrogen | 22400 | |
| PBS | Invitrogen | 20012 | |
| Red Blood Cell (RBC) lysis buffer | Sigma-Aldrich | R7757 | |
| CD43 beads | Miltenyi Biotec | ||
| B Cell Complete Media | Various | Various Components | RPMI, 15% FCS, 1% Non-Essential Amino Acids, 1% Sodium Pyruvate, 1% HEPES, 1% Pen-Strep, 50μM β-Mercapt–thanol |
| IL-4 | |||
| Anti-CD40 | BD Biosciences | 553787 | |
| polybrene | Sigma-Aldrich | 107689 | |
| Chloroquine diphosphate salt | Sigma-Aldrich | C6628 | Used at 100mM |
| Ph–nix Eco cells (Murine) | Orbigen | RVC-10002 | |
| PE-Cy5-α-mouse-CD45R (B220) | eBioscience | 15-0452-81 | |
| PE-α-mouse-IgG1 | BD Biosciences | A85-1 |
参考文献
- Bartholdy, B., Matthias, P. Transcriptional control of B cell development and function. Gene. 327, 1-23 (2004).
- Henderson, A., Calame, K. Transcriptional regulation during B cell development. Annu Rev Immunol. 16, 163-200 (1998).
- Graf, T. Differentiation plasticity of hematopoietic cells. Blood. 99, 3089-30101 (2002).
- Xiao, C., Rajewsky, K. MicroRNA control in the immune system: basic principles. Cell. 136, 26-36 (2009).
- Waterston, R. H. Initial sequencing and comparative analysis of the mouse genome. Nature. 420, 520-562 (2002).
- Griffiths, A. J. F., Miller, J. H., Suzuki, D. T., Lewontin, R. C., Gelbart, W. M. . Introduction to Genetic Analysis. , (2000).
- Gondo, Y. Next-generation gene targeting in the mouse for functional genomics. BMB Rep. 42, 315-3123 (2009).
- Plachy, J. Proviruses selected for high and stable expression of transduced genes accumulate in broadly transcribed genome areas. J Virol. 84, 4204-4211 (2010).
- Felice, B. Transcription factor binding sites are genetic determinants of retroviral integration in the human genome. PLoS One. 4, e4571-e4571 (2009).
- Karavanas, G. Cell targeting by murine retroviral vectors. Crit Rev Oncol Hematol. 28, 7-30 (1998).
- Noelle, R. J. A 39-kDa protein on activated helper T cells binds CD40 and transduces the signal for cognate activation of B cells. Proc Natl Acad Sci U S A. 89, 6550-6554 (1992).
- Muramatsu, M. Class switch recombination and hypermutation require activation-induced cytidine deaminase (AID), a potential RNA editing enzyme. Cell. 102, 553-563 (2000).
- Yelle, J., Dion, M., Hamelin, C. Efficient transfection of mammalian cells with viral DNA in optimal culture conditions. J Virol Methods. 7, 321-326 (1983).
- Chen, C., Okayama, H. High-efficiency transformation of mammalian cells by plasmid DNA. Mol Cell Biol. 7, 2745-2752 (1987).
- Fagarasan, S. In situ class switching and differentiation to IgA-producing cells in the gut lamina propria. Nature. 413, 639-6343 (2001).
- Basu, U. The AID antibody diversification enzyme is regulated by protein kinase A phosphorylation. Nature. 438, 508-5011 (2005).
- McBride, K. M. Regulation of class switch recombination and somatic mutation by AID phosphorylation. J Exp Med. 205, 2585-2594 (2008).
- Barreto, V. M. AID from bony fish catalyzes class switch recombination. J Exp Med. 202, 733-738 (2005).
- Delphin, S., Stavnezer, J. Regulation of antibody class switching to IgE: characterization of an IL-4-responsive region in the immunoglobulin heavy-chain germline epsilon promoter. Ann N Y Acad Sci. 764, 123-135 (1995).
- Castigli, E. CD40 expression and function in murine B cell ontogeny. Int Immunol. 8, 405-411 (1996).
- Ballantyne, J. Efficient recombination of a switch substrate retrovector in CD40- activated B lymphocytes: implications for the control of CH gene switch recombination. J Immunol. 161, 1336-1347 (1998).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved