Method Article
Nucleofectionとマウス胎児海馬および皮質ニューロンの初代培養
要約
このプロトコルは、エレクトロポレーションと文化のマウス海馬および皮質のニューロンを経由してトランスフェクション、解剖するために必要な手順を説明します。長期培養がシナプスと樹状突起棘の解析の研究に使用することができますが、短期的な文化は、軸索伸長やガイダンスの研究に使用されることがあります。
要約
海馬と皮質ニューロンは、中枢神経系(CNS)神経偏光、軸索/樹状突起伸長、およびシナプス形成と機能を研究するために広く使用されている。培養の利点は、これらのニューロンは非常に低密度で二次元の基板上に、独特の軸索と樹状突起を形成し、それらが容易に分極することです。このプロパティは、神経発達の多くの側面を決定するため、それらは非常に便利なてきた。さらに、これらのニューロンのためのグリアコンディショニングを提供することによって、彼らは機能的なシナプス結合を形成し、文化の中で数ヶ月間生存し、発展していきます。このプロトコルでは、文化とトランスフェマウス胎児海馬と皮質の神経細胞を分析する手法の概要を示します。トランスフェクションは、nucleofectionを経由してめっきする前に、神経細胞にDNAをelectroporatingことによって達成される。このプロトコルは、偏光、軸索伸長と分岐の間に蛋白質のダイナミクスと機能を研究するために開発(〜4 8時間メッキ後)の初期の蛍光タグ融合タンパク質を発現できるという利点があります。我々はまた、メッキの前に、この単一のトランスフェクションは、ニューロン(文化の中で> 2ヶ月)の生涯を通してイメージングのための適切なレベルで蛍光タグ融合タンパク質の発現を維持することを発見した。したがって、この方法論は、神経機能のほとんど、またはまったく中断して中枢神経系の開発を通して蛋白質の局在と機能を研究するために有用です。
プロトコル
1。カバーグラスとチェンバースの準備
- きれいなカバースリップとチャンバーの準備は健全な文化のために不可欠です。ショートカットは、これらの手順のいずれかで取られるべきでない。
- 専用のガラスの瓶やビーカーに濃硝酸で一晩(HNO3) - カバースリップ(キャロライナアシスタントブランド12ミリメートルまたは22ミリメートルラウンド、ドイツのガラスを)洗う。
- 硝酸からカバースリップを削除し、脱イオン水で(5 - 7X)広範囲に洗浄。
- 層流フードまたは生物学的安全キャビネットのカバースリップと乾燥を区切ります。乾燥時、30分間UV光でそれらを滅菌する。ストレージのための滅菌ペトリ皿に滅菌カバーグラスを置きます。 12ミリメートルカバースリップ上にめっきニューロンは直接滅菌35mmディッシュにカバースリップを配置し、セクション2に進んでいる場合。
- イメージングチャンバーは35mmペトリ皿の底に15ミリメートルの穴をあける(すべてのバリを除去)し、パラフィンやワセリンの3:1混合物で洗浄カバーグラスを取り付けることによって構成されている。
- 沸騰水浴内のコニカルチューブにパラフィン/石油ゼリーの混合物を溶かす。小さいペイントブラシとコート15ミリメートル穴の周り皿の下側を使用してください。それが分離されるようにパラフィン/石油ゼリーの混合物を攪拌しながら維持することを確認してください。料理をインキュベーター内に配置されているときにカバーの剥離、その結果、粘性となる石油ゼリーの濃度が高い、と一緒に接着されたチャンバ内のこれは通常、結果。残りのパラフィン/石油ゼリーは室温で保存することができます。
- 平らなトレイ上に逆さまに皿を置き、穴にカバースリップを配置。 80内の熱° Cオーブンパラフィンの混合物が溶融するまで(〜10分)。平らな面に皿を取り外し、パラフィンの混合物のセットをしましょう。
- 皿を裏返しして紫外光でカバーし、チャンバーの底の内側の両方を滅菌する。
- 1時間コートのカバースリップまたはホウ酸緩衝液(0.1Mホウ酸ナトリウム、pH8.5)に1.0mg/mLポリ- D -リジン(30kDa)とチャンバーのガラス領域。組織培養グレード脱イオン多量の水で3-5回すすいでください。ホウ酸緩衝液の痕跡をすべて削除してください。乾燥させて、後で使用するために直ちにまたは店舗室/カバースリップを使用します。我々は通常、準備の一ヶ月以内にきれいにカバースリップを使用してください。
2。神経解剖と培養液の調製
- 組織培養グレードの水に10倍HBSSと100X HEPESの適切な量を追加することで解剖の培地(DM)を準備する。 4℃で保存します。解剖時には氷上に置きます。
- 解剖前日には、メッキの培地(PM)および無血清培地(SFM)を準備する。 PMはNeurobasalミディアム、B27サプリメント、2mMグルタミン、0.3%グルコース、37.5 mM NaClおよび5%ウシ胎児血清(FBS)で構成されています。 SFMはNeurobasalミディアム、B27サプリメント、2mMグルタミン、0.3%グルコース、37.5 mM NaClで構成されています。
- 培地の平衡化の温度とCO 2含有よう少し半開きにキャップで一晩組織培養インキュベーターで解剖し、店舗のためにのみ十分な確認。我々は、余分なブドウ糖を追加し、NaClで約310mOsmに浸透圧を増加させる。我々は、文化はより生理的浸透圧(Neurobasal浸透圧は、一般的に205 - 245mOsmである)でもっと良いもの見つける。
3。長期培養のための皮質グリアフィーダーレイヤーの準備
- 長期培養を準備する必要のある場合は、2〜3週間皮質または海馬の解剖を続ける前に、プロトコルのこの部分を実行します。
- MEMとグリア培地(GM)、0.3%グルコース、ペニシリン/ストレプトマイシン、10%ウマ血清を準備します。
- 氷上で5分間冷却することにより、P1 - P3仔マウスを安楽死させる。 70%エタノールと氷とスプレーから各子犬を削除します。すぐにはさみで首を切る。コールドDMを(ステップ2.1)を含む皿に脳全体を削除します。
- two大脳半球および髄膜を取り外します。新皮質税とは、メディアを含まない新しい皿に移す。合計4脳から皮質を準備します。
- できるだけ細かいようにきれいに、滅菌カミソリの刃で皮質を飾らないと冷たいDMの12 mLを含む50mLのコニカルチューブにプラスチック製のピペットを刻んだ組織を取り除く。それぞれ0.25%(1.5mL)を、0.1%(1.5 mL)を、最終濃度にトリプシンとDNaseを追加。断続的な渦巻くと10分間37℃の水浴でインキュベートする。
- 皮質組織を含むチューブを外し、組織培養フードに持ち込む前に70%エタノールで十分に洗浄。 10 mLのピペットとピペット皮質組織の上下は約10〜15倍、またはまで、ほとんどのチャンクが消えます。
- ° C断続的な旋回を持つ別の10分間水浴中で37にチューブを返します。
- 徹底的に70%エタノールでチューブをきれいにし、組織培養フードに戻す。 5メートルで、上下のピペット皮質組織をLピペット約10〜15倍、またはチャンクがなくなるまで。
- 暖かいGM 15mLを加え、10分間200xg(1000rpm)で遠心。
- 上清を破棄し、新鮮なGMの20mLにペレット化した細胞を再懸濁し、血球計数器でカウント。 75センチメートル2フラスコあたりのGMの15 mLの内板5 - 7.5x10 6個の細胞。
- ある日、文化の各2月3日その後の日後、あなたの手に対してフラスコをノックでバラセルを押しのける。どんな外れた細胞と共に培養液を除去し、新鮮なGMの15 mLで置き換えます。
- 彼らは70〜100%程度コンフルエントのときにグリア細胞が、フラスコの成長の1〜2週間後に収穫することができます。グリア細胞で被覆された個々のカバーグラスを準備するには、場所6硝酸は、小さな絵筆と三角パターンで各カバースリップの上にパラフィン/石油ゼリーの3:1混合物の3つの点をきれいにして10cmの皿に25ミリメートルラウンドカバーグラスを滅菌し、場所。 30分間紫外線を開いて料理を扱います。コート1時間ホウ酸緩衝液では0.1 mg / mLのポリ- D -リジン(30kDa)とカバーガラスは、その後無菌組織培養グレード、脱イオン水で(3〜5倍)広範囲に洗浄し、乾燥させる。
- インキュベーターからグリア含有フラスコを削除、培地を廃棄し、予め温めておいたトリプシン/ EDTA溶液5 mLですすいでください。フラスコからトリプシン/ EDTA溶液を除去し、フラスコに新鮮予め温めておいたトリプシン/ EDTA 3 mLをピペット。 ° C、トリプシン処理を停止するには、GMの5 mLを追加する前に、37℃で1分間フラスコをインキュベートする。
- 10月15日回ピペッティングを繰り返すことによりフラスコからグリアを削除してから、15 mLコニカルチューブにメディアを転送する。 8分間200xg(1000rpm)で遠心。上清を除去し、カバースリップを含む10 cmディッシュあたりのGMの12.5 mLの10 GM mLの、カウント細胞、およびプレート5 × 10 5細胞を加える。
- 新鮮予め温めておいたGMごとに2〜3日で培地を交換する。ニューロンの解剖前日には、GMを削除し、SFM(セクション2.2)と交換してください。皮質または海馬培養をフラッディングするときにステップ4.12でこのグリアエアコンSFMを使用してください。
4。皮質および/または海馬解剖とエレクトロ
- nucleofectionソリューション(ロンザ)の適切な量を削除、解剖を開始する前に結合し、室温に暖かい。組み合わせるとNucleofectionのソリューションは、限られた寿命を持っているので、我々はそれぞれの準備(トランスフェクションあたり100μL)に必要な量を組み合わせる。
- CO 2(プラグの日はE0.5です)とE15.5で妊娠したマウスを安楽死させると10cmのペトリ皿に子宮を削除します。コールドDM(セクション2.1)に胎児と首を切るを削除します。
- 冷たいDMの別々の皿に脳全体を取りはずして、曲がったタングステン針で、両方neocortexの複数形を削除する。冷たいDMの新しい料理にmicroforcepsと場所の皮質と髄膜を取り外します。小さな虹彩またはヴェッカーハサミで、冷たいDM 1.0mLのでいっぱいの1.5 mLエッペンドルフチューブに皮質または海馬と場所を削除します。氷の上にこのチューブを保管してください。
- すべての皮質または海馬を解剖した後、20分間37℃のインキュベーターで組織し、場所チューブを含むエッペンドルフチューブに2.5%トリプシン110μLを加える。
- 静かに転倒エッペンドルフチューブで1.0mLのPM(セクション2.2)で上清と洗浄皮質または海馬を削除します。チューブでPMを1 mLを残して、二回洗浄を繰り返します。
- P1000ピペットで塊を15回ひいて粉にする、とPMの4 mLを含む新しい15 mLコニカルチューブに上清/セルを削除し、エッペンドルフチューブに残っているチャンクを残す。
- ブレーキオフで7分間20xg(350rpm)で15 mLのチューブを回転させる。上清を捨て、各トランスフェクションのための予混合、室温のnucleofectionソリューション(ロンザ)100μLを加える。 P1000ピペットの緩やかな上下の動きで5回ひいて粉にする。
- それぞれの新しいエッペンドルフチューブにnucleofectionソリューション/細胞混合液を100μLを削除し、DNAの適切な量を追加します。長期的な文化のために我々は一般的にトランスフェクションあたりのDNAの1 -2μgを使用してください。しかし、このラベルだけの文化で神経細胞の小<10%の割合。短期培養のためにより高いトランスフェクション効率が必要な場合我々は一般的にトランスフェクションあたりのDNAの5 -10μgのを使用してください。 2種類の異なったプラスミドでトランスフェクション時に我々はDNAの40μgの総まで使用している。プラスミドはμL/1μgのでTEバッファーに格納されています。
- キュベット(ロンザ)に細胞懸濁液/ DNAを追加し、プログラムO - 005(マウス中枢神経系ニューロン)を使用して、Nucleofector(ロンザ)で細胞をエレクトロポ。
- 素早く作業を、キュベットに予め温めておいたと平衡PMの500μLを追加し、新しい1.5 mLのエッペンドルフチューブにソリューション/セルを削除します。を1.0 mLにそれぞれトランスフェクションのボリュームをもたらすのに十分なPMを追加。長期培養のための若者文化、または5 - 10x10の3個 / cm 2と 3 - 5 × 10 3細胞/ cm 2で血球計算板とプレートで細胞を数える。<は/ LI>
- 短期的な文化のため、洪水温めたの2.0 mLを、メッキの1時間後にCO 2平衡SFMを搭載した35 mm培養皿。カバースリップを使用している場合、我々は、PMの半分を削除し、さらに2回繰り返して、SFMと交換してください。どちらイメージングチャンバーを洪水や非常に低い血清含有量(<0.5%)でカバースリップの結果を洗う。短期的な文化は、グリアフィーダー層で培養する必要がないと再供給する必要はありません。
- 長期培養では、パラフィン/石油ゼリーの3つのドットが含まれているグリアカバーカバーを取り外し、35mmディッシュに15ミリメートル穴、初期めっき後、1時間かけてそれを反転させる。グリア皿からエアコンSFMの二ミリリットルその後イメージングチャンバーに追加されます。長期培養を養うために、我々は、SFMごとに2〜3日の3分の1を削除して、新鮮、予め温めておいたとCO 2平衡SFMと交換してください。
5。代表的な結果:
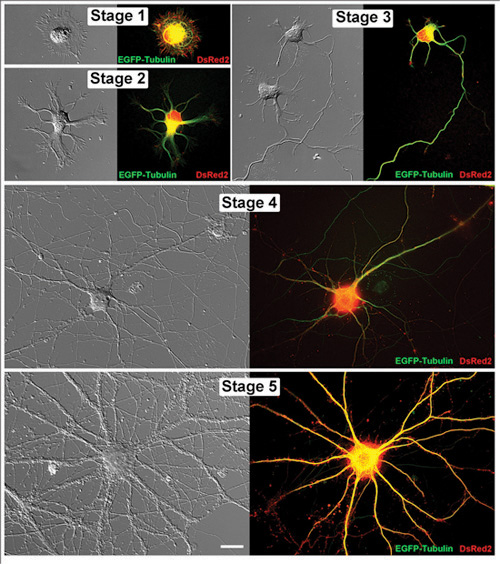
図1。海馬ニューロンを生きた代表の発達の連続した段階で海馬の神経細胞を生きた。ペア画像は微分干渉コントラスト画像と対応する蛍光顕微鏡写真の両方として表示されます。これらの各セルは、pCAXベクトルにおけるEGFP -チューブリンとDsRed2のをトランスフェクトされています。ステージ1(1DIV)、ステージ2(1DIV)、ステージ3(2DIV)、ステージ4(11DIV)とステージ5(32DIV):神経細胞は、in vitroで 、次の日(DIV)で撮像した。スケールバーは20μmのです。
ディスカッション
培養胚の海馬と皮質のマウスニューロンのためのこのプロトコルは、ラットの神経細胞の1,2を使用してバンカーのプロトコル、の修正として開発されました。我々はよく3,4,5,6,7として培養マウスとハムスターのニューロンのためにこのプロトコルを使用している。このプロトコルは、海馬と新皮質の両方に神経細胞にも同様に機能し、Mebergとミラー8によって発行されたプロトコルに似ています。彼らはよく特徴付けと、より確立されたモデル系されているため、一般的に、我々は、長期培養のために海馬ニューロンを使用してください。さらに、彼らは新皮質よりもニューロンのより均質な集団を含む可能性があります。しかし、このプロトコルを使用して培養大脳皮質ニューロンも生き残ると(未発表データ)も同様に区別する。我々は日常的に短期の文化のために海馬と新皮質の神経細胞を使用してください。新皮質の解剖はまた、西洋例えば、ブロッティングのための材料のよりよい選択肢と海馬解離(海馬のペアごとに2.5x10 5ニューロン)、より実質的により多くのニューロン(皮質のペアごとに1.5 × 10 6ニューロン)をもたらす。
任意の初代培養と同様に、それが動物の死から細胞をプレーティングするのにかかる時間を最小限に抑えることが不可欠です。それは一般的に解剖し、メッキで一貫して高速になるために10月20日解剖がかかります。それらはnucleofectionバッファに残っている場合、ニューロンの生存率が急激に減少するとしても、ロンザNucleofectorで作業する場合、それは、エレクトロポレーションの手順の間に素早く作業することが重要です。
私たちの撮影の多くは、全内部反射蛍光顕微鏡(TIRFM)で行われている。顕微鏡のこのタイプは、カバースリップを超えたイメージング数百ナノメートルのみが可能です。したがって、我々は頻繁に画像そのニューロンの領域は、軸索成長円錐と樹状突起棘は、カバースリップに直接付着する必要があります。従って、我々は、長期培養のためにグリア栄養を必要とする低密度培養を使用してください。我々は、長期培養のために、グリアフィーダー層なしで、高密度培養(> 2 × 10 4細胞/ cm 2)を使用し、それらが少し餌と非常によく生き残ることを発見した。それらは容易に広視野顕微鏡または共焦点顕微鏡で検出することができるが、しかし、これらのニューロンの樹状突起は、しばしば、あまりにも遠く離れて基板からTIRFMの画像になります。
我々の研究のほとんどでは、メッキの前に神経細胞をトランスフェクトし、文化の3ヶ月までのための蛍光標識タンパク質を画像化している。蛍光標識タンパク質のこの長期的な発現は、DNA(1 -2μg)の低濃度を使用することによって我々は神経細胞で過剰発現のアーティファクトを生成していないことを私たちに自信を与えます。しかし、この手順は、DNAの大量(10 -20μg)を使用する場合、タンパク質の過剰発現を研究するために使用することができます。我々はまた、単独でDsRed2のまたはEGFPを持つ神経細胞質にラベルを付けるものの、我々は通常、神経細胞をトランスフェクトするために使用するプラスミドは、EGFPまたはmCherry融合タンパク質が含まれています。このエレクトロポレーション法は、ベクトルの数とうまく動作します。我々は、CMVエンハンサーとβ-グロビンポリ- expressionの比較的高いレベルのために尾(pCAGGsまたはpCAXプラスミド)9、、と彼らはよく神経細胞によって許容されるという事実とβ-アクチンプロモーターを含むプラスミドを好む短期と長期培養の両方インチ一般に、タンパク質はメッキの約4時間以内に発現し、10 24 10内イメージングのための十分なレベルに到達し始める。私たちは正常に短期培養におけるCMV -プロモーター駆動型プラスミドを用いているが、彼らは長期培養で神経細胞を殺すことに過剰発現の高いレベルを引き起こすことを見出した。それにもかかわらず、我々は、低密度培養のグリアコンディショニングがより高い密度(非グリアFED)の文化と比較して、CMV -プロモーター駆動プラスミドをトランスフェクトした神経細胞の生存に役立つことを発見した。
開示事項
謝辞
すべての手順は、アニマルケアのウィスコンシン委員会の大学によって承認され、NIHのガイドラインに従ってであった。私たちは、彼女のNucleofector装置の寛大な使用のために博士はキャサリンカリルに感謝。我々は、プロトコル上のコメントのデントラボのメンバーにも感謝。この作品は、EWDへの助成金NIH R01 - NS064014、ダナ財団とホワイトホール財団によってサポートされていました
クリストファーViesselmann、ジェイソンBallwegとデレクLumbardはこの論文にも同様に貢献した。
資料
我々は-80保存することを*ほとんどの試薬は° Cも同様に-20℃で保存することができます。 -80それらを格納° Cは、その貯蔵寿命とわずかに一貫性のある文化では結果が長くなります。
参考文献
- Goslin, K., Asmussen, H., Banker, G., Goslin, K., Banker, G. Chapter 13. Culturing Nerve Cells. , 339-370 (1998).
- Kaech, S., Banker, G. Culturing hippocampal neurons. Nat Protoc. 1, 2406-2415 (2006).
- Dent, E. W., Callaway, J. L., Szebenyi, G., Baas, P. W., Kalil, K. Reorganization and movement of microtubules in axonal growth cones and developing interstitial branches. J Neurosci. 19, 8894-8908 (1999).
- Dent, E. W., Kalil, K. Dynamic imaging of neuronal cytoskeleton. Methods Enzymol. 361, 390-407 (2003).
- Dent, E. W. Filopodia are required for cortical neurite initiation. Nat Cell Biol. 9, 1347-1359 (2007).
- Hu, X., Viesselmann, C., Nam, S., Merriam, E., Dent, E. W. Activity-dependent dynamic microtubule invasion of dendritic spines. J Neurosci. 28, 13094-13105 (2008).
- Lebrand, C. Critical role of Ena/VASP proteins for filopodia formation in neurons and in function downstream of netrin-1. Neuron. 42, 37-49 (2004).
- Meberg, P. J., Miller, M. W., Hollenbeck, P. J., Bamburg, J. R. Chapter 7. Neurons: Methods and Applications for the Cell Biologist. , 112-129 (2003).
- Osumi, N., Inoue, T. Gene transfer into cultured mammalian embryos by electroporation. Methods. 24, 35-42 (2001).
- Zeitelhofer, M. High-efficiency transfection of mammalian neurons via nucleofection. Nat Protoc. 2, 1692-1704 (2007).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved