このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
ブリオスタチンの1/Ionomycinによる腫瘍反応性T細胞のex vivoでの拡張と共通γ鎖のサイトカインの策定
要約
のための効率的なプロトコル生体外で拡張が記述されています。このプロトコルは、選択的に乳がんの養子免疫療法で使用するための腫瘍特異的T細胞を拡大する。
要約
それは、乳がんの患者は腫瘍の1,2に対する既存の免疫応答を有することが報告されました。しかし、そのような免疫応答は、乳がんの開発または再発に対する完全な保護を提供するために失敗する。腫瘍反応性T細胞の頻度を増やすことによってこの問題を克服するために、養子免疫療法が採用されている。さまざまなプロトコルは、腫瘍特異的T細胞の拡大のために使用されている。これらのプロトコルは、しかしながら、抗原特異的T細胞の活性化のための腫瘍抗原のex vivoでの使用に制限されています。ごく最近、このようなIL - 2、IL - 7、IL - 15、およびIL - 21などの一般的なγ鎖のサイトカインは、抗腫瘍免疫応答3の強化のために単独でまたは組み合わせて使用されている。しかし、製剤は腫瘍反応性T細胞の拡大のために最もよく働くなるかは明らかではない。ここでは、選択的活性化と乳がんの養子T細胞療法で使用するためにHER-2/neu陽性乳癌癌のFVBN202トランスジェニックマウスモデルからの腫瘍反応性T細胞の拡大のためのプロトコルを提示する。プロトコルは、16時間の腫瘍抗原の不在でbryostatin-1/ionomycin(B / I)とIL - 2によるT細胞の活性化が含まれています。 B / Iの活性化は細胞内シグナルを模倣してそのそれぞれ4、プロテインキナーゼC活性および細胞内カルシウムを増加させることによりT細胞活性化の結果。無関係なT細胞を殺すことながら、このプロトコルは、特に腫瘍特異的T細胞を活性化。 B / I -活性化T細胞は、24時間のIL - 7およびIL - 15で培養し、IL - 2でパルスされています。 24時間後、T細胞を洗浄し、スプリット、および追加の4日間+ IL - 15 IL - 7で培養した。 ex vivoで拡大T細胞の腫瘍特異性と抗腫瘍効果が決定されます。
プロトコル
1。リンパ球5の単離
- 担癌FVBN202トランスジェニックマウスからの腫瘍所属リンパ節または脾臓を分離し、10%FBSを添加した氷冷RPMI1640で単一の細胞懸濁液を準備する。ポリスチレンチューブに比べて大きく、T細胞の収率で50 mlのポリプロピレンコニカルチューブの結果でB / I活性化。ケタミンとキシラジンの麻酔のための腹腔内注射されています。頸椎脱臼は、安楽死の方法として使用されます。
- 文化16時間のIL - 2(Peprotech社製)の80 U / mLのと一緒にブリオスタチン- 1(5 nM)およびイオノマイシン(1μM)で、15%FBSを含む完全培地中の細胞(10 6細胞/ mL)
- 24時間のIL - 7(10 ng / ml)およびIL - 15(10 ng / mL)を(Peprotech社製)との完全培地に10 6細胞/ mLの暖かい培地(37℃)および培養で細胞を3回洗浄。
- 24時間のためのIL - 2(40 U / mL)で細胞をパルス
- さらに4日間、細胞と培養してIL - 7およびIL - 15(10 ng / mL)を持つを分割する。培地を変更し、2日ごとに必要に応じてセルを分割。
2。細胞数とフローサイトメトリー分析5によってT細胞のフォールド展開を決定する
- 光顕微鏡による細胞の数
- トリパンブルーで適切な細胞の希釈(1:100)を準備し、血球計算盤の上にいくつかμLを追加
- 9の正方形をカウントし、希釈率を掛けた室の数に細胞数を割ることによって、総細胞数を決定します。結果は数× 10 4細胞/ mLを紹介します。
- フローサイトメトリーによる拡張セルにCD8 +およびCD4 + T細胞の割合を決定する
- 培養することにより、Fc受容体に対する抗体の非特異的結合氷上で20分間anti-CD16/CD32抗体(Biolegend)で細胞をブロックし、1%のアジ化ナトリウムを添加した氷冷PBS 2mLで細胞を2回洗浄。
- 氷上で20分間、FITC - CD4およびPE - CD8抗体で培養することによって細胞を染色し、1%FBSおよび0.1%アジ化ナトリウムを添加した氷冷PBS 2mLで細胞を2回洗浄する。
- 1%パラホルムアルデヒドで細胞を固定し、ベックマンコールター社FC 500でサンプルを実行し、サミットのバージョン4.3ソフトウェアを使用して分析する。
3。 ex vivoでの拡張性T細胞の腫瘍特異性を決定する
- 文化24時間5の照射神経正MMCの腫瘍細胞(15,000ラジアン)で10:1の比率で完全培地での生体外で展開されたリンパ球
- 使用° Cまで-80℃で収穫の上清とストア。5,6
- 検出し、IFN -γ、製造元のプロトコールに従って、マウスIFN -γELISAセット(BD Pharmingen社製)を使用して。5,6
4。 5,6 ex vivoでの拡張性T細胞の抗腫瘍機能を決定する
- 3 mLの完全培地(グルタミンおよびβペニシリンの100U / mLを、100μg/ mlのストレプトマイシン、10%FBS、を補充したRPMI - 1640で完全培地で48時間のための標的比10:1のエフェクターの腫瘍細胞とT細胞をインキュベート-メルカプトエタノール)と6ウェル培養皿でのIL - 2の20U / mLの(Peprotech社製)37℃/ 5%CO 2。
- 製造業者のプロトコルに従って、PE -抗マウスIgG、アネキシンV - FITCとヨウ化プロピジウム(PI)(BD Pharmingen社)に続いて神経の3つのカラー抗体染色(anti-c-Erb2/c-neu、クローンA - 4、カルビオケム)を実行
- 腫瘍細胞の神経陽性腫瘍細胞上にゲートと分析可能性(アネキシンV-/PI-)
5。乳癌のマウスモデル
FVBN202トランスジェニック雌マウス(Charles River Laboratories)は、腫瘍反応性T細胞の源に使用することができます。これらのマウスは、MMTVプロモーターの制御下でアクティブになっていないラット神経遺伝子を過剰発現し、その結果として、7歳の40〜10カ月の間に自発的な乳癌を開発する。これらのマウスは自発carcinoma8の開発前に非浸潤性乳管癌(DCIS)と同様の前癌性乳腺肥大症を開発する。自然発生腫瘍を有するマウスは、T細胞のドナーとして使用されています。
6。代表的な結果:
in vivoでの腫瘍で感作されていないナイーブT細胞の殺傷に16時間の結果を得るためにB / IとT細胞の活性化。腫瘍反応性T細胞のB / I選択した後、彼らは、γ鎖のサイトカイン(図1)6日間の文化の中で2.8倍にまで拡大する。両方CD8 +およびCD4 + T細胞が均等にγ鎖のサイトカイン(図2)で展開されます。 エキソビボ -拡張されたT細胞は、神経正のマウス乳腺癌(MMC)腫瘍細胞(図3)の存在下でIFN -γの産生により評価としてドナーマウスは、に感作されたこと腫瘍に対する高い応答性を示す。 T細胞を拡大し、ex vivoでの神経正MMCの腫瘍のセルにアポトーシスを誘導することができるlsの腫瘍細胞のように生存率は(図4)48時間以内に92%から61%に低下します。
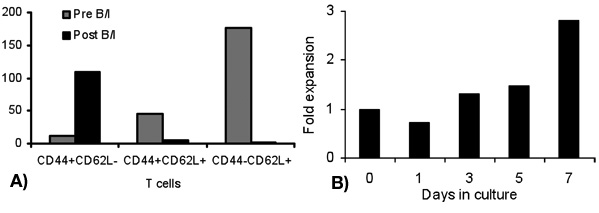
図1 B / I活性化(1日目)およびγ鎖のサイトカインとex vivoでの展開(3日目、5、7)以下の異なる時点でのリンパ球のフォールド拡大
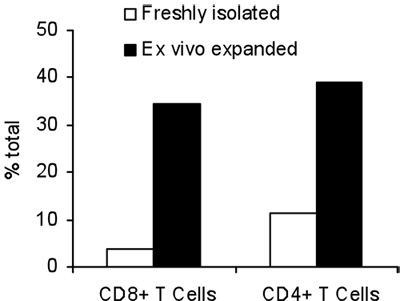
図2。CD4 +およびCD8 + T細胞の合計パーセンテージ前とγ鎖のサイトカインとの7日間の膨張の後に。
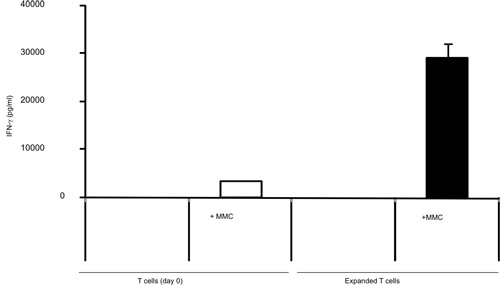
図3。IFN -γを使用して前のγ鎖のサイトカインとの7日間の膨張へと後の担癌マウスから単離したT細胞による産生、IFN -γELISA腫瘍で刺激した
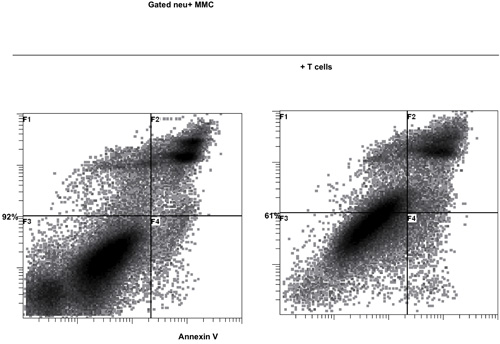
図4。神経正のマウス乳腺癌(MMC)の腫瘍細胞に対するガンマ鎖のサイトカインで、T細胞を拡大し、ex vivoでの細胞傷害機能
ディスカッション
エフェクターの抗腫瘍機能を持つ選択的腫瘍反応性の拡張性T細胞は、B / Iの活性化と生体外での拡張ガンマ鎖のサイトカインとIL - 2、IL - 7およびIL - 15を使用して提案されたプロトコルによって達成することができます。 IL - 2は、抗原特異的T細胞の分化と拡張をサポートすることができるT細胞増殖因子である一方、IL - 7はT細胞のアポトーシスを阻害し、拡張中にその生存をサポート?...
開示事項
謝辞
この作品は、NIHのR01 CA104757グラント(MH Manjili)によってサポートされていました。我々は感謝VCUマッシーがんセンターの支援とがん研究のための連邦基金を認めます。
資料
| Name | Company | Catalog Number | Comments |
| Bryostatin 1 | Sigma-Aldrich | B7431-10ug | |
| Ionomycin | Calbiochem | 407950 | |
| Mouse IL-7 | PeproTech Inc | 217-17 | |
| Mouse IL-15 | PeproTech Inc | 210-15 | |
| Human IL-2 | PeproTech Inc | 200-02 | |
| RPMI1640 | Invitrogen | 11875 | |
| FBS | Gemini Bio Products | 100-106 | |
| Penicillin/Streptomycin | Cellgro | 30-002-CI | |
| L- glutamine | Invitrogen | 25030081 | |
| β- mercapt–thanol | Sigma-Aldrich | M7522 | |
| anti-CD16/32 antibody | Biolegend | 101302 | |
| Annexin V-FITC Apoptosis Detection Kit | BD Biosciences | 556547 | |
| FITC-CD4 | Biolegend | 100406 | |
| PE-CD8 | Biolegend | 100708 | |
| anti-c-Erb2/c–Neu | Calbiochem | OP16 | |
| PE- anti mouse IgG | Biolegend | 405307 | |
| formaldehyde | Polysciences, Inc. | 04018 | |
| Hemocytometer | Hycor | 87144 | |
| Light microscope | VWR international | V200073 | |
| Mouse IFN-γ ELISA set | BD Biosciences | 555138 | |
| Cell culture flasks | Greiner Bio-One | 658175 |
参考文献
- Goodell, V., Waisman, J., Salazar, L. G., de la Rosa, C., Link, J., Coveler, A. L., Childs, J. S., Fintak, P. A., Higgins, D. M., Disis, M. L. Level of HER-2/neu protein expression in breast cancer may affect the development of endogenous HER-2/neu-specific immunity. Mol Cancer Ther. 7, 449-454 (2008).
- Disis, M. L., Knutson, K. L., Schiffman, K., Rinn, K., McNeel, D. G. Pre-existent immunity to the HER-2/neu oncogenic protein in patients with HER-2/neu overexpressing breast and ovarian cancer. Breast Cancer Res Treat. 62, 245-252 (2000).
- Liu, S., Riley, J., Rosenberg, S., Parkhurst, M. Comparison of common gamma-chain cytokines, interleukin-2, interleukin-7, and interleukin-15 for the in vitro generation of human tumor-reactive T lymphocytes for adoptive cell transfer therapy. J. Immunother. 29, 284-293 (2006).
- Bear, H. D., Roberts, J., Cornell, D., Tombes, M. B., Kyle, B. Adoptive immunotherapy of cancer with pharmacologically activated lymph node lymphocytes: a pilot clinical trial. Cancer Immunol Immunother. 5, 269-274 (2001).
- Morales, J. K., Kmieciak, M., Graham, L., Feldmesser, M., Bear, H. D., Manjili, M. H. Adoptive transfer of HER2/neu-specific T cells expanded with alternating gamma chain cytokines mediate tumor regression when combined with the depletion of myeloid-derived suppressor cells. Cancer Immunol Immunother. 58, 941-953 (2009).
- Cha, E., Graham, L., Manjili, M. H., Bear, H. D., Guy, C. T., Webster, M. A., Schaller, M., Parsons, T. J., Cardiff, R. D. IL-7 + IL-15 are superior to IL-2 for the ex vivo expansion of 4T1 mammary carcinoma-specific T cells with greater efficacy against tumors in vivo. Breast Cancer Res Treat. 89, 10578-10582 (2009).
- Kmieciak, M., Morales, J. K., Morales, J., Bolesta, E., Grimes, M., Manjili, M. H. Danger signals and nonself entity of tumor antigen are both required for eliciting effective immune responses against HER-2/neu positive mammary carcinoma: implications for vaccine design. Cancer Immunol Immunother. 57, 1391-1398 (2008).
- Stern, J. B., Smith, K. A. Interleukin-2 induction of T-cell G1 progression and c-myb expression. Science. 233, 203-206 (1986).
- Kittipatarin, C., Khaled, A. R. ex vivo expansion of memory CD8 T cells from lymph nodes or spleen through in vitro culture with interleukin-7. J Immunol Methods. 344, 45-57 (2009).
- Kokaji, A. I., Hockley, D. L., Kane, K. P. IL-15 transpresentation augments CD8+ T cell activation and is required for optimal recall responses by central memory CD8+ T cells. J Immunol. 180, 4391-4401 (2008).
- Le, H. K., Graham, L., Miller, C. H., Kmieciak, M., Manjili, M. H., Bear, H. D. Incubation of antigen-sensitized T lymphocytes activated with bryostatin 1 + ionomycin in IL-7 + IL-15 increases yield of cells capable of inducing regression of melanoma metastases compared to culture in IL-2. Cancer Immunol Immunother. 58, 1565-1576 (2009).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved