このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
単一粒子のためのマイクロ流体ベースの流体力学的トラップ
要約
この記事では、流体力学的流れに基づいて粒子の閉じ込めのためのマイクロ流体ベースの手法を提案する。我々はそれによって統合されたマイクロデバイスの任意の粒子の閉じ込めとマイクロマニピュレーションを可能にする、フィードバック制御のメカニズムを使用して流体よどみ点での安定した粒子のトラッピングを示しています。
要約
無料のソリューションで単一の粒子を閉じ込めると、操作する機能は、基本と応用科学のための鍵となる技術です。 、光磁気、電学、および音響技術に基づいて粒子捕獲のための方法は、分子から細胞レベルまでの物理学と生物学の大きな進歩につながっている。この記事では、我々は、単に流体力学流体の流れに基づいて、粒子の捕捉と操作のための新しいマイクロベースのテクニックを紹介します。この方法を使用して、我々は、長い時間スケールのための水溶液中でマイクロナノスケールの粒子の捕集を示しています。流体力学的トラップは、それによって流体よどみ点(ゼロ速度の点)と平面伸張流動を発生させる、二つの相反層流の流れが収束クロススロットのチャネル形状で統合されたマイクロ流体デバイスで構成されています。この装置では、粒子は流体のよどみ点での粒子の位置を維持するために流れ場のアクティブ制御によるトラップの中心に限定されています。このように、粒子が効果的にカスタムビルドのLabVIEWコードで実装されたフィードバック制御のアルゴリズムを使用して自由溶液中で閉じ込められている。制御アルゴリズムは、粒子追跡、粒子重心位置の決定、および圧力レギュレータを使用してオンチップの空気弁にかかる圧力を調節することによって流体の流れのアクティブな調整が続いてマイクロ流体デバイスにおける粒子、のための画像取得で構成されています。この方法では、オンチップの動的計量バルブ機能は、それによってよどみ点の位置と粒子のトラッピングの細かいスケールの制御を可能にする、コンセントのチャネルで相対的な流量を調節する。マイクロ流体ベースの流体力学のトラップは、粒子捕獲のための方法としていくつかの利点を示す。流体力学的トラップは、トラップされたオブジェクトの物理的または化学的特性上の特定の要件なしに、任意のパーティクルが可能です。さらに、流体力学的なトラッピングは、代替の力場ベースのトラッピング方法を使用して困難である濃縮若しくは混雑した粒子の懸濁液中の"単一の"ターゲットオブジェクト、の閉じ込めが可能になります。流体力学的トラップは、実装する簡単なユーザーフレンドリーであり、粒子のトラッピングと長い時間分析を容易にするために、既存のマイクロ流体デバイスに追加されることがあります。全体的に、流体力学的トラップは、表面固定化することなく閉じ込め、マイクロマニピュレーション、および粒子の観察のための新しいプラットフォームであり、小さな粒子の自由ソリューションのトラップで潜在的に摂動的、光学的、磁気的、電気フィールドが不要になります。
プロトコル
流体力学的トラップは、二層ハイブリッド(ポリジメチルシロキサン(PDMS)/ガラス)粒子閉じ込めのためのマイクロ流体デバイスで構成されています。 1-2は、マイクロ流体デバイスの作製を記述し、ステップ3-4デバイスの設計と操作について議論繰り返します。
1。 SU - 8モールド作製(ビデオには示されていません)
- アセトンとイソプロピルアルコール(IPA)を持つ2つのシリコンウェーハ(3"直径)を清掃してください。
- N 2と℃で1分間残留水分を除去するために65℃ホットプレート上に置くと、乾燥ウェーハ。
- 流体層のための〜40μmの厚さの金型を作成するために4000rpmで30秒間SU - 8 2050レジスト(PR)で被覆ウェハ#1を回転させる。制御層のための〜150μmの厚さの金型を作成するために1500rpmで30秒間のPRで被覆ウェハ#2を回転させる。
- ソフトベークウェハ65℃#1 95℃、3分および℃で6分間のためのC。 65でソフトベークウエハ#2℃95℃で5分間とするため℃で20分間。
- と適切な露光強度(〜150ミリジュール/ cm 2で 、〜260 mJの/ cm 2でそれぞれ)には、それぞれのマスク(::ポートと流体チャネル、ウェハ#2ポートと制御層ウエハ#1)とUVにウェハを公開。
- 65℃のポストベークウェハ#1 95℃、1分および℃で6分間のためのC。 65℃のポストベークウェハ#2 95℃で5分間とするためのC℃で10分間。
- 未硬化のPRが削除されるまで、プロピレングリコールメチルエーテルアセテート(PGMEA)とウェーハを開発する。 IPAとN 2と乾燥でウェーハを洗浄します。
2。マイクロ流体デバイスの作製
- トリクロロシラン数滴を含むガラス皿で〜10分間真空下でデシケータ内でウェーハを配置することにより、SU - 8金型の表面をSilanize。表面のシラン化は、SU - 8モールドオフ(PDMS)のレプリカを剥離するのに役立ちます。
- ベースのミックスと脱PDMS:それぞれ流体とコントロール層のための午前15時01分〜5:1の架橋剤の比率。
- 750 rpmで30秒間流体層モールド(ウエハ#1)の上にコートの午後3時01分PDMSの混合物をスピンし、シャーレにウェハを配置。ペトリ皿に制御層の金型を置き、〜4mmの厚さに金型の上に5時01 PDMSの混合物を注ぐ。
- 70℃30分間焼くウェーハ/ PDMS ° Cは部分的にPDMS層を治すために。
- 室温にウェーハ/ PDMSを冷却した後、SU - 8モールドオフメスとその皮付きのペトリ皿から、制御層(ウェハ#2)を形成するPDMSのレプリカを、カット。穴パンチ21ゲージの針を持つオンチップ膜弁として機能するそのマイクロチャネルへのアクセスポート。
- ウエハ#1(スピンコートPDMS流体の層を持つ)に制御層とPDMSレプリカを置きます。慎重に合わせて、実体顕微鏡を用いて流体層に制御層を密封する。完全に両方の層を硬化させる℃で一晩で70層とオーブンで焼く間のすべてのエアポケットを除去することを確認してください。この焼成工程では、二つの層を持つモノリシックPDMSのスラブになります。
- 室温に冷却した後、カットしてメスを用いてSU - 8モールドオフ制御と流体層の両方を含むPDMSレプリカピール。過剰PDMSを削除し、カミソリの刃で各デバイスのユニットを分離。 21ゲージ針と流体層のマイクロに穴パンチのアクセスポート。
- 完全なデバイスを得るためにカバースリップに結合PDMSのスラブを。アセトンとIPAと:まず、カバースリップを(1.5、24 × 45ミリメートルなし)クリーン。次に、30秒間に500 mTorrの下でカバーし、酸素プラズマによるPDMSレプリカの表面の両方を扱って、そしてすぐに不可逆的なシールを形成するために接触する2つのサーフェスを持参。
- PDMS層とカバーとの間の接着を高めるために一晩デバイスを焼く。
手順3〜4上記のマイクロ流体デバイスを用いた流体力学的トラップの実装について説明します。
3。流体力学的トラップの実験セットアップ
- 倒立顕微鏡のステージ上にマイクロ流体デバイスを配置し、ステージのクリップで固定します。
- バッファとサンプルソリューションで別々に二つのガスタイトシリンジを記入し、ハーバード大学の装置のシリンジポンプ(PHD 2000プログラマブル)の上に置きます。バッファーと試料溶液をそれぞれ1 mlおよび250μlのシリンジを介してマイクロ流体デバイスに配信されます。一般的に、50mMトリス/トリス塩酸緩衝液(pH 8.0)V / VトリトンX - 100は緩衝液として使用される0.02%含む。試料溶液は、緩衝溶液中の粒子の懸濁液(例えば蛍光ポリスチレンビーズ)で構成されています。
- シリンジ(サンプルとバッファーを提供する)とマイクロ流体デバイスとの間の流体接続を確立します。 1 / 16"外径(OD)× 0.020"に注射器を接続してルアーロックアダプタを使用して、内径(ID)ペルフルオロアルコキシ(PFA)チューブ。 24ゲージのメタとマイクロ流体デバイスの入口ポートにPFAチューブのもう一方の端を接続します。lのチューブ。 T -バルブは、サンプルのシリンジやサンプルの配信を制御するためのマイクロ流体デバイスのサンプルポートとの間に配置することができます。
- マイクロ流体デバイスの出口チャンネルの流体接続を確立します。 24ゲージの金属製チューブを使用してPFAチューブ(外径1 / 16"X 0.020"ID)に2つの出口チャネルに接続してください。アウトレット用PFAチューブは、長さは等しい必要があります。注射器とコンセントのチャネル間の一定の圧力降下を維持するために提供する緩衝液で満たされた1.5mLの遠心チューブに沈めるアウトレットチューブの両方。
- 運転中の流体層中に空気が漏れるのを防ぐために3 mLのルアーロックプラスチックシリンジを用いてフッ素化するキャリアオイルとオンチップバルブを埋める。弁室内の空気は流体層内にマイクロチャネル中にPDMS膜を介してプッシュし、後で出口ポートを介して流体の流れを持つデバイスから削除されます。
- オンチップのバルブ操作のための制御層のポートに加圧された不活性ガス(窒素)の供給を接続します。この目的のために、我々は窒素タンク(2200 PSI)とマイクロ流体デバイスでのオンチップバルブに00から30 PSIを供給する電子式圧力調整器を使用してください。窒素タンクは、¼"外径× 0.170"IDチューブを使用して圧力調整器に接続されています。圧力調整器は、その末端に24ゲージの金属製チューブ付き外径1 / 16"X 0.020"ID PFAチューブを介してマイクロ流体デバイスに接続されています。
- すべての気泡が出口チャネルを含めてシステムから削除されることを保証するために緩衝液0.5 mLで流体接続し、マイクロ流体デバイスをすすいでください。 2000-5000μL/ hrの間に気泡の範囲をクリアするために使用される典型的な流量。気泡がマイクロ流体チャネルの外リンスされた後、粒子捕獲のための典型的な体積流量である50〜100μL/ hrで、流量を減少させる。
- この時点では、流体の接続は、サンプルを確立され、緩衝液は、一定の流量(50〜100μL/ hr)でマイクロ流体デバイスに配信され、デバイスは、流体力学的トラッピングのための準備ができています。
4。流体力学的トラップの手順
- 粒子のトラッピングを自動化するカスタムビルドのLabVIEWコードを、(下のLabVIEWコードの使用上の注を参照)を実行します。
- カメラビューの中央に顕微鏡のXY移動ステージ、位置トラッピング領域(クロススロット)を使用する。対物レンズの焦点に捕捉領域を持参し、撮影条件を最適化するためにカメラの設定を調整します。
- ROIの中心がトラップの中心の位置となるようにカメラの視野内で関心の矩形領域(ROI)を選択します。
- オンチップのバルブに適用されるオフセット圧力を初期化します。コンセントのチャネルのいずれかを使用して、100〜200μm幅のくびれは、オンチップバルブのオフセット圧力を提供するために導入されています。定数オフ設定圧力は、チャネルクロススロットの中央付近のよどみ点の位置を調整するためのオンチップバルブを可能にします。ほとんどの実験では、オフセット圧力は、チャネル寸法(高さと幅)、くびれの幅、およびオンチップバルブ(バルブサイズ、膜の厚さ、等)の仕様に応じて0から12 psiの間に設定されています。
- フィードバック制御を開始し、トラップの応答を最適化するための比例ゲインを調整します。フィードバックコントローラは、エラーまたは粒子の位置とセットポイント(トラップの中心)間の距離を最小化よどみ点の位置を、移動するために、オンチップバルブにかかる圧力を調整します。流量とオンチップのバルブの位置に応じて、トラップの安定性を高め、不要な粒子の発振を除去する最適な比例ゲインの値は、ある。
- 粒子をトラップ。 LabVIEWコードは自動的にトラッピング領域に入る粒子のいずれかをトラップします。所望の粒子がトラップされると、それは必要に応じて、サンプルの流れを遮断し、緩衝液で捕捉粒子を分離することが可能です。
- 捕捉粒子を監視し、マニュアルフォーカスや自動焦点顕微鏡のセットアップを使用してイメージプレーン内で粒子のフォーカスを維持する。それは少し長い時間スケールのトラップイベント(数分から数時間)のコースの中にトラップの安定性を確保するために、フィードバック制御器の比例ゲインを調整する必要があります。
LabVIEWコード:フィードバックコントローラの使用上の注意
自動化された粒子のトラッピングは、カスタムLabVIEWコードを使用して実装線形フィードバック制御のアルゴリズムを使用して実現されます。 LabVIEWコードは、CCDカメラから画像をキャプチャし、積極的に、オンチップの動的空気弁の位置(部分的にオープン/クローズ状態)を調節する圧力調整器、に電位(電圧)を送信する。一つの出口ラインの弁のような位置の変化、流体流量Isはそれによってよどみ点を再配置すると流体力学的トラップを有効に、調整。フィードバックループの各ステップは順次であり、反復的に画像のキャプチャ(10-60 Hz)の速度で実行されます。 LabVIEWコードは、各フィードバックループのサイクルの間に次の手順を実行します。
- 。とCCDカメラ: 画像のキャプチャ画像は、10倍対物レンズ(0.4 NA)と蛍光顕微鏡を用いたマイクロ流体デバイスのトラッピング領域内の"ターゲット"粒子のために取得されます。
- 粒子追跡。粒子の重心の位置が決定され、粒子追跡アルゴリズムが開始されます。粒子は、重心位置が決定されるから、点広がり関数(PSF)、に粒子の発光強度のプロファイルを適合させることによりローカライズされています。
- 流れ場のコントロール。オンチップの動的な弁を対象とした更新された圧力は、比例制御とフィードバック制御のアルゴリズムを使用して計算されます。この方法では、バルブの作用は、トラップの中心に向かって粒子を導くために、粒子に流体力を発揮するよどみ点を、再配置するためです。
経過1)時間、2)から粒子の重心(x、y)は捕捉粒子の位置、3)トラップの中心の位置、4)距離:LabVIEWのコードは、トラップ粒子中に取り込まれた各画像については、次のデータが記録さトラップセンター、5)圧力は、オンチップバルブに適用される。さらに、コードでもAVIファイル形式での捕捉粒子の映画を記録します。
5。代表的な結果
我々は、流体力学的トラップを使用して、様々なサイズ(100、540、830nmの、及び2.2μmの直径)の蛍光ポリスチレンビーズを捕捉。図1(a)はマイクロ流体デバイスでのクロススロットの接合部にトラップされた粒子の像を示しています。捕捉粒子の軌道がトラッピングイベント中または記録されたムービーファイルから捕捉粒子を追跡し、ローカライズすることでLabVIEWのコードで記録された重心位置のデータから直接決定することができる。図1(b)出口チャネル方向に沿って捕捉粒子(2.2μmの蛍光ポリスチレンビーズ)の軌跡を示しています。ビーズは、当初は3分間(四角)にトラップされ、その後、出口チャンネル(円)の1つに沿ってトラップし、エスケープから放出される。圧縮流れの軸(入口チャネル方向、データは示していない)に沿って粒子軌道は、図1(b)に示すように伸長流の軸(流出の方向)に沿って粒子軌道に似ています。コンセントのチャネル方向に沿って閉じ込められたビーズ(2.2μmの直径)のためのトラップの中心から粒子の変位のヒストグラムを図1(c)に示されています。この作業で説明されているフィードバック制御のアルゴリズムを使用して、捕捉された粒子は入口と出口のチャネルの方向に沿ってトラップの中心の± 1μm以内に制限されます。
流体力学的トラップのために使用されるマイクロ流体デバイスの概略図を図2に示されています。統合されたマイクロ流体デバイスは、流体層と制御層から構成されており、この資料に記載したように標準的な多層ソフトリソグラフィを用いて製造されています。流体層はバッファとサンプルのチャネルだけでなく、流体力学的捕捉を容易にするクロススロットのチャネルのジオメトリが含まれています。制御層は流体層の出口チャンネルのいずれかの上に位置する空圧バルブで構成され、そして制御と流体層が薄いエラストマー膜によって分離される。デバイスの動作中に、制御層のバルブは、それによって出口チャネルに収縮を誘発する、流体層に薄い膜を強制的に窒素ガスを、加圧しています。ダイナミック空気弁は、出口のチャネルで相対的な流量を調整し、よどみ点の微細構造制御を可能にする制御層、にかかる圧力を変更することにより、変数の金額で出口チャネルを収縮。
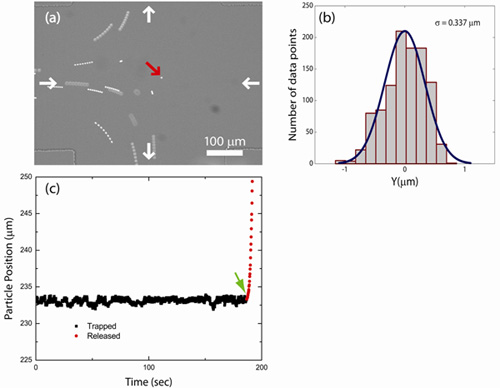
図1:粒子捕獲。流体力学的トラップに閉じ込められた単一のビーズの()イメージ。トラップの中心にビーズに加えて、いくつかのトラップしていないビーズがトラッピング領域で示されています。コンセントのチャンネル(正方形)に沿って捕捉粒子の(b)の軌跡。粒子がトラップ(矢印)から解放されるとき、それは出口のチャンネル(丸)の一つに沿ってエスケープします。(C)出口チャネルに沿ってトラップの中心からのトラップされたビーズ(2.2μmの直径)の変位のヒストグラム。
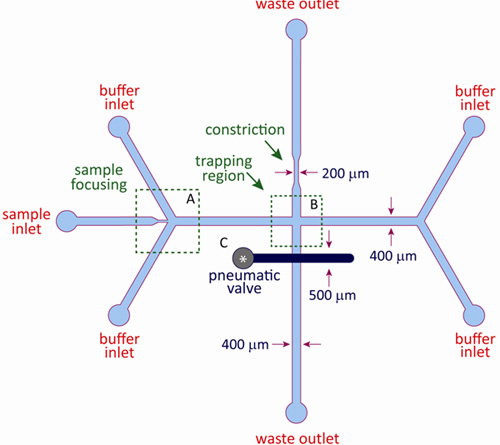
図2:流体力学的トラップのためのマイクロ流体デバイスの模式図は、流体力学的なトラップは2層マイクロ流体デバイスを使用して構築されます。流体層は、サンプル入口で構成され、F私たちのバッファーインレット、二廃棄物のアウトレット。制御層は流体層の出口チャンネルのいずれかの上に位置する空気膜のバルブで構成されています。反対の出口チャネルの狭窄は、空気弁のオフセット圧力を提供します。典型的なチャネル寸法は、100から500ミクロンの範囲です。地域では()、サンプル入口は2つのバッファの入口でフォーカスの流れです。地域では(B)、反対側の入口ストリームは、トラップが発生するクロススロットの接合部に収束する。空気弁(C)は、コンセントのチャネルのいずれかの上に配置されている。よどみ点の位置は、このバルブに圧力を調節することによって変調される。
ディスカッション
流体力学的流れに基づいてパーティクルを操作するための現在のマイクロ流体の方法は、接触型と非接触の方法として特徴づけることができる。非接触方式では循環流やmicroeddies 10日に依存するのに対し、接触型の方法は、物理的に閉じ込めると微細チャネル壁9に対して粒子を固定化するために流体の流れを使用してください。本研究では、我々は流体の流れの唯一のアクシ...
開示事項
謝辞
我々は有用な議論のためのイリノイ大学アーバナシャンペーン校でKenisグループを感謝し、寛大にクリーンルーム施設の使用を提供する。
この作品は、グラント第4R00HG004183 - 03(チャールズM.シュレーダーとMelikhan Tanyeri)の下、独立PIの賞にNIHの経路によって賄われていた。
この作品は、エリックM.ジョンソン- Chavarriaに大学院研究フェローシップを通じて、全米科学財団によってサポートされていました。
資料
| Name | Company | Catalog Number | Comments |
| 21 gauge blunt needle | Zephyrtronics | ZT-5-021-1-L | For punching port holes in PDMS |
| 3 ml plastic syringe | BD Biosciences | 309585 | For filling valve with oil |
| Si wafers | University Wafer | 3” P(100) single side polished 380 μm test grade | |
| Cover glass | VWR international | 48404-428 | 24 x 40 mm #1.5 |
| DAQ card | National Instruments | PCI 6229 | |
| Fluorescent beads | Spherotech, Inc. | FP-2056-2 | 2.2 μm Nile red |
| Fluorinert | 3M | FC 40 | Fluorinated carrier oil |
| Inverted Microscope | Olympus Corporation | IX-71 | |
| LabVIEW | National Instruments | Version 9.0f3 (32bit) | |
| Stereo Microscope | Leica Microsystems | MZ6 | For aligning PDMS control layer to fluidic layer. |
| Mechanical Convection Oven | VWR international | 1300U | For baking devices to create monolithic PDMS slabs with two layers. |
| Microfluidic tubing and connectors | Upchurch Scientific | 1/16 x .020 PFA tubing and super flangeless fittings | |
| PDMS | GE Healthcare | RTV 615 A&B | |
| Plasma Chamber | Harrick Scientific Products, Inc. | PDC-001 | |
| Pressure Transducer | Proportion Air | DQPV1 | |
| Spin Coater | Specialty Coating Systems | G3P-8 Spin Coat | |
| Photoresist | MicroChem Corp. | SU 8 2050 | |
| Syringe Pump | Harvard Apparatus | PHD 2000 Programmable | |
| Terminal Block | National Instruments | BNC 2110 | For analog output to pressure regulator and read out. |
| UV Collimated Light Source and Exposure System | OAI | Model 30 Enhanced Light Source |
参考文献
- Tanyeri, M., Johnson-Chavarria, E. M., Schroeder, C. M. Hydrodynamic Trap for Single Particles and Cells. Applied Physics Letters. 96, 224101-224101 (2010).
- Ashkin, A., Dziedzic, J. M., Bjorkholm, J. E., Chu, S. Observation of a Single-Beam Gradient Force Optical Trap for Dielectric Particles. Optics Letters. 11, 288-290 (1986).
- Neuman, K. C., Block, S. M. Optical trapping. Review of Scientific Instruments. 75, 2787-2809 (2004).
- Gosse, C., Croquette, V. Magnetic tweezers: Micromanipulation and force measurement at the molecular level. Biophysical Journal. 82, 3314-3329 (2002).
- Chiou, P. Y., Ohta, A. T., Wu, M. C., C, M. Massively parallel manipulation of single cells and microparticles using optical images. Nature. 436, 370-372 (2005).
- Cohen, A. E., Moerner, W. E. Method for trapping and manipulating nanoscale objects in solution. Applied Physics Letters. 86, 093109-09 (2005).
- Evander, M. Noninvasive acoustic cell trapping in a microfluidic perfusion system for online bioassays", Analytical Chemistry 79. , 2984-2991 (2007).
- Unger, M. A., Chou, H. P., Thorsen, T., Scherer, A., Quake, S. R. Monolithic microfabricated valves and pumps by multilayer soft lithography. Science. 288, 113-116 (2000).
- Kim, M. C., Wang, Z. H., Lam, R. H. W., Thorsen, T. Building a better cell trap: Applying Lagrangian modeling to the design of microfluidic devices for cell biology. Journal of Applied Physics. 103, (2008).
- Lutz, B. R., Chen, J., Schwartz, D. T. Hydrodynamic tweezers: 1. Noncontact trapping of single cells using steady streaming microeddies. Analytical Chemistry. 78, 5429-5435 (2006).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved