Method Article
拡大、精製、及びヒト末梢血NK細胞の機能的評価
要約
ここでは、効率的に拡大し、精製ヒトNK細胞の数が多いし、その機能を評価する方法を説明します。
要約
ナチュラルキラー(NK)細胞は、感染性微生物や種々の腫瘍に対する免疫監視に重要な役割を果たしている。 NK細胞とin vitroで拡大する機能の利用が限られては、NK細胞免疫療法の開発が制限されています。ここでは、効率的に人工的な抗原提示細胞(aAPC)として、膜結合IL21の発現K562細胞を用いた機能性NK細胞のex vivoでの膨大な量を拡大する方法を説明します。
これまでNK細胞養子療法はT細胞やNK細胞のポジティブセレクションの枯渇が続くドナーの定常状態の白血球除去輸血により得られた細胞の製品を利用してきた。製品は通常一晩IL - 2で活性化し、次の1日目に投与される。ため、末梢血中のNK細胞の低周波から、NK細胞の比較的小さな数字は、臨床試験で配信されている。
in vitroで NK細胞を伝播することができないことは、最適な臨床転帰のために十分な細胞数を生成するための制限要因となっている。 NK細胞のいくつかの拡張(1〜2週間以上5〜10倍)が高用量IL - 2単独2を介して達成されている。自家T細胞の活性化は、地元のサイトカイン3のリリースによって、おそらくまた、NK細胞の増殖を媒介することができる。間葉系間質または人工的な抗原提示細胞(AAPCS)によるサポートは、末梢血と臍帯血4の両方からNK細胞の拡張をサポートすることができます。抗体でコーティングされたビーズで組み合わせてNKp46とCD2活性化は、現在21日間で約100倍に拡大、その結果、NK細胞の拡大(Miltenyi Biotec社、オーバーンカリフォルニア州)のために販売されている。
aAPC -拡張使用するか、活性化NK細胞の臨床試験が進められ、大幅な拡張なしにプライムと活性化NK細胞5に白血病細胞株CTV - 1を使用して、1つです。二審は21日6で平均490倍の拡大を達成するため、NK細胞の増殖のためにEBV - LCLを利用しています。三番目はK562ベースaAPCを利用して4 - 1BBL(CD137L)と21日の平均NK拡大277倍を達成した膜結合型IL - 15(MIL - 15)7、形質導入。 NK細胞はK562 - 41BBL - mIL15を使用して展開、がaAPCが展開されていないNK細胞と比較してin vitroおよび in vivo での高い細胞毒性であり、ADCCに参加、その増殖が老化テロメアの短縮8に起因することによって制限されます。さらに最近ではNK細胞の350倍の拡大は、K562表現MICA、4 - 1BBLとIL15 9を使用して報告した。
NK細胞の拡大の私達の方法はここに21日の中央値は21,000倍に拡大を達成する老化することなく、NK細胞の急速な増殖を生成する説明。
プロトコル
1。バフィーコートから末梢血単核細胞の単離
末梢血単核細胞(PBMC)は、白血球除去輸血により誘導された健康なドナーバフィーコートサンプルからをFicoll - Paqueで浮遊密度遠心法によって得られる。
- をFicoll - Paque遠心分離は、若干変更してあたりの製造者のプロトコルとして行われます。
- 140mlの最終容積に正常なドナーから血液銀行バフィーコート(典型的なバフィーコートの量が40〜70 mLの場合)にPBSを追加。
- 層をFicoll - Paque(4管)15mLの上にバフィーコートサンプルの35 mLの。
- ブレーキなしで20分間400グラム間遠心する。
- をFicoll - PaqueからPBMCを回復する:プラズマのインタフェースを、をFicoll - Paqueの下部にある赤血球を廃棄しないでください。
- 10分間400グラムで、毎回遠心分離し、PBSでPBMCを三回洗浄する。
- PBMCを(セクション4)RosetteSepにより単離することができるこの段階では、NK細胞の増殖やNK細胞に直接使用できます
- 残りのPBMCを液体窒素で10%のDMSOを含むFBS中で凍結することができます。
- フィコールを吸引し、2つの50 mLの遠心分離管に手順5から赤血球を集め、PBS(50mLのマークに追加)で3回洗浄、それぞれの時間は、赤血球層の上部は、顆粒球を除去する上清スキミングを吸引除去する。
- 赤血球がNK細胞のRosetteSep精製( セクション4を参照)のために直ちに使用または4でAlseverのソリューションを等量に格納できる℃で後で使用するために(赤血球は4週間を限度として格納することができます)。
2。 NK細胞増殖
NK細胞の増殖は、末梢血を使用するか、NK細胞を精製開始することができます。拡大のために使用される末梢血単核球の量が3週間の拡張の終了時に希望するNK細胞の量に基づいて変化させることができる、詳細については、代表的な結果のセクションを参照してください。 (注1を参照)
刺激1
0日目
- 展開される各5 × 10 6 PBMCsをするため、カウント、100 Gyのでガンマ照射器を用いて10 × 10 6 K562 CL9 mIL21を照射します。
- 照射後、NK細胞の膨張媒体(NKEM)のPBSに懸濁するで細胞を洗浄。
- T75フラスコでNKEM 40ml中の種子10 × 10 6照射K562 CL9 mIL21と5 × 10 6末梢血単核球(1:2比)と37℃のインキュベーター内で直立℃、5%のCO 2を入れてください。
3日目と5
- 5分間400グラムで、遠心分離により細胞を回収し、新鮮なNKEM(メディア全体のボリュームの新鮮なIL2を加える)とメディアの半分を交換し、培養する。
刺激2
日7
- 一週間の終わりに培養中の細胞の数を数えます。
- フローサイトメトリーによる表現型解析のために5 × 10 5細胞を脇に置きます(注2を参照)
- 再刺激するそれぞれ5 × 10 6個の細胞の場合は、カウント、100 Gyのでガンマ照射器を用いて5 × 10 6 K562 CL9 mIL21を照射します。
- (注3を参照)2.5x10合計5個/ mLにNKEMで照射K562 CL9 mIL21(1:1比)を再懸濁しますの等しい数を追加。
- T75フラスコ中の種子の細胞(フラスコあたり最大50 mL)で。
10と12日間
- セルの数を数える。
- (注3を参照)、細胞数に基づいて、新鮮なNKEMを使ってメディア全体を変更します。
14日目
- 拡張の二週間の終わりに培養中の細胞の数を数える。
- フローサイトメトリーによる表現型解析のために5 × 10 5細胞を脇に置きます(注2を参照)
- 拡張がPBMCから開始された場合はNK細胞はRosetteSep精製プロトコルを使用して展開のこの段階(セクションIVを参照)で精製することができる。拡張は刺激3に進んでNK細胞を精製から開始された場合。
- 精製後にNK細胞(手順8のように)の純度を確認するためにフローサイトメトリーによる表現型解析のために5 × 10 5細胞を脇に置きます。
- 精製されたNK細胞のすべてを(注4を参照)を使用して刺激3に進みます。
刺激3
- (注3を参照)、細胞数に基づいてNKEMで照射K562 CL9 mIL21(1:1比)で再懸濁し、NK細胞。
17と19日間
- セルの数を数える。
- (注3を参照)、細胞数に基づいて、新鮮なNKEMでメディアを変更します。
21日目
- 展開の三週間の終わりに培養中の細胞の数を数える。
- フルNK細胞の表現型の抗体のパネルのためのフローサイトメトリー解析のための1 × 10 6細胞を(表1を参照)回復する。
- 将来の使用のためのバイアルあたり5 × 10 7細胞の最大密度で10%のDMSOを含むFBSで細胞を凍結する。
3。 NK細胞の細胞傷害性アッセイ
- NKEMにおけるNK細胞と種のバイアル、PE前日に解凍回復を可能にするために細胞毒性アッセイをrforming。
- 単一のターゲット細胞株を用いてそれぞれのNK細胞の細胞毒性アッセイの場合、6 × 10 5 NK細胞と3 × 5ターゲット細胞(注5を参照)が必要です。
- NKEMにカルセイン- AMを(在庫1 DMSOのmg / mL)に希釈することによりCAM -メディアを準備する(注6を参照)。
- (注7を参照)CAM -培地1 mL中に10 6の標的細胞を再懸濁します。
- 時々振とうしながら、37℃で1時間インキュベートする。
- 1 E::図1に示すようにT比1 × 10 6細胞/ mLと、対応するU底96ウェルプレート〜10の3ウェルの各々にNK細胞懸濁液の200uLを追加で再懸濁し、NK細胞。 (注8を参照)
- "最大"以外のすべての残りのウェルに完全なメディアの100uLを追加。
- "最大"に2%トリトンの100uL X - 100を追加。
- 5その後のEのためのNK細胞の連続希釈を行います。セルの100uLたびに転送することによってT比は、よく混ぜる。最後のウェル(:0.3125:1のT比E)から100uLを捨てる。
- カルセイン負荷の1時間後、1200rpmで5分間、遠心分離、二回NKEMで標的細胞を洗う。 (注9を参照)
- 1 × 10 5細胞/ mLで標的細胞を再懸濁しますを再カウント。
- (1 × 10 4 /ウェル)を各ウェルに標的細胞を100μLを加える。細胞接触を開始するには100グラムで1分間遠心。
- 37℃、4時間、5%CO 2をインキュベートする。
- 一様に放出カルセインを中断するために、100μLのピペッターでピペッティングにより穏やかに文化を混ぜ、細胞をペレットに5分間100グラムでプレートをスピンダウンして気泡をしないように注意しながら新しいプレートに上清100μLを移す。細い針を用いて形成する可能性のある気泡をポップ。
- 蛍光プレートリーダー(励起フィルター485 nmの、発光フィルター530 nm)を用いてプレートをお読みください。ボトムリードが推奨されます。
- × 100。 - [/(テストリリース - 自発的放出)(自発的な放出は最大放出)]の式に従ってパーセント特異的溶解を計算する
4。 RosetteSepによるNK細胞の精製
- 50 mlチューブ(:PBMC 100:1 RBC)に、末梢血や拡張された細胞のそれに赤血球の100倍過剰してください。
- 新鮮な赤血球を使用すると、次のステップに進むか赤血球がAlsever sソリューションに格納されている場合、赤血球の数をカウントし、2%FBS三回を加えたPBSと赤血球の適切な(100倍過剰)の量を洗って、1200rpmで遠心分離している場合10分ごとに時間のため。
- ステップ1.7または末梢血や拡張された細胞の5 × 10 7あたり1mLの最終容量にPBS + 2%FBSでステップ2.10から拡張された細胞由来のPBMCと赤血球を結合する。
- 末梢血や拡張された細胞の1 × 10 6あたりRosetteSepヒトNK細胞の濃縮カクテルの1μLを追加。
- よく混和して、5分ごとに混合穏やかに室温で20分間インキュベートする。
- 等しい優しくPBS + 2%FBSミックスのボリュームとをFicoll - Paqueの上にレイヤーを追加します。
- PBMC分離(セクションI)で説明をFicoll - Paque遠心分離の手順を繰り返します。
- 精製後に回収したNK細胞をカウントし、NK細胞の純度(手順8)のためのフローサイトメトリーによってphenotpyingために5x105細胞を脇に置きます。
5。ノート
注1。NK細胞は、末梢血から、またはRosetteSep精製NK細胞から直接拡張することができます。我々は同じような展開の効率化を指摘しているが、一部のドナーは、拡大する前にRosetteSepによって難易度の浄化、その結果非常に低いNK細胞数を持つことができます。
注2。我々は日常的にCD3陰性とCD16 -またはCD56陽性であるものとして、NK細胞を列挙し、拡張時の表現型解析のためにCD56 - FITC、CD16 - PE、およびCD3 - PE - Cy5標識を使用してください。
注3。各メディアの変化や刺激では、2.5 × 10 5 / mLの再懸濁し、細胞が膨張のピークの段階でmL当たり、または200万下のNK / PBMC細胞数を維持する。これは、栄養素の枯渇を防ぎ、最大の拡大と生存を達成するのに役立ちます。
注4。NK膨張率は、ドナーに依存しており、刺激の終了時に細胞の1または2の一部は実験的な必要性に応じて凍結させ、一部はさらに拡大することができます。我々は、後で拡張のために凍結細胞を使用して良好な成功を収めている。
注5。我々はNKEMと細胞毒性アッセイをセットアップするためのNKEMの4中に再懸濁さ4 × 10 5カルセイン- AM染色した標的細胞の700 ULSで再懸濁し、7 × 10 5 NK細胞の最小値を使用することをお勧め誤差の余地を可能にするためには。播種標的細胞用マルチチャンネルピ ペットを使用している場合セル(最大6 mLの6 × 10 5〜)の高いボリュームが使用されているメディア流域のサイズに基づいて必要になることがあります。また、推奨されるNK細胞数は、Eのために特別です:T比が高く、Eを使用するため、プロトコルに示す:T比が増加するそれに応じmL当たりNK細胞数(40:1 Eの例::T比の使用の4 × 10 6細胞/ mL)
注6。我々は、1:500、1:400以下の希釈液を使用して、選択肢の標的細胞株のための予備的カルセイン- AMのローディング滴定を行うことをお勧めします。 1:300、1:200と1:100最大と自発的な放出の間の最適な違いを実現する。
注7。標的として接着細胞株を使用して、最初の非酵素的細胞解離バッファーを用いて、単一の細胞懸濁液を準備する。 ADCCを実行する場合は、CAM -メディアにおける標的細胞の重複チューブを準備する。
注8 ADCCを実行する場合、10:1 Eに対応する3ウェルに同一のNK細胞を追加する:。ADCCのためのT。その他のドナーのために繰り返します。追加の標的細胞に対して、この手順を繰り返します。
注9。ADCC実験を行う場合、カルセイン負荷の45分後に、標的細胞に対するADCCを誘導する特異的抗体の10ugを追加。さらに15分後、1200rpmで5分間、遠心分離、二度完全培地で標的細胞を洗う。 1 × 10 5細胞/ mLで細胞を再懸濁し、プロトコル内の次のステップに進みます。
6。駐在結果
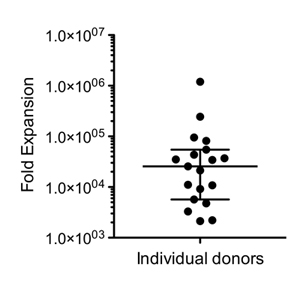
図2。展開がスキームどおりに実行されると、出発物質、1 × 10 9〜10 10細胞(ドナー依存ばらつき)に典型的なNK細胞の収量の範囲として5x106 PBMCを用いて、上記の。図は、NK細胞の倍に膨張を示す(N = 19)、元の製品に存在するNK細胞と比較し(中央値+ / - 四分位)。
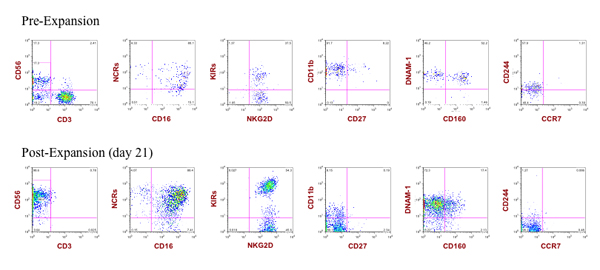
図3。展開されたNK細胞はいくつかの例外(CD11b、CD160およびCD244)と展開されていない一次NK細胞に匹敵する様々なNK細胞受容体を発現する。

図4。バフィーコートから末梢血単核球の回収は、ドナーに依存しており、300x10 6から800x10 6の範囲にすることができます。末梢血単核細胞の18% - NK細胞は2%を含むことができる。拡張セルのRosetteSep精製のため、40〜70%から当日純粋NKセル14の範囲の回復。拡張と浄化の推奨プロトコールに従うことにより、99%のNK細胞の純度が期待できる。

図5。拡張NK細胞は、神経芽細胞腫、AML、骨肉腫や悪性黒色腫(代表的なAMLの殺害は、パーセント特異的溶解として示される)を含む腫瘍細胞株の範囲に対して細胞毒性を示している。
開示事項
謝辞
著者は、最初のK562 aAPCとmIL21融合ベクターの作成に彼らの仕事のためにローレンスクーパー、Harjeetシン、とLenka Hurtonに感謝します。
この仕事のための資金は、UT MDアンダーソンの医師科学者のプログラム、聖剣帯の財団、およびフレンズの伝説によって提供されていました。
資料
NK細胞の増殖と活性化のメディア(NKEM)
- 90パーセントRPMI 1640(Cellgro)
- 10%ウシ胎児血清(ギブコ)
- 1Xペニシリン/ストレプトマイシン(Cellgro)
- 1 × L -グルタミン(Gibco社)
- 使用前にメディアを滅菌フィルタします。
- 50 U / mLのIL2(Proleukin、ノバルティスのワクチンおよび診断、株式会社)
- - 200 IU /μlのストックから希釈した。毎回使用する直前に、メディアの所望の量にIL2を追加。
PBMCおよびNK Cellアイソレーション
- をFicoll - Paque(GEヘルスケア)
- Alseverの溶液(シグマ)
- RosetteSepヒトNK細胞の濃縮カクテル(Stemcellテクノロジーズ)
NK細胞の細胞傷害性アッセイ
- カルセイン- AM(Invitrogen社)
- ストック溶液は、50μLのアリコートで凍結1mgの/ mLを、店舗にあります。細胞の染色のための必要な希釈を達成するためにNKEM媒体に溶解。
抗体
NK細胞の表現型解析のために使用される抗体のリストを以下の表に記載されています。
| Name | Company | Catalog Number | Comments | |
| 抗体 | テストごとのボリューム | 会社 | カタログ番号 | |
チューブ1 | アイソタイプFITC アイソタイプFITC アイソタイプFITC アイソタイプFITC FACSバッファー 合計ボリューム | 5 5 5 5 80 100 | BD Pharmingen社 BD Pharmingen社 BD Pharmingen社 BD Pharmingen社 | 555748 555749 557224 340442 |
| チューブ2 | CD56 FITC NKp30 PE NKp44 PE NKp46 PE CD3 PE - Cy5標識 CD16アレクサ647 FACSバッファー 合計ボリューム | 5 5 5 5 5 5 70 100 | BD Pharmingen社 BD Pharmingen社 BD Pharmingen社 BD Pharmingen社 BD Pharmingen社 BD Pharmingen社 | 340410 558407 558563 557991 555341 557710 |
| チューブ3 | CD56 FITC KIR2DL1 PE KIR2DL2 / 3 PE KIR3DL1 PE CD3 PE - Cy5標識 NKG2D APC FACSバッファー 合計ボリューム | 5 5 5 5 5 5 70 100 | BD Pharmingen社 R&Dシステムズ ミルテニーバイオテク社 R&Dシステムズ BD Pharmingen社 BD Pharmingen社 | 340410 FAB1844P 130-092-618 FAB12251P 555341 558071 |
| チューブ4 | CD56 FITC CD11b PE CD3 PE - Cy5標識 CD27 APC FACSバッファー 合計ボリューム | 5 5 5 5 80 100 | BD Pharmingen社 BD Pharmingen社 BD Pharmingen社 BD Pharmingen社 | 340410 555388 555341 558664 |
| チューブ5 | CD56 FITC CD266(DNAM - 1)PE CD3 PE - Cy5標識 CD160 Alexa647 FACSバッファー 合計ボリューム | 5 5 5 5 80 100 | BD Pharmingen社 BD Pharmingen社 BD Pharmingen社 eBiosciences | 340410 559789 555341 51-1609-42 |
| チューブ6 | CD56 FITC CD244(2B4)PE CD3 PE - Cy5標識 CD197(CCR7)APC FACSバッファー 合計ボリューム | 5 5 5 5 80 100 | BD Pharmingen社 BD Pharmingen社 BD Pharmingen社 eBiosciences | 340410 550816 555341 17-1979-42 |
参考文献
- McKenna, D. H. Good manufacturing practices production of natural killer cells for immunotherapy: a six-year single-institution experience. Transfusion. 47, 520-520 (2007).
- Koehl, U. ex vivo expansion of highly purified NK cells for immunotherapy after haploidentical stem cell transplantation in children. Klinische Padiatrie. 217, 345-345 (2005).
- Klingemann, H. G., Martinson, J. ex vivo expansion of natural killer cells for clinical applications. Cytotherapy. 6, 15-15 (2004).
- Ayello, J. Characterization of cord blood natural killer and lymphokine activated killer lymphocytes following ex vivo cellular engineering. Biol Blood Marrow Transplant. 12, 608-608 (2006).
- Carlens, S. A new method for in vitro expansion of cytotoxic human CD3-CD56+ natural killer cells. Hum Immunol. 62, 1092-1092 (2001).
- Boissel, L. Umbilical cord mesenchymal stem cells increase expansion of cord blood natural killer cells. Biol Blood Marrow Transplant. 14, 1031-1031 (2008).
- North, J. Tumor-primed human natural killer cells lyse NK-resistant tumor targets: evidence of a two-stage process in resting NK cell activation. J Immunol. 178, 85-85 (2007).
- Berg, M. Clinical-grade ex vivo-expanded human natural killer cells up-regulate activating receptors and death receptor ligands and have enhanced cytolytic activity against tumor cells. Cytotherapy. 11, 341-341 (2009).
- Fujisaki, H. Expansion of highly cytotoxic human natural killer cells for cancer cell therapy. Cancer Res. 69, 4010-4010 (2009).
- Fujisaki, H. Replicative potential of human natural killer cells. Br J Haematol. 145, 606-606 (2009).
- Gong, W. Ex vivo expansion of natural killer cells with high cytotoxicity by K562 cells modified to co-express major histocompatibility complex class I chain-related protein A, 4-1BB ligand, and interleukin-15. Tissue Antigens. 76, 467-467 (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved