このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
網膜色素上皮の全マウントするためのマウスの眼の解剖
要約
マウスの眼の解剖の正式なデモンストレーションは、網膜色素上皮の全マウントをもたらす。
要約
網膜色素上皮(RPE)はちょうど(ロッドとコーン)光受容体を含む神経網膜の下に、哺乳類の目の後ろに位置しています。 RPEは、密接にちょうどその上の神経網膜と色素立方細胞と関連付けますの単分子層である。この協会は、網膜疾患を研究する研究者に関心のRPEになります。 RPEはまた、相同性に向けられたDNA修復、P 国連アッセイの in vivoアッセイのサイトです。マウスの眼には、その小型サイズ(直径3.5ミリメートル程度)とその球形のために解剖することは特に困難です。この記事では詳細にRPEの全マウントをもたらす眼の解剖のための手順を示しています。この手順では、我々は目の球状構造、反対ではなく、操作する方法を示しています。簡単に言うと、結合組織、筋肉、および視神経は、眼球の後ろから削除されます。その後、角膜と水晶体が削除されます。次に、戦略的なカットが残っている組織の重要な平坦でその結果を作られています。最後に、神経網膜が優しくも、根底にある脈絡膜と強膜に接続されているそのままRPEを、明らかに、リフトオフさ。この全体のマウントは 、p 国連アッセイを実行したり、RPE組織の免疫組織化学または免疫評価のために使用することができます。
プロトコル
1。眼球の外から余分な組織を取り除く
- 35mmディッシュの蓋に1X PBSを注ぐ。レベルは、単に蓋の唇未満である必要があります。
- ストレートピンセットを使用して、35mmディッシュに蓄積管からの眼(s)を転送する。 1:目は2つの理由のためにPBSに浸漬されています。無関係な組織は、あなたが見ることができるので、目から離れて"フロート"と簡単にそれらを削除し、2になります。懸濁液中のまま解剖時には、目が自然にこの形状ではなく、それに対して作業できるように、その球状の形状を維持します。
- 直角鉗子(45 °と15 °)の両方のペアを使用して、静かに(角膜に向かってすなわち)穀物に対して組織を引っ張って、できるだけ多くの筋肉と結合組織として削除します。いくつかの結合組織が維持されます。努力は、できるだけ少ないとして眼球を圧迫するためになされるべきである。
- 春のはさみについては、15 °の鉗子を交換。 45 °の鉗子との着実な目を保持しながら、残りの筋肉や結合組織だけでなく、視神経を切り取るために春のはさみを使用してください。 *ヒント:トリムして木目に逆らって組織をプッシュするはさみの外側のエッジを使用してください(corneo -強膜の分周に向かって)と。すべての余分な組織を目から除去されるまで操作を続行します。
2。角膜と水晶体を取り除く
- 角膜を上に向けて、角膜の中心部にある小さな倍を挟まないように45 °の鉗子を使用してください。
- 春のはさみを使用して、フラップの基部に小さな切開を行います。フラップを手放す。
- 目を押し続けると、まだピンセットで、に低い鋏ブレードを挿入し、垂直に切開するとcorneo -強膜除算に向かってカットを行います。角膜と虹彩の両方が切断されるようにアイリスの下に下刃を維持しようとします。 corneo -強膜デバイドのすべての方法を切断しないでください。目に挿入されたはさみをしてください。
- あなたの45 °の鉗子を使用して、慎重にはさみがcorneo -強膜デバイドと平行になるように、目を回転させ、小さなカットを行います。徐々にすべての道の周りに小さな切開を行う、眼360 °回転させる。再び、虹彩と角膜の両方が切断されるようにアイリスの下で春のはさみの下刃を維持しようとします。離れて目の残りの部分から虹彩と角膜を持ち上げて、それらを捨てる。
- その側に目を傾け、レンズを強制的に、目の後半に軽く押し下げます。レンズを捨てる。残りのアイカップの内側は滑らかで、不透明になるはずの神経網膜、が並んでいます。
3。第4四半期に、その結果生じるアイカップ、 - "花弁のある"、花のような構造を
- 目は、アイカップの開口部があなたの体に垂直になるように配置する必要があります。安定して位置アイカップにお使い45 °の鉗子を使用してください。
- あなたの前のあなたの春のはさみを保持しているので、彼らはあなたの体に垂直な、オープンアイカップの上端にあなたの春のはさみの下刃を挿入します。あなたの45 °の鉗子を使用して、慎重に、単一の、ストレートカットが視神経乳頭に向かってcorneo -強膜の除算から作ることができるように、アイカップを合わせます。すべてのカットはcorneo -強膜デバイドに垂直でなければならず、指定されない限り、それに切断することなく、できるだけ視神経乳頭に近いもの行く必要があります。
- あなたの体との直角度を維持し、アイカップを180 °回転させる。第二垂直カットを作るステップ3.2での技術を使用してください。
- アイカップを回転させ、さらに2つのカットをするために3.2で説明した技法を繰り返す。すべての4つのカットが可能な限り離れて90 °に近くする必要があります。いくつかのばらつきがあるだろうので、目が完全に球形ではないことに留意してください。
4。八花弁の花のような構造になる、半分に四つの"花びら"のそれぞれをカット
- 35mmディッシュからきれいなスライドに等分アイカップを転送する。上向きにアイカップで、45 °の鉗子で、その下にスクープ。慎重に液体から持ち上げますときれいなスライド上に置きます。
- 直角鉗子の両方のペアを使用して、軽く上向きに神経網膜と、目を開く。外さないでください神経網膜 - それはあなたがそれに対して動作していないので、目がその球面形状の一部を維持するのに役立ちます。また、誤って以下の手順で破損しているからRPEを保護します。
- 花びらの一つがあなたの体に垂直になるまで、スライドを回転させます。
- そっと花びらの角をつかむ、あなたの15 °の鉗子を使用してください。花びらのコーナーは、ない神経網膜や網膜色素上皮角膜にする必要があります。それはその曲率を維持できるように、静かにコーナーを持ち上げます。
- 花びらとスライドの間に春のはさみの底刃を挿入します。 、ストレート、シングル垂直カットが視神経乳頭に向かってcorneo -強膜の除算から作ることができるようラインアップしてはさみを。できるだけwithouとして視神経乳頭の近くにカットtはそれに切断。それがスライド上にあるできるように、花びらを手放し。
- 次の花びらはあなたの体に垂直になるように、スライドに90 °回転させます。ステップ4.5を繰り返します。
- さらに2回のステップ4.5と4.6を繰り返します。結果として得られる構造は、8花弁の花のようになります。
5。神経網膜を削除します。
- ピペット試料上に1 × PBS 100〜200μL。これは、RPEからそれはがしするとオフ付着から神経網膜を防ぐことができます。
- 通常は神経網膜が緩くRPEに添付されます。しかし、それだけで神経網膜としないRPEを削除するには、練習やスキルを取る行います。直角鉗子の他のペアで(押したまま)目の残りの部分を安定化しながらゆっくりと斜め鉗子一対の神経網膜の花びらを把握する。離れて目の残りの部分から神経網膜を引っ張る。全体の神経網膜が削除されるまでこの手順を続行します。 *ヒント:目を固定するために視神経乳頭にあなたの15 °の鉗子の先端を貼る。その後、神経網膜の下になる方向に掃引する45 °の鉗子を使用し、それを持ち上げ、。それはcorneo -強膜デバイドに向かって視神経乳頭から神経網膜を持ち上げることが最善です。アイリスの緩んでいる残骸を引き離すようにしてください。アイリスは、非常に粘着性であり、そうでなければRPEに陥ることができる。
- 1X PBSで試料を洗浄します。ピペットは100〜200検体への1X PBSμLとそれをバックアップ吸う。 PBSを捨てます。ほこりやごみを除去するために、必要に応じて手順を繰り返します。
6。あなたのスライド上の試料(s)をマウントします。
- ピペット長方形の形状で、新しいスライド上に90%グリセロールの80〜90μL。グリセロールのであって、長方形のスミアを作るために、ピペットチップの側面を使用してください。 (これは、1つのスライドに2つのRPEを取り付けるための手順です。)
- 試験片の下15 °の鉗子の下アームを挿入します。ゆっくりと解剖のスライドから試料を持ち上げます。
- ゆっくりとグリセロールに試料を下ろします。優しくて、試料の下からそれを引き出すように鉗子が小刻みに動く。
- 他の試料のためのステップ6.1から6.3を繰り返します。
- 長辺があなたの体に垂直になるようにスライドを回転させます。それがスライドに触れているように、スライドに45 °の角度であなたのカバーガラスを保持する。彼らが触れるまでグリセロールの塗抹標本に向かって移動する。カバーガラスとスライドの間の接触を維持し、ゆっくりとスライドの端に向かって、離れて汚れからカバーガラスを移動する。スライドとカバーガラスの長辺までのラインが平行になるように。親指と人差し指の間にカバーガラスの角を保持する。
- もう一方の手で15 °の鉗子を拾う。腕のクルックのカバーガラスの上部(無料)エッジクレードル。非常にゆっくりと、カバーガラスを下げます。連絡先はカバーガラスとグリセロールとの間で行われると、停止し、移行するグリセロールを待ちます。この下げ、RPE全体マウントが完全に覆われるまで待ってを繰り返します。これは、気泡を捕捉から高粘度のグリセロールを防ぐためです。カバーガラスを押し下げてはいけません - グリセロールは、密着性が非常に悪くなり、その下から絞り出すなります。
- 透明なマニキュアと、カバーガラスとスライドが出会う周囲塗料。
- 乾燥するために空のラックの上にスライドを配置。
7。代表的な結果:
この手順の結果は、花のように見えるとはかなり対称的でなければならない構造でなければなりません。

図1。黒やアグーチの動物から野生C67Bl/6Jマウス。RPEから全体のマウントRPEは、色でダークブラウンでなければならず、滑らかな表面を持つ必要があります。それは、花びらの地形の起伏に気づくのは正常です。どんなGIVE試料の色素は、RPEおよび基礎となる脈絡膜の両方の色素沈着の可変密度に起因する多少の変数があります。白い矢印は、脱色性の"チャンネル"を指している - これは正常であり、眼の基礎となる血管系によるものです。 RPEおよび基礎となる脈絡膜の両方の物理的な損傷に青い矢印を指しています。

図2。希薄マウスからの全マウントRPE。希薄な動物から採取した検体は、ほとんど透明からカフェオレに色の範囲で指定できますし、いずれかの標本は、ここで黒丸で示された、その中でばらつきを持っているようです。一般的には、若い動物から採取したRPEはもっと明るいし、以前の動物から採取したものは暗いです。黒い矢印は、脱色表示される、基礎となる血管系、のいくつかを示します。
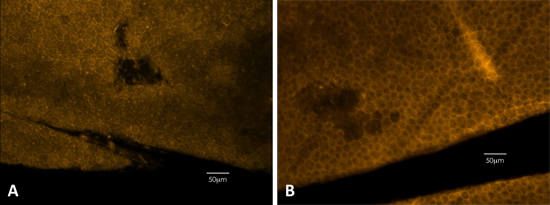
図3。ファロイジン染色は、RPEへの物理的な損傷を検出するために使用することができます。。ファロイジン染色では明らかに上皮の六角形の形状を示す、細胞膜の概要を説明します。黒いマウスから()の例。希薄マウスから(B)の例。
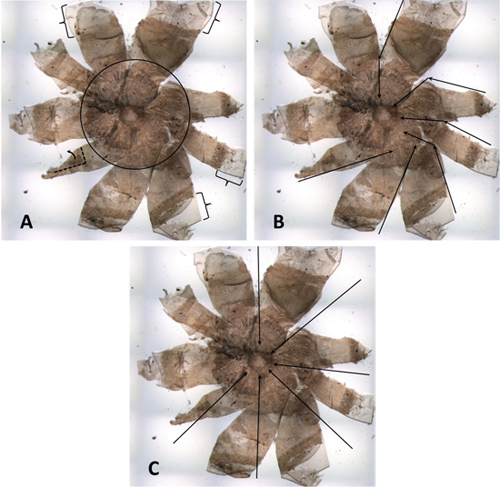
図4。希薄マウスからの悪い解剖RPE。(A)ブラケットには、および/ または折り畳みを座屈引き起こす可能性が広すぎる角膜のマージンを、示している。黒い円の中には目の後ろから削除されていない余分な組織の過剰な量を見ることができます。サンプルが希薄な動物からのものであるので、彼らは特に明白です。左下の花びらは、部分的に折り返しています。 (B)これは全体のマウントは、風車の外観を持っています。黒い矢印は、作成されたカットのいくつかを示します。視神経乳頭に向かってcorneo -強膜デバイドからのカットの多くは、直径に合っていません。 (C)黒矢印はカットが接線に直径と垂直に沿って、行われている方法を示している。
ディスカッション
RPEは、相同性指向修理のin vivoアッセイでは、p 国連検定のサイトです。 P 国連アッセイは、相同性指向修理の周波数の異なるDNA損傷の1,2およびDNA損傷のシグナル伝達と修復遺伝子3,4,5の効果を研究するために使用されています。このアッセイでは、RPE 1の単一セルのイベントを検出する、高感度です。また、開発6時の相同?...
開示事項
謝辞
この作品は、環境健康科学研究所によってサポートされていました[K22ES012264へAJRB]と米国癌協会InstitutionalResearchグラント[ACS - IRG - 00 - 173 - 04]パイロットprojectaward [AJRBへ]。我々はまたしてはいけないことの例については、原稿と特に映像とアダムブラウンのコメントの重要な読書のためにビショップの研究室のメンバーに感謝。私たちは、私たちに解剖のビデオの撮影用カメラのセットアップ彼の解剖スコープ/ビデオの使用を可能にするためGreehey小児がん研究所の博士ドナルドウェンに感謝。私たちは、シャープと私たちの顕微解剖ツールの修理のためコルテインスツルメンツでDaronブラウンに感謝する。
資料
| Name | Company | Catalog Number | Comments |
| straight forceps | Roboz Surgical Instruments Co. | RS-4903 | tip: .08 x .04 mm material: INOX |
| 45° forceps | Roboz Surgical Instruments Co. | RS-5005 | tip: .05 x.01 mm material: INOX |
| 15° "up" forceps | Roboz Surgical Instruments Co. | RS-5045A | tip: .1 x.06 mm material: INOX |
| spring scissors | Roboz Surgical Instruments Co. | RS-5604 | comb. tip width 0.3mm cutting edge length 3mm material: stainless steel |
| binocular dissecting microscope | Carl Zeiss, Inc. | Discovery V.8 | use reflected light source |
| phalloidin | Invitrogen | A22283 | Alexa Fluor 546 |
参考文献
- Bishop, A. J., Kosaras, B., Sidman, R. L., Scheistl, R. H. Benzo(a)pyrene andX-rays induce reversions of the pink-eyed unstable mutation in the retinal pigmentepithelium of mice. Mutat. Res.. 457, 31-31 (2000).
- Reliene, R. H. l. a. v. a. c. o. v. e., Mahadevan, A., Baird, B., M, W., Schiestl, R. H. Diesel exhaust particles cause increased levels of DNA deletions after transplacental exposure in mice. Mutat. Res. 570, 245-2452 (2005).
- Bishop, A. J., Barlow, C., Wynshaw-Boris, A. J., Scheistl, R. H. Atm deficiency causes increased frequency of intrachromosomal homologous recombination in mice. Cancer Res. 60, 395-399 (2000).
- Brown, A. D., Claybon, A. B., Bishop, A. J. Mouse WRN helicase domain is not required for spontaneous homologous recombination-mediated DNA deletion. J. Nucleic Acids. , (2010).
- Claybon, A., Karia, B., Bruce, C., Bishop, A. J. PARP1 suppresses homologous recombination events in mice in vivo. Nucleic Acids Res. , (2010).
- Bishop, A. J. p53-, and Gadd45a-deficient mice show an increased frequency ofhomologous recombination at different stages during development. Cancer Res. 63, 5335-5343 (2003).
- Bodenstein, L., Sidman, R. L. Growth and development of the mouse retinalpigment epithelium. Part I. Cell and tissue morphometrics and topography of mitoticactivity. Dev Biol. 121, 192-204 (1987).
- Burke, J. M. Epithelial phenotype and the RPE: is the answer blowing in the Wnt?. Prog Retin. Eye Res. 27, 579-595 (2008).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved