Method Article
電位感受性色素を持つカニ口と胃の神経節における神経細胞の光学的イメージング
要約
ここでは、カニ口と胃の神経節の神経細胞の詳細なアクティビティの高速かつ高分解能蛍光膜電位感受性色素イメージングのための方法論を提示する。
要約
ニューロンの膜電位感受性色素イメージングは、神経回路網の編成方法を理解するための主要な方法論であり、どのように参加しているニューロンの同時活動は、ネットワークに不可欠な機能性の出現につながる。ここでは、カニ口と胃の神経節でニューロンを生成する識別パターンにこの技術の応用の方法論を提示する。我々は、蛍光膜電位感受性色素ジ- 8 - ANEPPQとこれらのニューロンの負荷を示し、我々はどのように画像MiCAM02高速かつ高分解能CCDカメラの撮像システムを用いて染料ロードされたニューロンの活動をするために示す。我々は、MiCAM02イメージングシステムに関連付けられているBVAnaのイメージングソフトウェアを使用して記録された画像データの分析を示しています。従来の電気生理学的手法(細胞内と細胞外記録)と一緒に適用されるカニ口と胃の神経節内の複数のニューロンの詳細なアクティビティの同時膜電位感受性色素イメージングは根本的にどのように中枢パターン発生器ニューラルネットワークの仕事の理解のための新しい機会を開きます。
プロトコル
1。カニ口胃神経系の準備
成人のがんpagurus L.は、地元の情報源から入手(ニューカッスル大学、海洋研究所の鳩)、フィルタリング、通気海水(10 - 12 ° C)に格納されていました。解剖前に40分 - 動物は、20のために氷でそれらを充填することにより麻酔した。我々は、分離された口と胃の神経系(STNS)1を使用。冷やした生理食塩水(10〜13 ° C)で - STNSは(12 mL /分7)シリコーンエラストマーライニング(ELASTOSIL RT - 601、ワッカー、ミュンヘン、ドイツ)シャーレに釘付けと連続的に灌流した。 ;のMgCl 2、26;のCaCl 2、13;のKCl、11; trismaベース、10;マレイン酸、5のNaCl、440:生理食塩水は、(ミリモル* L - 1)から成っていた。 13℃とpH7.4で - - 7.6生理食塩水は、11の一定温度に維持した。
stomatoastric神経節(STG)のdesheathing含むSTNS郭清と準備の詳細な手順は、、GuttierezとGrashow 1でJoveの記事に示されている。全ての実験は、 第 24 回 1986年11月(86/609/EEC)の欧州共同体理事会指令に準拠して実施した。図1AはSTNSと図1Bの模式図は、そのニューロンは神経節の後部でフラットな半円として配置有する典型的なdesheathed STGを、それぞれ示す。
粘土で、STNS付きペトリ皿は、イメージング顕微鏡の動作プラットフォーム(オリンパス、東京、日本BW51 WI)に固定されています。両方は、顕微鏡ステージと顕微鏡は、光記録時の動きのアーチファクトを防ぐために(Scientifica、アックフィールド、イギリス)防振テーブル上に搭載されています。口と胃の神経節(STG)で生成されたモーターのパターンは、細胞外記録2-4を使用して監視されます。これは、次の手順で行われます。
- ワセリンベースの円筒状のコンパートメントは、電気バス(ペトリ皿は、イメージング顕微鏡の動作プラットフォームに配置される前にこれは解剖の段階で行われているから神経を隔離する主要な運動神経(LVN)のセクションを中心に構築されています)。
- 2つのステンレス鋼の電極ワイヤの片方がもう一方の基準電極としてお風呂で、この区画に配置されます。
- 差動信号は、記録をろ過し、AC差動増幅器(筑波大カイザースラウテルン、ドイツ)で増幅される。
- 神経節の運動は、オシロスコープを使用して監視されます(DL708E、横河電機、東京、日本)、さらにデータ集録ボードを使用して記録されます(CEDパワー、1401、ケンブリッジ電子設計、ケンブリッジ、英国)とスパイク2 v6.10ソフトウェア(ケンブリッジ電子設計、ケンブリッジ、英国)。ファイルは、スパイク2 v6.10(ケンブリッジ電子設計、ケンブリッジ、英国)を用いて分析されています。
2。色素溶液の調製
我々は、正の電流パルスを用いて微小電極を介して色素のローディングを容易にする二重正の電荷を持つ蛍光膜電位感受性色素ジ- 8 - ANEPPQ(バイオサイエンスケンブリッジ)5、使用。色素溶液は、できるだけ多くの光から保護する必要があります。色素溶液は、次のように調製する。
- 染料の5mgをDMSO(Invitrogen社)溶液中でF - 127プルロニック酸1mLで混合される。
- 溶解染料を含有するプラスチック製のバイアルは、微小電極を詰まらせることが大きな色素の粒子を分離するために、シグマのマイクロ遠心機1-14 12000回転/分(シグマ、Osterode、ドイツ)で20分間遠心分離する。
- 色素溶液の(上位200μL)上清をピペットを用いて分離し、独立したプラスチックバイアルに格納されています。両方のバイアルは、光への暴露を防止するためにアルミホイルでラップされます。
- 染料溶液を-20℃で凍結され
- 前の色素溶液を使用して、10〜15分間、暖かい(25℃)水に閉じ、ラップバイアルを配置することにより溶融する。
3。シャープ微小電極を用いた細胞内注入による色素ローディング
我々は、染料でニューロンをロードするために鋭い微小電極を使用。色素ローディングをチェックするために、我々はMiCAM02イメージングシステム(SciMedia、東京、日本)6を使用してください。イメージングシステムは、2台のCCDカメラを持っています:HRのカメラが1.4ミリ秒という最高の時間分解能でより良い空間分解能を提供する大規模なセンサーチップ(6.4ミリメートル× 4.8ミリメートル)を持って、HSのカメラは小さくしています(2.9ミリメートル× 2.1ミリメートル)がその最高の時間分解能として0.7ミリ秒を持つ高速なイメージングを可能にする高速化センサーチップ。染料ロードの手順は、次のとおりです。
- フィラメント(GB100TF 8P、サイエンス事業、ハイム、ドイツ)とブラウン(サッタインスツルメンツ、ノヴァト、カリフォルニア州、米国)長さは10センチメートルを使用して電極の引き手は、1mm外径のガラス管 - 微小電極は、フレーミング、P - 97でプルアップされています。電極の抵抗を持つようにプルアップされています25の範囲 - 3MのKClで40 Mohmを(のために適切な引きパラメータ設定は、電極の引き手のメーカーが提供するピペットの料理の本に従う)。
- 凍結した染料溶液は、溶融であり、それの非常に少量microfil針(MicroFil - 34G、世界の精密機器、サラソタ、フロリダ州、米国) -に吸い上げている染料がmicrofilの針の2 / 3 回の周囲いっぱいに吸い取ら。
- microfil針で色素溶液は、微小電極の先端部に注入されます。微小電極は、15分間暗所ボックスに配置されます。
- 微小電極は、3M KCl溶液で充填されています。電極は、微小電極に作用する毛細管力の吸引による電極の微細な先端に到達するための色素溶液を許可する、別の10〜20分間暗所電極のストレージボックスに戻されます。
- 準備微小電極は、電極ホルダーに入れ、細胞内のアンプのヘッドステージ(IA - 251A、ワーナーインスツルメンツ(株)、ハムデン、コネチカット州、米国)に固定されている。
- 細胞内のアンプは、微小電極に電流パルスを駆動するパルス信号を提供するデータ集録ボードに接続されています。
- 微小電極は、微小電極マニピュレータ(PatchStar、Scientifica株式会社、アックフィールド、イギリス)を使用してSTGニューロンの細胞膜に静かに置かれます。 10倍対物レンズの作動距離(UMPLFL10XW、NA 0.30、WD 3.3ミリメートル、オリンパス株式会社、東京、日本)以来、イメージング顕微鏡のは非常に小さい、微小電極は、斜位(30℃前後)と運動に配置する必要があります右の位置に微小電極の顕微鏡対物の再フォーカスと微小電極を移動させるのいくつかの手順が必要です。微小電極を開始するには、その先端がSTGを超えているような位置に移動されます。電極の先端がフォーカスされて表示されるまで、顕微鏡の対物が低下する。それがさらに低下するが微小電極に触れることほどではない。それは客観の焦点で再表示されるまで、微小電極が低下する。神経細胞が目的の焦点面にはっきりと表示されるまで、これらの手順が繰り返されます。それは触れるとゆっくりと、選択されたSTGのニューロンの膜を貫通するまで、微小電極が低下する。これは、オシロスコープを使用して監視されます。
- 細胞内電極は、その活動のプロファイルとその活動と細胞外電極2,3,7から記録されたSTG活性の関係、特定のニューロンを識別するために選択されたSTGのニューロンの活動を記録するために使用されます。
- 細胞内のアンプは、電流注入モードに切り替えられ、1秒間の最後とは、微小電極への電流が注入されると1秒間のギャップによって分離されている微小電極に正の電流ステップNA 10を注入するために30分間使用されています。記録されたニューロンに注入電流ドライブ、正に荷電した色素分子。機器が使用可能であれば複数のニューロンが同時に注入されることがあります。
- 噴射期間へと注入の終了後10分は、ニューロン内の染料の拡散がチェックされます。フィルタキューブMSWG2から(と、これを行うために、我々は、超低リップルのハロゲン光源(モリテックス、東京、日本のHL - 151)で10倍の目標とイルミネーションでMiCAM02イメージングシステムを(SciMedia株式会社、東京、日本)を使用して480から550 nmの励起フィルター、オリンパス株式会社、東京、日本)。撮像システムは、192 × 128ピクセルの解像度、40ミリ秒の撮像時間、"hbin"モード、およびイメージングセッションあたり10フレームでHRのカメラを使用するように設定されています。色素充填が成功した場合は画像は微小電極の位置の周囲のニューロンに染めパッチが表示されているはず、とこれ染めパッチは、10分後と30分後に撮影された画像の間に成長してください。染料の広がりは30分後に不足している場合、より多くの注入時間が付与されます。また、新しい色素の電極を使用することができます。
- 電極は、ニューロンから引き出されており、ニューロンは、少なくとも20〜30分リラックスに委ねられている。この時間内に、次のニューロンは、色素を注入することができます。
4。染めニューロンのイメージング
単一ニューロンの活動は、染料充填手順の後に撮像することができます。あるいは、二つ以上のニューロンは、イメージにいくつかのSTGのニューロンの同時活動を充填することができる。原則的に多くの、おそらくすべてのSTGのニューロンは、染料を充填することができる。神経細胞のイメージングは、HRのカメラを使用してMICAM 02イメージングシステムを使用して行われます。次のように画像処理の手順は以下のとおりです。
- 顕微鏡対物が変更され、高い光伝送効率20倍対物レンズ(XLUMPLFL20XW/0.95、NA 0.95、WD 2.0ミリメートル、オリンパス株式会社、東京、日本)は、画像データの収集に使用されます。この目的はまた、10倍の目標とは、ニューロンの詳細な画像を提供する高倍率を与えることが、もっと光を収集します。バイン dye負荷の小さな量はすでに我々は色素によって神経細胞に引き起こされる可能性がある写真の損傷を低減する画像処理用の低光の強度を使用することができますまた、この目的と、可視であるは、Gより多くの光を効率的な手段。
- 顕微鏡の操作の段階は、画像化されることを意味している神経細胞が目的の視野内にあると客観的がそれらに集中するように配置される。
- 細胞外記録データはまた、アナログ入力チャネルを介してMICAM 02イメージングシステムに供給されます。これは、光信号と対応するモータのパターンや分析フェーズで細胞外に記録されたスパイクの関連が比較的容易にできます。
- MICAM 02システムは、2.2ミリ秒撮影時間または1.5秒の撮像時間で48 × 32ピクセルの解像度で96 × 64ピクセルの解像度を使用するように設定されています。神経細胞の染色は非常に強力ではない場合、両方のケースでは'hbin"設定が使用されることがあります。
- 光レベルは、写真変調と記録された神経細胞の写真の損傷を避けるために、(ニューロンの染料すなわち依然としてイメージングのための十分な蛍光を生成する)可能な限り低く設定されています。
- 部屋の照明と残りのすべての光源がオフになっています。さらに、黒いカーテンが外部ソースからの光の露出を防ぐために、レコーディング機器の周囲に閉鎖されることがあります。
- 長い16秒 - イメージングセッションは4の間に設定されています。
- 染めニューロンの自発活動は、いくつかのイメージングセッションを介して記録されます。
5。光イメージングデータの解析
MICAM 02イメージングシステムに関連付けられている、イメージングデータを分析するために我々は、BVAnaソフトウェア(SciMedia株式会社、東京、日本バージョン10.08)を使用。ソフトウェアは、画像データの可視化をサポートしており、同様に分析ツールを幅広く提供しています。データ分析と解釈の手順は、次のとおりです。
- 興味のある適切な円形の領域は、それぞれの記録されたニューロンに選択されています。一般的に我々は2を使用してください - 48 × 32ピクセルの解像度でニューロン、および6を調査するための関心の3ピクセルの半径領域 - 96 × 64の解像度でニューロンを調査するための関心の8ピクセルの半径の領域を。
- データの時間的な平滑化は、色素が蛍光の相対的に低い量を生成する場合は特に、必要な場合があります(データの低バックグラウンドの値はこのことを示し、それが使用されている低光レベルまたは低レベルの色素負荷に起因する可能性があります、例えば、記録されたニューロンの神経突起の)。通常はこのような場合に我々は3で時間的平滑化を使用 - 5時間の単位を。
- 光学録音に加えて、我々はまた、イメージングシステムのアナログ入力を表示するために選択することで、細胞外記録を表示します。
- 光学データとアナログ入力の可視化のためのパラメータは、コンピュータの画面上ですべての録画を見るためには適切に設定する必要があります。
- ニューロン、LVNから細胞外記録法、およびそれ以前の細胞内記録に基づくニューロンの分類の光学録音を考えると、それはニューロンのアイデンティティを決定するとから記録された神経活動にもその活動を関連付けることが可能です。神経。
- それは光学録音が明確に示す、と複数の同様のイベントが、細胞外記録スパイク、また、他のニューロンの活動によって引き起こされる抑制性シナプス後電位のようなサブスレッショルドイベントに対応する神経活動を介して平均化の必要なしと期待される。
- BVAnaソフトウェアのデータのエクスポート機能は、関心ともLVNから録音が含まれているアナログ入力の選択された領域に対して計算された光学記録をエクスポートするために使用することができます。エクスポートされたデータは、さらに(例えば、最も単純なケースでMicrosoft Excel(マイクロソフト、レッドモンド、ワシントン州、米国)は追加の視覚化とデータ処理に使用されることがあります)だけでなく、他のデータ解析ソフトウェアを使用して処理し、分析することができます。
6。代表的な結果
LVNの記録と一緒にSTGカニの幽門中枢パターン発生器で、図2は、2つのニューロンの同時記録(PD、幽門拡張器ニューロンLP、横方向の幽門ニューロン)を示しています。 LPとその細胞内記録に基づいて特定されたPDの神経細胞の光学録音はLPとPDのニューロンに対応する細胞外記録でもその確かにこれらの一致を示す。神経節と細胞外記録サイトとの間の軸索の伝送遅延に起因するスパイクのピークの光学とLVNの記録(図2の挿入図参照)の間で一貫性のある12ミリ秒の遅延があります。提示されたデータはまた記録されたニューロンのスパイクに対応する相馬の神経活動が明確に検出可能であることを示しています。
s/ftp_upload/2567/2567fig1.jpg"altが="図1"/>
図口胃神経系(STNS)の1。)模式図。 COG、交連神経節、OG、食道神経節、STG、口と胃の神経節、STN、口と胃の神経、LVN、横心室神経。 B)カニ口と胃の神経節(STG) - 画像はSTGニューロンの半円形の後部配置を示しています。
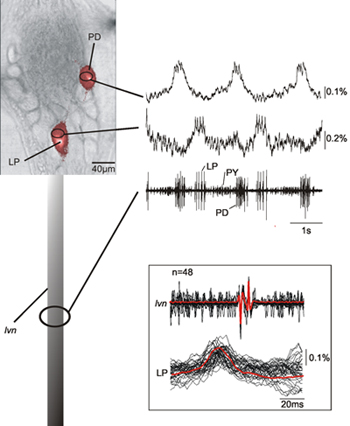
図2。PDとLVNの記録と一緒にLPのニューロンの同時単掃引記録。データは、光と神経録音は非常によく一致していることと我々は神経を形成して記録されたスパイクに対応する神経活動を識別することができることを示しています。光学的および電気的に記録された活動との間の一致を実証し、その平均 - 両方光学的および電気的に記録された - 挿入図は、LPの活動電位のいくつかのスイープのオーバーレイを示しています。私たちの光記録方式は、我々はまた、PDとLPニューロン14の特性が遅い膜電位の変化を記録することができるデータの低周波成分を除外していないという事実に起因する。
ディスカッション
従来の電気生理学的手法(細胞内および細胞外電極の録音)との組み合わせでニューロンをSTGの膜電位感受性色素イメージング8,9はどのようにこの小さな、よく知られていると、まだ複雑な神経システムの働きの理解の向上を可能にします。 STGは、中枢パターン発生器(CPG)神経回路網10、、11、従ってSTGの創発的機能的特性の理解は、また、どのように一般的に理解するのに役立つだろう(それは幽門と胃工場のリズムのネットワークを含む)のプロトタイプです。 CPGネットワークは、ネットワークレベルの機能を生成します。 CPGネットワークは、また、高次認知機能13に、モータ制御12で重要な役割を果たし、結果的に彼らの創発的特性のより良い理解は、神経科学の多くの分野で大きな影響を与える可能性があります。
開示事項
謝辞
我々は、ウルム大学で、そしてSciMedia株式会社(東京都、日本)で、ニューカッスル大学の科学、農業工学の計算科学学部の大学院でのサポートを認める。
資料
| Name | Company | Catalog Number | Comments |
| MiCAM02 | SciMedia | Imaging system | |
| BVAna v.10.08 | SciMedia | Data analysis software for the MiCAM 02 imaging system | |
| HL-151 | Moritex, Tokyo, Japan | Ultra-low ripple halogen light source | |
| BX51 WI | Olympus Corporation | Upright microscope for epifluorescence imaging | |
| 20x imaging objective | Olympus Corporation | XLUMPLFL20XW/0.95 | NA 0.95, WD 2.0mm |
| 10x imaging objective | Olympus Corporation | UMPLFL10XW | NA 0.30, WD 3.3mm |
| Filter cube with 480-550 nm excitation filter and 590nm emission filter | Olympus Corporation | MSWG2 | |
| Antivibration table | Scientifica Ltd | 63-534 | |
| PatchStar electrode manipulator | Scientifica Ltd | PS-7000C | Micro-electrode manipulator |
| CED Power 1401 | Cambridge Electronic Design | Data acquisition board | |
| DL708E Oscilloscope | Yokogawa | Intracellular amplifier | |
| AC differential amplifier | University of Kaiserslautern, Germany | Extracellular amplifier | |
| P-97 Flaming – Brown type electrode puller | Sutter Instrument Co. | Electrode puller | |
| Sigma Microcentrifuge 1-14 | Sigma-Aldrich | Centrifuge | |
| Genex Pipettors Mline | Scientific Laboratory Supplies LTD | PIP7774 | PIP7774 |
| Glass micropipette with filament | Science Products | GB100TF 8P | Glass for micr–lectrodes |
| MicroFil – 34G | World Precision Instruments, Inc. | Microfil needle | |
| Spike 2 v6.10 | Cambridge Electronic Design | Electrophysiology software | |
| Di-8-ANEPPQ | Cambridge BioScience | BT61014 | Fluorescent voltage sensitive dye |
| F-127 Pluronic Acid, DMSO | Invitrogen | P-3000MP | Solvent |
| NaCl | Sigma-Aldrich | S9888 | Crab saline component |
| CaCl2 . 2H2O | Sigma-Aldrich | C3881 | Crab saline component |
| KCl | Sigma-Aldrich | P3911 | Crab saline component, electrolyte solution |
| MgCl2 . 6H2O | Sigma-Aldrich | M9272 | Crab saline component |
| Trizma base | Sigma-Aldrich | T1503 | Crab saline component |
| Maleic acid | Sigma-Aldrich | M0375 | Crab saline component |
| Elastosil RT-601 | Wacker, Munich, Germany | Lining of Petri dishes |
参考文献
- Gutierrez, G. J., Grashow, R. G. Cancer borealis stomatogastric nervous system dissection. J Vis Exp. , (2009).
- Bartos, M., Nusbaum, M. P. Intercircuit control of motor pattern modulation by presynaptic inhibition. J. Neurosci. 17, 2247-2256 (1997).
- Blitz, D. M., Nusbaum, M. P. Motor pattern selection via inhibition of parallel pathways. J Neurosci. 17, 4965-4975 (1997).
- Stein, W., Smarandache, C. R., Nickmann, M., Hedrich, U. B. Functional consequences of activity-dependent synaptic enhancement at a crustacean neuromuscular junction. J Exp Biol. 209, 1285-12300 (2006).
- Loew, L. Potentiometric dyes: Imaging electrical activity of cell membranes. Pure & Appl Chem. 68, 1405-1409 (1996).
- Tominaga, T., Tominaga, Y., Yamada, H., Matsumoto, G., Ichikawa, M. Quantification of optical signals with electrophysiological signals in neural activities of Di-4-ANEPPS stained rat hippocampal slices. J Neurosci Meth. 102, 11-23 (2000).
- Heinzel, H. G., Weimann, J. M., Marder, E. The behavioral repertoire of the gastric mill in the crab, Cancer pagurus: an in situ endoscopic and electrophysiological examination. J Neurosci. 13, 1793-1803 (1993).
- Zecevic, D., Wu, J. -. Y., Cohen, L. B., London, J. A., Höpp, H. P., Falk, C. X. Hundreds of neurons in the Aplysia abdominal ganglion are active during the gill-withdrawal reflex. J Neurosci. 9, 3681-3689 (1989).
- Briggman, K. L., Kristan, W. B. Imaging dedicated and multifunctional neural circuits generating distinct behaviors. J Neurosci. 26, 10925-10933 (2006).
- Nusbaum, M. P., Beenhakker, M. P. A small-systems approach to motor pattern generation. Nature. 417, 343-350 (2002).
- Marder, E., Bucher, D. Understanding circuit dynamics using the stomatogastric nervous system of lobsters and crabs. Ann Rev Physiol. 69, 291-316 (2007).
- Grillner, S. Biological pattern generation: the cellular and computational logic of networks in motion. Neuron. 52, 751-766 (2006).
- Yuste, R., MacLean, J. N., Smith, J., Lansner, A. The cortex as a central pattern generator. Nat Rev Neurosci. 6, 477-483 (2005).
- Stein, W. Modulation of stomatogastric rhythms. J Comp Physiol A. 195, 989-1009 (2009).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved