Method Article
動的なマスク投影リソグラフィーを用いたニューラル培養システムのためのマイクロパターンハイドロゲルの作製
要約
簡単なテクニックは、通常の細胞培養基板上への動的なマスク投影リソグラフィ用デジタルマイクロミラーデバイスを用いた微細加工神経培養システムの急速な生産のために説明されています。これらの培養系は、天然の生物学的なアーキテクチャのより代表的かもしれない、と説明された技法は数多くのアプリケーションに適応することができます。
要約
ますます、パターン化細胞培養環境が細胞の特性を研究するために、関連する技術になりつつあり、多くの研究者がよりよい1〜3 生体の資質に模倣するin vitro実験で表現するために3D環境の必要性を信じています。このような癌研究4、神経工学5、心臓の生理学6、及び細胞-マトリックス相互作用7,8などの分野での研究は、細胞の挙動は、従来の単層培養と3次元構造との間で実質的に異なるが示されている。
ヒドロゲルがあるため、その様々な、汎用性と9-12官能を通じて調整する分子組成する能力の3D環境として使用されます。多数の技術がエレクトロ13、エラストマーのスタンプ14を含む細胞を支持マトリックスのようなコードの作成 のために存在し、インクジェット印刷15、添加剤の光パターニング16、静的なフォトマスク投影リソグラフィー17、および動的なマスクmicrostereolithography 18。残念ながら、これらのメソッドは、複数の製造工程および/または従来の細胞および組織培養の方法に容易に適応されていない機器を含む。このプロトコルで用いられる手法は、UV開始ラジカル重合によって誘導される架橋幾何学的に特定のポリ(エチレングリコール)(PEG)ヒドロゲル、のための動的なフォトマスクを作成するには、デジタルマイクロミラーデバイス(DMD)を使用して、後者の二つの方法を適合させます。結果として得られる"2.5D"の構造は、神経成長のための制約された3D環境を提供しています。我々は、PEGは、そうでない場合は型崩れがPuramatrixまたはアガロースのどちらかから作られた細胞寛大な自己組織化ゲルに構造を供給し、セル制限の領域となるデュアルハイドロゲルのアプローチを、採用しています。プロセスは、従来の細胞培養法と基質を使用するための高い再現性と容易に適合されている迅速なシンプルなワンステップの製作です。
このような胚性後根神経節(DRG)のような全体の組織外植片は、このような神経突起の成長などの実験的なアッセイのためのデュアルハイドロゲルの構造に組み込むことができます。さらに、解離細胞は、光架橋または自己重合ヒドロゲルの中にカプセル化することができる、または選択的に細胞制限の光パターニングを使用して透過性支持膜に付着。 DMDを使用して、我々は、ハイドロゲルの厚さ〜1mm前方にまで構築する作成されますが、(<200μm)をフィルム薄いPEGの構造は、フリーラジカル重合反応の酸素消光によって限られていた。私たちは、その後、薄いPEGの構造の重合を許可された重合液の上に油の層を利用する技術を開発した。
このプロトコルでは、我々は微細加工神経細胞および組織培養物の製造のための3Dハイドロゲルシステムの迅速な作成を説明します。実証デュアルヒドロゲルの構造は、本明細書に細胞の生存、遊走、および/ または神経突起成長とガイダンスを伴う神経科学の研究に役立つ可能性がin vitroモデル多彩な表現。また、プロトコルは、ハイドロゲルと多くの種類の細胞のために働くことができるように、潜在的なアプリケーションでは、多様かつ膨大な両方です。
プロトコル
1。 DMDのセットアップ
- DMDボード、UVライトガイド(コリメータ付き)と4倍対物レンズはすべて防振台上に垂直に取り付けられている。
- UVライトガイドは光が45 °ミラー、および24 °ミラーの面の下(図1)の面に対しての角度でミラーアレイに当たるように調整する必要があります。
- 対物レンズは、DMDから対物レンズまでの距離がレンズに関連付けられている焦点距離に対応するようにマウントされています。
- 倒立顕微鏡は、DMDから反射された集束光が顕微鏡で可視化できるように、対物レンズ、下に配置されます。重合の表面に対物レンズからの距離は約レンズの作動距離に対応している必要があります。顕微鏡ステージ上は、細かく画像をフォーカスするこの距離を調整するために使用することができます。この距離は、選択された重合面によって異なる場合があります。
2。組織移植片培養用のデュアルハイドロゲルのコンストラクト
A. DRGの外植片の接着
- コート膜自体をしないように注意しながら雨- X付き6穴コラーゲンコートした細胞培養用インサート(コーニング)、の壁。 (あるいは、疎水性のバリアーのペンを使用することができます。)
- 37℃、5%CO 2インキュベータで接着培地1.5mlで一晩水和物を挿入します。接着の培地は、10%ウシ胎児血清、1%ペニシリン/ストレプトマイシン、0.5mmのL -グルタミン、および20μg/ mlのNGFとneurobasal媒体です。
- E - 15ラットの仔から収穫胚後根神経節(DRG)。 DRGは、挿入ごとに4つのと同じくらい多くのコラーゲンをコートした6ウェルインサート、上にプレーティングする必要があります。
- 膜への付着をDRGのを可能にするために2時間挿入をインキュベートする。
B.動的なマスクの光重合
デジタルマイクロミラーデバイス(DMD)は選択的にミラーの位置に基づいて光を反射するプロジェクションテレビと同様、個々の鏡、、1024 × 768の配列です。我々の目的のために、DMDは、シンプルかつ迅速な方法で指定可能なハイドロゲルの形状を作成し、光架橋ハイドロゲルの上にパターンの紫外線(UV)光に使用されます。図1は、DMDとUV光パスの設定を示しています。私たちのDMDは、スタンドアロンのユニットですが、デバイスはまた、多くの既存の顕微鏡で使用するために統合することができます。
- インサートからすべての余分な液体を取り外し、および挿入の内側重合媒体の500μLを加える。重合媒体は、10%のPEG(MW 1000)、20μg/ mLのNGFと1%のペン/連鎖球菌を添加したneurobasal培地に溶解した0.5%のイルガキュア2959が含まれています。
- レイン- X処理したガラススライド上のDMDデバイスの下に挿入して置きます。
- 付属のALP - 3基本的なGUIのプログラムを使用して、DMDの"フォトマスク"として使用される適切な白黒イメージをロードします。我々の目的のために、分岐の形状は、神経突起のガイダンスシステムの実装を可能にするために選ばれました。
- 可視化のための倒立顕微鏡を使用して、DMDに反射する可視光の光源を用いてフォトマスク上の適切な場所で組織外植片の位置を合わせます。
- UV光源のための可視光源を切り替えて、架橋が十分になるまで、PEG溶液を照らす。 (与えられた条件とDMDで5.0ワット/ cm 2で事件については、架橋が55秒程度で完了することができます。)挿入時の4つのすべてのDRGを繰り返します。
- 滅菌DPBSと1%のペン - 連鎖球菌で各インサートを3回洗浄する。
- 細胞培養用インサートの下に1.5mlの増殖培地を追加し、30分間インキュベーターで平衡化することができます。増殖培地は2%B - 27、1%のペン/連鎖球菌、0.5mmのL -グルタミン、および20μg/ mLのNGFを含むneurobasal媒体です。
C.セカンダリヒドロゲル
Puramatrix
- 神経のアプリケーションでは、1%のPuramatrixは滅菌H 2 Oで0.15%に製造元の指示に従って希釈し、1μg/ mlの可溶性ラミニンで補足。
- すべての余分なメディアは、滅菌綿棒のアプリケーター、キムワイプ、またはマイクロピペットを用いて、DRGの外植片を含むPEGのボイド、から削除する必要があります。
- Puramatrixは、オーバーフローすることなく、空きスペースを埋めるためにマイクロピペットでPEGのボイドに追加されます。ボイドボリュームに応じて、通常は〜1μLは、構造ごとに使用されます。
- Puramatrixは、腫れPEG、すなわち生理的塩溶液と接触するとすぐに自己組織化のプロセスを開始しますが、増殖培地の1.5mLを挿入下に追加し、合計ゲル化を確保するために一時間インキュベーター内に配置されます。
- 当初は、Puramatrixは弱酸性ですので、pHが平衡するために、1時間後にメディアを変更してください。
- メディアの変更は、約48時間ごとに必要とされています。すべてのメディアがあることに注意してください機械的に弱いPuramatrixの整合性を保護するために、インサートの下に追加しました。
アガロース
- アガロースが完全に(〜1時間)に溶解するまで神経のアプリケーションでは、アガロースは、増殖培地に1%溶液に希釈し、60℃の水浴に入れ。次いで、この溶液を1μg/ mlの可溶性ラミニンで補足される。
- すべての余分なメディアは、PEGのボイドから削除する必要があります。
- アガロースは、オーバーフローすることなく、空きスペースを埋めるためにPEGのボイドに追加されます。ボイドの体積に応じて、通常は1μLを構造ごとに使用される見る。
- 増殖培地1.5 mLを6ウェルプレートに(8℃)あらかじめ冷却であり、そしてアガロースを含むインサートは、アガロースを可能にするためにチルドメディアに転送し、少なくとも3分間8℃の冷蔵庫内に維持されていますゲル。
- 最後に、挿入は予め温めておいた増殖培地を1.5mL(37℃)に移し、37℃インキュベーターで維持され、48時間毎に必要なメディアの変化と° C、。
3。デュアルヒドロゲル3Dセルのカプセル化
あらゆる自己組織化ゲルを使用する場合はデュアルハイドロゲルカプセルは適切です。光架橋ゲルは、このケースのPEGには、例えばPuramatrixまたはアガロースのために、自己組織化ゲルの幾何学的なプレゼンテーションのための構造的なサポートとして機能します。方法のいくつかは、特にフォトマスクのゲルと選択の種類は、特定の目的のアプリケーションに依存します。
- DMD上で適切なマスクをロードします。私たちのアプリケーション、細胞の生存のために、我々は単に細胞のイメージングを助けるためにPuramatrixの円筒形のプレゼンテーションを選んだ。細胞シグナル伝達を研究する研究者は、走化性分子の拡散を可能にするためにコンパートメント幾何学に興味を持つかもしれません。また、動脈の大まかな近似は、血管の研究への適用可能性を表現することが示された。
- レイン- Xコートスライド上DMDの下にポリエステルの細胞培養の雨- Xと挿入、および場所の壁を扱います。
- インサートに重合媒体500μLを加える。 55秒のUV光への曝露によってPEGの架橋を誘導する。
- 滅菌DPBSと1%のペン - 連鎖球菌で3回洗浄。
- PEGのボイドからすべての余分なメディアを削除します。
- ペレットへの所望の密度で細胞をスピンダウン。 Puramatrixが塩溶液と接触するとすぐに自己組織化を開始するよう注意は、混合前の細胞ペレットからすべての培地を除去するために注意しなければなりません。 10%ショ糖を添加した滅菌H 2 Oで希釈した0.15%Puramatrix内のセルを一時停止します。
- PEGの空隙内部にPuramatrix /セル/ショ糖混合物を注入する。
- インサートの下に増殖培地1.5 mLを加え、1時間培養器内のゲルすることができます。
- 一時間後にメディアを変更し、その後48時間ごとに〜を。
4。シングルヒドロゲル3Dセルのカプセル化
単一のハイドロゲルカプセルは、細胞が光架橋ハイドロゲルの内部で検査することができるあらゆる状況に適しているでしょう。
- DMD上で適切なマスクをロードします。細胞の生存の研究のために、我々は再びシリンダーを表現するために基本的な円形のマスクを選んだ。方法4に示したものと同様のマスクは、再び適切な研究分野に適用することができる。
- レイン- Xコーティングしたスライド上にDMDの雨- X、および場所の下にあるポリエステルの細胞培養インサートを扱います。
- 任意の濃度で細胞が均一な分布を確保するためによく混合、10%PEG溶液に直接添加することができます。
- インサートに重合媒体500μLを加える。 55秒のUV光への曝露によってPEGの架橋を誘導する。
- 滅菌DPBSと1%のペン - 連鎖球菌で3回洗浄。
- 毎〜2日の変更、以下、インサートの上に両方の成長培地を詰めます。
5。薄膜ハイドロゲル重合
- DMD上で適切なマスクをロードします。
- コラーゲンコートレイン- X、および雨- Xコートスライド上の場所とポリエステルの細胞培養インサートを扱います。
- ちょうどインサート(6ウェルプレートの挿入のための〜250〜300μL)の底部をカバーするのに十分な重合媒体を追加。メディアは、室温で30〜45分の挿入膜を透過することができます。
- マイクロピペットまたはキムワイプで挿入から過剰な重合媒体を取り外します。完全にインサートの底をカバーする紫外線透過性油の十分な量を追加。インサートは、重合媒体の飽和インサートメンブレン上の異なる層を形成するために石油のために十分な時間、室温で15-30分放置することができます。
- DMDの下に挿入し、スライドを置きます。 UV光への曝露によってPEGの架橋を誘導する。のためPEG層の薄さから、架橋は、DMDで5.0ワット/ cm 2の事件で、わずか15秒で完了することができます。
- 滅菌DPBSと1%のペン - 連鎖球菌で挿入3回洗浄する。 (油性残留物の持続性が懸念される場合は、そのようなツイーン20(1%)などの中性洗剤は、洗浄バッファーに追加されることがあります。)
- 6ウェル組織培養プレートに挿入して保管してください。所望の濃度では、浮遊細胞への増殖培地を追加し、所望の細胞密度を得るために細胞培養インサート内部の細胞懸濁液の十分な量をピペットで。その後、完全に細胞の生存率(〜1.5 mL)を維持するために、インサートの下に十分な増殖培地を加える。
- 48時間が経過した後は、いかなるunadhered細胞を取り除くために、滅菌DPBSと1%のペン - 連鎖球菌で挿入3回洗浄する。約48時間ごとに一度メディアを変更します。
6。代表的な結果
デュアルハイドロゲルの例としては、含まれているDRGの外植片は、図2に示すように構成します。細胞移動と神経突起伸長がデュアルハイドロゲルの構造のセル許容領域に制限されていることに注意してください。図3は、デュアルハイドロゲルの構造の内部にも同様にカプセル化された解離細胞を示す。 DMDのフォトマスクの動的な性質のため、カプセル化で使用可能な形状は、光学系の大きさや解像度によって制限されます。細胞のカプセル化は、単一の光重合ヒドロゲル、PEG、内部にも可能であり、図4で明らかなように死んで/生きて生存率試験を行った。 PEGのカプセル化は、PEGは、神経細胞のための理想的な環境を表していないとして、唯一の例として意図しています。したがって、私たちのPEGの構造で実現細胞の生存率は当然低いです。最後に、細胞培養インサート上で細胞接着のためのパターン化された限定的な層として薄いPEG膜を利用しての例を図5に示されています。さらに、可能な限り"悪い"結果の例を図6に提供されています。
結果は私たちの研究室で開発された手法の可能な用途のごく一部を表しています。彼らは我々のアプローチの容易さ、汎用性と実行可能性を実証することを目的としています、そして、自分の可能な適応を開発する研究者のための"原理の証明"として扱うことができる。
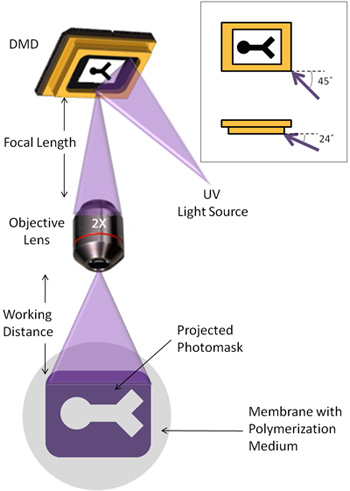
図1フォトリソグラフィーに使用される光路の模式図。挿入図:UV光は45 °、およびミラーアレイの面の下24 °の角度でDMDを照らす。

図2。デュアルハイドロゲルの構築物を含むDRG内のラベルの成長と増殖。ベータIIIチューブリン(緑)、DAPI染色された細胞核(青)でラベルした神経突起との重合PEGの構造(灰色)を描いたAD)画像。 DRGの外植片は、分岐(複数可)に向かって成長して神経突起と、Puramatrixに含まれ、パターンの円形領域に配置されています。
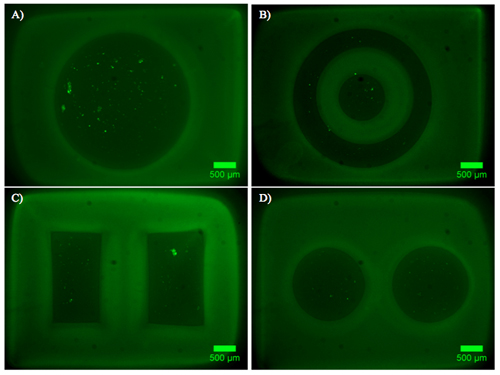
図3。増殖培地で48時間後にカルセインAM、生細胞のマーカーで標識細胞を含むデュアルヒドロゲルの構造。 AD)解離DRGニューロンを(〜5 × 10 3細胞/ mL)を含むPuramatrixで満たされた様々なPEGの形、。
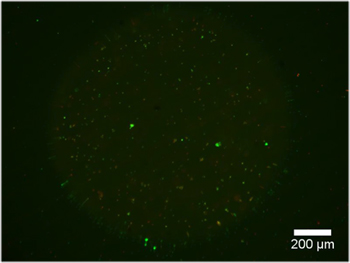
図4シングルハイドロゲルは、(5 × 10 3細胞/ mL)を増殖培地で24時間後にエチジウムホモダイマー-1(赤)で標識されたカルセインAM(緑)と死細胞で標識された生細胞を含む構築。
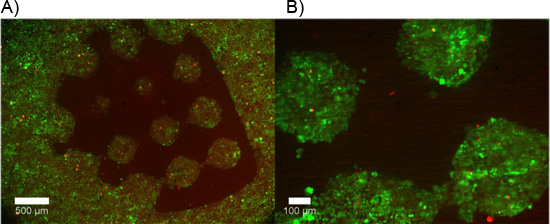
図5。セル制限PEGが選択的に透過性の支持体のコラーゲン被覆膜に解離細胞を接着するために"テストパターン"を使用して薄膜として重合。死んだ細胞は、エチジウムホモダイマー-1(赤)で標識している間、B)生細胞は、カルセインAM(緑)と48時間後にラベルが付いています。最小限の細胞接着は薄いPEG膜を含む領域で発生します。

図6。望ましくない結果の代表画像。 A)使用不能PEGにつながるPEGの部分重合は、構築する。不適切な重合は、重合媒体、不十分なUVの暴露または光学系の不適切な焦点の不十分な量のプレポリマー媒体中のメニスカスの存在により発生することができます。 B)ベータIIIチューブリン(緑)、DAPI染色された細胞核(青)で標識された神経突起との重合PEGの構造(灰色)を描いた画像。神経突起は、パターニングされたPEGチャンネルの外側に成長することができた。これは多くの場合、注入時のPEG部分の上にPuramatrixオーバーフローその状態で発生します。
ディスカッション
本明細書に記載される方法はシンプルで再現性の細胞培養システムを求めてあらゆる研究者によって使用される場合があります。理論的には、利用可能な光重合ヒドロゲルの多種多様のために、環境は、全体の組織外植片を含む任意のセルのタイプ、での使用を可能にするために調整することができます。さらに、デュアルハイドロゲルシステムは自分自身で非晶質の形状を形成する傾向が自己重合ヒドロゲルのプレゼンテーションにおける改善された空間的な制御が可能になります。結果として得られる"2.5D"マイクロパターンのハイドロゲルの構造は、便利な顕微鏡検査を可能にする2Dコンフィギュレーションに表示される神経成長のための3Dマトリックスを提供しています。ゲルが重合されている基板は、実験的なデザインでより細かく制御できるように、変化させることができる。我々の方法が細胞培養での使用に最適化された透過性は、我々は改善された生存率(図4)のようなスライドガラス上に重合(データは示していない)と比較して見てきたように、サポートしています。しかし、他の重合面には、異なるアプリケーションのためのより多くの適用可能性があります:ガラス基板上に作製は、例えば、マイクロ流体実験や細胞集合体形成で使用されているスライド。
これらの培養系での経験は、難易度の潜在的な領域の同定につながっている。最初に、慎重な技法は構造の無菌性を維持することが義務付けられています。 DMDセットアップの巨大な性質のため、それは、無菌条件下で重合工程を動作させることは困難である。この問題に対抗するために、方法に記載リンス工程が有用であり、抗生物質は、すべてのメディアで使用する必要があります。さらに、重合の構造の最終的な厚さと形状は、プレポリマー混合物の流体挙動に大きく依存し、メニスカスの存在が薄すぎたり、不完全(図6)重合してゲルの構造になることがあります。 2つのステップは、細胞培養用インサート内部のメニスカスの形成を最小限に抑えることができます。厚いヒドロゲル(> 200μm)のために、インサートの内側の壁の周り雨- Xの簡単な塗装で十分です。しかし、一時的に薄い構造(<200μm)のため、上記の、油の層が両方メニスカスを最小限に抑え、フリーラジカル重合の酸素消光を否定するために必要です。解像度は、ますます厚いゲルを実現した機能のサイズの減少とともに、厚さに依存していた。決議はまた、機能はハイドロゲルの正または負の救済を表すかどうかに応じて変化する。しかし、我々は焦点光学系として唯一の顕微鏡対物レンズを使用して〜100μm程度の規模の最小機能サイズを持つ構造のための十分な分解能を達成しました。
我々の実験はここで説明するデュアルヒドロゲルの構造が神経突起の成長と指導の基本的なのin vitroモデルの形成のための優れた基盤を表すことが示されている。採用微細技術は、既存の方法18,19の適応ですが、我々のセットアップはデザインを実装するために、単純なことを強調し、細胞培養インサート上でデュアルハイドロゲルの構造の生 産のために最適化され、細胞培養インサートも細胞の生存を改善するために不可欠だった以前に付着した組織外植片の周り架橋として。表示する検索結果の範囲は、私たちの研究室の利益によって制限されますが、我々は、この文書に記載されている方法は、3D細胞培養の製造のための比較的安価、迅速かつ使いやすい方法を探して研究者にも有用証明すると信じていますモデル。
開示事項
謝辞
著者らは、DMDのセットアップに関する有用な議論を解剖し、文化をDRGの上の専門知識を共有するための教授アンソニーWindebankだけでなく、教授Shaochen陳の研究室に感謝します。この研究は、Tulane大学とリージェンツのルイジアナ州会(LEQSF [2009〜10] - RD - 18)とNIH(NS065374)からの補助金によって一部で賄われていた。
資料
| Name | Company | Catalog Number | Comments |
| Digital Micromirror Device | Texas Instruments | DLPD4X00KIT | |
| Collagen Coated Transwell Permeable Support | Corning | 3491 | Also referred to as Cell Culture Insert in manuscript |
| Polyester Transwell Permable Support | Corning | 3412 | Also referred to as Cell Culture Insert in manuscript |
| Neurobasal Medium | Invitrogen | 21103-049 | |
| Fetal Bovine Serum | Invitrogen | 16000-036 | |
| L-glutamine | Invitrogen | 25030-164 | |
| Nerve Growth Factor | Invitrogen | 13257-019 | |
| Pen/Strep | Invitrogen | 15140-122 | |
| B-27 Supplement | Invitrogen | 17504-044 | |
| DPBS | Invitrogen | 14190-250 | |
| Puramatrix | BD Biosciences | 354250 | |
| PEG 1000 | Polysciences, Inc. | 15178 | |
| Irgacure 2959 | Ciba Specialty Chemicals | 0298913AB | |
| Oil | Have used both canola oil and silicon oil | Needs to be UV transparent, and minimize +/- meniscus formation | |
| OmniCure Series 1000 | EXFO | ||
| Rain-X |
参考文献
- Abbott, A. Cell culture: biology's new dimension. Nature. 424, 870-872 (2003).
- Schindler, M. Living in three dimensions: 3D nanostructured environments for cell culture and regenerative medicine. Cell Biochem Biophys. 45, 215-227 (2006).
- Maltman, D. J., Przyborski, S. A. Developments in three-dimensional cell culture technology aimed at improving the accuracy of in vitro analyses. Biochemical Society Transactions. 38, 1072-1075 (2010).
- Smalley, K. S., Lioni, M., Herlyn, M. Life isn't flat: taking cancer biology to the next dimension. In Vitro Cell Dev Biol Anim. 42, 8-9 (2006).
- Irons, H. R. Three-dimensional neural constructs: a novel platform for neurophysiological investigation. Journal of Neural Engineering. 5, 333-341 (2008).
- Bursac, N. Cultivation in rotating bioreactors promotes maintenance of cardiac myocyte electrophysiology and molecular properties. Tissue Eng. 9, 1243-1253 (2003).
- Cukierman, E., Pankov, R., Stevens, D. R., Yamada, K. M. Taking cell-matrix adhesions to the third dimension. Science. 294, 1708-1712 (2001).
- Cushing, M. C., Anseth, K. S. Materials science. Hydrogel cell cultures. Science. 316, 1133-1134 (2007).
- Kloxin, A. M., Kasko, A. M., Salinas, C. N., Anseth, K. S. Photodegradable hydrogels for dynamic tuning of physical and chemical properties. Science. 324, 59-63 (2009).
- Geckil, H., Xu, F., Zhang, X., Moon, S., Demirci, U. Engineering hydrogels as extracellular matrix mimics. Nanomedicine (Lond). 5, 469-484 (2010).
- Luo, Y., Shoichet, M. S. A photolabile hydrogel for guided three-dimensional cell growth and migration. Nature Materials. 3, 249-253 (2004).
- Wylie, R. G., Shoichet, M. S. Two-photon micropatterning of amines within an agarose hydrogel. Journal of Materials Chemistry. 18, 2716-2721 (2008).
- Ji, Y. Electrospun three-dimensional hyaluronic acid nanofibrous scaffolds. Biomaterials. 27, 3782-3792 (2006).
- Moeller, H. C., Mian, M. K., Shrivastava, S., Chung, B. G., Khademhosseini, A. A microwell array system for stem cell culture. Biomaterials. 29, 752-763 (2008).
- Xu, T. Viability and electrophysiology of neural cell structures generated by the inkjet printing method. Biomaterials. 27, 3580-3588 (2006).
- Liu Tsang, V. Fabrication of 3D hepatic tissues by additive photopatterning of cellular hydrogels. FASEB J. 21, 790-801 (2007).
- Beebe, D. J. Microfluidic tectonics: A comprehensive construction platform for microfluidic systems. Proceedings of the National Academy of Sciences of the United States of America. 97, 13488-13493 (2000).
- Lu, Y., Mapili, G., Suhali, G., Chen, S. C., Roy, K. A digital micro-mirror device-based system for the microfabrication of complex, spatially patterned tissue engineering scaffolds. Journal of Biomedical Materials Research Part A. 77, 396-405 (2006).
- Naiser, T., Mai, T., Michel, W., Ott, A. Versatile maskless microscope projection photolithography system and its application in light-directed fabrication of DNA microarrays. Review of Scientific Instruments. 77, 063711-063711 (2006).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved