このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
偏上皮細胞へのプラスミドのマイクロインジェクションによる低分子量GTPaseの機能を解析する
要約
この記事では詳細はマイクロインジェクション法を用いて偏光上皮細胞における低分子量GTPaseの過剰発現と解析に関わる手順を。
要約
頂端部が"無料"の表面と側底膜に直面している生化学的及び機能的に異なる心尖部と側底部領域にそれらの形質膜分極上皮細胞は、基板と隣接セルに接触している。両方の膜ドメインは、拡散障壁を形成するタイトジャンクション、で区切られています。このようなマディン-ダービーのような上皮細胞イヌ腎臓(MDCK)細胞はポリカーボネートフィルターに高密度で播種し、1 2、数日間培養する。アピカル-基底外側偏光は、培養に成功しrecapitulatedすることができます細胞極性の確立と維持は、RalA、Cdc42と、Rab8、Rab10とRab13 3 4 5 6 7などのRasスーパーファミリーの低分子量GTPaseの配列によって調節されている。不活性なGDP結合状態とアクティブなGTP結合状態の間にあるすべてのGTPアーゼのようなこれらのタンパク質は、サイクル。ヌクレオチド結合領域に特異的な変異は、このサイクル8で干渉する。例えば、Rab13T22Nは恒久的に、GDP -フォームとこのように呼ばれる"ドミナントネガティブ"にロックされてRab13Q67LはもはやGTPを加水分解しないことができる一方、その結果、'支配的なアクティブな"状態7にロックされます。その機能を解析するために細胞内でGTPアーゼの両方ドミナントネガティブと支配的なアクティブな対立遺伝子は、通常は内因性タンパク質9の機能を妨害するために高レベルで発現されています。短時間で過剰発現の高いレベルを達成するためにエレガントな方法は、フィルタはマイクロインジェクション法を用いてサポートしている上に成長させた偏細胞の核に直接関連するタンパク質をコードするプラスミドを導入することである。これはしばしば、特に心尖部または側底部にソートされている細胞膜受容体をコードするレポータープラスミドの同時注入と組み合わされます。頻繁に側底部にソート貨物を分析するために使用される貨物は、水疱性口内炎ウイルス糖タンパク質(VSVGts045)10の温度に敏感な対立遺伝子である。このタンパク質は39℃で正しく折り畳まれないことができると関心の調節タンパク質が細胞質ゾルで組み立てている間にこのように小胞体(ER)に保持されます。 31日までのシフト° Cその後VSVGts045は形質膜11にERや旅行を、適 切に折り畳むままにすることができます。このチェイスは、一般的にクリーンな結果につながる、さらにタンパク質の合成を防ぐために、シクロヘキシミドの存在下で行われる。ここでは詳細に側底選別に関与する調節タンパク質の包括的な分析を可能にする温度変化を含む偏光セルとその後のインキュベーションにプラスミドをマイクロインジェクションの手順を説明します。
プロトコル
1。プラスミドDNAの単離
- 製造業者のプロトコルに従ってエンドトキシンフリーDNAを調製するためにシグマアルドリッチのエンドトキシンフリーmaxiprepキットを使用してください。それは確実にDNA調製物からのエンドトキシンを除去するので、このキットは、私たちのために動作します。細胞核にDNAを注入されているエンドトキシンは、細胞死につながる。
- 単離されたDNA、渦とエッペンドルフ微量遠心機で13,000 rpmで1分間スピンして100μlのフェノール/ chlorofom /イソアミルアルコール(25:24:1)を追加します。新しいチューブに、上部の水相を移し、100μlのクロロホルム/イソアミルアルコール(24:1)、上記のような渦とスピンを追加します。新しいチューブにDNAを含む上層の水相を転送します。このステップは、マイクロインジェクションの針の目詰まりを防止するDNA、から任意のタンパク質を除去するために必要です。
- 300mMの2 X体積の100%エタノールの最終濃度に酢酸ナトリウム(pH6.0)を添加することによりDNAを沈殿させる。一晩-20℃でインキュベートする。エッペンドルフ微量遠心機で13,000 rpmで20分間DNAをスピン、70%エタノールで1回洗浄し、300μlのエンドトキシンフリー水(Sigma - Aldrich社)で再懸濁します。
- DNA濃度を決定する。典型的なDNA濃度は1〜5μg/μLの範囲である。
2。 MDCK細胞の培養
- MDCK細胞を分割する。細胞とシード4 × 10 5細胞明確な12 mmのトランスウェルフィルター(0.4μmの孔径、コーニングコスター、3460)上を数える。モック噴射制御して、シード3つのフィルタをする必要がある2つの異なった変異Rabタンパク質が含まれている実験用。
- 2mMのL -グルタミン、0.1 37 mg / mlのペニシリン/ストレプトマイシン、7%(vol / vol)のウシ胎児血清(= MEMの増殖培地)℃、5%CO 2のMEM培地で培養したMDCK細胞。
- 毎日基底外側チャンバー内のメディアを変更してください。それは動物の上皮細胞の状況を模倣するため、これは、分極処理を支援します。
- 細胞が閉じた単層に成長しているかどうかを顕微鏡で2日後の播種チェック。あなたが単層内の任意の穴を検出できない場合、3日目にして実験を行う。穴が残っている場合、4日目にして実験を行う。
3。マイクロインジェクションの手順と注入後のインキュベーション
- 実験当日に39℃インキュベーターに5 mlのMEMの増殖培地に加えて、各フィルタと場所用の60 × 15mmの板で50mMのHEPESを準備。さらに、12ウェル1mlのMEMの増殖培地に加え、フィルタごとの50 mM HEPES、0.1 mg / mlのシクロヘキシミドとプレート、および31 ° Cのインキュベーターに場所の1つのウェルを設定します。
- あなたのマイクロインジェクション顕微鏡をオンにして、39にその加熱段階を設定して℃に我々は、加熱された段階で倒立顕微鏡(Axiovert 200、カールツァイスマイクロイメージング社)、10Xと32Xの目標、およびエッペンドルフFemtojet(Injectman NI2)を使用してください。最後に、窒素と空気のテーブルを供給する窒素ガスのタンクを開きます。
- 100μlの - 10の合計体積では0.2 mg / mlの最終濃度までろ過された水(0.2μmのフィルターを使用)でDNAを希釈する。その後、30分間13,000 rpmでエッペンドルフの遠心でDNAをスピン。新しいチューブの上部と場所を削除します。このステップでは、希釈したDNAをマイクロインジェクションの針への読み込み時に正確に"クリーン"DNAをロードできることを保証します。あなたのDNAは、現在マイクロインジェクションのための準備ができています。
- その培養皿の最初のフィルタアウトを取ることによってあなたの細胞を準備します。 5mlにフィルターホルダーや場所からフィルタアウトカット外科ブレード(羽根外科ブレード、ステンレス鋼、番号11)、、39℃の温かいMEMの増殖培地に加え、50mMのHEPES(60 × 15 mmのプレート)。あなたがそれを切り出すために使用される外科用ブレードで培養プレートにフィルターを圧迫。外科ブレードの穴は、フィルタの中央を囲むようにフィルターの上に置きます。顕微鏡の加熱ステージ上にして培養プレートを置きます。
- マイクロインジェクションの針(Femtotip II、エッペンドルフ、930000043)にあなたの希釈したDNA(この場合、プラスミドのエンコーディングVSVGts045 - GFPで=モック噴射制御)の2-3μlをロードし、針の保護カバーをねじり、それを床に落としてください。今針はその所有者にねじ込まれる準備ができています。そのためには、あなたのinjectmanのメニューキーを押すと、バルブがシャットダウンされていることを確認します。そのホルダーに針をネジ、それが破損につながる可能性があるのできつく針で台無しにしない注意してください。今、もう一度、メニューキーを押すと、応用P cは microinjeciton手順中に針に吸い込まれてからメディアを防ぐことができます。最後に、保存されてホーミングを消去するには、ジョイスティックをタップします。
- 細胞に針を下げるには、10倍の目標を使用して液体上記光ビームに針をもたらす。今、細胞に焦点を当ててフォーカスホイール180を回して再びフォーカスを持ち出す°〜、と針を見つける。その後、徐々に(再び焦点に細胞をもたらすに向けた作業)再び焦点が合って持参し、焦点に針を移動させる、ために針をダウンさせる再びお客さま。針は、メディアの表面に接触するまで繰り返す、その時点であなたが表示されますすべてはハロである。あなたが32Xの客観的かつ細かい粗い設定に(焦点面からIE)の変化、細胞がフォーカスされている、しかし針はまだあいまいである点に到達したとき。
- 針の先端と頂端膜に触れると核として約10μmを差し引くことにより、Z -制限を設定すると、頂端側細胞膜の下に約10μmを敷設している。
- は、z -制限を設定した後、右の射出圧力を見つける。 95 PSIで起動します。圧力が高すぎる場合、あなたの細胞が爆破される。あなたの圧力が低すぎる場合には、ままの白いドットが表示されますが、他に何も起こりません。成功注入を使用すると、セルサイズの変化を伴わない位相変化が表示されます。注射の場合は、可能な限り高速に焦点面から針のミクロンのカップルを引き出す。核上の針(すなわち、個々のセルの中央)とジョイスティックの注入ボタンを押すと目的が、ボタンを押したままにしないでください。
- あなたの細胞上にあるあなたの外科ブレードの穴の中で100〜500細胞を注入する。作業が終了したら、2時間培養皿および外科ブレード39℃インキュベーターに、インキュベートを使用してセルを配置この時間の間に、VSVGts045 - GFPは小胞体に発現し、分泌される。しかし、39℃で、VSVGts045 - GFPは、正しく折り畳まれないことができるため、ERを残すことはできません。一方、関心の低分子GTPアーゼは、共射出実験で細胞質に蓄積されることになります。
- 2時間後、31℃で2時間12ウェルプレートとインキュベートで1ミリリットルのMEM増殖培地に加え、50mMのHEPES、0.1 mg / mlのシクロヘキシミドにあなたの細胞を配置このチェイス期間中、VSVGts045 - GFPは、正しく折り畳まERのままにして細胞表面に配信される。
- (プラスミドエンコーディングVSVGts045 - GFPを注入し、例えばRab13Q67LをV5タグ付き)フィルタつ(プラスミドエンコーディングVSVGts045 - GFPを注入し、例えばRab13T22NをV5タグ付き)と3 3.10 - 手順3.1を繰り返します。それぞれの注入は、20程度かかります - 60分。セルを修正するまでしかし、それは温度シフトのインキュベーションと表面染色を通じて、すべてのフィルタと同じように扱って絶対に不可欠です。固定後は、同時にすべてのフィルタについては、染色プロトコールの残りを実行することができる。
4。免疫蛍光分析のための表面染色
(注)は、VSVGts045 - GFPのGFPシグナルの漂白を避けるために、後続のすべての手順の間にアルミホイルで覆うことにより光から試料を保護する。
- あなたが表面染色を実行したい場合は、、氷の上に金属板の上に培養皿で細胞を配置し、氷冷PBS 2 +(PBS [0.2 g /リットルのKCl、0.2 g / LのKH 2 PO 4と1Xあなたの細胞を洗う8グラム/リットルのNaCl、および2.17グラム/リットルのNa 2 HPO 4 × 7 H 2 O] +0.1 g / LのCaCl 2及び0.1グラム/リットルのMgCl 2 × 6 H 2 O)。その後、場所、この場合には、目的タンパク質の細胞外ドメインを認識する抗体30μlのマウスモノクローナル抗体TK1(IgG 1の 、故トーマスクライスから得られる)、氷の上に金属板上に置かクリーンパラフィルム上に。ドロップの上に逆さまにあなたの細胞を使用してフィルタを配置し、フィルタの裏側に抗体の数滴を追加します。氷上で1時間インキュベートする。
- 12ウェルプレートに場所細胞は、氷冷PBS 2 3X洗浄+(またはRT暖かいPBS 2 +前の表面染色なし)、そして室温で15分間3%パラホルムアルデヒドで固定。
- PBS 2 +で細胞を1回洗浄し、+ 5分間PBS 2に残す。
- /透過化バッファ(BPB)(2%[重量/体積] BSA、0.4%[重量/体積] PBS 2のサポニン+)10%[体積/体積]ヤギ血清をブロッキングで細胞をインキュベートする。室温で1時間インキュベートする。
- この例では抗V5(マウスモノクローナル抗体IgG 2aは 、Invitrogen社)、BPBに1:200で、表現されるRabの低分子量GTPaseを検出する一次抗体を希釈する。 13,000 rpmで10分間エッペンドルフの遠心で希釈抗体をスピン。きれいなパラフィルム上に抗体溶液の代わりに30μlのはウェットチャンバー内に設置。逆さまに抗体のドロップ上にフィルタ上のセルを配置し、室温で1時間インキュベートする。
- 12ウェルプレートに戻って場所細胞(上右側)と室温でBPBを持つ30以上の分を5倍に洗う。
- このケースのヤギ抗マウスIgG 1アレクサ(表面に検出しVSVGため、Invitrogen社)594標識、およびCy5標識二次抗体は、この例のヤギでは、あなたのラブのGTPアーゼを認識する抗マウスIgG 2aに、適切な二次抗体を希釈するBPBに1:200、(ジャクソンのImmunoResearch)をCy5で標識し、上記のようにスピン。ダウン抗体のドロップダウンにフィルタ逆さでウェット室と場所細胞のクリーンパラフィルムの上に場所30μlの抗体溶液。室温で1時間インキュベートする。
- ステップ4.6を繰り返します。
- 脱イオン水と位置Rに3Xフィルター上にディップ細胞microslidesへIGHTサイドアップ。細胞の上に10〜15μlをマウントする(10%蒸留水で[重量/容量] DABCO、50%[重量/体積]グリセロール)を追加します。トップと顔の組織を使用しての上に置いて18 × 18ミリメートルマイクロカバーガラスは静かに細胞にマイクロカバーガラスを押してください。マニキュアで密封する。
- 共焦点顕微鏡で試料を分析する。我々は、63Xの水浸レンズを搭載したマイクロLSM 510、カールツァイスマイクロイメージング(株)を使用。
- 数字の調製のために、Adobe PhotoshopやAdobe Illustratorなどのプログラムを使用して画像を調整して組み合わせる。
5。代表的な結果
低分子量GTPaseの共発現は、ソートをVSVGを妨害する方法の例については親切に心尖missorting 3,4、または表面の配信7の阻害のいずれかの公開された記事を参照してください。
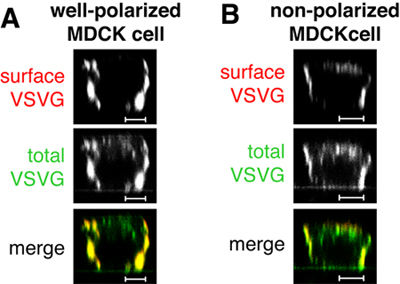
図1。表面染色(赤、図1の)で判断してモック注入では、のみをコードするプラスミドVSVGts045 - GFPの注入、すなわち、タンパク質は十分に偏MDCK細胞の基底外側表面に配信されます。そのすべてではないVSVGts045 - GFPは° Cとして総タンパク質(緑色で、図1と図B)のための広範な細胞内シグナルによって証明される31日現在で追いかける時の側底膜に配信されるのに注意。十分に分極されていない細胞でVSVGts045 - GFPは、頂端膜(図1 B)にも配信されます。コントロール標本は図1のBの細胞のように見える場合、あなたのデータを信頼し、より良い偏細胞を用いた実験を繰り返すことはできません。スケールバーは5μmである。
ディスカッション
成功するマイクロインジェクションの実験のための最も重要なステップは、DNAや細胞の極性の品質と純度です。極性細胞がなければ、あなたの噴射制御が既にVSVGをmistargetedことになり、実験は使用できません。 DNAは低品質のものである場合、DNAは、貧しい人々やすべてにおいて所望のタンパク質の無発現を導く注射針を詰まらせることができる。また、そのようなpRKVなどの高い発現レベル?...
開示事項
謝辞
この作品は、H. Fölschへの健康(GM070736)の国立研究所からの助成金によって賄われていた。 SFアンリーは、A * STAR大学院奨学金の受賞によってサポートされていました、そしてRS姜氏は病の研修プログラムの細胞と分子基盤(GM8061)によってサポートされていました
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | |
| 加熱された段階で200顕微鏡をAxiovert | カールツァイス株式会社 | カスタムオーダー | |
| Injectman NI2 Femtojetマイクロマニピュレーター | エッペンドルフ | カスタムオーダー | |
| Femtotips II(マイクロインジェクションの針) | エッペンドルフ | 930000043 | |
| Microloaderヒント | エッペンドルフ | 930001007 | |
| 明確な12 mmのトランスウェルフィルターサポート | コーニングコースター | 3460 | |
| エンドトキシンフリープラスミドmaxiprepキット | シグマアルドリッチ | NA0400 |
参考文献
- Mellman, I., Nelson, W. J. . Nature reviews. 9 (11), 833-833 (2008).
- Rodriguez-Boulan, E., Kreitzer, G., Musch, A. . Nature reviews. 6 (3), 233-233 (2005).
- Ang, A. L., Fölsch, H., Koivisto, U. M. . The Journal of cell biology. 163 (2), 339-339 (2003).
- Kroschewski, R., Hall, A., Mellman, I. . Nature cell biology. 1 (1), 8-8 (1999).
- Moskalenko, S., Henry, D. O., Rosse, C. . Nature cell biology. 4 (1), 66-66 (2002).
- Schuck, S., Gerl, M. J., Ang, A. . Traffic (Copenhagen, Denmark). 8 (1), 47-47 (2007).
- Nokes, R. L., Fields, I. C., Collins, R. N. . The Journal of cell biology. 182 (5), 845-845 (2008).
- Collins, R. N. Molecular cell. 12, 1064-1064 (2003).
- Hall, A. . Science (New York, N.Y. 279 (5350), 509-509 (1998).
- Scales, S. J., Pepperkok, R., Kreis, T. E. . Cell. 90 (6), 1137-1137 (1997).
- Keller, P., Toomre, D., Diaz, E. . Nature cell biology. 3 (2), 140-140 (2001).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved