Method Article
ナチュラルキラー細胞傷害性アッセイにおけるHIV - 1感染プライマリCD4 + T細胞を標的細胞としての準備と使用
要約
HIV感染細胞にナチュラルキラー細胞溶解反応を測定するために細胞毒性のアッセイは、標的細胞の純度によって制限されます。ここでは、CD4をダウンモジュレートするHIV - 1の能力を活用することにより、HIV - 1感染の主なT細胞芽球の高度に精製された人口の分離を示しています。
要約
ナチュラルキラー(NK)細胞はウイルス感染細胞に対する自然免疫応答の重要なコンポーネントです。 HIV感染細胞に対するNK細胞の機能で任意のaberrancyを識別することが潜在的にそれらの細胞溶解活性を増強する治療法につながる可能性があるため、HIV - 1感染細胞を認識し、溶解するNK細胞の能力を理解することが重要です。ではなく、標的細胞としてのHIV感染の主なT細胞の芽球細胞毒性アッセイで感染- T -細胞のラインを使用する必要があります。 T -細胞株は、さらに感染することなく、NK細胞溶解に非常に敏感です。さらに、溶解をもたらす標的とエフェクター細胞の間に主要組織適合遺伝子複合体クラスIのミスマッチを防ぐために、自家一次電池を使用する必要があります。主なHIV感染細胞に対するNK細胞の細胞溶解反応を評価した初期の研究では、感染細胞の1,2の重要な殺害を示すことはできなかった。しかし、NK細胞の機能的アッセイで標的細胞として、一次T細胞のHIV - 1感染を使用すると、非感染細胞3を汚染する原因が存在することは困難であった。非感染細胞の比率にこの矛盾した感染細胞は、ドナーNK細胞機能の変動が原因ではないかもしれないサンプル間のNK細胞死滅の変化になります。従って、それは実験3,4の間に細胞の比率を標的とするエフェクターを標準化するために精製された感染した細胞集団で作業することが有益であろう。ここでは、死んでいるまたは死にかけている細胞の3-6を削除するには、感染した細胞や市販キットの利用可能性にダウンモジュレートCD4するHIV - 1の能力を活用することによって、HIV - 1感染細胞の高度に精製された人口の分離を示しています。精製された感染した一次T細胞の芽球は、5月7日エフェクター人口としてNK細胞を精製した脱顆粒や細胞毒性アッセイのいずれかでターゲットとして使用できます。脱顆粒アッセイにおけるエフェクターとしてNK細胞の使用は、8は "細胞傷害性顆粒"と呼ばれる特殊なリソソームの溶菌内容を解放するNK細胞の能力を評価します。 CD107a、細胞溶解性顆粒が形質膜に融合するNK細胞表面に発現してなるリソソーム膜タンパク質に対する蛍光標識抗体で染色することによって、我々は、細胞認識をターゲットに反応して脱顆粒、NK細胞の何パーセントを決定することができます。また、NK細胞溶解活性は、NK細胞の存在下で標的細胞内からの51 Crの放出により溶解標的細胞の割合の決定を可能にする細胞傷害性アッセイで評価することができます。
プロトコル
1。ヒトCD4 +末梢血からT細胞(図1参照)の分離
- 末梢静脈血(40〜60 MLS)はバキュテイナに回収されるヘパリンナトリウム( ベクトンディッキンソン)を含むチューブ。
- 末梢血は、バキュテイナから転送されます 50 mLのポリスチレンコニカルチューブ(チューブ当たりの血液を20mL)にチューブ。
- RosetteSep CD4 + T細胞分離試薬(StemCell Technologies社は )よくない20以上の50 mlチューブに血液1mLと混合に1mLのボリュームに追加されます。
- 次いで混合物を20分間20〜25℃でインキュベートする。
- 20分後に、カルシウムとマグネシウムを含まない(CMF)はリン酸緩衝生理食塩水[PBSを(HyClone] W / 2%熱不活化(30分間56℃)ウシ胎児血清[FBS(HyClone)]混合物に追加されます。 40mlの最終容量を達成するために。
- 希釈混合物(30ml)をしてリンパ球分離培地15mlの上に[LSM(Cellgro)]新鮮な50 mLのポリスチレンコニカルチューブにして積層されている。
- 50 mLチューブは、その後ブレーキオフで20分間1200 × gで遠心分離されています。
- 50 mLチューブはLSMと媒質との間の界面が乱されないように、慎重に遠心分離機から削除されます。界面で細胞を10 mLのピペットで採取し、新鮮な50mLのポリスチレンコニカルチューブに入れられます。
- 収集されたインターフェースを50 mLの最終的な音量になるようにPBSのw / 2%FBSで希釈されています。
- 希薄化後のインターフェイスを含む50 mLの試験管は、上のブレーキと10分間1200 × gで遠心分離されています。
- 遠心分離後、上清を吸引し、ペレットは10 PBS wのMLS / 2%FBSに再懸濁する。
- 細胞懸濁液は、単一の50 mLコニカルチューブに結合され、PBSのw / 2%FBSで50 MLSに希釈されています。
- 複合細胞懸濁液を含むチューブは残りのすべてのLSMを削除するには、10分間300 × gで遠心分離される。
- 上清を吸引し、ペレットを10%FBS、ペニシリンの100 U / mlのストレプトマイシンの100 mcgか/ mlの(HyClone)と2mM L -グルタミン(CellGroを含むRPMI - 1640培地10 MLS(HyClone)に再懸濁している)(RPMI -完全)と血球計数器を使用してカウント。
- CD4 + T細胞を精製したの濃度は、RPMI -完全で3 × 10 6 / mLに調整されます。
- CD4は、+のは、その後、培養ビーズ[T -細胞増殖キット(Miltenyi Biotec社 )] 37℃72時間の細胞比ごとに3つのビーズ℃、5%C0 2の加湿の時に結合さanti-CD3/anti-CD28とそれらによって刺激されるインキュベーター。
2。 CD4 + HIV - 1とT -細胞(図1参照)の感染
- 刺激されたCD4 + T細胞を含む細胞懸濁液を培養プレートから除去し、血球計数器を使用してカウントされます。
- CD4 + T細胞(〜2 × 10 6)が感染していないコントロールとして使用するために15 mLコニカルチューブに添加されています。
- CD4の残りの部分は、+ T -細胞懸濁液は、感染の50 mLコニカルチューブに入れられます。
- CD4 + T細胞懸濁液を含むチューブを10分間300 × gで遠心分離し、培養上清を吸引する。
- 刺激されたCD4 + T細胞はウイルス粒子を含む培養液中に直接再懸濁させ、その後20〜25℃9時2時間1200 × gでスピン感染している。一般的に我々は、複製コンピテントウイルスの場合は0.01の複製欠損HIV株(例えば、DHIV - 3)またはMOIのために5の感染多重度(MOI)で、CD4 + T細胞を感染させる(例えば、HIV - 1 NL4 / 3) 。最終容量は重要ですが、チューブを遠心分離のためにバランスを取る必要があります。ポリブレン( サンタクルス ) は、10マイクログラム/ mlの最終濃度でspinfectionに前培養液中に追加されます。
- spinfectionが完了すると、上清を除去し、細胞を100 U / mLのIL - 2を補充したRPMI -完全で3 × 10 6 / mLの細胞密度で再懸濁する。複製能力のないウイルスが細胞または複製能を、ウイルスが細胞に感染するために使用された場合5〜7日間を感染させるために使用された場合、感染と非感染細胞は、72時間培養です。メディアは、培養中、48時間毎に変更する必要があります。
3。末梢血からヒトナチュラルキラー細胞の分離
- 末梢静脈血(〜100ml)をバキュテイナにCD4 + T細胞を分離するために使用される同一のドナーから採取されるヘパリンナトリウム( ベクトンディッキンソン ) を含むチューブ。
- 血液をバキュテイナから転送されます 20 mLのアリコートで50 mLコニカルチューブにチューブ。
- バキュテイナチューブは、その後CMFハンクス平衡塩類溶液[HBSS(Hyclone)] 8 mLで洗浄し、洗浄液を50mLのconicals containiに転送されます。ngの末梢血20mLの。各50 mLコニカルで作成されたボリュームは35 mLです。
- 希釈した血液は、新鮮な50 mLコニカルチューブとブレーキオフで30分間、400 × gで遠心分離チューブにLSMを15 mLの上に階層化されています。
- チューブを慎重に遠心分離機から削除され、LSMと媒体との間の結果のインタフェースは、10 mLのピペットを用いて各チューブから採取し、新鮮な50 mlコニカルチューブに入れられます。
- 細胞懸濁液は、CMF HBSS(上のブレーキで15分間400 × gで遠心分離)で1回洗浄する。
- 最初の洗浄後に上清を除去し、得られたペレットは、組み合わされている円錐形の単一の50mlにし、残りのすべてのLSMを削除するには、CMF HBSS(オンブレーキと10分間30 × gで遠心分離)で2回洗浄した。
- 最後の洗浄の後、ペレットは、ACK溶解緩衝液10ml(150mMのNH 4 Clを 、1.0mMのKHCO 3および0.1mM EDTA pH7.3)にでresupendedし、5分間室温(20〜25℃)でインキュベートする。このステップでは、末梢血単核細胞(PBMC)から混入赤血球を除去するために必要です。
- 10分後。 CMFのPBSを40mLの溶解反応を停止させるために、細胞懸濁液に添加される。
- PBMCと溶解した赤血球を含む細胞懸濁液とチューブは、その後のブレーキと10分間300 × gで遠心分離される。
- 上清を除去し、ペレットを2%FBS及び2mMのEDTAを含むPBS 5mLに再懸濁し、血球計算盤を用いてカウントされます。
- ナチュラルキラー(NK)細胞は、その後、[負の選択-人間(Miltenyi Biotec社 )]メーカーの指示に従ってNK Cellアイソレーションキットを使用してPBMCから分離されています。
- フロースルーの列からは、15ミリリットルチューブに回収され、チューブが上にブレーキと10分間300 × gで遠心分離されています。
- 上清を除去し、ペレットを再懸濁する。再懸 濁したペレットは、イスコフ改変ダルベッコ培地[IMDM( ギブコ )] 10%AB +熱不活性化(30分間56℃)のヒト血清(HS)を補充してカウントを1 mLの合計量で1本のチューブに結合されます血球計算盤。
- 細胞懸濁液の量は、NK細胞の最終濃度が3 × 10 6 / mLのなるようにIMDM W/10%HSで調整されます。細胞懸濁液を半分に分割されます。 NK細胞の一組は、組換えヒトインターロイキン2の200 U / mLを受け取ります。細胞の他のセットは、サイトカイン処理培地に残されます。
- NK細胞の培養物を37℃、5%CO 2で一晩インキュベートする
- 結果として得られるNK細胞は、その後、CD107aの脱顆粒アッセイまたは51 Cr放出アッセイのいずれかのエフェクター細胞として使用されています。
4。 HIV - 1感染細胞の精製(図1を参照)
- 感染細胞を含む培養液をプレートから除去し、上にブレーキと10分間300 × gで遠心分離されています。
- 上清を吸引し、ペレットを2%FBSを含むPBS 2mLに再懸濁し、2mMのEDTAと、細胞が血球計数器でカウントされます。
- HIV - 1が含まれていない感染細胞はHIV - 1がダウンCD4を調節するという事実を利用することによって、ウイルスが潜んでいるものから離れて隔離されています。この目的のためのCD4が陽性アイソレーションキット(Invitrogen)を一CD4細胞の比率あたりのビーズが使用されていることを除いてメーカーの指示に従って使用されます。
- CD4 + T細胞の除去時には、死んだ細胞は、メーカーの指示にしたがって死細胞除去キット(Miltenyi Biotec社)を使用してウイルスを保有して精製された細胞集団から削除されます。
- フロースルーの列に死細胞の除去の後は、上のブレーキと10分間300 × gで遠心分離される。上清を除去している、ペレットは1 mLのRPMI -完全に再懸濁し、細胞がカウントされます。
- 精製された感染細胞は、今CD107aの脱顆粒アッセイまたは51 Cr放出アッセイで標的として使用するための準備が整いました。
5。 CD107aの脱顆粒アッセイ(図2を参照)
- NK細胞の培養物は、プレートから除去され、細胞懸濁液がカウントされます。
- NK細胞懸濁液を上にブレーキと10分間300 × gで遠心分離されています。
- NK細胞は、RPMI -完全に再懸濁し、最終濃度は10 6細胞/ mLに調整されます。
- 上記の手順で生成された孤立感染および非感染T細胞からの細胞懸濁液は、上のブレーキと10分間300 × gで遠心分離されています。
- 上清は、削除され、ペレットは、2x10 6細胞/ mlでRPMI -完全に再懸濁した。
- K562細胞は、彼らがNK細胞溶解に非常に敏感であるため、陽性対照の標的細胞として使用されています。 T彼細胞は上にブレーキと10分間300 × gで遠心分離され、上清を2 × 10 6細胞/ mlでRPMI -完全に除去し、ペレットを再懸濁し、
- 目標の96 - V -底も板100 MCLおよび100 MCLエフェクタでウェルに添加されています。
- よく標的細胞に100 mcLofエフェクタと培地100 MCLを含む非特異的NK細胞の脱顆粒のために使用されます。
- 各ウェル10 mcLFITC結合抗CD107a(BDIS)に追加されます。
- 次いで、プレート上にブレーキで2分間20 × gで遠心分離される。
- 遠心プレートを37℃、5%CO 2で4時間インキュベートされる。
- インキュベーション後プレートは上にブレーキで5分間400 × gで遠心分離される。
- 上清をペレットから削除されます。
- 各ウェルを100 mcLofフローバッファ(PBSのw / 2%FBS、0.1%のNaN 3)の合計で20分間氷上での蛍光標識抗体の次のパネルで染色され
- anti-CD3/14/20 [パシフィックブルー標識(Biolegend)]
- 抗CD56 [APC(Biolegend)]
- 20分のインキュベーション後に、フローバッファ200 MCLは、各ウェルに添加し、プレートを上にブレーキで5分間400 × gで遠心分離される。
- フローバッファは、慎重にもペレットを妨害しないように注意しながら200 MCLのマイクロピペットチップを搭載した2 mLの吸引ピペットを用いて各から吸引される。
- ステップ15と16はもう一度繰り返されます。
- ペレットは、CMF PBSで1%パラホルムアルデヒド200 MCLに再懸濁する。細胞懸濁液は、フローチューブに転送されます。
- 全量を各チューブにCMF PBSで1%パラホルムアルデヒドで〜100 MCLを添加することにより300 MCLに起動されます。
- NK細胞に対応するイベントは、(2 × 4)FACS DIVA(BDIS)取得のためのソフトウェアおよびフロージョーソフトウェア(TreeStar)を用いて分析を用いてフローサイトメーターによって収集されます。
6。 CD107aゲーティング戦略(図3を参照)
- シングルセルのゲートは、前方散乱の高さ(FSC - H)VS前方散乱の幅(FSC - W)プロットを使用して作成されます。
- サイズと粒度プロットに対してFSC対側方散乱(SSC)のプロットは、単一セルのゲート上に作成されます。通常はリンパ球は、比較的低い粒度及び中程度のセルサイズを持っている。
- 単球(CD14)、T細胞(CD3)、B細胞を省略してリンパ球ゲート内の細胞は、NK細胞上のゲートにCD3/14/20染色した細胞を対CD56染色された細胞のドットプロットにプロットされます( CD20)。
- CD56 POSゲート人口は、CD107aのために評価されます。
- ターゲットグループなしでNK細胞は、CD107aがマイナスと考えられるもののためにゲートを設定するために使用されます。
7 の51 Crリリースアッセイ(図4を参照)
- 感染した標的細胞を℃、5%CO 2で37 500 MCLの合計で2時間saline/10 6個の細胞の125 MCCI社の51 Cr( パーキンエルマー社 )で標識されています。ポジティブコントロールとして10 6 K562細胞は℃、5%CO 2で37 500 MCLの合計で2時間に100 MCCI社の51 Crで標識されています。総体積は、RPMI -完全で500 MCLに起動されます。 51 Crの量は、ここで計算される標的細胞に添加:(http://las.perkinelmer.com/Catalog/RadCalculator.htm?Mode=RadioactivityCalculator)
- 標的細胞がラベルされていますが、以前に単離したNK細胞を培養物から削除され、カウントされます。 NK細胞を含む細胞培養物は、上のブレーキと10分間300 × gで遠心分離されています。
- NK細胞を含むペレットをRPMI -完全に再懸濁し、3管に分割されます。細胞密度は、1つのチューブ、第2のチューブに2.5x10 5 / mlの、サードチューブに5 × 10 5 / mLの10 5 / mLに調整されます。
- 標識した標的細胞をインキュベーターから取り出し、RPMI -完全の4.5mlを各試験管に追加されます。チューブは、300 × GFまたは10分で遠心分離されています。
- 上清は、放射性液体廃棄物の容器の中にペレットを妨害しないように慎重にオフ注がれています。
- ステップ4および5はすべて吸収されないの51 Crを除去するためにさらに2回繰り返されます。第三洗浄からの上清は、非放射性液体廃棄物用容器に処分することができる。
- 標識されたターゲットは、10 5 / mlの最終細胞密度にRPMI -完全に再懸濁する。
- 標識されたターゲット100 MCLは、/ 10 4標的細胞の最終細胞数の96 - V -底ウェルプレートのウェルに分注しています。
- 表1は、51 Cr放出アッセイのための典型的なセットアップの例です。各グループは三連で行われます。
1 2 3 4 5 6 7 8 9 A K562 E:T(1:1) K562 E:T(1:1) K562 E:T(1:1) K562 E:T(2.5:1) K562 E:T(2.5:1) K562 E:T(2.5:1) K562 E:T(5:1) K562 E:T(5:1) K562 E:T(5:1) B UI E:T(1:1) UI E:T(1:1) UI E:T(1:1) UI E:T(2.5:1) UI E:T(2.5:1) UI E:T(2.5:1) UI E:T(5:1) UI E:T(5:1) UI E:T(5:1) C HIV - 1感染E:T(1:1) HIV - 1感染E:T(1:1) HIV - 1感染E:T(1:1) HIV - 1感染E:T(2.5:1) HIV - 1感染E:T(2.5:1) HIV - 1感染E:T(2.5:1) HIV - 1感染E:T(1:1) HIV - 1感染E:T(1:1) HIV - 1感染E:T(1:1) D E F K562自発リリース K562自発リリース K562自発リリース UI自発リリース UI自発リリース UI自発リリース HIV - 1感染自発的な放出 HIV - 1感染自発的な放出 HIV - 1感染自発的な放出 G K562の最大のリリース K562の最大のリリース K562の最大のリリース UIの最大のリリース UIの最大のリリース UIの最大のリリース HIV - 1感染Maxmumリリース HIV - 1感染Maxmumリリース HIV - 1感染Maxmumリリース - 上記のNK細胞懸濁液の100 MCLは、各ウェルを含む標的細胞に添加されています。
- 目標の100 MCLは、エフェクター細胞が最大と自発的な放出のグループのため欠席されている対応するウェルに添加されています。自発的放出のグループは、RPMI -完全の追加の100 MCLとインキュベートされる。
- 96穴プレートを上にブレーキで2分間20 × gで遠心分離される。
- 遠心プレートを4時間37℃および5%CO 2をインキュベートする。
- RPMI -完全にヒト赤血球細胞の10倍希釈の4時間のインキュベーション5 MCL後最大のリリースの井戸を除き、各ウェルに添加する。
- 10%のドデシル硫酸ナトリウムの100 MCLは、最大のリリースのウェルに添加される。
- プレートは、細胞をペレットに5分間400 × gで遠心分離される。
- 無細胞上清100 MCLは、各ウェルから採取し、別々のガンマカウンターチューブ( パーキンエルマー社)に配置されます。チューブは、2470年自動ガンマカウンター( パーキンエルマー )に配置されます。培養液の51 Crの存在量は、2分の読書の平均から毎分のカウントとして測定されます。
- 分あたりのカウント数(CPM)検体およびコントロールの測定値は以下の式を使用して%特異的溶解を計算するために使用されています:
[(実験的なCPM - 自発的なCPMの平均値)/(上限インプレッション単価の平均値 - 自発的なCPMを意味する)] × 100
8。代表的な結果:
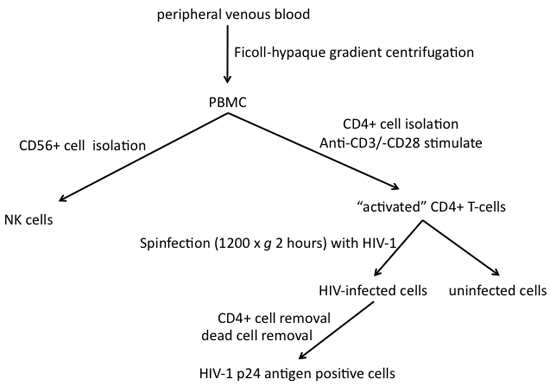
図1。ナチュラルキラー細胞との世代のHIV - 1末梢血から感染した標的細胞の分離に関連する手順。
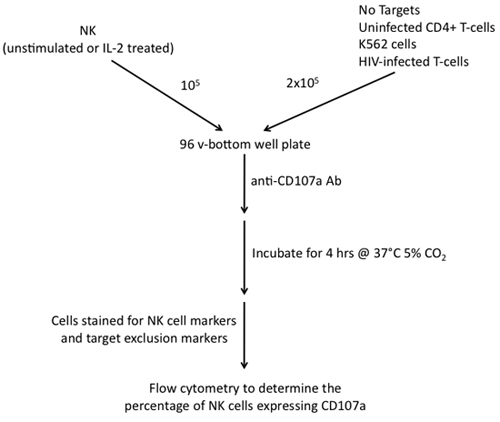
図2。エフェクターとK562細胞、NK細胞を利用したCD107aの脱顆粒アッセイの構築に関連する手順、感染していないCD4 + T細胞やターゲットなどのT細胞のHIV - 1感染。
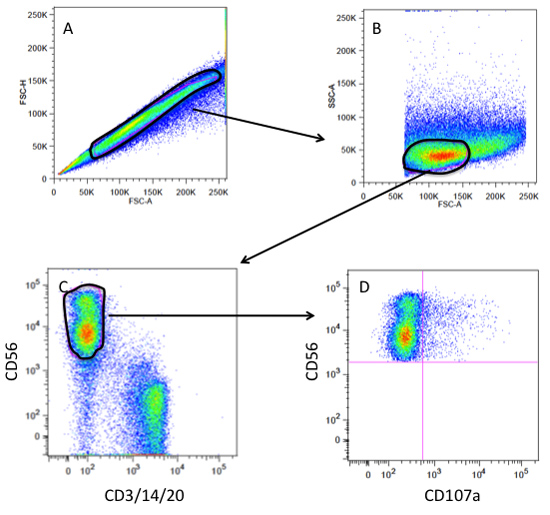
図3。 CD107aの脱顆粒アッセイのためのフローサイトメトリーゲーティング戦略。のプロット上の単一のセルとを除く塊または二重線で(A)ゲートFSC -(前方散乱の領域)VS FSC - H(前方散乱の高さ)。 (B)単一細胞のゲートは、リンパ球集団にFSC - VS SSC(側方散乱光)ゲーとしてプロット。 (C)リンパ球ゲートはCD3/14/20としてプロット(T細胞、単球、B細胞)対CD56(NK細胞)CD56 POS andCD3/14/20 NEGの人口(NKゲート)のゲーティング。 (D)NKゲートは(CD107a POS)脱顆粒したNK細胞を可視化するCD107a対CD56としてプロット。
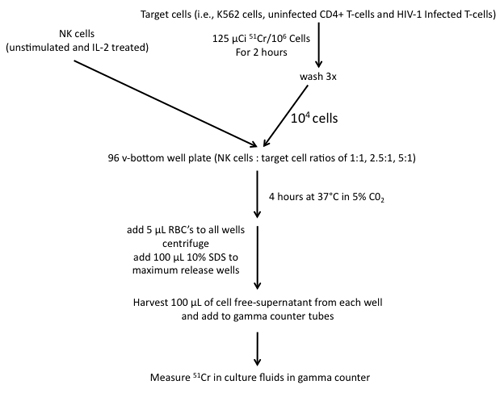
図4。エフェクターとK562細胞、NK細胞を利用した51 Cr放出アッセイの構築に関連する手順、感染していないCD4 + T細胞やターゲットなどのT細胞のHIV - 1感染。
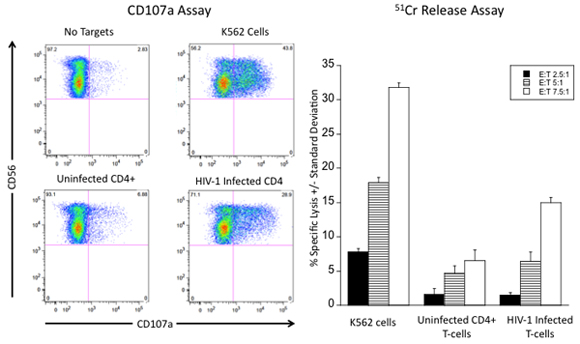
図5。に対してナチュラルキラー細胞傷害性応答を評価するための代表的な結果がHIV - 1感染細胞(A)のNK細胞は標的なしとK562細胞への応答の脱顆粒する能力について評価した、主要なCD4 + T細胞とHIV感染の主のT細胞として発現する表面CD107aそのNK細胞の割合によって評価。各象限内の数字は合計NK細胞の割合を表します。 T):B)NK細胞は細胞比(Eをターゲットにするさまざまなエフェクター細胞にK562細胞を、非感染CD4 + T細胞と51 Cr放出アッセイにおいてT細胞のHIV - 1感染を溶解する能力について評価されています。
ディスカッション
正しく完了したら、このプロトコルで説明されているアッセイは、反対脱顆粒およびHIV - 1感染細胞を(図5を参照)溶解するNK細胞の能力の代表的な画像を提供する必要があります。 HIV感染細胞とNK細胞の溶解、HIV感染細胞への応答におけるNK細胞の脱顆粒は10に直接比例しているべきです。 HIV感染細胞に細胞毒性応答を測定するには、2つのNK細胞の機能アッセイのための信頼性の高い結果が非常にNK細胞だけでなく、感染細胞の高度に精製された人口の精製分離に依存しています。 NK細胞とHIV - 1感染細胞を精製したことは、細胞率を目標とし、かなり正確なエフェクターを達成するための非常に重要です。同様に、標的細胞集団から死とアポトーシス細胞の除去は、エフェクター細胞との51 Cr標識またはインキュベーションの前に重要です。 の51 Crの同位体標識のステップ中に死亡またはアポトーシス細胞の存在とアポトーシスを起こした細胞によって内在化されることがあります高い自発リリースになりますし、計算された%特異的溶解が歪みます。また、死またはアポトーシス細胞の存在は、CD107aの発現の異常に高いレベルで、その結果、NK細胞の脱顆粒を引き起こすことがあります。各レプリケートから削除上清の量の違いがよく高い標準偏差につながるとして、51 Cr放出アッセイにおけるNK細胞と標的細胞のインキュベーション後の細胞フリー上清を除去する際に正確なピペッティングが必要です。変更は、特定の受容体またはリガンド6,11への敵対的抗体との共培養の前にエフェクターや目標をインキュベートすることにより、HIV感染細胞のNK細胞の溶解をトリガーに特定のNK受容体の役割を評価するために、これらのプロトコルに行うことができます。サイトカイン処理したNK細胞(例えば、IL - 2、IL - 15)刺激NK細胞が12の機能を評価するために使用することができます。同様に、抗体依存細胞毒性アッセイは、これらのプロトコルを用いて行うことができる。抗HIV抗体は(例えば、抗gp120の)NK細胞の低親和性のFc受容体CD16 13により認識のための標的細胞に添加することができます。これらのアッセイは、HIV感染細胞に対するNK細胞の細胞傷害性応答を測定するための設定が、また、HIV感染細胞の認識を以下のサイトカインを産生するNK細胞の能力を測定するように変更することができます。我々はこのプロトコルでは、標的細胞として、in vitroで感染した細胞の使用を説明したが、我々は最近、HIVに感染した患者から標的細胞の生成を説明してきました。これは、インターロイキン-2 11の存在下でマイトジェンで刺激後2週間にわたって細胞の拡大が続くCD4 + T細胞の分離を必要とします。拡張の2週間後、この資料に記載されているプロトコルは、標的細胞を単離するために使用されています。
開示事項
資料
| Name | Company | Catalog Number | Comments |
| Vaccutainer Tubes (Sodium Heparin) | BD Biosciences | 367874 | |
| RosetteSep CD4+ T-cell Isolation Kit | Stem Cell Technologies | 15062 | |
| CMF PBS | Hyclone | SH30256.01 | |
| FBS | Hyclone | 10437-028 | |
| Lymphocyte Separation Medium | Cellgro | 25-072-CV | |
| RPMI-1640 | Hyclone | SH30096.01 | |
| Penicillin / Streptomycin | Hyclone | SV30010 | |
| L-glutamine | Cellgro | 25-005-Cl | |
| T-cell Expansion Kit | Miltenyi Biotec | 130-091-441 | |
| CMF HBSS (1x) | Hyclone | SH30588.01 | |
| 0.5M EDTA | 46-034-Cl | ||
| NK Cell Negative Isolation Kit | Miltenyi Biotec | 130-092-657 | |
| IMDM | GIBCO, by Life Technologies | 12440-046 | |
| CD4+ Positive Isolation Kit | Invitrogen | 113.31D | |
| Dead Cell Removal Kit | Miltenyi Biotec | 130-090-101 | |
| Polybrene | Santa Cruz Biotechnology, Inc. | sc-134220 | |
| CD3 PacificBlue | BD Biosciences | 558117 | |
| CD14 PacificBlue | Biolegend | 325616 | |
| CD20 PacificBlue | Biolegend | 302328 | |
| CD56 APC | Biolegend | 318310 | |
| CD69 PE | BD Biosciences | 555531 | |
| CD107a FITC | BD Biosciences | 555800 | |
| 51Chromium | PerkinElmer, Inc. | NEZ030002MC | |
| Gamma Counter Tubes | PerkinElmer, Inc. | 1270-401 | |
| 2470 Automatic Gamma Counter | PerkinElmer, Inc. | 2470-0050 | |
| FACS Diva | BD Biosciences | 643629 | |
| FlowJo | Tree Star, Inc. | FJ-9-1YR |
参考文献
- Ruscetti, F. W. Analysis of effector mechanisms against HTLV-I- and HTLV-III/LAV-infected lymphoid cells. J Immunol. 136, 3619-3624 (1986).
- Zheng, Z. Y., Zucker-Franklin, D. Apparent ineffectiveness of natural killer cells vis-a-vis retrovirus-infected targets. J Immunol. 148, 3679-3685 (1992).
- Ferrari, G. Clade B-based HIV-1 vaccines elicit cross-clade cytotoxic T lymphocyte reactivities in uninfected volunteers. Proc Natl Acad Sci U S A. 94, 1396-1401 (1997).
- Shankar, P. Impaired function of circulating HIV-specific CD8(+) T cells in chronic human immunodeficiency virus infection. Blood. 96, 3094-3101 (2000).
- Ward, J. HIV-1 Vpr triggers natural killer cell-mediated lysis of infected cells through activation of the ATR-mediated DNA damage response. PLoS Pathog. 5, e1000613-e1000613 (2009).
- Ward, J. HIV modulates the expression of ligands important in triggering natural killer cell cytotoxic responses on infected primary T-cell blasts. Blood. 110, 1207-1214 (2007).
- Bonaparte, M. I., Barker, E. Killing of human immunodeficiency virus-infected primary T-cell blasts by autologous natural killer cells is dependent on the ability of the virus to alter the expression of major histocompatibility complex class I molecules. Blood. 104, 2087-2094 (2004).
- Stinchcombe, J. C., Griffiths, G. M. Secretory mechanisms in cell-mediated cytotoxicity. Annu Rev Cell Dev Biol. 23, 495-517 (2007).
- O'Doherty, U., Swiggard, W. J., Malim, M. H. Human immunodeficiency virus type 1 spinoculation enhances infection through virus binding. J Virol. 74, 10074-10080 (2000).
- Alter, G., Malenfant, J. M., Altfeld, M. CD107a as a functional marker for the identification of natural killer cell activity. J Immunol Methods. 294, 15-22 (2004).
- Fogli, M. Lysis of endogenously infected CD4+ T cell blasts by rIL-2 activated autologous natural killer cells from HIV-infected viremic individuals. PLoS Pathog. 4, e1000101-e1000101 (2008).
- Tomescu, C., Chehimi, J., Maino, V. C., Montaner, L. J. NK cell lysis of HIV-1-infected autologous CD4 primary T cells: requirement for IFN-mediated NK activation by plasmacytoid dendritic cells. J Immunol. 179, 2097-2104 (2007).
- Ward, J. P., Bonaparte, M. I., Barker, E. HLA-C and HLA-E reduce antibody-dependent natural killer cell-mediated cytotoxicity of HIV-infected primary T cell blasts. Aids. 18, 1769-1779 (2004).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved