このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
廃棄されたヒト胎児脳組織から神経幹細胞の生成
要約
捨てられた人間の胎児皮質組織から神経幹細胞の単離および培養上シンプルで信頼性の高い方法が記載されている。既知のヒト神経疾患から派生した培養物は、病理学、細胞及び分子過程の特性だけでなく、薬理学的有効性を評価するためのプラットフォームを提供するために使用することができます。
要約
神経幹細胞(NSC)は、皮質板の開発中に脳室帯の神経上皮に沿って存在する。これらの初期の前駆細胞は、最終的に、中間前駆細胞を生じさせると後で、大脳皮質を形成する様々な神経細胞およびグリア細胞のサブタイプ。廃棄された正常な胎児組織からヒトNSCを(そのニューロスフェアと呼ばれる)を生成し、拡大する能力は、直接ヒトの正常なNSC開発1-5の機能的側面 を研究するために使用する手段を提供します。このアプローチはまた、それによって前駆細胞増殖、遊走および分化6-9を変更する病気のプロセスを識別する機会を得た、既知の神経疾患からのNSCの世代に向けて送ることができます。我々は、高速化、アルツハイマー病の表現型10,11に貢献するかもしれない人間のダウン症候群のNSCでの病理学的メカニズムを識別するに焦点を当てている。 生体内でも、in vitroでのマウスモデルのどちらのヒト21番染色体上に位置する遺伝子の同一のレパートリーを複製することができます。
ここでは、中止された人間の胎児皮質から症候群のNSCをダウン分離し、文化の中で、それらを成長させる、シンプルで信頼性の高いメソッドを使用します。方法論は、ヒトNSCのめっき及び継代、限られた解剖学的ランドマーク、細胞ソーティングと解剖、組織の収穫の特定の側面を提供します。また、より選択的な細胞のサブタイプにヒトNSCの分化を誘導するためのいくつかの基本的なプロトコルを提供します。
プロトコル
1。解剖および神経幹細胞培養の維持のためのソリューションと材料の準備
- 事前に100mlの解剖媒体(KNOCKOUT DMEM/F12、Invitogen)を準備して冷蔵庫に。
- Prepare100 mlの培地(ステムプロNSC SFM、Invitrogen社)と37℃保管℃の水浴でC。
- 細胞の長期凍結保存のための細胞凍結培地を(KNOCKOUT DMEM/F12 +10%FBS + 5%DMSO)の準備。
- 必要に応じて、組織固定のために4%パラホルムアルデヒド(PFA)を準備する。
- ハンドル付き滅菌、高圧蒸気滅菌ピンセットとメスのブレードは、解剖のために使用されます。
- ピペットの銃を脇に置いて、10 mlの転送ピペット、および解離は40μMのセルストレーナー(BDファルコン352340)。
- 組織のストレージおよび凍結細胞のための凍結バイアル(BD)のために解剖のためのいくつかの10cmの培養皿(BD)、解離の50 ml遠心チューブ(BD)、1.5 mlの遠心チューブを脇に置きます。
2。人間の胎児の脳からヒト神経幹細胞を単離する
- すぐに胎児の終了後に実行可能な組織の収穫は、手続きの成功に不可欠です。選択科目の手順については、サンプルを取得するタイミングは、胎児の死亡の後の時間を最小化するように事前に配置することができます。受胎産物は、2時間後にプロシージャ内で収穫されますが、理想的には数分以内に選択科目の手続きに達成することができます。胎児組織は、しばしば断片化されています。しかし、一般的には脳のかなりの部分は、視覚的に識別するためそのまま残ります。在胎週数(GA)の制限事項が制定法によって決定されますが、18〜22週GAの間にこのプロトコルを使用して行われている。
- 胎児の脳を氷冷KNOCKOUT DMEM/F12ソリューションを含む10mlのペトリ皿に配置されます。解剖学的ランドマークが皮質の異なる部分を識別します。前頭葉と頭頂後頭野は中心溝とシルビウス裂の外挿した交点が配向している。ための境界心室はそのままと破損していないように注意しながら、中心溝の前部前頭葉皮質からと外科ブレードでシルビウス裂の境界に沿って組織を細かく分析。
- 前頭皮質の区切られたブロックからの残留血液および髄膜を取り外します。サンプルの品質が十分であれば、それは様々な目的のためにいくつかの小さなサンプルにブロックを分析するのに最適です。セクション(PFA、4%パラホルムアルデヒドで固定)とタンパク質/ mRNAのアッセイ(高速-80℃で凍結)。
- 50 ml遠心チューブに、選択された脳のブロックを転送し、組織の体積の約3倍で、氷冷KNOCKOUT DMEM/F12ソリューションを追加します。すべての組織が(一般的に20〜30倍)断片化し、単一または近くに、単一のセルを取得するために40μmのセルストレーナー(BDファルコン352340)を介して細胞をフィルタリングするようになるまでゆっくりと10 mlの転送ピペットで機械的なピペッティングにより組織を解離するサスペンション。
- 5分間2000rpmで細胞懸濁液と室温を遠心、10 mlの新鮮な暖かい培地(ステムプロNSC SFM)に細胞ペレットを再懸濁し、そして血球計算盤で細胞数を数える。
- それぞれ25cm 2の培養フラスコに5ミリリットル暖かい培地を追加し、各フラスコに2X10 6細胞を移す。培養物は、分析前に1週間、37℃/ 5%CO 2インキュベーター中で維持されます。さらに文化や実験のために週に一度half培養液を交換する。
3。さらなる特徴またはexperimentationsのための神経幹細胞のManipulaton
- ニューロスフェアは、通常200〜400μmの間の範囲のNSCの直径推奨培養条件下で1〜2週間で形成する。この段階でニューロスフェアは単一細胞を得るために15分間37℃で、カルシウムとマグネシウムを含まないハンクス培地(ハンクス)に0.2 g / LのEDTA ° Cで解離させることができる。細胞懸濁液を新鮮なハンクスにすすぎ、2000回転、で紡糸、とサブカルチャーのための暖かい培地中で白い色を保ちされています。
- 分化を開始するには、解離細胞はカバースリップ当たり1X10 5細胞(24mmX24mm)の密度でpoly-D-lysine/laminin 1コーティングカバーガラス上に播種されています。オリゴデンドロサイト分化がためにKNOCKOUT DMEM/F12(Invitrogen社、メイン、MD)2パーセントB27(50X、Invitrogen社、メイン、MD)+10 ng / mlのbFGFを100 ng / mlのSHH + 10ng/ml PDGF - AAで細胞を維持することによって達成され2日は、その後、別の5日間増殖因子なしで同じ培地に切り替え。神経分化は7日のノックアウトでDMEM/F12 2パーセントB27を(50X)細胞を維持することによって達成される。アストロサイト分化が週にKNOCKOUT DMEM/F12 1パーセントFBSで細胞を培養することによって行われます。
- 遺伝子による神経幹細胞のトランスフェクションは、予め形成されたニューロスフェアから解離細胞で行うことができます。ここで、我々は、電気穿孔法によりEGFP - C1をトランスフェクトした神経幹細胞を示した。 EGFP - C1構造のエレクトロポレーションは、マウス神経幹細胞(VPG -用AMAXA Nucleofectorキットを使用して行われました会社の命令に続くAMAXA Nucleofectorデバイス(ロンザAAD - 1001)と1004)、。一言で言えば、1 X 10 6細胞を5μgのDNAを100μlのトランスフェクション培地と混合し、パルスのエレクトロポレーション後、細胞はさらに培養用培地を維持する神経幹細胞に再懸濁した。トランスフェクションされた細胞の分化は、ステップ3.2で説明した同じ手順に従って、エレクトロポレーション後、ニューロスフェア3-4日の解離で処理した。
4。凍結神経幹細胞とサブカルチャー
- 解離細胞懸濁液は1X10 7細胞/バイアル/ mlの濃度で遠心分離し、凍結培地に再懸濁する。徐々に-20℃、-80で細胞を凍結° C、長い時間の貯蔵のために液体窒素に移す。
- 細胞は、高速37℃の水浴で解凍し、中に再懸濁した凍結培地を除去するため遠心分離洗浄のための血清DMEM/F12 +10%を、加温し、温めておいた培地に再懸濁する。
5。代表的な結果:
18週で正常胎児から神経幹細胞は在胎週数が記載される方法およびニューロスフェアが丸い、滑らかな境界線とはかなり均一なサイズ(Fig.2A)と一週間後に見られる以下の培養した。これらのニューロスフェアは、EGFP - C1または他の構築物でトランスフェクトし、蛍光顕微鏡(図2b、)で追跡することができる。確立されたニューロスフェアは、EDTAとの解離とコーティングされたカバースリップ上に分散した細胞として播種した。それぞれのプロトコルの下で分化した細胞を4%parafamaldehydeで固定し、異なる細胞タイプ特異的なマーカーで染色した。多能は、ニューロン(Fig2C、D、ローダミン)アストロサイトを示すマーカーの発現(Fig2E、F、ローダミン)、オリゴデンドロサイト(Fig2G、H、ローダミン)で観察される。 EGFPのエレクトロポレーションを受けていない細胞はまた、異なる細胞型に分化して異なる細胞特異的なマーカーで染色した。多能は(Fig3C、ローダミン及びFig3D、フルオレセイン)アストロサイト(Fig3A、B、フルオレセイン)ニューロンを示すマーカーとオリゴデンドロサイト(Fig3E、F、ローダミン)の発現が観察される。
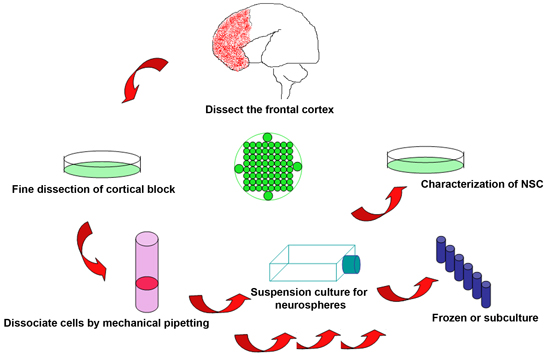
図1。破棄されたヒト胎児脳から神経幹細胞を分離する実験手順の概略図

図2。 試験管内で propogated未分化および分化したヒト神経細胞。 (A)ニューロスフェアは、滑らかな、円形の境界線を示し、1週間以上の培養後の急速な成長を位相差顕微鏡の下に表示されます。 (B)、様々なプラスミド及び構造の導入はトランスフェクションによって達成することができます。 EGFP - C1トランスフェクション後3日には、複数のセルはフルオレセインの免疫染色と蛍光顕微鏡下で見られるように緑色蛍光タンパク質の発現を示す。 EGFP - C1トランスフェクションしたニューロスフェアは、ニューロン(C、D)、アストロサイト(E、F)、オリゴデンドロサイト(G、H)に異なる条件下で解離し、分化しており、ローダミンの蛍光下で見る。同時に、トランスフェクトされたEGFP陽性細胞はフルオレセイン蛍光の下に表示されます。トランスフェクトした細胞(白矢印の頭)はトランスフェクトされていない細胞(白矢印)と区別がつかない。細胞核をHoechst33342で染色されています。スケールバーは用は200μm、BとCHの場合は25ミクロンでは100μmです。
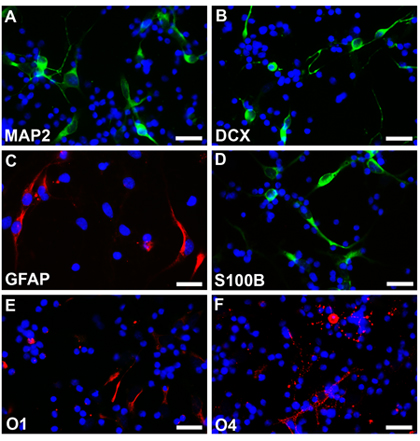
図3。トランスフェクションなしのニューロスフェアは神経細胞(A、B、フルオレセイン)、アストロサイト(C、ローダミン、D、フルオレセイン)およびオリゴデンドロサイト(E、F、ローダミン)への異なる条件下で解離と区別されています。細胞核をHoechst33342で染色されています。スケールバーは、AFは25μmです。
Access restricted. Please log in or start a trial to view this content.
ディスカッション
文化新鮮な組織と生ヒト細胞株に向けたさまざまなアプローチがある。歴史的に、新鮮な組織を採取され、中枢神経系における種々の細胞型を生成するために直ちに培養。このアプローチは、しかしはっきりと得られたヒトサンプルの場合には、通常非常に小さいことができるサンプルの数によって制限されます。操作の最小限の度合いを考えると、新鮮な培養神経細胞では、拡張培養から?...
Access restricted. Please log in or start a trial to view this content.
開示事項
謝辞
HD054347とVLSへNS063997 - 01:この作品は、国立衛生研究所によって部分的にサポートされていました。この作品はまた、保健契約#C024324 VLSへのニューヨーク国務省を通じて、エンパイアステート幹細胞の基金によって部分的にサポートされていました。ご意見は、ここに表明し、執筆者の個人的な見解であり、必ずしもエンパイアステート幹細胞委員会、ニューヨーク州保健局、または、ニューヨーク州の見解を反映するものではありません。 VLSはドリスデューク臨床科学発達受賞者です。我々はまた、抗O1、抗O4抗体の彼の贈り物のために教授ティモシーVartanianに感謝。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | コメント(省略可能) |
|---|---|---|---|
| KNOCKOUT DMEM/F12 | インビトロジェン | 12660-012 | 解離培地 |
| 幹プロNSC SFM | インビトロジェン | A10509 - 01 | 培地 |
| ウシ胎仔血清 | インビトロジェン | 10091-148 | 凍結媒体 |
| ハンクス溶液(-のCa 2 +、 -のMg 2 +) | インビトロジェン | 14175-095 | 解離培地 |
| DMSO | シグマアルドリッチ | D2650 | 凍結媒体 |
| EDTA | シグマアルドリッチ | 431788 | 解離培地 |
| パラホルムアルデヒド | シグマアルドリッチ | 158127 | 固定液 |
| bFGFの | R&D | 234 - FSE | 分化培地 |
| SHH | R&D | 1845 - SH | 分化培地 |
| PDGF - AA | R&D | 221 - AA | 分化培地 |
| B27 | インビトロジェン | 17504-044 | 分化培地 |
| マウス抗MAP2 | シグマアルドリッチ | M2320 | 1:200 |
| ウサギ抗DCX | 細胞シグナリング | 4604s | 1:200 |
| ウサギ抗GFAP | DAKO | Z0334 | 1:200 |
| ウサギ抗- S100B | DAKO | Z0311 | 1:200 |
| ウサギ抗- O1 | 教授ティモシーVartanianの贈り物* | 午前1時50分 | |
| ウサギ抗O4 | 教授ティモシーVartanianのギフト* | 午前1時50分 | |
| 40μmのセルストレーナー | BDファルコン | 352340 |
*ティモシーVartanian、MD、PhDは、神経と神経科、ワイルコーネル医科大学、ニューヨーク、アメリカ合衆国
参考文献
- Gage, F. H., Ray, J., Fisher, L. J. Isolation, characterization, and use of stem cells from the CNS. Annu. Rev. Neurosci. 18, 159-192 (1995).
- Vescovi, A. L., Snyder, E. Y. Establishment and properties of neural stem cell clones: plasticity in vitro and in vivo. Brain Pathol. 9, 569-598 (1999).
- Schwartz, P., Bryant, P., Fuja, T., Su, H., O'Dowd, D., Klassen, H. Isolation and characterization of neural progenitor cells from post-mortem human cortex. J Neurosci Res. 74, 838-851 (2003).
- Martinez-Serrano, A., Rubio, F. J., Navarro, B., Bueno, C., Villa, A. Human neural stem and progenitor cells: in vitro and in vivo properties, and potential for gene therapy and cell replacement in the CNS. Curr Gene Ther. 1, 279-299 (2001).
- Rajan, P., Snyder, E. Neural stem cells and their manipulation. Methods Enzymol. 419, 23-52 (2006).
- Ruiz-Lozano, P., Rajan, P. Stem cells as in vitro models of disease. Curr Stem Cell Res Ther. 2, 280-292 (2007).
- Sheen, V., Ferland, R., Harney, M., Hill, R., Neal, J., Banham, A., Brown, P., Chenn, A., Corbo, J., Hecht, J., Folkerth, R., Walsh, C. Impaired proliferation and migration in human Miller-Dieker neural precursors. Ann Neurol. 60, 137-144 (2006).
- Bahn, S., Mimmack, M., Ryan, M., Caldwell, M., Jauniaux, E., Starkey, M., Svendsen, C., Emson, P. Neuronal target genes of the neuron-restrictive silencer factor in neurospheres derived from fetuses with Down's syndrome: a gene expression study. Lancet. 359, 310-315 (2002).
- Ferland, R. J., Batiz, L. F., Neal, J., Lian, G., Bundock, E., Lu, J., Hsiao, Y. C., Diamond, R., Mei, D., Banham, A. H. Disruption of neural progenitors along the ventricular and subventricular zones in periventricular heterotopia. Hum Mol Genet. 18, 497-516 (2009).
- Esposito, G., Imitola, J., Lu, J., De Filippis, D., Scuderi, C., Ganesh, V. S., Folkerth, R., Hecht, J., Shin, S., Iuvone, T., Chesnut, J., Steardo, L., Sheen, V. Genomic and functional profiling of human Down syndrome neural progenitors implicates S100B and aquaporin 4 in cell injury. Hum Mol Genet. 17, 440-457 (2008).
- Esposito, G., Scuderi, C., Lu, J., Savani, C., De Filippis, D., Iuvone, T., Steardo, L. J. r, Sheen, V., Steardo, L. S100B induces tau protein hyperphosphorylation via Dickopff-1 up-regulation and disrupts the Wnt pathway in human neural stem cells. J Cell Mol Med. 12, 914-927 (2008).
- Flax, J. D., Aurora, S., Yang, C., Simonin, C., Wills, A. M., Billinghurst, L. L., Jendoubi, M., Sidman, R. L., Wolfe, J. H., Kim, S. U., Snyder, E. Y. Engraftable human neural stem cells respond to developmental cues, replace neurons, and express foreign genes. Nat Biotechnol. 16, 1033-1039 (1998).
- Fults, D., Pedone, C. A., Morse, H. G., Rose, J. W., McKay, R. D. Establishment and characterization of a human primitive neuroectodermal tumor cell line from the cerebral hemisphere. J Neuropathol Exp Neurol. 51, 272-280 (1992).
- Conti, L., Cattaneo, E. Neural stem cell systems: physiological players or in vitro entities? Nat Rev Neurosci. 11, 176-187 (2010).
- Svendsen, C. N., ter Borg, M. G., Armstrong, R. J., Rosser, A. E., Chandran, S., Ostenfeld, T., Caldwell, M. A. A new method for the rapid and long term growth of human neural precursor cells. J Neurosci Methods. 85, 141-152 (1998).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved