このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
網膜神経節細胞の生存を研究するために視神経挫滅モデルマウス
要約
このプロトコルは、逆行性に網膜神経節細胞、およびどのように続いて網膜神経節細胞の生存とアポトーシスを分析するために視神経挫滅するためにラベルを付ける方法を示しています。それは、緑内障を含む視神経障害の様々なタイプ、のための実験的疾患モデルです。
要約
視神経への損傷は不可逆的な視力喪失につながる網膜神経節細胞(RGCs)、の緩やかな死が続く、軸索変性につながることができます。人間のような疾患の例としては、外傷性視神経障害、緑内障の視神経の変性などがあります。それは、視力低下や失明につながる視神経の頭の中で典型的な変化、進歩的な視神経の変性、および網膜神経節細胞の消失、制御されていない場合、によって特徴付けられる。
視神経クラッシュ(ONC)傷害のマウスモデルでは、外傷性視神経障害のための重要な実験的な疾患モデル、このモデルでは緑内障など、視神経が徐々に網膜神経節細胞のアポトーシスに導くに圧挫です。この疾患モデル、治療手段の開発に不可欠な神経細胞死と生存、の一般的なプロセスとメカニズムを研究するために使用することができます。さらに、薬理学的および分子的アプローチは、異なるタイプの視神経障害の治療に潜在的な治療薬を特定し、テストするには、このモデルで使用することができます。
ここでは、1日目における網膜神経節細胞のベースライン逆行性標識法(RGCs)、4日目(II)視神経挫滅、(III)網膜を収穫し、一日でRGC生存率を分析(I)のステップのデモンストレーションでステップを提供する11、および(IV)代表の結果。
プロトコル
使用されるすべての機器や試薬は無菌である。全ての動物実験は、動物のケアによって承認され、NEI / NIH(動物実験のプロトコルのNEI - 570)で委員会(ACUC)を使用して、NIHのガイドラインと規則に従って行ったれました。
1。 1日目に網膜神経節細胞のベースライン逆行性標識法(RGCs)
この手順の目的は、三日間視神経挫滅の前にマウスの上丘に神経トレーサー色素を注入することにより逆行性に網膜神経節細胞を標識することです。染料は逆行網膜神経節細胞に取り込まれ、生きているRGCs(図1)のマーカーを提供する。このアプローチは、ほとんど変化1-5実行可能なRGCsの再現可能なラベルが得られます。
- 深くマウスを麻酔。頭頂部の毛をきれいに。小さな定位固定装置にマウスを置きます。保護oinmentは、両眼に適用されます。頭部の皮膚を消毒三回ヨードと70%アルコールのスクラブを使用して、各。
- 頭蓋骨を露出する皮膚に切開を加えて、3%の過酸化水素を使用して、それが乾燥して清潔に保つ。
- ブレグマを識別し、マークします。ブレグマと各半球7の正中線に横0.5ミリメートルの後ろに2.9ミリメートルで、上丘、上記の穴を開けます。掘削中に、穴が二次熱損傷を防止するために掘削されたサイトへ生理食塩水適用されます。
- 定位測定装置とハミルトンシリンジを用いて、脳の骨表面から1.6mmの深さでそれぞれの半球の上丘に非常にゆっくりとFluoroGold神経トレーサー色素(3%の1μlの生理食塩水に蛍光色素)を注入する。
- 切開部位を縫合。鎮痛のためのブプレノルフィンの皮下注射をする。
- 暖かく、乾燥した地域にマウスを移動し、直立姿勢を維持し、そしてそのホームケージにそれを返すことができるようになるまでそれを監視する。標識手順の後の最初の3日間は、全身性鎮痛薬(例えば、ブプレノルフィン)および局所抗生物質軟膏1日2回与えられているとマウスが密接に監視されています。
2。 4日目の視神経挫滅
この手順では、我々は、網膜神経節細胞の緩やかな死につながる軸索(図2)、の主要な損傷を引き起こすことが視神経に挫滅が適用されます。
- トレーサー色素アプリケーションの3日後には、マウスが深く麻酔です。解剖顕微鏡を使って、片方の眼の結膜は、春のはさみのペアを使用して、4時の位置についてで切開しています。
- ゆっくりと軌道筋肉を偏向し、それらを脇に置く。目の世界からの出口で白い視神経を公開。あらゆる血管を傷つけないように細心の注意を払って。
- クロスアクションのピンセットの助けを借りて、約3秒間眼球から約2 mmに視神経に挫滅を適用します。出血を引き起こすために眼動脈を傷つけないように細心の注意が払われています。
- 圧挫終了後、切開を縫合されています。
- マウスは、麻酔から回復する前に、鎮痛のためにブプレノルフィンの皮下注射をする。
- それは直立姿勢を維持し、そのホームケージにそれを返すことができるようになるまで、暖かく乾燥した領域にマウスを移動し、それを監視する。圧挫の手順の後の最初の3日間は、全身性鎮痛薬(例えば、ブプレノルフィン)および局所抗生物質軟膏1日2回与えられているとマウスが密接に監視されています。
3。網膜を収穫し、11日目でRGC生存率を分析する
この手順の目的は、retinaetoは、網膜神経節細胞の生存率を分析し収穫することです。
- 11日目(ONC後7日目)で、マウスをCO 2注入し、頚椎脱臼により安楽死されています。
- 目が軌道に圧力をかけてピンセットの助けを借りて摘出されています。
- 目が2時間4%パラホルムアルデヒド溶液で固定し、PBSで3回洗浄する。網膜を解剖。網膜の解剖の手順は、すでに6。Gustmann、S.らによって2010年にJoveのことで以前に公開されているので、ここでは説明されません。
- 生存網膜神経節細胞のイメージは網膜の定義された領域で蛍光顕微鏡を用いて撮影され、網膜神経節細胞の密度をカウントすることができます。視神経挫滅の有無に蛍光標識された網膜神経節細胞の代表的な結果を図3に示されています。
4。代表的な結果:
七日視神経挫滅後の網膜神経節細胞の生存を、分析するために、網膜は、収穫固定し、平らにし、マウントされた。網膜像は、蛍光顕微鏡を用いて撮影した。無傷通常のRとの比較etina(ノーマル、左)、実行可能なRGCsの数は(緑、逆行上丘に注入FluoroGold神経トレーサー色素で標識された)視神経挫滅(右、ONC)(図3)と網膜で有意に低いです。 。
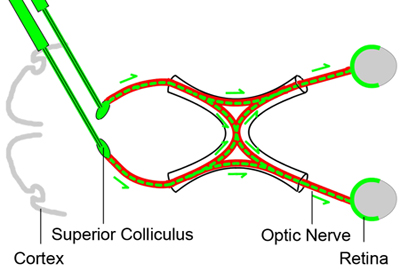
図1。網膜神経節細胞のベースライン逆行性標識法
視神経挫滅後の異なる時点で実行可能な網膜神経節細胞をカウントするためには、網膜神経節細胞(視神経前に脳三日間の上丘に神経トレーサー色素(緑色)を注入して逆行性に標識される赤)圧挫。網膜神経節細胞の軸索は上丘に存在するので、トレーサーの染料は逆行RGCsで取り上げられ、生活RGCs用マーカーを提供する。
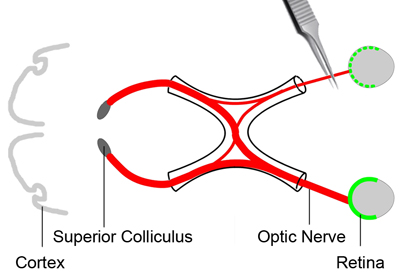
図2。視神経挫滅損傷
網膜神経節細胞の生存率の状況を分析するために、圧挫は、軸索への一次損傷を引き起こすために視神経(赤)に適用されます。これは、網膜神経節細胞の緩やかな死につながる。トレーサー色素(緑)注射の3日後には、マウスは麻酔です。片眼の結膜を切開される。軌道筋肉をそらし、それを脇に置く。目の世界からの出口で視神経を公開。クロスアクションのピンセットを使用して約3秒間眼球から約2 mmに視神経に挫滅を適用します。
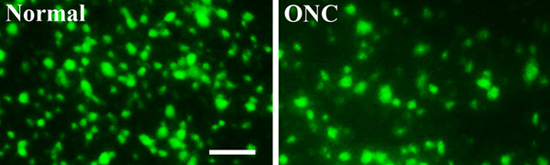
図3。視神経挫滅の有無に蛍光標識された網膜神経節細胞
七日視神経挫滅後の網膜神経節細胞の生存を、分析するために、網膜は、収穫固定し、平らにし、マウントされた。網膜像は、蛍光顕微鏡を用いて撮影した。無傷正常網膜(左、ノーマル)、実行可能なRGCsの数(緑、逆行上丘に注入FluoroGold神経トレーサー色素で標識された)と比較して視神経挫滅(右、ONCと網膜で有意に低かった)(図3)。スケールバー:50μm以下
ディスカッション
視神経挫滅モデルマウスは、RGC死と生存の過程を研究するのに便利です。このモデルはまた、しばしばRGCアポトーシスと生存の異なる試薬と遺伝子の影響を調査するために使用されます。このモデルの利点の1つは、最小限のバリエーションを持つ再現性の高い学位を持っているということです。
しかし、特別な注意はこのモデルではいくつかのステップが必要です。彼?...
開示事項
謝辞
我々の研究は、NIH、国立眼研究所の学内研究プログラムによってサポートされています。
資料
| Name | Company | Catalog Number | Comments |
| Stereotaxic apparatus | ASI Instruments | SAS-4100 | |
| Dissecting microscope | World Precision Instruments, Inc. | PZMIV-BS | |
| Scalpel handle | Fine Science Tools | 10003-12 | |
| Scalpel Blades #15 | Fine Science Tools | 10015-00 | |
| Microdrill | Fine Science Tools | 18000-17 | |
| Suture needle | Fine Science Tools | 12050-03 | |
| Spring scissors | Fine Science Tools | 16144-13 | |
| Dumont #5 forceps | Fine Science Tools | 11252-50 | |
| Hamilton syringe | Hamilton Co | 88400 | |
| Gauze sponges | Office Depot | 674889 | |
| Fluorochrome | Sigma-Aldrich | 39286 | |
| Alcohol | Sigma-Aldrich | 459844 | 70% |
| H2O2 | Sigma-Aldrich | H3410 | 3% |
参考文献
- Yoles, E. GM1 reduces injury-induced metabolic deficits and degeneration in the rat optic nerve. Investigative ophthalmology & visual science. 33, 3586-3591 (1992).
- Fisher, J. Vaccination for neuroprotection in the mouse optic nerve: implications for optic neuropathies. J Neurosci. 21, 136-142 (2001).
- Levkovitch-Verbin, H. RGC death in mice after optic nerve crush injury: oxidative stress and neuroprotection. Investigative ophthalmology & visual science. 41, 4169-4174 (2000).
- Li, Y. VEGF-B inhibits apoptosis via VEGFR-1-mediated suppression of the expression of BH3-only protein genes in mice and rats. The Journal of clinical investigation. 118, 913-923 (2008).
- Tang, Z. Survival effect of PDGF-CC rescues neurons from apoptosis in both brain and retina by regulating GSK3beta phosphorylation. The Journal of experimental medicine. 207, 867-880 (2010).
- Gustmann, S., Dunker, N. In vivo-like organotypic murine retinal wholemount culture. J Vis Exp. , (2010).
- Franklin, K., Paxinos, G. . The Mouse Brain in Stereotaxic Coordinates. , (1997).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved