Method Article
ライブラット皮質ニューロンのミトコンドリア膜電位と活性酸素種の定量
要約
我々は、特定の刺激の適用前と適用後のTMRM蛍光強度の相対的変化を決定するために皮質ニューロンで、蛍光指示薬、TMRMのアプリケーションを実証する。我々はまた、蛍光プローブHのアプリケーションを表示 2 DCF - DA皮質ニューロンにおける活性酸素種の相対的レベルを評価する。
要約
ミトコンドリア膜電位(ΔΨm)は、ATPを生成するための呼吸鎖の生理的機能を維持するために不可欠です。 ΔΨmの大幅な損失は、その後の死でエネルギーが枯渇セルをレンダリングします。活性酸素種(ROS)が重要なシグナル伝達分子であるが、病的状態におけるそれらの蓄積は、酸化ストレスにつながる。細胞内ROSの二つの主要な源は、環境の毒素と酸化的リン酸化のプロセスです。ミトコンドリア機能障害と酸化ストレスは多くの疾患の病態生理に関与しているので、ΔΨmとROSを判断する能力は、細胞とミトコンドリアの機能の生理学的状態に関する重要な手がかりを提供することができます。
いくつかの蛍光プローブ(ローダミン123、TMRM、TMRE、JC - 1)種々の細胞型でΔψmを決定するために使用することができる、と多くの蛍光指標(Dihydroethidium、Dihydrorhodamine 123、H 2 DCF - DA)はROSを決定するために使用することができます。ほぼすべてのΔΨmまたはROSを評価するために使用可能な蛍光プローブのは、単一波長の指標であり、ΔΨmまたはROSのレベルを増加または減少させる刺激に比例した蛍光強度を増加または減少される。従って、それはベースラインレベルと特定の刺激を加えた後にこれらのプローブの蛍光強度を測定することが不可欠です。これは、1つはベースラインレベルと刺激間の蛍光強度の変化の割合を決定することができます。蛍光強度の変化はΔΨmまたはROSの相対的なレベルの変化を反映している。このビデオでは、我々はベースラインレベルとの間およびFCCP、ミトコンドリアの脱共役剤を適用した後TMRM蛍光強度の変化率を決定するためにラット皮質ニューロンの蛍光指示薬、TMRMを、適用する方法を示しています。 FCCPの治療に起因するTMRM蛍光の低いレベルは、ミトコンドリア膜電位の脱分極を反映している。我々はまた、H 2 O 2の適用後、ベースラインの最初の皮質ニューロンにおけるROSのレベルを、評価し、蛍光プローブH 2 DCF - DAを適用する方法を示しています。このプロトコルは、(若干変更して)また、異なる細胞型で、他の脳領域から分離されたニューロンのΔΨmとROSの変化を決定するために使用することができます。
プロトコル
1。細胞の培養
- 皮質ニューロンを単離し、前述の技法を用いて成長とポリ- D -リジンとラミニン1でコートしたガラスボトム(マテック(株)、アッシュランド、マサチューセッツ州)で培養皿に播種されています。
2。蛍光プローブTMRMとH 2 DCF - DA用のストック溶液を準備する
- 無水ジメチルスルホキシド1mlにTMRM 5.0 mgを溶解してTMRMの10 mMのストック溶液を調製。 1分間ボルテックスして。その後、アリコートを行い、-20℃に保存する、光から保護し、一ヶ月以内に使用してください。
- 次に、無水DMSO 1ml中にH 2 DCF - DAの4.87 mgを溶解することによってH 2 DCF - DA 10 - mMのストック溶液を調製。同様に、1分間攪拌のためのそれ。その後、アリコートを行い、-20℃に保存する、光から保護し、一週間以内に使用してください。
3。 TMRMとH 2 DCF - DAでのロードラット皮質ニューロン
TMRMは、ミトコンドリアの高度に負に帯電内部に蓄積される電位差、細胞透過性蛍光指示薬です。ミトコンドリアTMRMの自動消光を避けるためにTMRMの低濃度(10〜50 nMの範囲)を使用することが重要です。その後、TMRMの蛍光シグナルはミトコンドリア内膜を通過するΔΨmに直接協力関係することができます。 ΔΨmの消失は、蛍光強度が失われるおそれがミトコンドリアからリークするTMRMなります。 H 2 DCF - DAは細胞透過性の細胞内エステラーゼによってDCF - DAに変換プローブ、および蛍光DCFでの酸化の結果です。高負荷の濃度もH 2の不在O 2におけるDCF蛍光の飽和を引き起こす可能性があるので、DCF - DA 2〜10μMとそれの間の範囲H 2の最終濃度は、異なる脳領域から派生した神経細胞で実験的にテストする必要があります。いかなる内因性または外因性の酸化剤(例えば、一酸化窒素、過酸化水素)の存在は、DFC蛍光強度が増加します。以下、我々はTMRMとH 2 DCF - DAでラット皮質ニューロンをロードするためのプロトコルを提供しています。
- TB::145 mMのNaCl、5mMのKCl、10mMのグルコース、1.5mMのCaCl 2を 、1mMのMgCl 2、および10 TMRMとラット皮質ニューロンをロードするには、まず、タイロードバッファ(テキストオーバーレイで培養神経細胞を3回洗浄mMのHEPES、NaOHで7.4にpHを調整)。その後、結核で1 / 1000倍の10mM TMRMの株式を希釈することによりTMRMの20 nMのを準備して、TBの1mlあたり希薄化後TMRMの2μlを加える。室温、暗所で45分間TMRMと神経細胞をインキュベートします。 45分後、顕微鏡のステージ上に培養皿をマウントし、イメージングを起動します。
- H 2 DCF - DAとラット皮質ニューロンをロードするには、結核と培養神経細胞を3回洗浄。次に、TBで10mMのH 2 DCF - DA株式1 / 10倍に希釈してH 2 DCF - DAの2μMを準備して、TBの1mlあたり希薄化後のH 2 DCF - DAの2μlを加える。その後、室温で暗所で45分間H 2 DCF - DAを持つニューロンをインキュベートする。 45分後、画像を取得する前に、余分な蛍光指示薬を削除するには、結核と神経細胞を4回洗浄する。
4。 ΔΨmを決定するためにTMRMとともにインキュベートした神経細胞のイメージングを生きる
- TMRMとともにインキュベートした神経細胞のライブイメージング、共焦点レーザー走査顕微鏡(テキストオーバーレイ:LSM 510、カールツァイス社)を実行するために、ライブの時系列のプログラムのアプリケーションとを、使用されています。画像を取得し、退色を避けるために必要な時間を最小限に抑えるために:、低解像度と減衰レーザーパワー(1%:低解像度レーザパワー256 × 256テキストオーバーレイ)を適用します。
- 。次に、反射光を使用してTMRMでロードされたマウントされているニューロンのフォーカスを調整します。 514 nmで照射し、570nmで検出によるTMRM蛍光を調べます。ちょうど飽和レベル以下のカメラの検出のゲインを設定します。
- 一度画像を得るために解像度、レーザーパワー、カメラの検出のゲイン、およびタイムラプス間隔を含むすべてのパラメータが設定されています。実験間でこれらの設定を変更しないでください。次に、フィールドを変更します。画像の収集を開始。
- ΔΨmの変更をテストするには、そのようなFCCPまたは2μgの/オリゴmlの、1μMのような刺激が著しく、それぞれ、ミトコンドリア膜電位を脱分極や過分極となる、適用することができます。これらの変更は、FCCPの場合にはベースライン蛍光強度と比較してTMRM蛍光強度の減少、またはオリゴマイシンの場合にTMRM蛍光強度の増加が反映されます。
5。 ROSを決定するためにH 2 DCF - DAとインキュベートした神経細胞のライブイメージング
- H 2 DCF - DA、最初にインキュベートニューロンのライブイメージングを実行するには、顕微鏡のステージ上に培養皿をマウント。私たちの細胞のフォーカスを調整しますINGは、反射光を。 488 nmで励起と515 nmの放射によるDCFの蛍光を調べる。
- 次に、5-7%、検出器のゲイン、および256 × 256の解像度にレーザーパワーを調整する。実験間でこれらの設定を変更しないでください。その後、時系列のプログラムを使用してライブ映像を得るために周波数を設定します。
- 新しいフィールドを選択して、画像を取得開始します。 ROSレベルの変化を検出するには、H 2 O 2の100から200μMで細胞を扱う。これは、ベースラインレベルと比較してDCF蛍光強度の増加が反映されます。
6。データの分析
- エリアを選択するLSMのプログラムからツール:関心領域を(ROIテキストオーバーレイ)を使用してください。その後、TMRMまたはROS蛍光強度を測定する。それぞれ、TMRMまたはROSの蛍光強度を測定するために撮像された細胞の全体の細胞体からミトコンドリアの地域またはROIのからROIを選択してください。
- TMRM用または各時間ポイントのROSのすべての画像形成されたセルのための全体の細胞体からの各セルのすべてのROIの平均蛍光強度を計算する。バックグラウンドの蛍光強度を計算するセルの隣の領域を選択します。いくつかの測定を行い、平均バックグラウンド強度を計算する。
- Microsoft Excelを使用して、各時間ポイントの各セル内のROIの平均蛍光強度から平均的なバックグラウンドの蛍光強度を引きます。バックグラウンド強度を差し引いた、この式を用いてベースラインの蛍光(:=ベースライン蛍光の任意の時点でFが=蛍光強度、ΔF= FF O / F O × 100、テキストオーバーレイ)にTMRMまたはDCF蛍光強度を正規化する。その後、時間の経過とともに蛍光強度の変化を示すグラフを生成するシグマプロットプログラムを使用します。
7。代表的な結果
図1Aは、TMRMとインキュベートラット皮質ニューロンの蛍光画像を示しています。 FCCP、ミトコンドリア脱共役剤、の添加は、ミトコンドリアの脱分極とTMRM蛍光強度(図1B)の損失につながる。ベースラインTMRMの蛍光レベルは、FCCPの添加(。;図1C第一350秒)の前に安定している。時間をかけてTMRM蛍光変化の定量分析は、FCCP(図1C)の添加後TMRMの蛍光の有意な減少を示しています。
図1Dは、DCFを搭載したラット皮質ニューロンの蛍光画像を示しています。細胞体の増加DCF蛍光強度(図1E)のH 2 O 2の添加により。ベースラインDCF蛍光レベルは、H 2 O 2のアプリケーションの前に(最初の120秒)変更されていません。 DCF蛍光の経時的測定は、着実なレベルを示し、H 2 O 2処理(図1F)の後にどの増加。
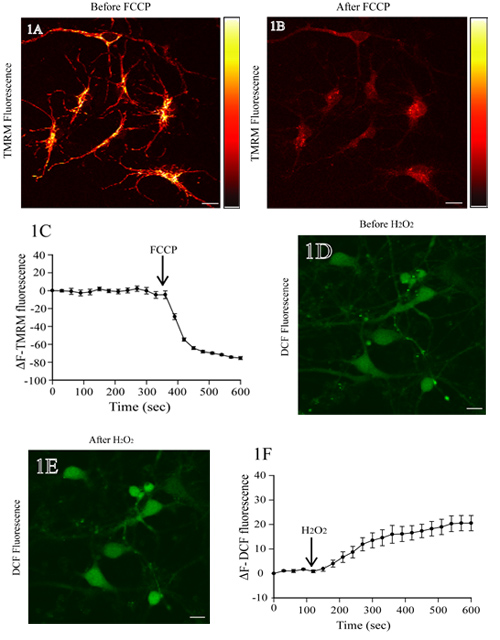
図1。ミトコンドリア膜電位とライブラット皮質ニューロンのROSレベルの評価。 TMRMを搭載した皮質ニューロンの(A)代表蛍光画像。ベースラインTMRM蛍光をスキャンした後、神経細胞はprotonophore FCCP(1μM)で処理した。右側にはそれぞれ、明るい黄色と表す黒の最大値と最小輝度とTMRM蛍光の疑似強度バーです。ミトコンドリアの領域からTMRMの蛍光の消失は、FCCP治療(パネルB)に応じてΔΨmの崩壊を示している。異なる時点でTMRM蛍光強度の変化の定量的表現は、FCCPの治療の前と後のパネルC.(D)でH2DCF - DAを搭載したラット皮質ニューロンの蛍光画像を示しています。ベースラインDCF蛍光を決定した後、細胞を200μMのH 2 O 2で処理し、及びDCF蛍光の変化を評価した。 DCF蛍光の増加は、H 2 O 2処理(E)に応じてROSレベルの増加を反映している。 DCF蛍光の変化の定量分析、H 2 O 2処理の前後には、パネルF.スケールバーに=10μmを示しています
Video.7.1 - labmedia 2704_Joshi.avi
40倍対物レンズを用いてFCCPを添加する前と後の皮質ニューロンにおけるTMRMの細胞イメージングを生きる。擬似カラーの強度は、FCCPの添加後(赤色、FCCPの添加後の)最大値(FCCPの添加前に、明るい黄色、)と減少TMRM蛍光強度を示しています。 ビデオを表示するにはここをクリック
ビデオ。 7.5 - labmedia 2704_Joshi.avi
40倍対物レンズを用いてH 2 O 2を添加する前と後の皮質ニューロンにおけるDCFの細胞イメージングを生きる。ベースラインDCF蛍光は、細胞体にライトグリーン色をしているとH2O2添加は、DCを増加させる鮮やかな緑色にF蛍光強度は。 ビデオを表示するにはここをクリック
ディスカッション
私たちは、それぞれ蛍光指示薬TMRMとH 2 DCF - DAを使用して、ラット皮質ニューロンでΔΨmとROSを決定する方法を説明するステップバイステップの手順を提示している。他の細胞型の場合は、経験的にTMRMまたはH 2 DCF - DAの最終濃度とローディング時間を決定することが重要です。一般的に、TMRM 20から200 nMから濃度範囲、およびTMRMと細胞のインキュベーション時間は20〜60分ごとに異なります。 H 2の最終濃度は、DCF - DAは、2〜10μMの範囲であり、そしてこの指標を含むローディング溶液中の細胞のインキュベーションは、30〜45分ごとに異なります。
どんな刺激がないのに細胞と蛍光強度の変化(TMRM蛍光のちらつきなど)の両方の光毒性を避けるために写真を撮るのレーザーパワーと走査速度を最適化することが重要です。最適化された光の設定は、刺激のない状態で(閾値)飽和上または下にない蛍光シグナルになるはずです。ライブイメージングの10〜15分の任意の刺激の非存在下でのプローブの蛍光強度には変化がないときに、特定のレーザーパワーおよび走査速度で選択したフィールドから画像を収集するために最適な条件が達成されています。
ΔΨmを決定するために他の蛍光プローブはローダミン123およびテトラメチルローダミンエチルエステル(TMRE)が含まれています。しかし、それらは単離されたミトコンドリア2の呼吸のプロセスを阻害することが見出された。重要なのは、TMRMは、低濃度でミトコンドリア呼吸に影響を与えません2と低光毒性と他のプローブに比べて3退色しています。 H 2 DCF - DAは、それがよく細胞内に保持されるROSのための良い指標であり、そのような過酸化物、超酸化物、および一酸化窒素4のようないくつかの酸化剤の種を、認識する。
開示事項
謝辞
この作品は、国立衛生研究所(JCBへK22NS050137)によってサポートされていました。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | |
|---|---|---|---|
| グラスの底の培養皿 | マテック株式会社 | P35G - 1.5 - 14 - C | |
| NbActive4 | BrainBits | NbActive4 | |
| TMRM | インビトロジェン | T668 | |
| H 2 DCF - DA | インビトロジェン | C400 | |
| NaClの | シグマ | S6191 | |
| 塩化カリウム | シグマ | P3911 | |
| のCaCl 2•2H 2 O | シグマ | C3306 | |
| のMgCl 2•6H 2 O | シグマ | M2670 | |
| D -グルコース | シグマ | G6152 | |
| HEPES | インビトロジェン | 15630 |
参考文献
- Hilgenberg, L. G., Smith, M. A. Preparation of dissociated mouse cortical neuron cultures. J. Vis. Exp. , (2007).
- Scaduto, R. C., Grotyohann, L. W. Measurement of mitochondrial membrane potential using fluorescent rhodamine derivatives. Biophys. J. 76, 469-477 (1999).
- Ward, M. W. The amyloid precursor protein intracellular domain (AICD) disrupts actin dynamics and mitochondrial bioenergetics. J. Neurochem. 113, 275-284 (2010).
- Gunasekar, P. G., Kanthasamy, A. G., Borowitz, J. L., Isom, G. E. NMDA receptor activation produces concurrent generation of nitric oxide and reactive oxygen species: implication for cell death. J. Neurochem. 65, 2016-2021 (1995).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved