Method Article
Cの生体レーザー軸索切断にエレガンス
要約
で神経細胞をカットするためのプロトコル C.エレガンス MicroPointパルスレーザーが提示されます。私たちは、ワームを固定化、システムをセットアップし、そして標識された神経細胞を切断について説明します。利点は、比較的低コストのシステムおよび神経突起または焼灼細胞を切断する機能が含まれています in vivoで。
要約
神経細胞は軸索と樹状突起、前または後シナプスの専門分野を含む細長い膜の拡張を介して他のセルと通信する。ニューロンは、けがや病気によって損傷している場合は、それが再生することがあります。細胞の内部外部要因は、関数を再生成し、復元するニューロンの機能に影響を与える。最近、線虫C.線虫は遺伝子を同定するための優れたモデル生物とニューロン1-6の再生に影響を与えるシグナル伝達経路として浮上している。 C言語で神経再生を開始する主な方法虫は、レーザーを介したカット、または軸索切断です。軸索切断時には、蛍光標識した神経突起は、高エネルギーのパルスを用いて切断されます。 C言語で最初に、神経再生エレガンスは、増幅フェムト秒レーザ5を用いて検討した。しかし、その後の再生の研究は、従来のパルスレーザーを正確に生体内で神経細胞を切断し、同様の再生反応1,3,7を誘発するために使用することができることを示している。
我々はパルスレーザーMicroPointを使用してワームの in vivoレーザー軸索切断、容易に入手可能であると広く標的細胞のアブレーションのために使用されていることをターンキーシステムで行うためのプロトコルを提示する。我々は、レーザーを揃えワームを取り付け、特定のニューロンを切断し、その後の再生を査定について説明します。システムは、一つの実験中に複数のワームのニューロンの多数をカットする機能を提供します。従って、本明細書に記載レーザー軸索切断は、再生のプロセスを開始し、分析するための効率的なシステムです。
プロトコル
1。システムの組み立て
私たちのシステムの特定のコンポーネントは以下の通りです。正しく組み立てられると、ユーザーは、(どちらかのマウスまたはジョイスティックを使って)他にステージを移動し、片手で顕微鏡を集中することができるようにフットペダルを使ってレーザーをアクティブにし、上の明確な見解を持つ必要があります画面イメージ。
- MicroPointレーザーは、化合物の顕微鏡の落射蛍光ポートに装着。我々は、ニコン80Iを使用しますが、どんな研究用正立または倒立範囲は動作するはずです。 MicroPointシステムでは、カットしたい細胞を標識する蛍光体を一致させる必要がカスタム二色性を、含まれます。別の蛍光色素で標識した細胞をカットすると、追加のdichroicsが必要です。さらに、パルス発生器とフットペダルはMicroPointシステムに付属しています。
- 100倍、1.4 NA油の手術を行うと再生を評価するための客観的、加えてスライド上にサンプルを検索するための必要に応じて追加の目標。我々は手術のためにニコンプランアポVCを使用し、および4xが粗い焦点とサンプルを見つけるのに便利であることがわかります。
- ジョイスティックを舞台にモーターを備えた。ステージのみをターゲットに使用されているので、非常に高い精度と再現性を備えたステージは、不要です。我々は、前OptiScan IIを(説明を参照)を使用します。
- カメラ。コンピュータのモニタ上で画像を視覚化しながらカメラは、100 ×客観的で標識された神経突起を集中し、ターゲットとするのに十分なフレームレートを提供する必要があります。我々は、光退色や損傷(以下、1.7参照)からの潜在的な交絡の影響を避けるために、軸索切断手順の実行中に照明光の減衰を好む。このように、カメラはこの低下光のレベルに対応するために十分な感度である必要があります。私たちは、浜松オルカ05Gを使用し、その16.3 Hzでのイメージングが十分であることを発見。同等のカメラで代用することができます。
- カメラを駆動することができるコンピュータ、モニタ、およびイメージングソフトウェア。さらに、我々は、マウス(の議論を参照)と電動ステージを操作するためのイメージングソフトウェアを使用してください。
- エアテーブル。この要件は、場所によって異なりますが、手術が100倍目的で実行されるので、我々は振動絶縁が不可欠であることがわかりました。
- ライトガイドと蛍光体を照射するためのシャッター機構を持つ光を供給。ライトガイドはMicroPointにアタッチされます。シャッター機構は、独立してレーザーの照射強度を減らすために有用です。我々は前にルーメン200またはライカEL6000を使用し、軸索切断のための全光強度の80%まで減衰させる。
2。レーザーのセットアップ
最初にレーザーを調整し、集中するための詳細なプロトコルは、MicroPointのレーザーシステムで提供されています。我々は、そのプロシージャが最初のセットアップ時に、うまく守られていることを前提としています。これは、接眼レンズの十字線とレーザーの位置合わせが含まれています。ここでは、レーザーの焦点と強度の定期的なメンテナンスのためのプロトコルを提供しています。
MicroPointのマニュアルで説明したように、パルス窒素レーザーは、深刻な人間の目を損傷することが可能です。ケアは、レーザービームを直視しないように注意が必要です。一度インストールすると、バリアフィルタは安全に接眼レンズを介して放射線をブロックする必要があります。
生物の神経細胞を切断砂の粒の大きさは、挑戦することができます。レーザーによるダメージの面積が非常に小さいので、それは正確にサンプルをターゲットにするために、レーザーの焦点の3次元位置を知ることが不可欠です。レーザーの焦点は、ミラーリングされたスライドを使って検出されます。最初に、我々は、レーザーの焦点のzの位置が画像のパスの焦点と一致していることを確認してください。次に、損傷の焦点のXY位置は、イメージングソフトウェアの十字線が付いています。
z平面に焦点を当て
- 中立密度フィルターND16(図1a)に押し込みます。我々は重視しながらレーザーを減衰させる落射照明のパスにNDフィルターを使用してください。をさらに細かく焦点を当て、ND16とND4蛍光フィルタの両方でプッシュ。
- スイッチで1パルスにMicroPointのレーザーを設定するには、"選択"(図1b)、および、適切なロングパスバリアフィルタ(図1c)にフィルターホイールを動かすになった。
- ステージ上にミラー化されたスライドを配置し、透過光を使用して4X目的で、その中のピンホールに焦点を当てる。
- ミラーリングされたスライドにイマージョンオイルの滴を追加し、100Xを目的としたホールに再び焦点を合わせる。レバー(図1d)とレーザーのシャッター(図1e)を切り替える光路とカメラのシャッターを開きます。これは正確に焦点に役立つでしょう:必要に応じて、ピンホールのエッジが鮮明になるように透過光強度を減少させる。
- フットペダルを押してください。レーザーが正しくフォーカスされている場合、これはミラーに小さな穴を生成する必要があります。
- わずかに、ミラー化されたスライドの平面上に顕微鏡を集中し、再びレーザーを撃つ。これは、さらに小さくすることが必要最初のショットより穴、またはまったくマークを残さない。ミラーリングされたスライドの下に焦点を当てて繰り返します。
- 穴が2.5で生産されていない場合、またはミラーの表面の上または下に焦点を合わせてより大きなサイズで穴が生産される場合には、アブレーションの頭の上にフォーカスリングのレーザーに再び焦点を合わせる。穴がまだ適切に接眼レンズの十字線で整列されていることを確認します。一貫して使用して、z平面の焦点はほとんど調整する必要はありません。
xy平面に焦点を当て
- 上記2.3を介して2.1の手順に従いますし、ミラーのスライドに小さな穴を作るために、フットペダルを押してください。
- 開始メニューElementsの取得"からモードをキャプチャする"ライブ"。 "メジャー"でツールバー"ROIエディタ"を選択し、"ダブルクロス"ツールを選択して、新しい穴の中心で、それらを合わせて十字線をドラッグします。し、"終了エディター'a'はROIを保存]をし、ライブキャプチャモードを再開]をクリックします。
- マウスでステージを操作する要素の'マウスXY"の設定を有効にします。
- 、元の位置(s)にNDフィルター(s)を引いて10にレーザーパルスを設定し、ミラーリングされたスライドを削除します。
レーザーのパワーを調整する
- レーザーのパワーは、お好みのニューロンをカットするために必要な最小限の電力に調整する必要があります。生きているワーム(後述)をカットしながら減衰器のプレート(図1f)を動かして電源を調整します。レーザーパワーが高すぎる場合、それは末梢損傷を引き起こしたり、ワームに風穴をあける予定。レーザパワーが低すぎる場合、それはニューロンを切断しません。システムが設定されると、アッテネータの位置はほとんど変更する必要はありません。レーザーが弱くなる、と減衰器のプレートは、切削を継続するために移動する必要がある場合、それは色素細胞の色素は、(説明を参照してください)交換する必要のようだ。
3。ワームを固定
- M9は3%溶融アガロース(22mmのKH 2 PO 4、42mM Na2HPO4、85ミリメートルのNaCl、1mMの硫酸マグネシウム)の溶液を調製します。 15 mLのファルコンチューブに溶融アガロースの5 mLを分注する。水を別のチューブを埋める。モジュラー発熱体の場所のチューブは55℃に設定各チューブのためのミニウォーターバスを作成するために水を発熱体を埋める。注:アガロースを事前に大量に用意し、その後の実験のために再溶融することができます。
- 2枚の画像それぞれと、これらのスライドの間にきれいなスライドにラベルテープの二つの層を配置。きれいなスライドの中央にプラスチック製の電球のピペットを用いてアガロースのドロップを分注し、その結果アガロースパッドは、テープの2つの部分(図2)の厚さになるように、最初に別のスライドを垂直に置きます。 30秒後にパッドから二のスライドの1つを削除します。すすぎ、その後のスライドで使用するために水で満たされたファルコンチューブにプラスチック製のピペットを格納する。
- 次に、場所パッドの中心に0.10ミクロンまたは0.05μmのポリスチレンビーズの3〜5μL。興味のニューロンの蛍光タンパク質を発現する50から10までワームを追加。興味の神経細胞が非対称的にワームの右側または左側に分散している場合は、正しい面が上を向くようにワームを反転するプラチナのピックを使用してください。ワームは、アガロースパッドを準備中の10分以内にスライド上に配置する必要があります。
- 慎重にワームにカバースリップを配置。これはキューティクルを破壊し、ワームを破壊するようにカバースリップを配置した後、アガロースパッドに相対的に移動しないでください。顕微鏡ステージ上にプレパラートを置きます。
4。カットのニューロン
- 光路切替レバー付接眼レンズに直接光。 4X目的でカットするワームに焦点を当て、カバースリップ上にオイルを一滴、および100X客観的にスイッチを配置する。カメラに光パスを返します。
- 十字線の中央下にお好みのニューロンを移動するマウスを使用してください。レーザーを発射し、神経突起を切断するために、フットペダルを押してください。必要に応じて、パルスを2組のニューロンを切断するために使用することができます。最初は、それは神経細胞は、その後の再生を評価するために、個々のワームで切断されている正確に追跡すると便利です。正しく実行するときに、レーザー軸索切断は、周囲の皮膚組織や他の神経細胞(図3を参照)に著しい損害を与えることなく、ニューロンの小さなブレークを生成します。特定のケースで、小傷は損傷部位の周囲に形成することがあります。
- ワームは、アガロースのパッド上に残っていることに注意して、直接上方への移動にカバースリップを除去することによりワームを回復する。カバースリップをオフに挿入しないでください。その後、ニードルノーズピンセットでワームの周りにパッドをカットし、OP50 8を含む新鮮なシードNGMプレート上にアガロースのセクションを配置します。ビーズからワームを解放し、アガロースを除去するためにパッドの上に滅菌M9の10μLを置きます。
5。再生のためのスコアのニューロン
- ステップ2.2で概説したようにアガロースパッドを準備します。
- 3月5日&の場所のワームムー、ポリスチレンビーズのL。カバースリップを適用します。スライドを順次製造することができる、あるいはすべてのワームは、事前と10cmの培養皿、アガロースの潤いを保つために湿らせたキムワイプを含む各に保持されているスライドに調製することができる。
- 切断された神経細胞を可視化するために100倍の目標を使用してください。多くの神経細胞では、切断部位より遠位の神経断端はそのまま残ります。我々は、ニューロンが実際に(図4)切断されたことを示すものとしてこの残骸の存在を使用してください。この切り株の存在はカットされていないものからカットして再生成されているニューロンを区別することが可能になります。注:両方の遠位と近位断端は最初にカットされた後に撤回。
- 再生を評価する。さまざまなパラメータを決定することができます。一つのシンプルなアッセイでは、負傷したニューロンの成長円錐(図4a)を形成し、再生しているかどうかである、またはない(図4b)。また、神経突起の長さがトレースと比較することができます。
6。代表的な結果
例として、我々は、γ-アミノ酪酸(GABA)の運動神経の再生の特性を説明します。腹神経索に存在し、背側神経索に円周方向にプロセスを拡張し、これらのニューロンは、、適切な運動9のに不可欠です。 GABAニューロンは、UNC -47またはUNCの制御-25プロモーター(C. elegansの遺伝センターから入手可能な株をそれぞれEG1285とCZ1200、、下、このような緑色蛍光タンパク質(GFP)などの遺伝的に符号化された蛍光体を、発現させることによって可視化することができる)。
マウントL4段ワーム説明されているように、彼らの右サイドのGABAニューロンが上を向いているようにワームを反転し、カバースリップを配置。 、背側と腹側のコードの中間にそれぞれのワームの後交連1-3カット。これらは後で得点することは困難であるため、他の交連との交差または束生のこと交連の切断は避けてください。説明されているようにワームを回復する。
成功した軸索切断後18〜24時間、ワームは、手術から回復し、正常な運動器官と産卵行動を示すことになります。死亡または病気のワームを捨てる。説明したように、残りを再マウントし、再生を評価する。我々は、通常の実験条件ごとに少なくとも30カットニューロンを評価することを目指しています。 oxIs12動物では、切断されたL4 GABAニューロンの典型的に60〜70%がチップといくつかの神経突起の枝の延長で膜の拡大、および切断部位(図4a)から移行によって証明される成長円錐の構造を、開始しているでしょう。多くの場合、成長円錐は、背側神経索、隣接するニューロンの交連、または遠位断端と再接続に移行しているでしょう。ニューロンの残りの30%はどちら軸索切断のサイトへの近位断端を形成し、ない成長を開始していないか、またはわずかな糸状仮足(図4b)を拡張してきましたなります。

図1。紫外線は、レーザー軸索切断システムをパルス 。特定のコンポーネントがあります:(a)のNDフィルターは、(b)にパルスセレクター(C)フィルタホイールのレバー(D)レバー(E)レーザーシャッター、(f)は減衰器のプレートを切り替える光路。
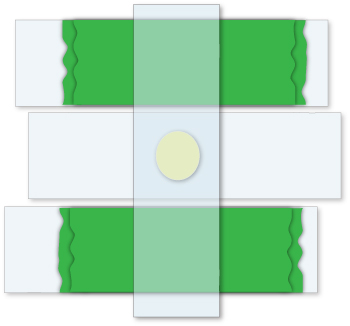
図2。アガロースのパッドを準備 。所望の厚さのアガロースパッドを準備するには、テープの二層は(緑)は、2つのスライド上に配置されます。スライドは最初の二つの間に配置され、及びアガロースのドロップは、きれいなスライドに追加されます。最後に、4枚目のスライドは、テープの2枚の厚さのパッドで、その結果、最初の三つに垂直に配置されます。
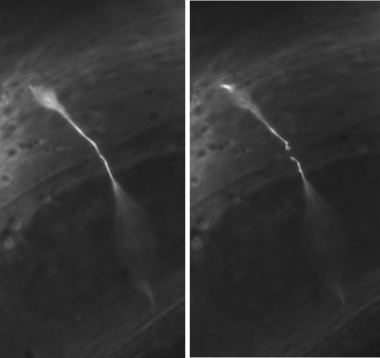
図3。代表的なGABAニューロンaxotomies。典型的な実験で、GABAニューロンの交連は、ワームの外側面の中央に切断されています。切断交連は、(左パネル)と後(右パネル)軸索切断の直前に示されています。すべての画像は100 ×油浸対物で撮影された。
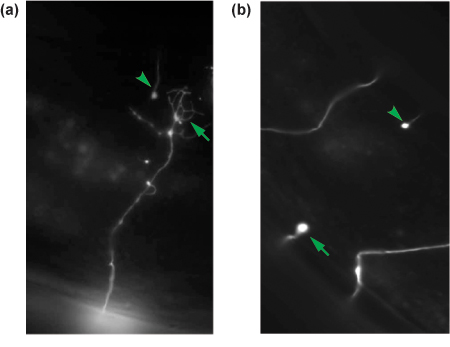
図4。 GABAニューロンのaxotomiesの代表的な結果 。 24時間後の軸索切断切断軸索が再生のために採点されます。成長円錐(矢印)と再生軸索は、(a)非再生する軸索は、(b)に近位断端(矢印)と見られている間に示されています。各カットの軸索の遠位断端は、それぞれのパネルに示す(矢印)と軸索が切断されていることを示している。
ディスカッション
レーザーシステムの様々なCの神経突起をカットするために使用されている虫 、そしていくつかの研究は詳細3,7,10,11でその性能を検討した。我々のプロトコルで使用されているMicroPointのレーザーは、セットアップと保守が容易である、とTi -サファイアレーザーシステムと比較して研究者へ低コストで利用可能なターンキーシステムです。チタンサファイアのシステムと比較すると、しかし、MicroPointのレーザーは、一部のアプリケーションでは不利かもしれないより広い領域への損傷を引き起こすことが期待されています。チタンサファイアのシステムが必要な場合は、そのようなシステムを構築する上で優れたプロトコルが利用できる12です。
現在のプロトコルは、C言語で神経細胞の多様で行うことができます。 elegansは 、しかし、我々は、ニューロンの異なるタイプ間の再生能力の差が13を期待していることに注意してください。さらに、異なるトランスジェニック背景には、再生の成功に影響を与える可能性があります。再生成するGABAニューロンの割合が異なるトランスジェニックマーカーの系統間のかなり一貫しているが、我々はoxIs12 15ワーム対juIs76 14の再生の全体的なわずかな増加を指摘している。タッチのニューロンのマーカーの違いも2を記載されている。
我々はより速く、より一貫性の固定化16のビーズの結果として、マイクロビーズではなく、麻酔薬でワームを固定化することを好む。我々は麻酔17のためにすべての可能な交絡影響の自由な再生を観察することができるようにも有益です。固定化のための代替麻酔フリー法は、マイクロ流体デバイスの使用です。軸索切断のためのマイクロフルイディクスの使用は、広範囲に17-22を記載されている。
我々は一貫して使用して、レーザーの機能は最高のクマリンが色素細胞に440時MicroPointのマニュアルに記載されている手順に従って、それぞれ週に1回交換されていることがわかります。必要に応じて、減衰量のスライダーは、パワーを高めるために使用することができますが、これは古い色素またはレーザーのずれを示す可能性があります。また、色素細胞は限られた寿命を持っており、最終的には(トラブルシューティングを参照してください)再構築または交換する必要があります。
それは動物が不完全麻痺している場合は特に、レーザーの焦点をマーク十字線の下にターゲットの神経突起を操縦することが困難な場合があります。我々は、それは確かに可能ですが、手動ステージは、この目的のために最適でないことがわかります。ジョイスティック制御の電動ステージはより正確であり、我々は、電動ステージを移動するためにマウスでドラッグイメージをサポートするソフトウェアを使用する最善であることがわかります。ニコンの要素は、この機能を提供し、このプロトコルで説明されていますが、フリーMicromanagerのパッケージだけでなく、他のイメージングソフトウェアは、同様の機能を持つことができます。細かいターゲティングの異なる方法ではなく、動物ではなく、レーザーのフォーカスを移動することです。このアプローチを優先する場合ガルバノビームステアリング機構は、アドオンMicroPointのレーザーに対して利用可能です。
神経再生の研究への応用のほかに、レーザーは、皮膚、筋肉、または特殊化した細胞のような他の細胞型を、切除する、または特定の神経シナプス23から27を混乱させるために使用することができます。また、けがや病気に付随する神経細胞の変性を調節する経路は、このシステムを用いて調査することができます。このように、パルスレーザーの使用は、遺伝的要因と神経再生とその他の関連プロセスを容易にする細胞生物学的変化の両方に光を当てるしていきます。
トラブルシューティング:
いくつかの一般的な問題とそれに関連するソリューションは、ここで説明する。
- レーザーは、正常に切断されていません 。どちらかのレーザーが(セクション2を参照)焦点が合っていないので、これは可能性が高い、または色素細胞の色素は、(MicroPointマニュアルを参照)、交換する必要があります。また、色素細胞を交換または再構築する必要があります。
- ワームは、アガロースパッドの上に動いている 。これは一般的にアガロースのパッドがあまりにも湿っているというサインです。私たちは、ワームがこの問題を回避するためにその上に配置される前にパッドが約30秒間放置する必要があることがわかります。また、小さいサイズ(0.05μm)をマイクロビーズを使用して試すことができます。
- ワームの回復は困難と非効率的です 。これは、不正なカバースリップの除去により、または乾燥したアガロースパッドによって発生することができます。パッドがあまりにも乾燥している場合は、軸索は、ビーズの外観を開発することがあります。ワームはすぐに十分にそれが行われた後にパッド上に配置されていないため、場合によっては、これはです。また、アガロース溶液の古い株式は、繰り返し溶融後、3%の濃度よりも高い場合があります。
開示事項
謝辞
NIHの助成金R01 NS066082 - 01とT32GM007223、ベックマン財団、とエリソン医学財団:Hammarlundラボの仕事は、によって運営されている。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | コメント |
|---|---|---|---|
| 0.05μmのポリスチレンビーズ | Polysciences、(株) | 08691 | |
| 0.10μmのポリスチレンビーズ | Polysciences、(株) | 00876 | |
| アガロースGPG / LE | バイオ分析アメリカン | 00972 | 超高純度 |
| ファルコン14mlのポリスチレン丸底チューブ | BDバイオサイエンス | 352057 | 17 × 100 mmのスタイル、nonpyrogenic |
| サーモサイエンティフィックプレーンprecleaned顕微鏡スライド | エリーサイエンティフィック社 | 420 - 004T | 3"× 1"× 1ミリメートル |
| カバースリップ | VWR | 48366 205 | 18ミリメートル× 18 mmの第1 1 / 2 |
| KIMTECH科学キムワイプ | キンバリークラーク | 34155 | |
| BDファルコン100 × 15ミリメートルスタイルシャーレ | BDバイオサイエンス | 351029 | |
| テープブランク3/4W X 500L | TimeMed | T - 512 | |
| 液浸油 | ニコン | 、入力ND = 1.515 | |
| EG1285またはCZ1200 | C. elegansの遺伝センター | http://www.cbs.umn.edu/CGC/strains/ | |
| OptiScan II | PRIORサイエンティフィック | ||
| NIS - ElementsシリーズはArまたはBrの | ニコン | ||
| MicroPointアブレーションレーザーシステム | サイエンティフィックフォトニック | ||
| 化合物の顕微鏡 | ニコン | Eclipseの組み合わせ例 | |
| 浜松カメラ | 浜松ホトニクス | モデルC8484 - 05G01 | |
| インテルCore 2 Duoを搭載したDellのPrecision T3400はPC | デル | ||
| Windows XP Professionalの | マイクロソフト | バージョン2002、シリーズパック3 | |
| デュアルドライ風呂インキュベータ | フィッシャーサイエンティフィック | アナログコントロール | |
| 4Xプランフルーア客観 | ニコン | ||
| 100XプランアポVCの油浸対物 | ニコン | ||
| デュモン#45分の5鉗子 | デュモン | 11251〜35 | Dumoxel標準のヒントは、また、#7を使用することができます |
| 解剖顕微鏡 | ニコン | SMZ800 | NI - 150高輝度照明装置付き |
参考文献
- Hammarlund, M., Nix, P., Hauth, L., Jorgensen, E. M., Bastiani, M. Axon regeneration requires a conserved MAP kinase pathway. Science. 323, 802-806 (2009).
- Ghosh-Roy, A., Wu, Z., Goncharov, A., Jin, Y., Chisholm, A. D. Calcium and Cyclic AMP Promote Axonal Regeneration in Caenorhabditis elegans and Require DLK-1 Kinase. Journal of Neuroscience. 30, 3175-3183 (2010).
- Wu, Z. Caenorhabditis elegans neuronal regeneration is influenced by life stage, ephrin signaling, and synaptic branchi ng. Proceedings of the National Academy of Sciences. 104, 15132-15137 (2007).
- Yan, D., Wu, Z., Chisholm, A. D., Jin, Y. The DLK-1 Kinase Promotes mRNA Stability and Local Translation in C. elegans Synapses and Axon Regeneration. Cell. 138, 1005-1018 (2009).
- Yanik, M. F. Neurosurgery: Functional regeneration after laser axotomy. Nature. 432, 822-822 (2004).
- Gabel, C. V., Antoine, F., Chuang, C., Samuel, A. D. T., Chang, C. In vivo nanosecond laser axotomy: cavitation dynamics and vesicle transport. Optics Express. 16, 9884-9894 (2008).
- Rao, G. N., Kulkarni, S. S., Koushika, S. P., Rau, K. R. In vivo nanosecond laser axotomy: cavitation dynamics and vesicle transport. Optics Express. 16, 9884-9894 (2008).
- Wood, W. B. The Nematode Caenorhabditis Elegans. , Cold Spring Harbor Laboratory Press. (1988).
- McLntire, S. L., Jorgensen, E., Kaplan, J., Horvitz, H. R. The GABAergic nervous system of Caenorhabditis elegans. Nature. 364, 337-341 (1993).
- Bourgeois, F., Ben-Yakar, A. Femtosecond laser nanoaxotomy properties and their effect on axonal recovery in. C. elegans. Optics Express. 15, 8521-8531 (2007).
- Chung, S., Mazur, E. Femtosecond laser ablation of neurons in C. elegans for behavioral studies. Applied Physics A: Materials Science & Processing. 96, 335-341 (2009).
- Steinmeyer, J. D. Construction of a femtosecond laser microsurgery system. Nature Protocols. 5, 395-407 (2010).
- Wang, Z., Jin, Y. Genetic dissection of axon regeneration. Current Opinion in Neurobiology. , Forthcoming (2010).
- Huang, X., Cheng, H. -J., Tessier-Lavigne, M., Jin, Y. MAX-1, a Novel PH/MyTH4/FERM Domain Cytoplasmic Protein Implicated in Netrin-Mediated Axon Repulsion. Neuron. 34, 563-576 (2002).
- McIntire, S. L., Reimer, R. J., Schuske, K., Edwards, R. H., Jorgensen, E. M. Identification and characterization of the vesicular GABA transporter. Nature. 389, 870-876 (1997).
- Fang-Yen, C., Gabel, C. V., Samuel, A. D. T., Bargmann, C. I., Avery, L. Laser microsurgery in C. elegans in Methods in Cell Biology: Caenorhabditis elegans: Modern Biological Analysis of an Organism. , Elsevier Academic Press. Forthcoming Forthcoming.
- Guo, S. X. Femtosecond laser nanoaxotomy lab-on-a-chip for in vivo nerve regeneration studies. Nature Methods. 5, 531-533 (2008).
- Zeng, F., Rohde, C. B., Yanik, M. F. Sub-cellular precision on-chip small-animal immobilization, multi-photon imaging and femtosecond-laser manipulation. Lab on a Chip. 8, 653-656 (2008).
- Rohde, C. B., Zeng, F., Gonzalez-Rubio, R., Angel, M., Yanik, M. F., F, M. Microfluidic system for on-chip high-throughput whole-animal sorting and screening at subcellular resolution. Proceedings of the National Academy of Sciences. 104, 13891-13895 (2007).
- Hulme, S. E., Shevkoplyas, S. S., Apfeld, J., Fontana, W., Whitesides, G. M. A microfabricated array of clamps for immobilizing and imaging C. elegans. Lab on a Chip. 7, 1515-1523 (2007).
- Ben-Yakar, A., Chronis, N., Lu, H. Microfluidics for the analysis of behavior, nerve regeneration, and neural cell biology in C. elegans. Current Opinion in Neurobiology. 19, 561-567 (2009).
- Samara, C. Large-scale in vivo femtosecond laser neurosurgery screen reveals small-molecule enhancer of regeneration. Proceedings of the National Academy of Sciences. , (2010).
- Nelson, F. K., Riddle, D. L. Functional study of the Caenorhabditis elegans secretory-excretory system using laser microsurgery. Journal of Experimental Zoology. 231, 45-56 (1984).
- Sulston, J. E., White, J. G. Regulation and cell autonomy during postembryonic development of Caenorhabditis elegans. Developmental Biology. 78, 577-597 (1980).
- Kimble, J. Alterations in cell lineage following laser ablation of cells in the somatic gonad of Caenorhabditis elegans. Developmental Biology. 87, 286-300 (1981).
- Allen, P. B. Single-synapse ablation and long-term imaging in live C. elegans. Journal of Neuroscience Methods. 173, 20-26 (2008).
- Pujol, N. Distinct Innate Immune Responses to Infection and Wounding in the C. elegans Epidermis. Current biology. CB 18, 481-489 (2008).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved