Method Article
使用してMG53を介した細胞膜修復の可視化 in vivoでと in vitroでシステム
要約
動物全体でMG53を介した細胞膜修復のと細胞レベルで動的なプロセスを視覚化するために使用されるプロトコルは、ここで説明する。これらのメソッドは、細胞膜の再シール性と再生医療の細胞生物学を調査するために適用することができます。
要約
細胞膜への急性損傷の修復は正常な細胞生理の元素プロセスであり、欠陥のある細胞膜の修復は、多くの退行性のヒト疾患にリンクされています。膜の再シール機械の主要コンポーネントとしてMG53の最近の発見は、基本的な組織修復の生物学だけでなく、再生医療の潜在的なトランスレーショナルアプリケーションのためのよりよい分子的理解が可能になります。ここでは詳細モデルマウスにトレッドミル運動負荷プロトコールを用いて筋損傷の修復にMG53の生体機能に探索するため、隔離された筋肉の繊維に染料エントリを測定することにより、 生体外での膜修復の能力をテストするため、および動的なプロセスを監視するための実験プロトコルをMG53を介した小胞輸送および生細胞共焦点顕微鏡を用いて培養細胞の細胞膜の修復の。
プロトコル
1。マウスモデルで筋損傷の程度を明らかにするためのトレッドミル走
- 実行中のプロトコル中に使用するためにトレッドミルの表面の角度を確立する。一般的には、フラットレベルまたは7 °と15 °度の角度は、下り坂や上り坂が使用されます。他の人がトレッドミルは他の手段で上昇することが必要ですが、いくつかのトレッドミルは傾斜を調整するために不可欠な装置で持っている。
- 実行中のプロトコル中に動物からの廃棄物を収集するためにトレッドミルで動物を入れる前にトレッドミルの下にトレイまたは青のラボのパッドを配置。
- マウスを実行する前には、トレッドミルの環境に環境に順応させる必要があります。これは、オフ配電網とでベルトドライブのモーターがベルトが(つまり0 m / sの時に設定した速度で)動いていないとの15分間トレッドミルで動物を置くことが含まれます。
- 動機付けの電気グリッドをオンにします。使用されるパルスの強度と頻度は、通常、トレッドミルで制御が、1つのメーカーごとに異なりますすることができます。一般的に、最大強度は高い周波数が(少なくとも2秒ごとに一回)コンプライアンスを向上させられる実行するためにマウスをやる気にさせる必要はありません。
- 実行中のプロトコルを開始するためにトレッドミルベルトをアクティブにします。約5メートル/分の初期速度はマウスのためのウォームアップに使用する必要があります。トレッドミルの速度は、通常、トレッドミルの開始後、毎分1〜2メートル/分を追加することによって、徐々に加速することができる。
- ほとんどのプロトコルでの動物のコンプライアンスは、実験的な実行が始まる前に3〜10日のためのウォームアップ速度で短い一連の実行を(5分)行うことで改善することができます。
- マウスは疲労の兆候が現れるまで、運動は通常、最大速度(一般的には<30 M / M)になるまでの時間をトレッドミルの速度を増加させますれる急性疲労が達成され、維持されます。疲労を判定するための基準は変わるが、一般的にトレッドミルの表面に戻ることなく、電気、グリッド上の電気グリッドまたは5秒間の時間の半分以上を費やして、マウスなどがあります。個々のマウスが使い尽くされた後、それはトレッドミルから削除することができ、実行の合計時間を記録することができます。
- トレッドミルの角度の変更は、筋線維1の筋線維鞘の膜を引き裂くこと(下り坂角度付き)運動負荷を(上り坂の角度で)増加させる又は偏心収縮の損傷を誘導する急性実行中の臨床試験で使用することができます。エバンスブルー色素は、損傷した筋肉線維2,3を識別するために、組織学的染料として使用するためにそのような手順の前に動物に注入することができます。
- プロトコルを実行して持久力トレーニングは、筋肉や心臓血管系のリモデリングを生成するために長期間(最大カ月まで)にわたって動物に運動負荷を提供します。手続きがしかし(> 1時間)最大速度は、一般的に低くし、動作している時間が非常に長くなることがある(ステップ1.5)上記と同じであるウォームアップ。
- マウスの実行の完了後にケージに戻すことができます。マウスが動作している間トレッドミルは、通常、特に長いプロトコル上で、非常に汚れる。それは、それぞれの使用後、通常70%エタノールを噴霧して、トレッドミルをきれいにする必要があります。
UV -レーザー損傷後の絶縁型筋線維の膜修復能力の2 のex vivoアッセイ
- マウスの足から短趾屈筋(FDB)筋肉の浅層をばらばらにする。最初に、下に筋肉を傷つけないように注意しながら正中線で唯一のオープンの皮膚をカットし、水平方向のカットを行い、皮膚を取り除く。 FDB筋(近位腱)の平らな白い腱が踵骨に接続されて見ることができます。ぶっきらぼうに鉗子で腱を分離し、添付ファイルのサイトに腱の近くを切断し、鉗子で無料の腱を取得し、接続されて残っている結合組織を削減しながら周囲の組織からFDBを分離するためにゆっくりと引き上げます。個々の数字に遠位腱の分岐を確認した時点でFDBは、これらの腱は筋肉の深い層に接続する場所切断することによって削除される可能性があります。
- コラゲナーゼソリューション37の水平方向の1.5mlのエッペンドルフチューブにあらかじめ温めておいた37℃、テープチューブ° Cオービタルシェーカー1ml中のFDB筋束を入れ、65分間200rpmで振とうする。インキュベーションの時間は擦り切れ外観と筋肉の薄い色で示され、十分な消化を確保するために調整する必要があります。
- 消化バンドルが容易に中断することなく通過させるのに十分な直径を持つの切り口と1ミリリットルのピペットチップを経由して2.5のCa 2 +タイロードの〜600μlを含む1.5μlの遠心管に消化されたFDBのバンドルを慎重に移す。静かにバンドルから緩い繊維を振るチューブを反転させる。
- 30μLピペットの先端をカットしているので、Dピペットへのバンドルを描画し、溶液中にそれをプッシュバックするピペッターを使用して - (直径20μmの15の間)iameterは筋束よりほんの少し小さいだけです。。繊維の大半は、バンドルの関連付けが解除されるまで、このプロセスを繰り返します。
- 軽くチューブを回しても関連付けが解除繊維を混ぜ、グラスボトムデルタT皿に所望の量とドロップしてください。ロードするボリュームは、分離の効率性および特定のプロトコルのための皿の上に必要とされる有用な繊維の数によって異なります。残りの繊維は、° C、追加研究のために約6時間4℃でチューブに保存することができます。
- 5分間静座って皿を許可する。これは、繊維が皿のガラスの底に付着することができます。
- UVレーザーを搭載した共焦点顕微鏡でガラス底皿を置きます。通常のストライエーションパターンと形状のようなストレート、ロッドの存在を確認する> 100Xの倍率で位相差顕微鏡下で繊維を観察。
- FM1 - 43またはFM4 - 64 styrylpyridinium染料2.5μM5の最終濃度までのソリューションへの追加4。
- 繊維は右下のビューのフィールド(図1)の左上から45 °の角度で配向しているので、繊維の位置に画像ウィンドウでの損傷を誘発する。 5秒間の最大電力に設定するUVレーザー(80 mWの以上、364分の351 nm)を用いて原形質膜の5 × 5画素の領域(約0.9μmx0.9μm)を照射する。照射領域は、細胞膜を分割する必要があります、つまり、残りは繊維(図1)の外側に見られるようになったが5x5のボックスの半分は、繊維の内部でなければなりません。
- 最大5分間5秒ごとの間隔で繊維に染料エントリの画像をキャプチャ。
- 蛍光色素が最終的に繊維にエンドサイトーシスおよび任意のデータ分析を複雑にされるように、皿あたり3つ以下の繊維について、手順2.8を繰り返します。 3繊維の後に新しい料理は、ステップ2.5から準備する必要があります。
- 染料エントリの量を測定するためにキャプチャされた各フレームの間に蛍光強度の変化(ΔF/ F 0)を計算することにより、データを分析する。これは、パブリックに利用可能なImageJの(http://rsbweb.nih.gov/ij/)などの解析ソフトウェアを使用して2約200μmの領域の平均蛍光を測定する必要があります。 、、とΔFはΔF/ F 0、F 0は最初のキャプチャされたフレーム(怪我の前に時刻t = 0)における関心領域の平均蛍光である:繊維間の比較については、以下の計算は、各フレームのためになされるべきである後続の各フレームの蛍光変化(FF 0)。
3。細胞膜の修復の動的なプロセスを監視するためにセルの共焦点イメージングを生きる
- マイクロピペットは、パイレックスの毛細血管から作られた。キャピラリーはマイクロピペットプラー上に配置し、あらかじめ設定したプログラム(ヒート= 695、= 50を引いて、ヴェル.= 55、時間= 250)で引っ張られた。
- マイクロピペットは、3軸(XYZ)マニピュレーターに装着した。
- 細胞をガラス底のデルタTの皿に、通常の方法を用いてプラスミドDNAをトランスフェクトされています。実験が始まる+タイロードバッファの前にメディアが2.5mmののCa 2に切り替えてください。
- トランスフェクションした細胞を含むガラスの皿は、40X 1.3NA油浸対物レンズと共焦点顕微鏡を走査型レーザーに配置されました。
- 急性生細胞損傷は、細胞膜にマイクロピペットを挿入することによって行い、その後速やかに細胞3,6の外マイクロピペットを撤回した。連続したライブセルイメージは、1.54秒/フレームの間隔で得られた。
- のCa 2 2.5mmの内のサポニン誘導膜破壊アッセイの場合、0.005%サポニン(Sigma社)+タイロード緩衝液は、重力流のカスタム組立て灌流システム7で灌流した。灌流速度は約1ml /分と灌流の先端が直接撮像されるセルの上に置かれるべきです。
4。代表的な結果:
マウスのトレッドミルのランニングの代表的なムービーが撮影中に行うことができます。骨格筋の損傷に起因するマウス-映画はmg53 - /の削減実行能力を説明します。
上記の詳細UV -レーザー損傷のプロトコルによって引き起こされる被害の程度は、分析した繊維の膜修復の能力に依存します。この能力は、繊維が分離されたマウスの遺伝子型、細胞外の条件、およびタンパク質発現(トランスフェクションまたは感染症)への任意の変更によって影響を受けます。通常の野生型のファイバーは、染料のエントリ(図2a)中程度のわずかなことができます。 mg53 - /から派生した筋線維-危険にさらさ膜の修復能を持つマウスは、光ファイバ(図2b)に染料の多くの重要なエントリが表示されます。
MG53含有vesiの微小電極の損傷のショーの転座のための典型的な結果損傷部位にクル。図3aおよび3bショーGFP - MG53は、細胞膜へのマイクロピペットを挿入することにより損傷したC2C12筋管をトランスフェクション。マイクロピペットの損傷の前に細胞に、GFP - MG53は、細胞膜と細胞質3の両方に位置しています。マイクロピペットの浸透に続いて、GFP - MG53を含む小胞が損傷部位(のような矢印で示される)に向かって移動。図3cは、GFP - MG53サポニンの0.005%、形質膜を透過性ができる洗剤で治療されたトランスフェクションしたC2C12筋芽細胞を示しています。サポニン処理時に、GFP - MG53は、細胞質から細胞膜へ移行。
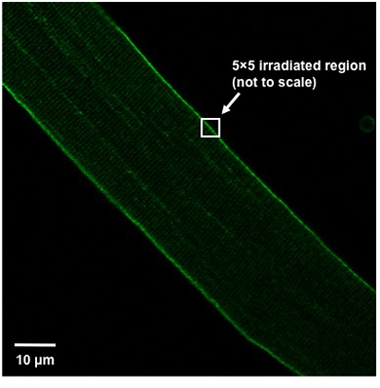
Weisleder、ら。図1。ファイバーアライメントと傷害の領域定義。ビューと示されて負傷領域の定義のフィールド内で孤立筋線維の適切な方向。
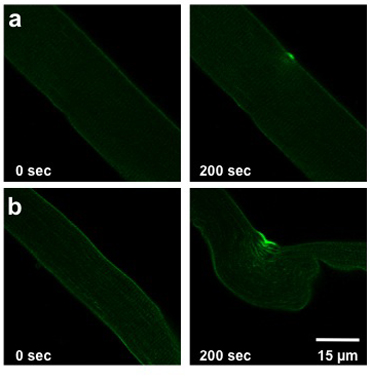
Weisleder、ら。図2。 FDBの繊維。画像の紫外レーザー損傷は前の傷害(0秒、左)へと200秒の損傷後(右)で繊維を示す。野生型マウス()からの繊維は、軽傷を示しています。侵害膜修復を有するマウスからの繊維は、(b)に入力することより色素ができます。
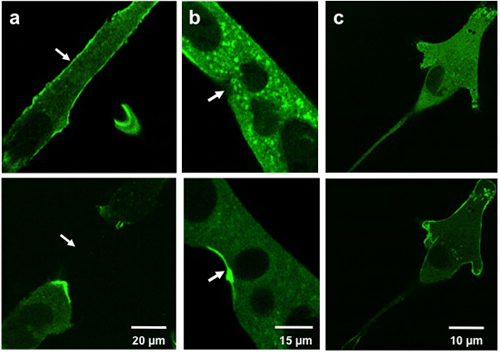
Weisleder、ら。図3。培養細胞に微小電極とサポニンダメージ。画像は、C2C12筋管(A、B)と傷害(上記)と損傷後(下)への事前のC2C12筋芽細胞を(C)を示す。微小電極(A、B)で負傷した細胞が傷害部位(矢印)にMG53転座を示す。サポニン(C)で処理した細胞は、細胞膜にMG53転座を示す。
ディスカッション
トレッドミルのランニングは、投与動物に運動負荷を提供することで有用な手法です。筋肉の機能や持久力を測定するための方法論としては、一貫して再現可能な方法8で実行することが困難であることで有 名騒々しいアプローチです。一般的に、枯渇度はこのようないくつかのノックアウトマウスの線と9は、野生型マウスとの間のそれらのような実験群の主な相違点を、解決するためにエンドポイントとして使用することができます。このようないくつかの医薬品試験など、より微妙な違いを、作り出す実験操作は、この手法に関連したノイズ上記の相違点が解決されない場合があります。これらの技術の再現性と感度を最大にするために、それは非常に密接にセッションにセッションの状態を維持することが重要です。動物は、行使だけでなく、ウォームアップ期間の条件が使用されている時刻は、重要な要因であると裁判から裁判に一貫性を保つ必要があります。
マウスの特定の菌株は、他の株よりもトレッドミル上ではるかに多くの時間を実行し、持久運動を10に異なる対応できるようにひずみの影響はトレッドミルのプロトコルの設計に大きな影響を与えることがあります。一般的なガイドラインとして、多くのマウスは、トレッドミルの速度で一定の増加(1 M / M、5 M / Mの初期速度は、開始後の各分追加)と疲労の研究では200から300合計メートルを実行できるようになります。持久力運動のためにマウスが30分2〜3回週に9〜12メートル/ mの間に実行される可能性があります。しかし、個々の研究は、通常、個々の実験的なニーズに合わせて、プロトコルのいくつか最適化が必要になります。
UV -レーザー損傷の手順は、骨格筋線維3,6,11の膜修復の能力を測定するための効果的な方法であることが示されている。これらの実験の成功への一つの重要なコンポーネントは、縞の規則的なパターンとしわに表示されないスムーズな筋鞘付きストレート、ロッド状の外観を表示する唯一の筋線維を使用することです。他の筋線維が選択されている場合、膜の損傷は、すでにこれらの実験結果からのこれらの繊維との解釈で存在してもよい複雑されることがあります。それは、照射領域の繊維と定義の向きは、図1で定義されていることも重要です。これは、このように繊維間の比較を可能にする、再現性の大きさの傷害を提供します。傷害の定義された領域は、繊維内に完全にある場合、内部の損傷はむしろ筋鞘を中断するよりも作成されます。また、ΔF/ F 0のため計算値は、平均蛍光の測定のために選択対象の領域に非常に敏感です。損傷部位を含む隣接した約200μmの2の面積、およびは、適切です。怪我のために定義されている地域とは異なり、この領域では繊維内に完全になるように置いてください。あなたが繊維の外側にスペースを含める場合、より重篤な表現型をもつ繊維でΔF/ F 0を削減しながら、結果の空白の領域が少ない染料エントリを持つ繊維でΔF/ F 0が増加します。これは、このように繊維間の比較をより困難に、アッセイの感度を減少させる。
マイクロピペットのダメージのアッセイのために、マイクロピペットやガラス底皿との間の角度は、効果的に細胞膜を損傷するために約45度にする必要があります。細胞がしっかりと皿の底に添付する必要があり、丸い細胞が、彼らはマイクロピペットを突っつい後にデタッチされる可能性が最も高いので、使用すべきではないマイクロピペットの損傷のために選ばれた。サポニンpermeabilzation実験では浸透アッセイをマイクロピペットに比べて実行するために以下の技術的要求と相対的に速くなります。しかし、サポニンはその皿の中で他のセルを拡散し、損傷することがあるので1つのセルのみを皿ごとに使用できることを含むサポニン損傷にはいくつかの制限が、あります。
開示事項
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | |
|---|---|---|---|
| げっ歯類のトレッドミル | コロンブスインスツルメンツExer 3月6日または同等の | ||
| 70%エタノール | ISC Bioexpress | ||
| 先端の細いピンセットを含む解剖ツール、春のはさみ | 世界の精密機器 | ||
| 2 mg / mlのコラゲナーゼタイプI | シグマ | ||
| 0のCa 2 +タイロード緩衝液(140mMのNaCl、5mMのKCl、10mMのHEPES、2mMのMgCl 2、pH 7.2の、290 mosm) | シグマ | ||
| 2.5mmのCa 2 +のタイロード緩衝液(140mMのNaCl、2.5mMのCaCl 2を 、5 mMの塩化カリウム、10mMのHEPES、2mMのMgCl 2、pH 7.2の、290 mosm) | シグマ | ||
| 温度制御可能オービタルシェーカー | ニューブランズウィック州または同等の | ||
| デルタTPGディッシュ | フィッシャーサイエンティフィック | 1207133 | |
| エンタープライズは80 mWのUVレーザーまたは同等の共焦点顕微鏡とLSM 510共焦点顕微鏡 | ツァイス | ||
| FM1 - 43またはFM4 - 64色素 | インビトロジェン | ||
| ホウケイ酸キャピラリーサイズ0.8〜1.0 x 100 mmの | パイレックス | 部品番号9530から2 | |
| マイクロピペットプラー | サターインスツルメンツ | モデルP - 97 | |
| 3軸マニピュレーター | ナリシゲ | MHW - 3 | |
| ラディアンス2100レーザー走査型共焦点顕微鏡または同等の顕微鏡 | BioRad社 | MHW - 3 | |
| サポニン | シグマ | 47036 |
参考文献
- Armstrong, R. B., Ogilvie, R. W., Schwane, J. A. Eccentric exercise-induced injury to rat skeletal muscle. J Appl Physiol. 54, 80-93 (1983).
- Hamer, P. W., McGeachie, J. M., Davies, M. J., Grounds, M. D. Evans Blue Dye as an in vivo marker of myofibre damage: optimising parameters for detecting initial myofibre membrane permeability. J Anat. 200, 69-79 (2002).
- Cai, C. MG53 nucleates assembly of cell membrane repair machinery. Nat Cell Biol. 11, 56-64 (2009).
- Cochilla, A. J., Angleson, J. K., Betz, W. J. Monitoring secretory membrane with FM1-43 fluorescence. Annu Rev Neurosci. 22, 1-10 (1999).
- McNeil, P. L., Miyake, K., Vogel, S. S. The endomembrane requirement for cell surface repair. Proc Natl Acad Sci U S A. 100, 4592-4597 (2003).
- Cai, C. Membrane repair defects in muscular dystrophy are linked to altered interaction between MG53, caveolin-3, and dysferlin. J Biol Chem. 284, 15894-15902 (2009).
- Wang, X. Cardioprotection of ischemia/reperfusion injury by cholesterol-dependent MG53-mediated membrane repair. Circ Res. 107, 76-83 (2010).
- Knab, A. M. Repeatability of exercise behaviors in mice. Physiol Behav. 98, 433-440 (2009).
- Zhao, X. Enhanced resistance to fatigue and altered calcium handling properties of sarcalumenin knockout mice. Physiol Genomics. 23, 72-78 (2005).
- Massett, M. P., Berk, B. C. Strain-dependent differences in responses to exercise training in inbred and hybrid mice. Am J Physiol Regul Integr Comp Physiol. 288, 1006-1013 (2005).
- Bansal, D. Defective membrane repair in dysferlin-deficient muscular dystrophy. Nature. 423, 168-172 (2003).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved