Method Article
siRNAを介した遺伝子サイレンシングと組み合わせることで生細胞のカルシウムイメージングでは、CAを識別 2 + ER膜のリークチャネルとその調節機序
要約
小胞体は、タンパク質の生合成とカルシウムの恒常性において重要な役割を果たしている。私たちは、私たちはCa2 +のリークチャネルの役割に対処し、それらの推定調節機構を特徴づけることを可能にする実験系を確立しています。このシステムは、siRNAを介した遺伝子サイレンシングと生細胞のCa2 +イメージングを行います。
要約
哺乳類細胞では、小胞体(ER)が1シグナリング、カルシウムだけでなくタンパク質の生合成において重要な役割を果たしている。 ER膜のヘテロSec61複合体はERの内腔への新規合成ペプチドの水性パスを提供します。様々な研究室から最近の研究では、このヘテロ複合体はまた、一過性のCa 2 +リークチャネル2-8を形成する可能性が示唆された。この概念のための重要な観察 は、ピューロマイシンは、+ ERからのCa 2の一時的な放出につながることによってリボソームとSec61複合体からの新生ポリペプチドのそのリリースでした。さらに、ER内腔タンパク質BIPがSec61複雑な9,10のレベルでのイオン透過性を防止するために関与していることがin vitroで観察されていた。私達は私達が直接潜在的なのCa 2 +リークチャネルとしてSec61複合体の役割に対処するため、その推定調節機構は11月13日特徴付けることができる実験系を確立しています。このシステムは、siRNAを介した遺伝子サイレンシングと生細胞のCa 2 +イメージング13を組み合わせたもの。細胞はSEC61A1遺伝子またはネガティブコントロールsiRNAを、それぞれ、符号化及び非翻訳領域(UTR)に対して向けられるのsiRNAで処理されています。相補性解析では、細胞は野生型SEC61A1遺伝子のsiRNAによる耐性発現を可能にするIRES - GFPベクターで同時トランスフェクトされています。その後、細胞は細胞質ゾルのCa 2同時に変更+蛍光顕微鏡を介して細胞数の濃度を監視するメトリックのCa 2 +インジケーターフラ-2を使用してロードされます。細胞質ゾルのCa 2の連続的な測定は、+また、ピューロマイシン、小分子阻害剤、およびCa 2タプシガルギン+漏れなど様々な薬剤の影響を評価することができます。この実験系では、この受動的なのCa 2 +流出を制限するタンパク質とメカニズムを特徴づける様々な細胞型、IIのERからパッシブのCa 2 +流出の異なる小胞体膜タンパク質の寄与)を評価する)私に私たちのユニークな機会を与え、 ⅲ)関連するコンポーネントの病気リンクされている変異の影響を検討する。
プロトコル
1。ストック溶液の調製
- カルシウムを含まない緩衝液(140mMのNaCl、5mMのKClを、1mMのMgCl 2、0.5mMのEGTA、10mMのHEPES - KOH、10 mMグルコース、液(pH 7.35))を用意。
- フラ-2可溶化は、1 mMのストック溶液を得るためにDMSOにいます。解決策は、均一光の黄色になるまでボルテックスを用いて混ぜる。光からカップを守る。フラ-2は、HeLa細胞からロードするための4μMの最終濃度に10%ウシ胎児血清(FBS)および1%ペニシリン/ストレプトマイシンを含有する、1mlのダルベッコ変法イーグル培地(DMEM)に原液午前希釈する。
- 蒸留水(pH 7.0)で12.5 mMのピューロマイシンのストック溶液を調製。 -20℃で保存のアリコート500μMのピューロマイシンの最終濃度にカルシウムを含まない緩衝液で12.5 mMのピューロマイシンのストック溶液を希釈する。
- 1 mMのストック溶液を得るためにDMSOでタプシガルギンを溶かす。
- 20μlのクロロホルムで1 mg ophiobolinを可溶化し、その後、25μlのDMSOを混ぜる。クロロホルムが蒸発するまで、マイクロ遠心チューブは開いたまま。したがって、最終的なophiobolinの濃度は100 mMのです。 -20℃で保存のアリコート使用前に、最終濃度100μMにカルシウムを含まない緩衝液にストック溶液を希釈する。このように、生細胞イメージングのための最終DMSO濃度は0.1%を超えていない。
- -20℃で10mMのと店舗のアリコートの濃度にDMSOでトリフルオペラジンを溶かす使用前に10μMの最終濃度にカルシウムを含まない緩衝液にストック溶液を希釈する。したがって、生細胞イメージングのための最終DMSO濃度は、ophiobolin A用と同様に、0.1%を超えることはない。
- 20μMストック溶液を調製するためにRNaseフリー水でsiRNA(SEC61A1 siRNAは、SEC61A1 - UTRのsiRNAおよびコントロールsiRNAを)溶かす。ボルテックスを用いて混合し、目で可溶化を観察。 -20℃で保存50μlのアリコート
2。 HeLa細胞での遺伝子サイレンシング
ERのCa 2 +流出の特定のタンパク質の寄与を調べるために、それぞれの遺伝子を効率的に二つの異なる種類のsiRNA(図1)で沈黙する必要があります。さらに、サイレンシングの効果は、それぞれの野生型遺伝子の発現によって克服されなければならない。一般的に我々は、目的の遺伝子のそれぞれのコーディングおよび非コーディング(UTR)地域、、に対して向けられるsiRNAを使用してください。 UTR -指示siRNAを採用することで補完するための便利な方法を提供します。
- 25 mmのカバースリップ(1時間ポリ- L -リジン(1 mg / ml)を200μlで前処理した)6 cmの培養皿でシード5.2 × 10 5 HeLa細胞(ATCCない。CCL - 2) 10%ウシ胎児血清(FBS)と1%で、37ペニシリン/ストレプトマイシンとインキュベート℃、5%CO 2(最終容量3.9ミリリットル)の加湿環境でCを含むダルベッコ改変イーグル培地(DMEM)インチ
- SEC61A1 siRNAは、SEC61A1 - UTRのsiRNA、または製造業者の指示(20 nMのsiRNAの最終濃度)に応じてHiPerFect Reagentのを使用して、ネガティブコントロールsiRNAを細胞にトランスフェクション。簡単に言えば、前に実際のトランスフェクションの手順に別個のマイクロ遠心チューブに新鮮なsiRNAを準備:OPTIMEMの80μlに溶解している各siRNAのを4μl(20μM)に20μlのHiPerFectトランスフェクション試薬を追加する。この混合物を穏やかにボルテックスし、10分間室温でインキュベートする。シード5.2 × 10 5 HeLa細胞(3.9 mL)に滴下したsiRNAミックスを(104μl)を添加。
- 24時間後、培地を変更(3.9 ml)と同じsiRNAのミックス(104μL)で2回目のために細胞をトランスフェクト。
- ウェスタンブロット分析によってサイレンシングを評価する。それが80%以上でなければなりません。リン酸緩衝生理食塩水(PBS)とDMEMでそれらを収穫中の細胞培養皿から細胞を洗浄。伯爵自動セルカウンターを採用することにより細胞を数える。プロテアーゼ阻害剤カクテル(3μg/ mlのペプスタチン、3μgの/を補充細胞溶解緩衝液(10mMのNaCl、10mMトリス- HCl、pH8.0の、3 mMのMgCl 2、0.5%NP40)で細胞を溶解ロイペプチン、3μg/ mlのアンチパイン、3μg/ mlのChymastatin)とSDS -サンプルバッファーと混合(60mMのトリス- HCl、pH6.8で、2%SDS、10%グリセロール、5%β-メルカプトエタノール、0.01%ブロモフェノールブルー)10.000細胞/μlの最終濃度を得るために。熱サンプルを56℃15分間と、その後、断片のDNAへの20分間、いくつかのグラスビーズとボルテックスを追加するためのC。レムリ型SDS - PAGE(通常は分離ゲル用アクリルアミド15%)により、各サンプルの別の20μlを。転写バッファーで3時間または一晩(100mMのグリシン、12.5 mMトリス- HCl)のために一定の400mAで("ウェットブロット")エレクトロブロッティングによりPVDF膜上に分離したタンパク質を転送する。その後、その後、室温で30分間PBSで5%(w / v)の低脂肪粉乳とブロックとは、ウサギと抗β-アクチンからSec61αのC末端に対して向けられた一次抗体にブロットを公開マウスから抗体。 PBS - TritonX - 100(0.05%)とtでブロットを洗浄してくださいそれぞれ、5分間PBSでwice。 ECL Plexのヤギ抗ウサギIgG - Cy5標識またはECL Plexのヤギ抗マウスIgG - Cy3で共役とイメージクワントTLソフトウェア7.0との組み合わせで台風、トリオのイメージングシステムを用いて一次抗体を可視化する。 SEC61A1遺伝子の場合には、最大のサイレンシングの効果は、通常、最初のトランスフェクション後96時間を見られている。代表的な実験は、 図に示されています。 2。
3。 HeLa細胞の相補性
SEC61A1サイレンシングの表現型を救出するためには、SEC61A1 cDNAををpcDNA3 -内部リボソーム侵入部位のマルチクローニングサイト(MCS)(IRES)- GFP -ベクトルサイトメガロウイルス(CMV)プロモーター、MCSを、含まれて挿入されたIRES、加えて緑fluoresecentタンパク質(GFP)をコードする配列。
- 第一のsiRNAトランスフェクション後48時間、両 替二度目のための培地(3.9 ml)及び製造業者のプロトコール(トランスフェHDへのベクトルの最終的な比率である4μgのに応じてトランスフェHDを使用して空ベクターまたはプラスミドSEC61A1式のいずれかで細胞を形質転換16μlのトランスフェHDへのベクトル)。簡単に言えば、前の変換手順に別個のマイクロ遠心チューブに新鮮なプラスミドを準備する:OPTIMEMの80μlに溶解している各プラスミド4μgのために、16μlのトランスフェHD変換の試薬を追加する。 10分間室温で穏やかにボルテックスこのミックスとインキュベート。シード5.2への滴下プラスミド混合(0.1ml)を× 10 5 HeLa細胞を(3.9 ml)を追加。
- 発現プラスミド、カルシウムイメージングと収穫前に蛍光顕微鏡法の対象と培養皿の48時間後。必要に応じて、より良い蛍光シグナルのためにPBSでDMEMに交換してください。冷却CCDカメラを装備した蛍光顕微鏡で蛍光画像を記録します。形質転換効率は明視野モードでカウントし、80%以上でなければならないの細胞でGFP蛍光を提示する細胞の数で割ることにより決定することができます。典型的な結果をFig。 3。
4。生細胞のカルシウムイメージング
- 測定前に、別々の3.5センチメートルの培養皿でトランスフェクトしたHeLa細胞でコーティングしたカバースリップを転送する。フラ-2は、25℃暗黒11,12のCで45分間1ミリリットルDMEMで午前4μMで細胞をロードします。
- IMIC金属チャンバーに25mmのカバーガラスを固定し、細胞を2回洗浄し、カルシウムを含まない緩衝液(各時間を300μl)でインキュベートする。
- 交互に340nmおよび380nmで励起および510nm(:;エミッタ、70分の605 nmのビームスプリッター、565 nmのフィルターセット)で放出される蛍光を測定することにより、多色VとIMIC顕微鏡に関するデータの収集を開始。毎3秒20から50まで細胞/フレームが含まれているサンプル画像F340とF380のに対応する比率F340/F380として記録フラ-2信号、それぞれ、340および380nmで蛍光強度をバックグラウンドには、減算。
- 1分後に、カルシウムを含まない緩衝液で同じバッファを持つピューロマイシンで細胞を(500μM)と同様に取り扱う。また、小分子阻害剤(例えば、10μMのトリフルオペラジンまたは100μMophibolin Aなど)、またはカルシウムを含まない緩衝液で細胞を扱う。
- レシオメトリック測定の後、2または10分間行い(1μM)タプシガルギンを追加して、測定を継続しています。
- 最終的には、cytoslicの[Ca 2 +]確立されたキャリブレーション法により比の測定から推定される。2は、Excel 2007と起源6.1でデータを分析。
5。代表的な結果:
これまでのところ、我々はSEC61A1遺伝子のサイレンシングはカルシウムに影響を及ぼすかどうかの質問(Ca 2 +)のER(図1)からの漏れを取り上げた。 SEC61A1遺伝子は 96時間HeLa細胞の2つの異なるsiRNAによるサイレンシングをした。ほとんど影響されない細胞増殖と生存率を黙らせる一方で、半透過性細胞のERへのタンパク質輸送はほぼ完全に阻害された。さらに、SEC61A1沈黙細胞が著しくERからのCa 2 +漏れを基準にして影響を受けました。遺伝子サイレンシングの効果はSEC61A1遺伝子の発現によって逆転した。したがって、すべての有核細胞の小胞体膜に存在するSec61複合体は、Ca 2 +ホメオスタシスの重要な役割を果たすことが期待できるのCa 2 +リークチャネルを形成する。しかし、ER膜のSec61複合体によって形成された制御されていないイオンの透過性を持つ大規模な、水で満たされた孔の存在は、真剣+ ERの内腔からサ イトゾルへのCa 2の規制解除を妨げる、細胞内の重要な仕組みとシグナリング。我々は、バインドされたCaMのではなく、ナノモル親和性および配列特異性を持つのCa 2 + -フリーapocalmodulinいる哺乳類Sec61αの細胞質のN末端 におけるカルモジュリン(CaM)結合モチーフを同定した。細胞レベルで、二つの異なるカルモジュリン拮抗薬は、Caを刺激(4と5の図 )の非存在下でERから> 2 +放出。 Sec61チャネルがSec61αのIQモチーフに変異を含んでいることが存在していたときに、後者は観察されなかった。従って、 のCa 2 + -カルモジュリンはカルシウムを制限+ ER( 図6)からの漏れをに関与している。
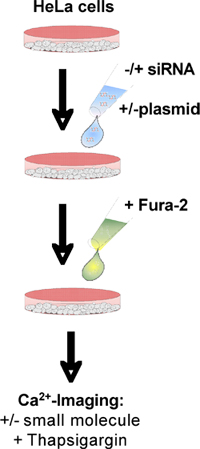
図1。フローチャート。詳細は本文を参照してください。
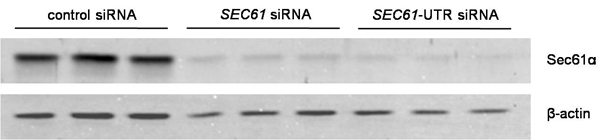
図2効率を黙らせるためのデータ分析。サイレンシングはSec61αとβ-アクチン(ローディングコントロール)に対して向けられた抗体を用いたウェスタンブロット分析により評価した。一次抗体は、ECL Plexの二次抗体と蛍光イメージングを用いて可視化した。
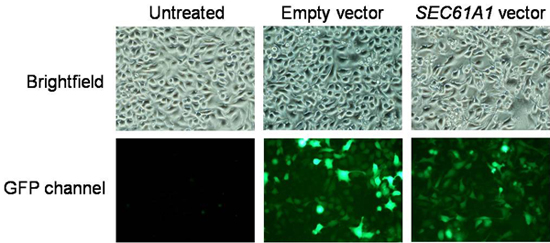
図3。トランスフェクション効率のためのデータ分析。画像は、冷却CCDカメラを装備した蛍光顕微鏡で記録した。形質転換効率は明視野モードで計数した細胞でGFP蛍光を提示する細胞の数で割ることにより決定することができます。

コントロールまたはSEC61A1 - siRNAとCaMと拮抗ophiobolin A. HeLa細胞の有無の存在下でHeLa細胞の生細胞のカルシウムイメージングから図4。スクリーンショットはSEC61A1(B)またはに対するsiRNAで処理した示されるように96時間ネガティブコントロールsiRNA()。これらの細胞はカルシウムインジケータフラ-2 AMをロードし、0.5mMのEGTAを含むCa 2 +の遊離緩衝液中でインキュベートし、その後、バッファ内のバッファまたはophiobolin Aは(Ophio)を添加し、インキュベーションが再開された。 10分後、Ca 2 +放出は、外部のCa 2 +の非存在下でタプシガルギン(TG)を適用することによって開始された+とインキュベーションを続けた。連続的なカルシウムイメージングからスクリーンショットは、指示された時間で撮影されました。
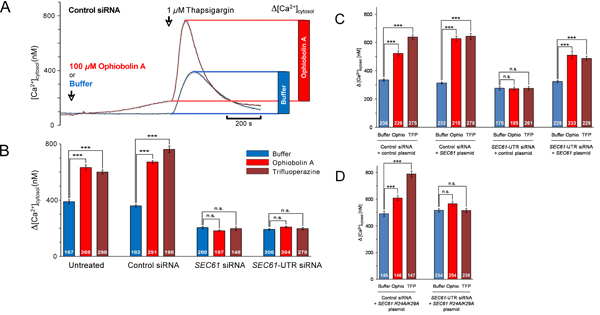
図5。生細胞のカルシウムイメージング実験のデータ解析。 図に示す一連の実験の(A)速度論と定量分析。 4A。 Cytoslicの[Ca 2 +]確立された校正方法2で比の測定から推定された。タプシガルギンの効果は、棒線図として示されています。 (BD)に細胞を48時間コントロールsiRNAまたはSEC61A1 - siRNAの指示で処理し、コントロールベクター(C)、またはプラスミドSEC61A1式(C)、または示されたプラスミド変異SEC61A1式(D)のどちらかで形質転換した。 48時間後、カルシウムイメージング実験は4と5Aを図のように実施された。細胞質ゾルのCa 2の変化の統計的分析+など示されているに示したような実験でタプシガルギン添加後の濃度。 P値が<0.001は、対応のないt検定で有意差ありと定義され、3つのアスタリスク(***), NS、有意ではないで示されます。分析された細胞の数が示されている。平均値が与えられる、エラーバーは平均(SEM)の標準誤差を表しています。我々はこれらの例は、refから適応されたことに注意してください。 13。
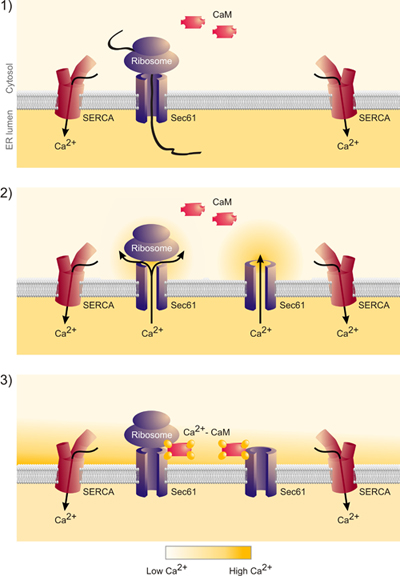
図6。これらのデータは、Sec61複合体から発生期のチェーンのリリースでは、確かにカルシウムの小胞体からの放出とSec61複合体の細胞質ゾルの口の周りにカルシウムのナノドメインの形成につながることを示している。このカルシウムはカルモジュリンとカルシウム - カルモジュリンによってバインドされていますSec61複合体を閉じます。"
ディスカッション
哺乳類細胞では、小胞体(ER)は、カルシウムシグナル伝達だけでなく、タンパク質生合成において重要な役割を果たしている。ここで、我々は、私たちは直接つの潜在的なのCa 2 +リークチャネルの役割に対処するため、その推定調節機構13を特徴付けることができる実験系を記載している。この実験系では、この受動的なのCa 2 +流出を制限するタンパク質とメカニズムを特徴づける様々な細胞型、IIのERからパッシブのCa 2 +流出の異なる小胞体膜タンパク質の寄与)を評価する)私に私たちのユニークな機会を与え、 ⅲ)関連するコンポーネントの病気リンクされている変異の影響を検討する。
我々は唯一の生存細胞を分析する必要があるとその全体的な生存率が80%以上でなければならないことに注意してください。したがって、細胞の生存率は、日常的に製造業者のプロトコールに従って核- ID緑/青の細胞の生存率の試薬を用いて評価されます。さらに、細胞質ゾルのCa 2の変化の統計的分析は、+濃度は必須です。したがって、実験では細胞の4つの別のバッチのために実施されなければならないし、少なくとも20細胞を二つカバースリップは、一回の実験の条件ごとに分析する必要があります。我々は、様々な実験はカバースリップ上で播種後、同時に実行しなければならないことに注意してください。
開示事項
謝辞
SLは、DFG(大学院研究科845)から奨学金によって支えられている。この作品は、DFG(SFB 530/C1&967用)からの補助金によってとHOMFORによってサポートされていました。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | |
|---|---|---|---|
| DMEM +グルタミン | インビトロジェン | 31966 | |
| OPTIMEM +グルタミン | インビトロジェン | 51985 | |
| FBS | Biochrom | S0115 | |
| ペニシリン/ストレプトマイシン | PAA | P11 - 010 | |
| HiPerFect | キアゲン | 301707 | |
| トランスフェHD | ロシュダイアグノスティックス | 04709713 | |
| 核- IDブルー/グリーンの細胞生存率の試薬 | エンツォ生命科学 | ENZ - 53004 | |
| フラ-2 AM | インビトロジェン | F - 1221 | |
| ピューロマイシン | シグマ | P 7255 | |
| タプシガルギン | インビトロジェン | T - 7459 | |
| Ophiobolin | エンツォ生命科学 | ALX - 270〜109 | |
| トリフルオペラジン | シグマ | T 6062 | |
| Countess ®自動化セルカウンター | インビトロジェン | ||
| 台風-トリオイメージングシステム | GEヘルスケア | ||
| DS - 5McカメラとTE2000 - S顕微鏡 | ニコン | ||
| 多色VとIMIC顕微鏡 | フォトニクスまで |
参考文献
- Clapham, D. E. Calcium signalling. Cell. 131, 1047-1058 (2007).
- Lomax, R. B., Camello, C., Van Coppenolle, F., Petersen, O. H., Tepikin, A. V. Basal and physiological Ca2+ leak from the endoplasmic reticulum of pancreatic acinar cells. J. Biol. Chem. 277, 26479-26485 (2002).
- Van Coppenolle, F. Ribosome-translocon complex mediates calcium leakage from endoplasmic reticulum stores. J. Cell Sci. 117, 4135-4142 (2004).
- Flourakis, M. Passive calcium leak via translocon is a first step for iPLA2-pathway regulated store operated channel activation. FASEB J. 20, 1215-1217 (2006).
- Giunti, R., Gamberucci, A., Fulceri, R., Banhegyi, G. Both translocon and a cation channel are involved in the passive Ca2+ leak from the endoplasmic reticulum: a mechanistic study on rat liver microsomes. Arch. Biochem. Biophys. 462, 115-121 (2007).
- Ong, H. L., Liu, X., Sharma, A., Hegde, R. S., Ambudkar, I. S. Intracellular Ca2+ release via the ER translocon activates store operated calcium entry. Pflugers Arch. Eur. J. Physiol. 453, 797-808 (2007).
- Amer, M. S. Translocon closure to Ca2+ leak in proliferating vascular smooth muscle cells. Am. J. Physiol. Heart Circ. Physiol. 296, 910-916 (2009).
- Tu, H. Presenilins form ER Ca2+ leak channels, a function disrupted by familial Alzheimer's disease-linked mutations. Cell. 126, 981-993 (2006).
- Hamman, B. D., Hendershot, L. M., Johnson, A. E. BiP maintains the permeability barrier of the ER membrane by sealing the lumenal end of the translocon pore before and early in translocation. Cell. 92, 747-758 (1998).
- Alder, N. N., Shen, Y., Brodsky, J. L., Hendershot, L. M., Johnson, A. E. The molecular mechanism underlying BiP-mediated gating of the Sec61 translocon of the endoplasmic reticulum. J. Cell Biol. 168, 389-399 (2005).
- Aneiros, E., Philipp, S. E., Lis, A., Freichel, M., Cavalie, A. Modulation of Ca2+ signalling by Na+/Ca2+ exchangers in mast cells. J. Immunol. 174, 119-130 (2005).
- Gross, S. A. TRPC5 is a Ca2+-activated channel functionally coupled to Ca2+-selective ion channels. J. Biol. Chem. 284, 34423-34432 (2009).
- Erdmann, F. Interaction of calmodulin with Sec61a limit Ca2+ leakage from the endoplasmic reticulum. EMBO J. 30, 17-31 (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved