このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
哺乳類上皮細胞上に細菌付着のインビトロアッセイ
要約
このプロトコルは、培養細胞に付着している細菌のコロニー形成単位の数を数えるに構成された単純な細菌の接着アッセイです。アッセイは堅牢であり、アドヘシンの独立は学び、数多くのバリエーションが細菌性病因に取り組む多くのラボで使用されています。
要約
感染症を引き起こすために、細菌はそのホストを植民地化する必要があります。細菌性病原体は、細胞1をホストするために添付ファイルを促進することができる様々な分子や構造を表現する。これらのアドヘシンは、宿主細胞表面の受容体や細菌と宿主との間のブリッジとして機能する可溶性タンパク質との相互作用に依存しています。接着前の侵略および/または毒素の分泌に重要な第一歩であり、したがってそれは、細菌性病因で検討する重要なイベントです。さらに、付着した細菌は、しばしば絶妙に微調整された細胞応答を誘導する、の研究は"細胞の微生物学2'のフィールドに出産を与えている。細菌宿主細胞上の接着とその侵略のための堅牢なアッセイは、したがって、細菌性病因の研究において重要な役割を果たし、長い多くの先駆者の研究室3,4で使用されている。これらのアッセイは、現在、細菌性病因に取り組む多くのラボで実践されています。
ここで、我々は、特定のアドヘシンの寄与を示す標準の遵守のアッセイを説明します。我々は、 大腸菌の菌株2787年5、拡散粘着(AIDA)に関与するautotransporterアドヘシンを発現するヒト病原性の菌株を使用してください。コントロールとして、我々 は 、AIDA遺伝子、2787Δ アイーダ (F.バーサウムとM.モーレス、未発表)、およびE.の商用実験室株を欠く変異株を使用大腸菌 、C600(New England Biolabs社)。細菌は一般的に使用されるHEP - 2のヒト上皮細胞株からの細胞に付着して残っている。このアッセイは、以下の広範囲に6日までに記載されている。
プロトコル
1。予備:細菌株及び上皮細胞。
細胞や細菌の操作は、層流フードの下に、無菌的に実行されます。
- たてE.を隔離大腸菌株2787、2787Δ アイーダ 、およびC600グリセロールストックからの溶原性のブイヨン(LB)寒天プレート(1%トリプトン、0.5%塩化ナトリウム、0.5%酵母エキス、1.5%寒天)上で、37で成長℃、アッセイのばらつきを最小限に抑えるために、それは新たにメッキ菌株を常に使用すると℃の密閉ペトリ皿上にのみ数週間、最大で4℃で菌株を維持することをお勧めします。
- 10%の熱不活化ウシ血清(熱不活性化が56で行われる℃で30分間)を添加した高グルコースダルベッコ改変イーグル培地(DMEM)で培養HEp - 2細胞(ATCC CCL - 23)。ルーチン培養中に我々はまた、10 U / mlペニシリン、10μg/ mlのストレプトマイシンを追加します。
- 37 HEp - 2細胞を成長· CO 2 5%を含有する雰囲気中で細胞培養におけるC。 75センチメートル2フラスコで増殖させ、彼らがコンフルエントに達するたびに継代培養された細胞を、維持するために標準的な細胞培養の手順を使用します。彼らが30〜40継代に到達し、それらを破棄するまで、我々は培養細胞を使用してください。
- 75センチメートル2フラスコでHEp - 2細胞がほぼコンフルエントに達しているときにアッセイを準備し、したがって、接着アッセイのために準備が整いました。
2。 1日目:接種と上皮細胞の準備
- 8グラム/ LのNaCl、0.2 g / Lの塩化カリウム、0.2 g / LのKH 2 PO 4、0.21グラム/ LのNa 2 HPO 4::7H暖かいダルベッコのリン酸が(DPBS緩衝生理食塩水で一度フラスコにHEp - 2細胞を洗う2 O)
- 新鮮な暖かい完全培地を添加する前に5分間EDTA - 細胞を、0.05%トリプシンでインキュベートする。新鮮な培地が追加された後、細胞をピペッティングにより再懸濁する。
- 5分間、2,000 rpmで細胞懸濁液を遠心し、DPBSでペレットを再懸濁し、再度遠心する。
- 10%の血清を添加したが2 × 10 5細胞/ mlの濃度で、どの抗生物質を含まない新鮮な培地で細胞を再懸濁します。
- 24ウェルプレートの中央にシードデュプリケートウェルの3セットで細胞懸濁液の1ミリリットル(各系統用)と、細胞培養インキュベーターで一晩インキュベートする。
注:血清を徹底的にdecomplementedするとその抗生物質がこの段階の後に省略されていることが重要です。これを怠ると、感染菌を殺すかもしれない。 - LBブロス5mlの(1%トリプトン、0.5%塩化ナトリウム、0.5%酵母エキス)で各細菌株の一つ孤立したコロニー(2787年、2787Δ アイーダとC600)を植菌し、37℃で一晩成長°激しく振盪とC(180 rpmで)。
3。 2日目:細胞の感染
- 彼らは少なくとも90%コンフルエントと汚染されていないことを確かめるために倒立顕微鏡下でHEp - 2細胞を検査する。
- 新鮮な培地1 mlの10%の血清を補充がない抗生物質を含まないを追加、それぞれによく、暖かいDPBSで細胞を洗浄し。セルなしの3つのウエルに新鮮培地を追加することも。これは、各菌株のための接種物中の細菌の総数を決定するために使用されます。
- 細菌培養の600nm(OD 0.600 nm)での光学密度を測定します。 HEp - 2細胞を含むデュプリケートウェルの一組にしてもいずれでもない細胞を含む各細菌培養物のアリコートを追加。通常、我々は10 6コロニー形成単位(cfu)に対応する一晩培養液量を使用してください。 (:セル細菌)これは、5:1の感染の多重度(MOI)を表します。我々が直接私たちの一晩培養を使用していますが、それは(そのような細胞毒のような、例えば)一晩培養中に存在する分泌分子の有害な影響を避けるために、細菌を遠心分離し、DPBSでそれらを再懸濁するために時々お勧めです
注:MOIは、100:1〜1:10の間で異なる場合があります。高いMOI収量より高い変動と背景と細菌はプレートのプラスチックに固執する傾向がある。 MOI下でも高い変動性をもたらします。 MOI選択されると、それは一貫性があるとこのMOIを保つために不可欠です。 - 37℃で3時間の細胞培養インキュベーターに感染した細胞をインキュベート℃、5%のCO 2。
注:これは、細胞と接触して、すべての細菌を直接持って来るために、低速(1〜2分間など千× g)で簡単にプレートを遠心することも可能です。これは、感染を同期させる利点があり、短いインキュベーション時間(わずか15〜30分)が可能。 - 感染細胞から培地を取り出し、冷めないようにDPBSで細胞を3回洗浄。このステップでは、付着細菌は通常、標準的な顕微鏡で見ることが、我々は日常的にこのチェックを実行することができます。
- 細胞を溶解し、付着した細菌をデタッチするにはteriaは、よく細胞を含むそれぞれに1%トリトンの100μlのX - 100を追加します。他の洗剤は(そのようなインスタンスのためのサポニンとして)使用することができます。
- 室温で10分間細胞をインキュベートし、LB培地900μlを加える。
- 静かにアップダウンを繰り返しピペッティングにより懸濁液をホモジナイズする。接種を含む細胞を含まないウェルを同様に穏やかにホモジナイズされています。
注:一部の細菌は、我々は0.05%トリプシンとのインキュベーションにより上皮細胞を切り離し、その場合には、洗剤に敏感すぎかもしれない- EDTAを20分間37℃で付着細菌と一緒に細胞はまた、ピペットチップでウェルから掻き取りすることができます。 - LB寒天培地上の3希釈(通常1:1,000、1:10,000及び1:100,000希釈)からLBブロスとプレートを100μlを用いて付着した細菌や接種の懸濁液の連続10倍希釈液を調製し、37℃で一晩インキュベート° C 。
4。 3日目:CFUカウントとデータのプレゼンテーション。
- プレート上のコロニーをカウントし、希釈液の各シリーズを平均化することにより、付着した細菌のと接種のcfuの数を計算する。 10から300コロニーの間を持つ唯一のプレートはカウントする必要があります。
5。代表的な結果:
次の表は、異なる日に行わ3つの実験から付着した細菌や接種のカウントcfuの典型的な結果を示しています。

結果は、図1Aに示すように、直接付着したCFUとして報告することができます。接種材料のサイズが原因で成長率またはピペッティングエラーの違いの菌株間で異なるため、それは多くの場合、付着細菌の割合として結果を報告することをお勧めします。図1Bに示すように、付着細菌の割合は、接種のCFUの数によって付着細菌のCFUの数で除して算出することができます。図1Bのすべての列を比較するために反復測定ANOVAとBonferroniのポストテストを行うことにより、我々は2787年と2787Δ アイーダの間に、同様に2787とC600の間に有意差(P <0.05)が、有意差があることがわかります2787Δ アイーダとC600の間に。
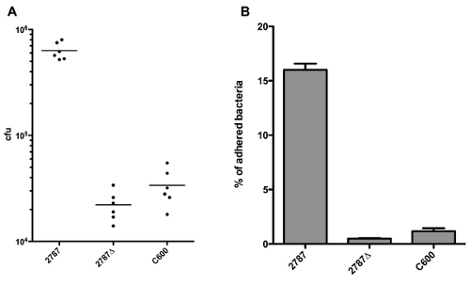
図1。付着した細菌のCFU(A)または付着細菌の割合(B)のような結果の表現
観察された遵守の割合は、しばしば実験的なセットアップ(および、より少ない程度で、実験上)に非常に依存しています。特に重要なMOIで、洗浄回数は、その割合は、文字通りに解釈されるべきではない。
接種材料中の細菌は、しばしば細胞のウェルの中の細菌の本当の総数と比較して接種のサイズを傾斜、細胞の存在下で細菌よりもはるかに速く成長することができます。この問題を軽減するために、それはどちらにお勧めです:(i)の接種を決定するために細胞と井戸を使用してください:HEp - 2細胞は、追加のウェルに播種し、感染している。アッセイの終わり、ではなく、廃棄の上清と洗浄で、10%トリトンX - 100100μlをウェルに添加する。細胞が溶解されると付着し、非付着細菌を含むライセートを穏やかにピペッティング上下を繰り返すことで均一化される;または(ii)アッセイの終わりに感染した細胞の上清を収集するだけでなく、上清DPBSで洗浄し、これらのプールされた上清中のCFUの数を決定します。これは、非付着菌のCFUの数が得られます。付着細菌の割合は、付着および非付着細菌のcfuの数を加えることにより付着した細菌のCFUの数で除して算出することができます。
アッセイの頑健性を示すために、最近設立された気管子豚の細胞株は、nptr 8から細胞とインキュベートS4074で行わアッセイ、 アクチpleuropneumoniae 7の接着剤ブタ病原性株でこのプロトコルを比較することができます。さておき細菌や細胞の増殖に必要なメディアの違いから、唯一の違いは、感染のために使用される細菌は指数関数的に成長している文化から、ではなく、定常期の一晩培養からのものであるということです。 A.あるpleuropneumoniaeそれはそうでなければ毒素の分泌は、細胞死とバイアスの結果を引き起こす、MOI 10:1を尊重し、感染の3時間を超えていないことも非常に重要です。 Aのほかに、この菌株それはコンフルエントの細胞を使用すると細胞は脱却していないことを視覚的に確認することが重要ですので、pleuropneumoniaeは容易にプラスチックに付着することがあります。
ディスカッション
このプロトコルは、(ゲンタマイシン保護アッセイ3を使用など)の侵入を研究するように変更することができる標準的な細菌付着アッセイを説明します。コロニー形成単位の計数は、ギムザ染色などの顕微鏡下での標準的な可視化技術に依存するアプローチは、との比較により、定量化が可能になります。後者は、密着性の定性的なビューを提供しますが、接着の様々なパターンを?...
開示事項
謝辞
著者らの研究室での作業は、カナダ自然科学工学研究評議会、健康研究のカナダ研究所、およびカナダリサーチチェアプログラムからの補助金によってサポートされています。 JLは、フォンデルシェルシュエンサンテケベックからの資金提供を通じて、GroupeドールエチュードデProtéines Membranaires(GEPROM)からフェローシップでサポートされています。
資料
| Name | Company | Catalog Number | Comments |
| 試薬 | 会社 | カタログ番号 | |
|---|---|---|---|
| 高グルコースDMEM | GIBCO -インビトロジェン | 12430-054 | |
| DDPBS | GIBCO -インビトロジェン | 14190-144 | |
| ウシ成長血清 | Hyclone | SH3054 | |
| ペニシリン/ストレプトマイシン | GIBCO -インビトロジェン | 15140-148 | |
| 24ウェルプレート | コーニング | 3337 | |
| トリトンX - 100 | フィッシャーサイエンティフィック | BP151 - 100 |
参考文献
- Kline, K. A. Bacterial adhesins in host-microbe interactions. Cell Host Microbe. 5, 580-580 (2009).
- Cossart, P., Boquet, P., Normark, S., Rappuoli, R. Cellular microbiology emerging. Science. 271, 315-315 (1996).
- Elsinghorst, E. A. Measurement of invasion by gentamicin resistance. Methods Enzymol. 236, 405-405 (1994).
- Pizarro-Cerda, J., Lecuit, M., Cossart, P., Sansonetti, P., Zychlinsky, A. . Molecular Cellular Microbiology. , 161-161 (2002).
- Srivastava, A., Isberg, R. R., Sansonetti, P., Zychlinsky, A. . Molecular Cellular Microbiology. , 179-179 (2002).
- Benz, I., Schmidt, M. A. Cloning and expression of an adhesin (AIDA-I) involved in diffuse adherence of enteropathogenic Escherichia coli. Infect Immun. 57, 1506-1506 (1989).
- Charbonneau, M. E., Berthiaume, F., Mourez, M. Proteolytic processing is not essential for multiple functions of the Escherichia coli autotransporter adhesin involved in diffuse adherence (AIDA-I). J Bacteriol. 188, 8504-8504 (2006).
- Jacques, M., Paradis, S. E. Adhesin-receptor interactions in Pasteurellaceae. FEMS Microbiol Rev. 22, 45-45 (1998).
- Auger, E. Host-pathogen interactions of Actinobacillus pleuropneumoniae with porcine lung and tracheal epithelial cells. Infect Immun. 77, 1426-1426 (2009).
- Jacques, M. Role of lipo-oligosaccharides and lipopolysaccharides in bacterial adherence. Trends Microbiol. 4, 408-408 (1996).
- Nataro, J. P., Kaper, J. B. Diarrheagenic Escherichia coli. Clin Microbiol Rev. 11, 142-142 (1998).
- Jallat, C., Darfeuille-Michaud, A., Rich, C., Joly, B. Survey of clinical isolates of diarrhoeogenic Escherichia coli: diffusely adhering E. coli strains with multiple adhesive factors. Res Microbiol. 145, 621-621 (1994).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved