Method Article
マウスにおけるカハール(ICC)ネットワークの間質細胞の可視化
要約
カハール(ICC)の間質細胞は消化管(GI)管のペースメーカー細胞である。彼らは、平滑筋細胞とGI収縮を調節するためにポスト神経節神経繊維間の複雑なネットワークを形成する。ここで、我々は、免疫蛍光断面の方法とマウスICCネットワークのホールマウントの可視化を提示する。
要約
カハール(ICC)の間質細胞が蠕動運動に必要な自発的な徐波を生成し、腸神経システム1からの神経入力を媒介する胃腸(GI)管の間葉系由来する"ペースメーカー細胞"です。 ICCの異なるサブタイプは、消化管2,3の筋層内の個別のネットワークを形成する。これらのネットワークへの損失または損傷は、運動障害4の番号に関連付けられています。 ICCの細胞は細胞膜上KIT受容体チロシンキナーゼを発現し、KITの免疫染色は、ICCのネットワーク5,6にラベルを付けるために、過去15年間使用されています。重要なのは、通常のKITの活性は、ICCの開発5,6が必要です。頻繁に機能獲得型のKITの変異7,8を抱いている消化管間質腫瘍のICCの細胞の結果(GIST)の悪性形質転換。我々は最近、ETV1はICC / GIST系統で発現する系統特異的生存因子であり、通常のICCのネットワーク形成の両方のためにとGISTの腫瘍形成9のために必要なマスター転写制御因子であることを示した。我々は、さらにそれが腫瘍形成にKITの活性化変異と協働することを示している。ここで、我々は、主に以前に発行されたプロトコル10,11に基づいて、マウスでのICCのネットワークの可視化のための方法を、説明します。さらに最近では、塩化物チャンネルanoctamin 1(ANO1各)もICC 11,12の特定の細胞膜のマーカーとして特徴付けられている。ために彼らの細胞膜局在化の、両方のタンパク質の免疫蛍光は、ICCのネットワークを可視化するために使用することができます。ここで、我々は、固定凍結cyrosectionsと全体のマウントの準備がICCのネットワークの可視化について説明します。
プロトコル
1。マウス消化管の解剖
- ローカルIUCACガイドラインによって安楽死させたマウス
- 発泡スチロールの表面上の各肢を固定し、70%エタノールで腹部表面をすすぐ。横隔膜から恥骨までの長い正中切開で腹腔を開きます。一遠位食道と遠位大腸の第二のカットで切断し、一括して胃から肛門まで消化管を取り外し、慎重に小さなハサミを用いて十二指腸と盲腸で靭帯を切断してください。 PBSでペトリ皿の中で消化管を置きます。ピンセット(図1)を用いて腸間膜を離れて分析する。胃、小腸、大腸、幽門と回盲接合部で切断して分離する。給餌針(それ以上の年齢のマウス)または鈍針(若いマウス)に接続されている5ミリリットル注射器を用いてPBSで消化管の各部分の内腔を洗浄します。
- 腸間膜の境界に沿って胃、小腸、大腸を開きます。消化管の各部分の2つの部分、全体のマウントの可視化および凍結切片用に一つずつをカット。
2。全体のマウントのサンプル調製と免疫染色
- 4℃で少なくとも1時間氷冷アセトン及び修正サンプル1.0 mlを充填した1.5cmのマイクロ遠心チューブ℃に消化管の各部分の全体部分を置きサンプルは-20℃で最高1週間保存されることがあります我々は通常、アセトンでサンプルを保存し、cyrosectionsの準備に進みます。
- PBSでサンプル2Xを洗ってください。 PBSでペトリ皿にサンプルを置きます。 miscroscopeを解剖下に、慎重に筋層を残して、ピンセットで一端を保持することによりメスで粘膜層を削り取る。
- 筋肉は、別の抗体で染色する為の5mm片に切断することができます。染色前にPBSで2日以上保存しないでください。
- ブロックとのインキュベーションステップは24ウェルプレートの1つのウェルにまたは1.5ミリリットルのマイクロチューブで行うことができます。ブロッキング緩衝液0.5ml(5%ヤギ血清、0.1%トリトン4℃で1時間、PBSでX - 100 ° C)でブロック。
- ブロッキング緩衝液で希釈した一次抗体とインキュベートし、一晩4 °回転C.私たちは正常ACK - 2ラット抗キット、ウサギ抗ANO1各、および全体のマウント免疫染色用ウサギ抗PGP9.5抗体を用いている。
- 室温でローテーター上PBSで5分間2Xのために洗浄する。
- ローテーターで室温で2時間ブロッキング緩衝液で希釈した二次抗体とインキュベートする。我々は一般的にのAlexa Fluor ® 488抗ウサギとAlexa Fluor 594の抗ラット抗体を使用してください。
- 室温でローテーター上でPBSで3倍の15分間洗浄する。
- 顕微鏡の間に組織の方向性を確保するために上にスライド、漿膜側にマウントします。このオリエンテーションでは、カバースリップに直面し、1つは、顕微鏡のスライドに焦点を当てたとして最初に検出される漿膜側が保証されます。我々は、解剖顕微鏡でこれを行います。時には、私たちは簡単に適切に配向し、蛍光顕微鏡下で組織を調べます。キットまたはANO1各を視覚化する蛍光顕微鏡下では、一つはカバースリップの側からの最初のICC - MYネットワークに遭遇するはず。完全に乾燥することなく可能な限り次に、吸引PBS。ハードセットマウントメディア(我々は金を延長使用)を50μl加え、穏やかに組織の上にカバースリップを配置。 -80室温と店舗のスライドで一晩マウントの設定を許可℃に
- 顕微鏡検査のために、我々はZ -ドライブを搭載した広視野顕微鏡を使用していました。我々は、どちら20X空気の目標(NA 0.75、プランアポクロマート)または60X油浸対物(NA 1.4、プランアポクロマート)を使用し、全体の筋層にまたがるZ -セクションは2μm1μmを取った。画像はその後Autoquantデコンボリューションソフトウェアを使用してデコンボリューションされた。また、他の多くは、同様の結果との代わりに共焦点顕微鏡を使用している。
3。凍結切片の調製と免疫染色
- ろ紙上に平らな、消化管の各部分、漿膜側を下に置きます。ティッシュの周りろ紙をカット。室温で2時間のPBS中4%パラホルムアルデヒド(PFA)(我々は右使用前にPBS中に密封されたバイアルの32%のパラホルムアルデヒドを希釈)におけるろ紙の上に置いて組織。または組織の大きさに応じて、12ウェルプレート、または1.5mlマイクロチューブに - 固定、6で行うことができます。プレートで実行する場合、パラフィルムでは、PFAの露出を最小限に抑えます。長い固定時間は、特にACK - 2抗キットの抗体のために、抗原のマスキングになることがあります。
- PFAから組織を取り出して、PBSで30%のショ糖の場所。組織は4で一晩をシンクすることができます℃を
- 1時間で30%のショ糖とOCTの1:1の比率で組織を平衡化する。その後、消化管の縦軸はcyrosectionsと平行になるはずOCTで満たさcryomoldに垂直に組織をマウントします。異なる遺伝子型とまたは別の治療とマウスを調べるときに、それは並列処理を確保するために同じcryomoldに別のマウスから組織をマウントすると便利な場合があります。ストレージ用の-80 ° Cの冷凍庫にドライアイスと場所でフリーズ。
- 10μmの凍結切片をカット-80℃の冷凍庫でのスライドとストアへ。我々は通常、スライドごとに2つのセクションをカット。我々はまた、通常一凍結切片スライドのH&E染色を行います。
- 免疫蛍光の場合は、最初の15分間室温でスライドを平衡化します。その後、PAPのペンを用いて組織の周りに円を描く。
- 1時間ブロッキングバッファー(全マウント免疫染色の場合と同じ)150μlでブロックする。
- ブロッキングバッファーを吸引除去し、ブロッキング緩衝液で希釈した150μlの一次抗体を追加し、4℃で一晩インキュベート℃で加湿チャンバーに。
- PBSで5分2Xを洗ってください。
- 室温で2時間ブロッキング緩衝液で希釈した二次抗体とインキュベートする。我々は通常、アレクサ488抗ウサギおよびAlexa 594抗ラット抗体を使用してください。
- PBSで3倍の15分間洗浄する。
- 完全に組織を乾燥させずにスライドを吸引除去する。 DAPI(我々は金を延長使用する)と場所#1.5カバーでメディアをマウントハードセットのドロップを追加。 -80℃の冷凍庫で設定し、保存するために一晩室温で場所のスライド。
- DAPI、FITC、およびテキサスレッドフィルタのセットを使用してトリプル蛍光画像を取得する。
4。代表的な結果:
ここでは、例として大腸を使用してください。 H&Eは、ショ糖の染色どこ円形および縦走筋層と緑のラインdemarksの間に黄色のラインdemarks筋層間神経叢の間の境界免疫は、基準のパラフィン切片(図2)に比べていくつかの案件を表示するために使用される固定凍結切片を保護粘膜とmuscularlis。漿膜から粘膜に、凍結切片を調べるには、まず厚い円形の筋肉(CM)層に続く薄い縦走筋(LM)層が発生する。 CMの核は小さく、円形でなければならない一方、LMの核はやや細長いでなければならないので、セクションには縦走筋と平行にする必要があります。 LMとCMの間でPGP9.5で染色される神経細胞で作られた筋層間プレキシです。 CMを通してPGP9.5も汚れ神経突起。筋層間ICCネットワーク(ICC - MY)は筋層間神経叢を取り囲み、多極細胞で作られています。縦筋層内に、双極細胞は、筋肉と並行して実行されている稀な筋肉のICCSは(ICC - IMの)があります。円形の筋層内に、また、円形の筋肉と並列実行し、このカットで横断面である双極細胞であるICC - IMが豊富にあります。筋層と粘膜下組織の接合部で、ICC - SMPではで構成される粘膜下ICCのネットワークは、多極ICCSのフラットなネットワークです。いずれかのカバースリップ(Figure. 3)から焦点として、大腸の免疫全体のマウントキットを調べると、片方が最初にICC - MYネットワークに出会うことが予想され、その後、CMのICC - IM、およびICC - SMPのネットワーク。ホールマウントの画像の3D再構成を使用してICCのネットワークの容積測定は、10を記載されている。広視野顕微鏡を用いて、デコンボリューション(図3)後に削除することができるRAW画像の大幅な面外蛍光がある。粘膜の除去が不完全では、高いバックグラウンドの蛍光になります。 ANO1各は別のICCののマーカーとKITの共同免疫染色で、ANO1各は、ICCの染色(図4)の完全なオーバーラップを示しています。
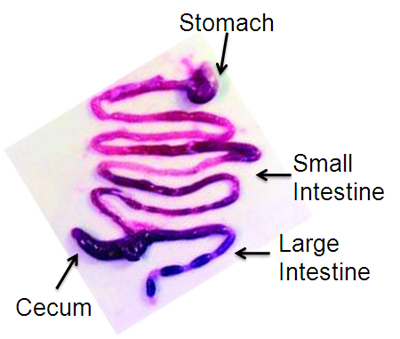
図1代表は許可13で転載、マウス消化管の解剖。
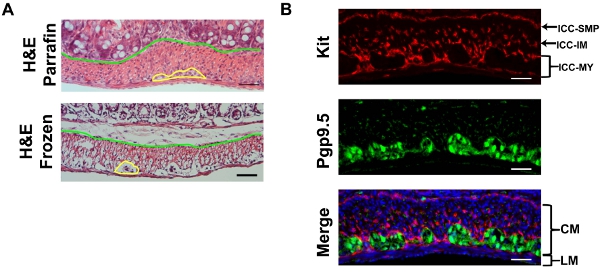
図2。)代表H&凍結切片の一部収縮のアーティファクトを表示するセクションを説明すると参照パラフィンが埋め込 まれたように調製された凍結切片のマウス大腸のE染色。黄色の線は、筋層間神経叢と青い線が筋層から粘膜を分離demarks。 B)代表者キット(赤、ACK - 2)とPGP9.5(緑)マウス大腸のDAPI(青)対比で二重免疫蛍光。 LM:縦走筋のCM:円形の筋肉。スケールバーは20μm。

図3。代表者キット(赤、ACK - 2)は3つの焦点面での同じフィールドのホールマウント免疫蛍光、ICC - MY LM / CM国境での平面、CMでのICC - IMの面、およびICC - CM /粘膜下組織の境界でのSMPの飛行機。 RAW画像とデコンボリューションされた画像が表示されます。スケールバーは20μm。
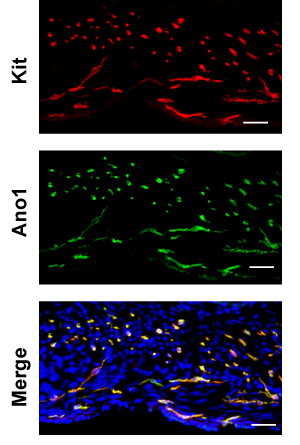
図4大腸内ANO1各(緑)とキット(赤、ACK - 2)の二重免疫蛍光代表。スケールバーは20μm。
ディスカッション
カハール介在細胞は、最初に消化管筋層のメチレンブルーと銀クロム酸の汚れを使用してちょうど1世紀前にサンティアゴRamóón y Cajalがによって特徴づけられた。カハールは、最初にICCのは軸索と樹状突起を思い浮ばせる、そのプロセスに基づいて、神経細胞と考えていました。多くのその後長年にわたり、ICC生物学の研究は、そのキットの検出ができないだけICCで表現されるまで、特定のマーカーの欠如によって制限されていますが、またそれらの開発6で必要です。それ以来、KIT免疫蛍光は広くICC生物学の研究で使用されており、また、膀胱などの他の収縮器官におけるICCの上昇につながっている。最近、ANO1各第二信頼できるICCのマーカーとして同定されている。
様々な固定および実装技術を使用してICCを識別するための免疫蛍光を用いて、過去15年間に多数の出版が行われている。保護されたパラホルムアルデヒドとショ糖が付いている我々の手"の固定凍結"凍結切片では最高のcryosectioning後にアセトンまたはパラホルムアルデヒドポスト固定に比べて動作します。全体のマウントの場合、我々は、粘膜切開続いてアセトン固定は最も堅牢な結果を示すことを発見した。
歴史的に、ACK - 2はマウスICCの識別に最適なキットの抗体をされています。それは、細胞外ドメインを認識するモノクローナルラットであり、それはまた、マウスを生きるために与えられた時に腸閉塞を引き起こすブロックする抗体である。しかし、ACK - 2エピトープは、徐々にパラホルムアルデヒド固定によって破壊され、標準抗原の検索方法によって救出されていません。我々は、ACK - 4エピトープは、パラホルムアルデヒド固定に対してより抵抗性であることを見出した。固定凍結ブロックとセクション、パラフィン包埋ブロックとセクションに比べて形態より維持され、アーカイブ、長期的(図4)により適している。 ACK - 2もACK - 4も、正常にパラフィン切片で使用されている。我々はD13A2、新しいウサギモノクローナル抗体は、消化管の両方の固定凍結およびパラフィンセクションで非常にうまく動作することを特徴している。
このキットは、メラノサイトを含むいくつかの他の細胞型、、造血細胞、生殖細胞で、とにも消化管で発見されている特定のマスト細胞に発現している。幸い、ほとんどの肥満細胞は、筋層内の粘膜とではない見られる。ウサギ抗ANO1各およびラット抗キットとの二重染色では、各抗体の非特異的な染色(図4)を除去することができます。また、キットとICCのサブクラス間ANO1各の相対的な発現が異なると思われることは注目に値します。例えば、小腸で、キットの染色ではANO1各染色が同等であるのに対し、深部筋神経叢のICCに比べてはるかに激しい筋層間ICCのです。
開示事項
謝辞
この作品は、国立がん研究所(K08CA140946、YCへ)、(5F32CA130372、PCへの)、(R01CA102774とPBにR01HL055748)、国防総省(YCへPC094302)、GIST研究舒曼ファミリー基金(にによってサポートされていましたPC)、そしてスターのがんコンソーシアム(PC、YC、CLSとPBに)。我々はcryosectioningと免疫染色のヘルプはカティアMANOVA、Ningのファン、およびMSKCC分子細胞学の中核施設のMesurh Turkekulに感謝の意を表します。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | コメント(省略可能) |
|---|---|---|---|
| ラット抗キットの抗体(クローンACK - 2) | ベイバイオサイエンス | 14から1172 | 2μg/mlで使用してください。エピトープは、overfixationで失われます。 |
| ラット抗キットの抗体(クローンACK - 4) | Cedarlane | CL8936AP | 2μg/mlで使用してください。 |
| ウサギ抗KIT抗体(クローンD13A2) | 細胞シグナリング | 3074 | 1:100希釈で使用してください。唯一の抗体はパラフィン切片でうまく動作することをここに記載。 |
| ウサギ抗PGP9.5抗体 | アブカム | ab10404 | ラベル神経細胞の細胞質。筋層間神経叢の神経細胞をマーキングするのに便利。 1:1000希釈で使用してください。 |
| ウサギ抗ANO1各抗体 | アブカム | ab53212 | 2μg/mlで使用 |
| Alexa Fluor 594のヤギ抗ラットIgG | インビトロジェン | - 11007 | 2μg/mlで使用 |
| のAlexa Fluor ® 488ヤギ抗ウサギIgG | インビトロジェン | - 11008 | 2μg/mlで使用 |
| 動物の餌付けのニードル | フィッシャー | 01-208-87 | シリコンは、成体マウスの消化管をフラッシュするための針が有用チップを渡した |
| ブラントニードル | ベクトンディクソン | 305180 | プリ離乳仔の消化管をフラッシュするための鈍針が便利 |
| DAPIとゴールド褪色防止試薬を延長 | インビトロジェン | P - 36931 | DAPIによる代替ハード設定マウントメディアを使用することができます |
| 組織 - Tek社Cryomold | 組織 - Tek社 | 4557 | |
| 組織 - Tek社OCT | 組織 - Tek社 | 4583 | |
| 32%パラホルムアルデヒド(10ミリリットル密封アンプル) | EMサイエンス | 15714 | 密封されたアンプルを開き、使用する直前に4%に希釈する |
| バッファをブロックする | 5%ヤギ血清、0.1%トリトンPBSでX - 100 |
参考文献
- Sanders, K. M. A case for interstitial cells of Cajal as pacemakers and mediators of neurotransmission in the gastrointestinal tract. Gastroenterology. 111, 492-515 (1996).
- Ward, S. M., Sanders, K. M. Physiology and pathophysiology of the interstitial cell of Cajal: from bench to bedside. I. Functional development and plasticity of interstitial cells of Cajal networks. Am J Physiol Gastrointest Liver Physiol. 281, 602-611 (2001).
- Komuro, T. Structure and organization of interstitial cells of Cajal in the gastrointestinal tract. J Physiol. 576, 653-658 (2006).
- Sanders, K. M., Ordog, T., Koh, S. D., Torihashi, S., Ward, S. M. Development and plasticity of interstitial cells of Cajal. Neurogastroenterol Motil. 11, 311-338 (1999).
- Ward, S. M., Burns, A. J., Torihashi, S., Sanders, K. M. Mutation of the proto-oncogene c-kit blocks development of interstitial cells and electrical rhythmicity in murine intestine. J Physiol. 480, 91-97 (1994).
- Huizinga, J. D. W/kit gene required for interstitial cells of Cajal and for intestinal pacemaker activity. Nature. 373, 347-349 (1995).
- Rubin, B. P., Heinrich, M. C., Corless, C. L. Gastrointestinal stromal tumour. Lancet. 369, 1731-1741 (2007).
- Hirota, S. Gain-of-function mutations of c-kit in human gastrointestinal stromal tumors. Science. 279, 577-580 (1998).
- Chi, P. ETV1 is a lineage-specific survival factor in Gastrointestinal Stromal Tumour (GIST). Nature. , (2010).
- Kwon, J. G. Changes in the structure and function of ICC networks in ICC hyperplasia and gastrointestinal stromal tumors. Gastroenterology. 136, 630-639 (2009).
- Hwang, S. J. Expression of anoctamin 1/TMEM16A by interstitial cells of Cajal is fundamental for slow wave activity in gastrointestinal muscles. J Physiol. 587, 4887-4904 (2009).
- Gomez-Pinilla, P. J. Ano1 is a selective marker of interstitial cells of Cajal in the human and mouse gastrointestinal tract. Am J Physiol Gastrointest Liver Physiol. 296, G1370-G1381 (2009).
- Sommer, G. Gastrointestinal stromal tumors in a mouse model by targeted mutation of the Kit receptor tyrosine kinase. Proc Natl Acad Sci U S A. 100, 6706-6711 (2003).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved