Method Article
腫瘍溶解性ウイルスと生きている組織のex vivoでの感染
要約
腫瘍溶解性ウイルスは、癌の治療薬として期待されています。治療前に患者から得られた生体組織標本の感染力を把握する能力は、この治療的アプローチのユニークな利点です。このプロトコルは、のための組織を処理する方法について説明します。生体外で感染症。
要約
腫瘍溶解性ウイルスは、(OVS)を選択的に複製し、腫瘍細胞1を殺す新規な治療です。がんの治療薬としてHSV、レオウイルス、ワクシニアOVSを含む腫瘍溶解性、さまざまなプラットフォームの有効性を評価するいくつかの臨床試験は現在進行中2月5日です。腫瘍溶解性ウイルスの一つの重要な特徴は、それらが遺伝的に顕微鏡やバイオルミネッセンスイメージング6,7によって組織の感染を可視化することを可能にするレポーターの導入遺伝子を発現するように変更できるということです。それが成功した腫瘍溶解性ウイルス療法8の可能性を確認するために治療前に患者のex vivoでの組織を感染させる可能性があるので、これはユニークな利点を提供しています。そのためには、適切に組織の不均一性を補正し、感染9〜特に前の組織の生存率を、評価する組織をサンプリングすることが重要です。腫瘍溶解性プラットフォームでだけでなく、失敗に終わったと生産性の高い感染症を区別するために、均質化後の組織の直接滴定により表される場合には、報告の導入遺伝子を用いてウイルス複製をフォローすることも重要です。このプロトコルの目的は、これらの問題に対処するためであり、ここで1を説明します。細胞培養2の腫瘍組織の採取と準備。 GFPまたはホタルルシフェラーゼ4のいずれかを発現しているワクシニアウイルスと培養組織の代謝色素アラマーブルー(3)ex vivoでの感染を使用して組織の実行可能性の評価。蛍光顕微鏡またはin vivoイメージングシステム(IVIS)5 で使用して、導入遺伝子発現の検出。プラークアッセイによるウイルスの定量化。この包括的な方法は、組織の処理の容易さ、組織の不均一性の補正、組織の生存率の制御、および不稔感染や骨善意ウイルス複製の間に差別を含む、いくつかの利点があります。
プロトコル
1。組織の処理
- 最良の結果を得るには、このプロトコルは、新たに分離した組織を使用して実行する必要がありますFBS、1%のPennicilin /ストレプトマイシンソリューション、および0.1%の前処理にAmphothericin B液直後の手術を10%含むDMEM培地に堆積。これが不可能な場合、組織は、処理前に4℃でこの培地で一晩放置することができます。
- サンプルを処理する前に、少なくとも5分間70%エタノール溶液でそれらを堆積することにより、金属の鉗子と替刃を殺菌する。また、10%含むDMEM培地2mlのFBS、1%のPennicilin /ストレプトマイシンソリューション、および0.1%Amphothericin Bで24ウェルプレートを準備
- 滅菌ピンセットを用いて層流の細胞培養フードに組織サンプルを収集し、側で無菌側の蓋を最新の状態に保ち、空の15センチメートルペトリ皿の中で組織を預ける。
- 細胞培養のフードでは、図1のように組織内の領域の様々な異なるコアを得るために2ミリメートル生検パンチを使用してください。それらは容易に水平軸に沿って切断することができるように各コアの間に十分なスペースを残し、鉗子の助けを借りて、15cmのシャーレの蓋にコアを預ける。
- 図1のように滅菌カミソリの刃を使用して、4さえ四半期に各コアを分割する。
- すでにFBS、1%のPennicilin /ストレプトマイシンソリューション、および0.1%Amphothericin B液を10%含むDMEM 1.5 mlを含む、図1のようにA1〜A4の異なるウェル内の特定のコアから各コアの四半期を入れ、ピペットチップを使用して。各コアについて、この手順を繰り返します。与えられたウェル/条件でバイアスを最小限に抑えながらこれは、腫瘍の代表的なサンプリングを許可する必要があります。よりよい表現のために、コアの数を増やす。
2。組織生存率の評価
- 図1に示すように、5%CO 2で加湿インキュベーター中37℃で1時間インキュベートとして以下の組織の処理は、よく#A1と#A2に25μlのアラマーブルーを追加します。
- アラマーブルーを持つ以下のインキュベーションでは、それぞれA1とA2井戸から3倍の100μlを削除し、96ウェルプレートの6つの異なるウェルに移す。蛍光プレートリーダー(530励起、590放射)を使用して信号を読み、自分の記録用データを保持。
- アラマーブルー信号が読み取られた後、DMEMを含むだけでなくA1からC1までピペットチップを使用して、組織のすべての部分を、転送、10%FBS + PS + AmphoB。よくA1からメディアの過剰な量を転送しないように注意してください。
- GFP発現とメディアの25μlで希釈したルシフェラーゼ発現ワクシニアウイルスの10 6 PFUとそれぞれのウェルA3とA4に感染する。よくA2は全くいないことも含ま任意の導入遺伝子を発現するウイルスに感染することができます。
- 72時間後、井戸C1とD1に25μlのアラマーブルーを追加し、ステップ2.2を繰り返します。
3。蛍光顕微鏡によるGFP遺伝子発現の可視化
- 良い蛍光写真を撮影するために組織片をカバーするすべての細胞培養培地を削除します。
- 蛍光対応の解剖顕微鏡を使って、最初に適切な解像度で、位相コントラスト像を取る
- 蛍光モードに切り替わり、この場合のGFPで、興味のある遺伝子を可視化するために適切なフィルタを使用して撮影してください。
- バックグラウンド蛍光の写真を撮るために興味のある遺伝子(例えばRFPなど)のことから、可能な限り別の波長の蛍光フィルターを使用して、
4。 in vivoイメージングシステム(IVIS) で使用してルシフェラーゼ発現の可視化
- 作業を始める前にIVISが初期化されていることを確認します。
- 井戸A4およびB4に、ルシフェリン基板10 mg / mlの5μlを追加、よく混ぜ、室温で5分間インキュベートする。
- 5秒にIVIS露光時間を設定し、井戸の写真を撮る。画像が飽和状態になる場合は、下の露光時間で繰り返す。信号がない場合、露出時間を増やします。
- IVISイメージングソフトウェアを使用して、よくB4からの信号を使って背景を削除し、発光シグナルを定量化するために関心領域を選択することができます。
5。プラークアッセイによるウイルス力価を評価
- ウイルス力価を定量する前に、組織は、最初にウイルス粒子を解放するためにホモジナイズされている必要があります。 -80℃で保存されていますこれは、感染した組織サンプルで数ヶ月後に行うことができます。
- 分析スケールを用いて均質化する必要があるサンプルを秤量する。このケースでは、我々はよくA2から収集したサンプルを使用します。
- 組織は、5 mlのポリスチレン丸底ファルコンチューブになって置いて、1mlのPBSを加える。組織ホモジナイザーを用いて組織をホモジナイズする。必要に応じて、後で一度にウイルス力価の評価のために-80ホモジネートを格納する。
- 、力価ワクシニアウイルス、最初のプレート6ウェルプレートで100万U2OS細胞へと37度で一晩インキュベート5%CO 2の湿潤な彼らは翌日のコンフルエンシーが約95%に達していることなど化されたインキュベーター。
- 各希釈段階の間にヒントを変更することを確認し、ウイルスの連続希釈を行うために無血清培地を使用してください。一般的に我々は10希釈で1を行い、900μlのに転送するために100μlのを使用してください。どのように多くの希釈作られて予想されるウイルス収量に依存します。
- 希釈液を作るに続いて、U2OS細胞に感染するために希釈したウイルスストックの500μlのを(各希釈用)を追加してメッキU20S細胞をカバーするメディアを取り出してください。 5%CO 2の加湿インキュベーター中37℃で1時間分のために細胞をインキュベート。
- この時間の間に、DMEM 20%FBSを含有する濃縮2 X、および37度の水浴で3%CMC溶液をウォームアップ。
- 1時間のインキュベーションの後、感染したU2OS細胞をカバーするメディアを取り出してください。一緒に2X DMEM、20%FBSおよび感染U2OS細胞の各ウェルをカバーするためにこの混合液2 mlを使用して:3%CMCの1:1のボリュームを混在させる。
- 別の48時間、37度5%CO 2の加湿インキュベーターに戻し、細胞を置く。
- 48時間後、各ウェルにおけるCMCオーバーレイの上にメタノールと酢酸の固定液2 mlを加えると細胞培養フードで10分間室温でインキュベートする。
- 固定オーバーレイを破棄し、水道水を使用して、井戸の残りを洗い流してください。
- ウェルあたりのクマシーブルー溶液を2ミリリットルの固定U2OS細胞を染色し、プレートシェーカー上で、低速度で、室温で30分間インキュベートする。
- クマシーは井戸から染色や水道水を使用してプレートを洗浄取り外します。時間程度の蓋で乾燥することができます。
- 結果としてウイルスプラークは、図2Cで簡単に可視化することができます。プレートは、この段階で無期限に保存することができます。
- 10〜100プラークが表示されている希釈段階でプラークをカウント。
- 使用される希釈によりカウントされたプラークの数を乗算し、PFU / mlの力価を与えるために2で、結果の数値を掛ける。 25プラークが十分にカウントされている場合たとえば、100万倍希釈が使用されていたところ、初期の未希釈サンプルの力価は、2または5000万PFU / mlに掛けた1百万掛けた25です。さらに当初はPFU / gで力価を報告するサンプルの測定重量によってこの数を割る
6。代表的な結果:
正確に外科的に得られた腫瘍/正常組織のサンプルがあるか、ウイルス感染の可能性がないかどうか、一つは最初の組織サンプルは、実行可能な以上になることを確認する必要がありますが。決定するために図1Aは、生存率が代謝色素(アラマーブル)とその正常と腫瘍の両方の組織を用いて評価できることを示し、少なくとも72時間の期間にわたって代謝的に活性なままにしておくことができます。これは、組織培養ex vivoでのウイルス複製をサポートできることを示唆している。腫瘍溶解性ウイルスの重要な利点は、治療またはイメージング導入遺伝子を発現するように設計できることです。図2D - Eは、GFPやルシフェラーゼが、さらに、これらの組織は生存しても感染の可能性のあることを支持する、ex vivoで感染した組織から検出できることを示しています。増加した導入遺伝子の発現は、一般的にウイルスの複製に関連付けられているが、必ずしも治療活性に重要であると考えられている、自己増幅し、普及につながる生産的なウイルスのライフサイクルとイコールではありません。このような理由から、それはより多くのウイルスが最初に組織を感染させるために使用されたものよりも生産されているかどうかを判断する必要があります。図2Bは、感染直後に採取した組織してプラークアッセイによるウイルス定量の際に、より多くのウイルスが72時間の感染後に得られることを示しています。全体的に、これらのデータは、外科的に切除した腫瘍組織は時間ウイルスの複製をサポートすることができる中に、少なくとも72時間の期間については細胞培養中で実行可能な状態を維持できることを示している。

図1。プロトコルをサンプリング/切片組織の概要。組織サンプルは、その後、無作為に井戸A1 - A4に配布される4分の4に分割されているいくつかの2mmのコアを除去することによって処理されます。カラーコードは、各ウェルに用いる試薬を示している。井戸内の灰色の網掛けの四角は、描かれた6個のコアから各四半期を表す。よくA1の組織は、初期のアラマーブルーの読書の後にメディアを使用して、新しいだけでなく(C1)に転送されます。第二読会は、ウイルスによる72時間のインキュベーションの最後に実行されます。ウェルズA4とB4は、72時間のインキュベーション後の感染後にルシフェリンで補足されています
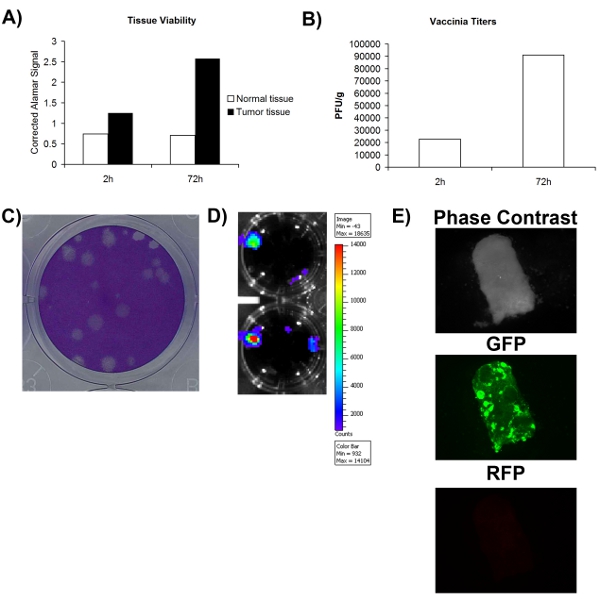
図2。患者組織サンプルの実行可能性と感染力。 a)組織の生存率は2時間と72時間後にコレクションにアラマーブルの信号で測定される。 Y軸は空白のアラマーブルーの信号を補正した表します。B)ワクシニアウイルスの力価組織サンプル2および72時間後に感染。Cクマシー染色。D以下のU2OS細胞のワクシニアウイルスのプラークの)例)患者VV -ルシフェラーゼ-感染組織から得られた発光信号のグラムごとに収集されたIVISを用いて画像化。E)は、蛍光顕微鏡画像は、 VV - GFPに感染した患者の組織サンプルの。
ディスカッション
このプロトコルの重要なステップの1つは、新鮮な組織サンプルを得ることである。サンプルが不適切なメディア(例えばPBS)で、手術室での長い待ち時間は、次の細胞培養に配置されている場合、これは組織の存続を危うくし、感染力を防ぐことができます。注目すべきは、正常組織は本質的に腫瘍組織に比べて、これらの影響を受けやすいです。もう一つの重要なポイントは、組織とそのサイズの一貫性をサンプリングするために使用するコア数です。このような組織の低酸素状態とinfectectable面などの要因は、コアとコアの四半期のサイズに応じて変動しますので、サイズの不一致は、患者サンプル間のばらつきにつながる。このは部分的に組織スライサーを使用して解決することができますが、ここで説明した方法の一つの利点は簡単にamenableはないソフトや粘性組織を含めて、、それは比較的容易であることが汚染を受けにくい、と組織の種類の多様に広く適用可能であるスライス組織へ。特に、コアの数は、よりよい組織の表現を得るために増加することができます。また、コアはそのようなDNA、RNA、またはタンパク質の抽出と並行して行われるため、他の潜在的なアッセイに対応するために、より多くの部分(例えば5-8)に切断することができる。しかし、コアが再現可能なサイズにカットすることができる作品の数は、異なるサイズのcorersを使用して変更することができるコア、の実際のサイズに依存します。オプションで、再現可能なサイズの組織片を得るのに役立つ一つの方法は、より小さな部分にそれらを細分化促進するために前に定規を使用してコアの長さを均等にすることです。プロトコルは、自然に他のウイルスに対応するように変更することができると我々は、組織が実行可能になると、最大6日間レプリケーションをサポートできることを見出した。プロトコルは、さらにcytrokinesを含む他のウイルス発現導入遺伝子の測定に拡張することができます。以下の感染は、組織をさらに組織の組織学のさらなる改良を可能にし、それがどのようにウイルス感染10月12日に関連する免疫組織化学的方法により切片と染色用パラフィンに埋め込 むことができます。
開示事項
謝辞
我々は図2に示されたデータのために人間の手術標本を提供するための博士Hesham Abdelbaryに感謝したいと思います。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | コメント(省略可能) |
|---|---|---|---|
| 高グルコースDMEM | Hyclone | SH30243.01 | |
| ウシ胎仔血清 | NorthBio株式会社 | NBSF - 701 | |
| Amphothericin B液 | シグマアルドリッチ | A2942 | 0.1%で使用 |
| Pennicilin -ストレプトマイシン | シグマアルドリッチ | P4333 | 1%で使用 |
| アラマーブルー | インビトロジェン | DAL1025 | |
| D -ルシフェリンカリウム塩 | 分子イメージング製品 | D -ルシフェリンカリウム塩1グラム | 0.22μmのフィルターで10 mg / mlのとフィルターでPBSに再懸濁し |
| MEM粉末 | ギブコ | #41500018 | 使用前に0.22μmのフィルターで2X MEMとフィルタを作るの半分提案ボリュームにしてください |
| カルボキシメチルセルロース(CMC) | シグマアルドリッチ | C9481 | 脱イオン水とオートクレーブの3%溶液を作る。粉は懸濁するためには時間がかかることに注意してください |
| クマシーブリリアントブルーR | シグマアルドリッチ | B7920 | |
| 2ミリメートル生検パンチ | Miltex | MX - 33から31 | |
| ダブルエッジプレップブレード | Personna医療 | 74から0002 | |
| 蛍光disection顕微鏡 | ライカ | モデルM205 FA | |
| in vivoイメージングシステム(IVIS) で | キャリパーライフサイエンス | IVIS ® 200シリーズ | |
| 組織Tearor | Biospec製品 | モデル985370-395 |
参考文献
- Parato, K. A., Senger, D., Forsyth, P. A., Bell, J. C. Recent progress in the battle between oncolytic viruses and cancer. Nat Rev Cancer. 5, 965-976 (2005).
- Renouf, L. C., Thway, K., Sibtain, A., McNeish, I. A., Newbold, K. L., Goldsweig, H., Coffin, R., Nutting, C. M. Phase I/II study of oncolytic HSV GM-CSF in combination with radiotherapy and cisplatin in untreated stage III/IV squamous cell cancer of the head and neck. Clin Cancer Res. 16, 4005-4015 (2010).
- Lal, R., Harris, D., Postel-Vinay, S., de Bono, J. Reovirus: Rationale and clinical trial update. Curr Opin Mol Ther. 11, 532-539 (2009).
- Park, B. H., Hwang, T., Liu, T. C., Sze, D. Y., Kim, J. S., Kwon, H. C., Oh, S. Y., Han, S. Y., Yoon, J. H., Hong, S. H., Moon, A., Speth, K., Park, C., Ahn, Y. J., Daneshmand, M., Rhee, B. G., Pinedo, H. M., Bell, J. C., Kirn, D. H. Use of a targeted oncolytic poxvirus, JX-594, in patients with refractory primary or metastatic liver cancer: a phase I trial. Lancet Oncol. 9, 533-542 (2008).
- Breitbach, C. J., Reid, T., Burke, J., Bell, J. C., Kirn, D. H. Navigating the clinical development landscape for oncolytic viruses and other cancer therapeutics: no shortcuts on the road to approval. Cytokine Growth Factor Rev. 21, 85-89 (2010).
- Boeuf, F. L. e. Synergistic interaction between oncolytic viruses augments tumor killing. Mol Ther. 18, 888-895 (2010).
- Silva, N. D. e., Atkins, H., Kirn, D. H., Bell, J. C., Breitbach, C. J. Double trouble for tumours: exploiting the tumour microenvironment to enhance anticancer effect of oncolytic viruses. Cytokine Growth Factor Rev. 21, 135-141 (2010).
- Diallo, J. S. A high-throughput pharmacoviral approach identifies novel oncolytic virus sensitizers. Mol Ther. 18, 1123-1129 (2010).
- Cooke, S. L. Intra-tumour genetic heterogeneity and poor chemoradiotherapy response in cervical cancer. Br J Cancer. , (2010).
- Pennington, K., Chu, Q. D., Curiel, D. T., Li, B. D. L., Mathis, J. M. The Utility of a Tissue Slice Model System to Determine Breast Cancer Infectivity by Oncolytic Adenoviruses. J Surg Res. , 1-6 (2010).
- Hochberg, M. Tropism of herpes simplex virus type 1 to non-melanoma skin cancers. Br J Dermatol. , (2010).
- Kuip, H. v. a. n. d. e. r. Short term culture of breast cancer tissues to study the activity of the anticancer drug taxol in an intact tumor environment. BMC Cancer. 6, 86-86 (2006).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved