Method Article
大人の準備ショウジョウバエアイズ
要約
成人を準備するために標準的なアプローチショウジョウバエ目がここに表示されます。プロトコルは、眼の欠陥の総形態素解析に使用することができます、または指定された調整が目の特定の細胞タイプ(光受容体の例:クローン分析)や電子顕微鏡分析のための遺伝子の遺伝的な要件を決定するために使用することができると。
要約
ショウジョウバエは、長い間それが遺伝的に扱いやすいですしやすさが主な要因、発展を研究するモデル系として使用されています。長年にわたり、変異株とテクニカルトリックの茄多は、洗練された質問をし、妥当な時間内に応答することができるように開発されている。既知のすべての主要なシグナル伝達経路の成分の相互作用への根本的な洞察は、順方向で得られた遺伝子ショウジョウバエの研究を逆にしている。実験室の条件下では、ハエが機能して目にすることなく生き残ることができる、ので、フライアイは、例外的に突然変異解析に適していることが証明されています。さらに、昆虫の眼の表面は、解剖顕微鏡下で見たときに定期的に、滑らかな表面を形成する約800個単位の眼(ファセットやommatidiumの複数形)で構成されています。に基づいて、画面の例については、(それぞれ、または全体的な目の大きさ、(図1。"険しい目"表現型)このように、それは突然変異が外部から滑らかな表面の損失を探すことによって、眼の発生や成長に影響を及ぼす可能性があるかどうかを確認するのは簡単です。外眼部の形態は、例えば1を参照してください)。眼の表現型のそれに続く詳細な分析は、大人の目の固定、プラスチック製の埋め込みと薄切片を必要とする。
ショウジョウバエの眼は、いわゆる目の成虫原基、幼虫および蛹の段階で増殖し、分化上皮細胞の袋(審査の例2を参照)から発生する。 、4つのレンズ分泌錐体細胞、色素細胞(R -細胞のクラスターの周り"六角形")と毛、各個眼は8つの光受容体(図2 PRやR -細胞)を含む20セルで構成されています。 R8 [図であり、最も容易に光に敏感な器官によって識別されるそれぞれの個眼の光受容体、、rhabdomeresは、6つの"外"(R1 - 6)と二つの"内側の"光受容体(R7 / 8で構成された台形で構成されています2])R7の下にあるため、唯一の目の深い分野からのセクションで見られる。各ファセットの台形は、正確にその隣人と目の全体の前後と背腹軸(図3A)のものに揃えて配置されます。特に、背側と腹側(それぞれ黒と赤の矢印、)のommatidiumの複数形は、目の半分は、互いに鏡像であり、平面内細胞極性シグナリング(レビューの例3を参照)中に確立された二つのキラル形態に対応しています。
半薄い目のセクションを生成する方法(例えば図3に示したものなど)がわずかにもともとトムリンソンと4レディで記述されたものから変更されてここで説明する。それは透明な錐体細胞を除くすべての細胞の形態学的分析を行うことができます。加えて、R -細胞(図中の青矢印2および3)の顔料がR -細胞の遺伝子型のための細胞自律的マーカーとして使用することができる、したがって、遺伝子の遺伝的要件R -細胞のサブセットのこと容易に5,6を決定する。
プロトコル
1。頭部の解剖を飛ぶ
- あなたが手ですべての材料を(ゼラチンコートしたスライドを含む)があることを確認してください。グルタルアルデヒドとオスミウム固定液を準備します(下記参照)。氷の上で1.5 mlチューブに、アリコート200μlのグルタルアルデヒドの修正ソリューションを埋め込むことが遺伝子型ごと。
- CO 2パッドの上にハエを麻酔(我々は通常一頭の手順の実行中に破壊される場合には遺伝子型ごとに6を埋め込 むための7つのハエの頭を解剖する)。
- ホールドとわずかにフライの胸部を押すと、背側を上に、ピンセットで、頭部を切断する鋭いメスを使用してください。
- ピンセットで首を触れることによってフライヘッドを安定させ、慎重に片目の小さな部分をそぎ落とす。これは、固定液の浸透を高めます(あなたがクローン解析のためにあなたの目のセクションを使用する場合は、noまたは小さいクローンで目をカット)。後で区分けとなる無傷の目に触れないし、損傷を避けること。
- 目カットオフの表面にピンセットまたはメスの頭を触ると(固定液の上に浮かぶ多くの場合、ヘッド)氷の上にグルタルアルデヒド/リン酸固定液中に頭を転送解剖ヘッドが長くグルタルアルデヒドの修正に保管すべきではないオスミウムを添加する前に15分以上。同じ遺伝子型の他のハエと手順1.2から1.5を繰り返します。
2。固定と包埋(すべてのステップのために手袋を使用!)
- 10,000 rpmで1分間エッペンドルフ遠心分離機でflyheadsを回転させる。ヘッドがシンクしていない場合でも、引き続き。
- OSO 4溶液200μlのを追加し、少なくとも30分間、氷上で1時間までのために修正。
- パスツールピペットを使用して、グルタルアルデヒド/オスミウム液(廃棄物の適正処理の手順を使用することを確認してください!)削除し、200μlのオスミウム溶液を交換してください。 1から6時間氷上でインキュベートする。常に頭が完全に液体で覆われていることを確認し、頭や目が崩壊する可能性があるので、ソリューションのすべてを削除することはありません!
- パスツールピペットを使用して、氷の上に少なくとも5分(エタノール以来、廃棄物の適正処理の手順を使用することを確認して今オスミウムを含む!)のために0.5〜1ミリリットルの30%エタノールとインキュベートを追加、固定液を捨てる。
- 50%、70%、(80%)、90%と倍の100%エタノールで上記の手順を繰り返します。電子顕微鏡分析のために目を使用する場合は80%エタノールのステップが含まれています。 70%の洗浄ステップの後、サンプルを氷上から削除することができます。
- プロピレンオキサイド(揮発性、フード内で作業を続行)、同量のエタノールを交換してください。室温で10分間インキュベートする。
- 酸化プロピレンの洗浄を繰り返します。酸化プロピレンの蒸発による目の崩壊を避けるために並行して多くの遺伝子型を処理する場合のバッチで動作します。
- プロピレンオキサイドのソリューション:酸化プロピレンの大部分を除去し、プラスチック製のトランスファーピペットを使用しては、1:1の樹脂の500μL程度加える。一晩室温で平衡化させます。
3。金型の埋め込みと配置
- すべての金型をお使いの異なる遺伝子型を追跡するためにラベルが付いていることを確認し、100%の樹脂と金型を埋める。オーバーフィル(金型の表面を横切ってまっすぐ見て、金型の表面上にない"高丘")しないでください。電磁界解析のための硬質樹脂を使用してください。
- 転送ピペットを使用して、頭から50%の樹脂を除去する、100%の樹脂と置き換えると、室温で3-4時間インキュベートします。ヘッドは樹脂を浸透しているとして、彼らはチューブの底に沈むだろう。
- 少しフックを作成するために一度、ハード面に到達したつまようじを使用して、金型内に一度頭を転送する。
- 樹脂の流出から保護するために、解剖範囲の作業領域にアルミ箔を置きます。
- 解剖針を使用し、樹脂で、スコープ、スワール少し頭も探して、慎重に先の尖った端に近い金型の底部に移動します。
- 慎重に目の接線面が約半分に頭に注意しながら、金型の正面の壁にそのまま(!)目(またはあなたが断面を持つようにしたい場合はあなたの将来のセクショニング面)首の表面を下に揃える離れて鋳型壁から直径。まれに、眼の表面とヘッドのキューティクルの間に空の空間として見ることができる眼の崩壊。折りたたま目を持っている場合、 第 7 回スペア目でそれを置き換えます。
- すべてのヘッドを繰り返します。一度にすべての位置揃えを行うには、樹脂製の針を取り外したときに彼らが動いていないと確認するためにすべての目を再度確認してください。
- あなたが解剖針を取り除くときに移動するの目に問題がある場合は必要に応じて、目の位置を、すぐに少し離れて頭から針を収納してから、ゆっくりと完全に針を取り除く。
- 70℃一晩金型を焼く℃に
4。トリミングとセクショニング
- K、金型を曲げることで金型から硬化したブロックを削除します。ブロックがどの遺伝子型(小型のシンチレーションバイアル内など店舗)に対応するかを追跡しeeping。
- トリミングのために、プレキシグラスやアルミのブロックに表向きにマウントされているあなたのミクロトーム用の適切なチャックを使用してください。チャックでトリミングするブロック、上の目を、マウントします。
- テフロンコーティングされたかみそりを使用して解剖スコープの下で、あなたのブロックの唯一の最上位層を遮断、命じた。これは、目を見てくださいので、切片の将来の平面を予測できるものの明確な面を残す。あなたの指を切断しないでください!
- ヘッド周りのプラスチックのほとんどが切断されるまで(つまり、目を整列するときに金型の上部に分かれていたもの)頭の両側に、前面の余分なプラスチックを切り取ります。徐々にプラスチックの複数の薄い層を切断して頭部に近づくことが最良です。
- 、きれいなカミソリの刃を使用して慎重に後のセクションにする正確な平面で目の上から薄い層を削除する(通常は接線方向に眼に、オリジナルの金型の表面に少し角度)。
- あなただけの目の外側の表面を切り取るために開始されるまで続けます。あなたがミクロトームのアライメントが容易に輝く、透明な表面を、取得するためにブレードのクリーンエリアを使用するようにしてください。
- カミソリの刃で保存するには、ブロックの側面のまわりトリミング原油のための古いブレードを使用し、(最初のカットと4.6)トリミング罰金のための新たなブレードを使用してください。最後に、あなたの将来の断面平面に相当するわずかに傾いた、カットオフトップの3つの角錐を持つことになります。
- ミクロトームでブロックをマウントします。実際の切片はミクロトームの種類によって異なり、ここでは詳しく説明されません。我々は、0.5〜1μmのセクションをカットするヒストグラムの品質のダイヤモンドナイフでソーバルMT5000を使用してください。光学顕微鏡分析のために、切片厚のわずかな変化は重要ではありません。セクショニングのクローンが白+遺伝子、セクションによってマークされていれば、1μm以下のセクションでは、セクションごとにrhabdomeres(図2)に隣接する十分な色素顆粒を持って確保する。
- のセクションでは、水に浮くでしょう。回転運動での水面下から木製のQ -ティップの平坦化されたエンドを持つ最初の20から30のセクションを持ち上げて、ゼラチンコートしたスライドガラス(約100℃で加熱プレート上に保持に水の滴にそれらを転送する)。
- 別の20から30までのセクションで繰り返します。水が蒸発したとの項では、スライドに付着されるまで待ちます。通常、3眼のセクションでは、あるスライドにうまく収まるタウンシップの行によってつの列(3眼)(上部/下部のセクション)に配置。
5。染色および顕微鏡分析
- クローンをセクショニングの場合を除き、セクションを染色。 90設定された加熱ブロック上のセクションを持つ場所のスライド℃のスライド上に0.22μmフィルターに接続された30mlのシリンジからトルイジンブルーの染色液を分注し、10秒間染色。すぐに蒸留水で広範囲にすすいでください。空気乾燥した。
- プラスチック製のトランスファーピペットを用いて、スライド上にメディアをマウントするDPXの3滴を配布し、カバースリップでカバーしています。 3セント硬貨でトップとマウンティング培地硬化(室温で例えば一晩)ができます。
- 光学顕微鏡と画像。良いセクションを検索し、詳細な分析と撮影用63x油浸レンズに切り替えるために5倍または10倍レンズを使用してください。我々は、通常、位相コントラスト設定を使用しますが、暗視野光学系も同様に動作する。
6。代表的な結果:
最も頻繁に、目は遺伝学的スクリーニングの一部として、または一般的な眼の構造や極性のどちらかに影響を及ぼすことが知られている遺伝子との遺伝的相互作用をテストするプロセスで検出された外部険しい目の表現型の詳細な分析のためのプラスチックに埋め込まれています。目のセクションの代表的な結果を図3に示されています。野生型ommatidiumの複数形(図3A)は、色素細胞の格子に囲まれた完全な光受容体の補数を示しています。対照的に、 斜視(stbm、別名バン-ゴッホ7)変異体では、ommatidial極性がフル光受容体の補数が存在しているのにもかかわらず、失われたとされ、回転とキラリティーは、無作為化した(図3B)です。さらに、切片stbm対立遺伝子は、AWのころから-背景、顔料顆粒は、図に欠けています。 3B。図3Cは、クローン解析の例を示しています。 ショウジョウバエ Rhoキナーゼ(DROK)が目8の構造的完全性のためだけでなく、ommatidial回転に必要とされる。野生の変異-ホモ接合DROK 2クローンは色素細胞とrhabdomeres(通常は中の顔料の有無によって識別することができる、クローンが目のない - FLPと背景のwを補完強く発現して白いマーカー遺伝子を持つP -エレメントを使用して誘導される型およびヘテロ接合組織)。それは色素の欠如により、変異体領域を識別することが可能である。 R - CEにおける色素沈着の細胞自律性に起因するLLSは、前述したように、個々のR -細胞の遺伝子型は(図3Cの矢印を参照)を決定することができます。
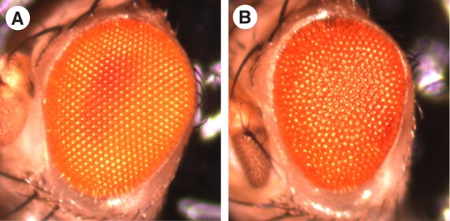
野生型の目()の滑らかな表面とは対照的に、変異体眼の表面は目の表現型の根底にあることを示し、(B)外部から頻繁に荒いです、ので、 図1。 ショウジョウバエの眼は、生物学者のための優れたモデルシステムである。すべての図では、前方は左にあり、背側は最高です。博士ジェニファーカーチス、NMSU、エルパソ、テキサス州、米国の画像の礼儀。
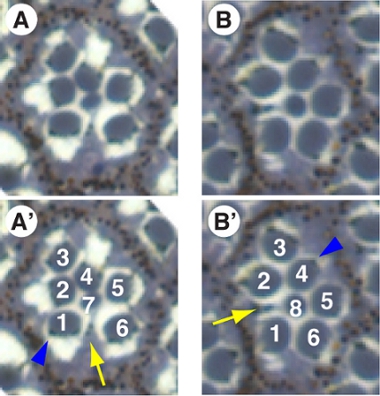
図2に記載の方法を使用して区分単ommatidiumの複数形の光学顕微鏡像。わずか7 R -細胞は、R8の上にR7嘘以来、個眼ごとに一度に表示されます。 (、')(R7レベルでは、R7の細胞体は、R1とR6の黄色の矢印)との間で検出される"。対照的に、R8のレベル(B)で、R8の細胞体は、R1とR2(B'の黄色の矢印)との間で検出される。青い矢印は細胞自律的な顔料のマーカーとして使用できる顔料の顆粒をマーク。

図3。野生型()、stbm(B)とDROK(C)変異大人ショウジョウバエのような目でタンジェンシャルセクション。セクション下の回路図はommatidiumの複数形の極性を(矢のために(A)参照)を示します。円は、感光体の補数の欠陥でommatidiumの複数形を表しています。黄色の線は、対称性(赤道)の背側/腹側のラインを表す。 ()野生型のよく指向ommatidiumの複数形とは対照的に、平面組織はstbm変異体(B)に失われます。変異体背景-示さstbmの変異体のセクションは、そのwに起因する色素を欠いていることに注意してください。 DROKの変異は致死的であるので、(C)、彼らはクローンで分析する必要があります。顔料(オープン青い矢印)を欠いているR -細胞間にこのように、色素細胞が、(青色の矢印を充填)、野生型またはヘテロ接合体であるホモ接合変異体である。回転の欠陥に加えて、DROK変異体はまた、R -細胞の欠落または過剰な数字を含めて構造的な欠陥を示しています。クローン解析のために、セクションでは顔料の粒剤を不明瞭にしないために染色されないことに注意してください。
ディスカッション
モデル生物、ヒトを含む高等真核生物で高度に保存されたシグナル伝達経路のほとんどのための必須遺伝子ファミリーの創立メンバーの多くが同定された遺伝子スクリーニングとしてショウジョウバエを用いた。 、実験室条件下で、機能的な目は生存のために不要なので、目には、新たな遺伝子機能の発見と遺伝子ネットワークの評価に特によく適し組織です。記載された方法を用いてフライアイの超微細構造解析は、このように開発し、疾患に関連する基本的な発見につながった。最初に、単一細胞クローン分析が知られている密接に関連する細胞自律的な劣性のマーカーと組み合わせたX線誘発クローンを用いて行った。さらに最近では、クローンを生成するためにFLP / FRTシステムの可用性が大幅に目のセクション6,9に致死突然変異の表現型解析を容易にした。
目のセクションの分析はここで説明する接線のセクションに限定されていません。必要に応じて、ヘッドは薄膜や延髄などの頭の中でより深い層を研究するために得られる金型と横断切片内の任意の方向に整列させることができる。ここで説明するプロトコルは、このように目と頭の構造ショウジョウバエの大人の解析のための汎用的な方法です。
開示事項
利害の衝突は宣言されません。
謝辞
私は図の写真のために博士ジェニファーカーチスを感謝したいと思います。批判的に原稿を読み取るための1とジェレミーフェイガン博士フィレンツェマーロウ。私たちの活動は、NIHの助成金1R01GM088202によってサポートされています。
資料
一般的な機器:
- 一般的なフライの飼育のために10を参照してください
- 標準的な解剖顕微鏡(例えばニコンSMZ - 645ステレオズーム顕微鏡)、好ましくは、あなたの手の影を防ぐために、リングの光源を持つ。
- 解剖時の汚れからの保護を提供するために、3MMワットマン濾紙で覆われたCO 2フライパッド、。
- ゼラチンコートしたスライド:(沸騰するのはほとんど持って、約2時間かかります)加熱板上で1Lの水で10gゼラチンと1グラムCrKSO 4 × 12 H 2 Oを溶解。ディップよく洗い(石鹸)とリンス(のdH 2 O)ゼラチン溶液と一晩箔で覆われた空気乾燥にホルダーにスライド。
- 加熱オーブン(70℃、ニトロセルロースフィルターの乾燥に使用されていた古い真空オーブンは、この目的に適している)。
- たとえば電子顕微鏡施設で使用されている極薄切片(0.5-1μm厚のセクション)、することが可能ミクロトーム。我々は、ヒストグラムの品質のダイヤモンドナイフでソーバルMT5000ウルトラミクロトームを使用してください。ガラスナイフでも動作する。
固定のソリューション:
- 0.2 Mリン酸ナトリウム緩衝液、pH7.2のストック溶液を調製。
- 0.1Mリン酸ナトリウム緩衝液、pH7.2(4週間に4℃で保存することができます)の2%グルタルアルデヒドを準備します。あなたが埋め込むしたい遺伝子型ごとに200μlのを持っている、少なくとも十分に行う。氷上に置きます。
- オスミウム溶液:2%の0.1Mリン酸ナトリウム緩衝液、pH7.2中OSO 4。ソリューションを保存することができないので、埋め込むしたい遺伝子型ごとに200μlのを持っている唯一の十分な確認。氷上に置きます。
グルタルアルデヒドとOSO 4は非常に有毒であり、十分に換気フード内で、細心の注意を払って取り扱ってください。あなたのピペットの黒化を防止するためにOSO 4を取り扱う際にはフィルター付きチップを使用してください。
脱水:30%、50%、70%、(80%)、90%、および100%エタノール溶液を作る。好ましくは、クール度30%、50%、使用前に氷上で70%エタノール。
ソリューションを染色。
1%のホウ砂のトルイジンブルーの1%です。
| Name | Company | Catalog Number | Comments |
| ソフト | ハード | ||
|---|---|---|---|
| 樹脂 | 54グラム | 50グラム | |
| 硬化剤B | 44.5グラム | 50グラム | |
| アクセラレータC | 2.5グラム | 1.75グラム | |
| 可塑剤D | 10グラム | 0.75グラム |
表1。樹脂の準備
慎重に、樹脂を調製するために、しかし十分に大きい攪拌棒とマグネチックスターラーを用いてプラスチック製ビーカーにすべての材料を混ぜる。泡を避けてください。混合後、-20℃標準シンチレーションバイアルまたは類似の容器に分注して凍結℃のあなたのEMの施設が困難製剤を要求しない限り、すべてのアプリケーションのために軟質樹脂を使用してください。 (その未重合形で発がん性)樹脂を処理するための手袋を使用してください。 70℃で一晩、機器や廃棄物に焼くの樹脂を重合する。廃棄物は、その後安全に破棄され、機器は、洗浄、再利用されることがあります。こぼれた未重合樹脂をイソプロパノールで洗浄することができます。
| 試薬 | サプライヤー | カタログ番号 |
|---|---|---|
| パッドを飛ぶ | 例えばジェネシー | 59から119 |
| グルタルアルデヒド | シグマ | G7526 - 10 X 10 ML |
| OSO 4 | Polysciences、(株) | 0972A - 20 |
| プロピレンオキシド | フィッシャー | 04332から1 |
| #3のメスハンドル、 | フィッシャー | 22080046 |
| メスの刃#11 | フィッシャー | 08から916 - 5B |
| トランスファーピペット | フィッシャー | 13から711 - 7M |
| Durcupan(R)ACM樹脂 | シグマ(フルカ) | 44610 - 1EA |
| 鋼解剖針 | フィッシャー | S17346 |
| BEEMフラット埋め込み型 | 電子顕微鏡科学。 | 70904〜12 |
| テフロン被覆かみそりの刃 | 電子顕微鏡科学。 | 71970 |
| Q -ティップ(滅菌綿棒) | フィッシャー | 14-959-81 |
| スライドガラス | フィッシャー | 12-550-143 |
| カバーはなし1、22X60 mmをスリップしない | フィッシャー | 12 - 531K |
| ゼラチン | フィッシャー | ICN96010280 |
| クロム(III)K SO 4和物 | シグマ | 243361 |
| ダイヤモンドヒストグラムナイフは6mm | Diatome米国 | 60彼の |
| トルイジンブルーO | フィッシャー | BP107 - 10 |
| ホウ砂(ナトリウムホウ) | フィッシャー | AC20629 - 1000 |
| DPX封入剤 | シグマ | 44581 - 100ML |
表2。材料
参考文献
- Harvey, K. F., Pfleger, C. M., Hariharan, I. K. The Drosophila Mst ortholog, hippo, restricts growth and cell proliferation and promotes apoptosis. Cell. 114, 457-457 (2003).
- Secombe, J., Li, L., Carlos, L., Eisenman, R. N. The Trithorax group protein Lid is a trimethyl histone H3K4 demethylase required for dMyc-induced cell growth. Genes Dev. 21, 537-537 (2007).
- Cagan, R. Principles of Drosophila eye differentiation. Curr Top Dev Biol. 89, 115-115 (2009).
- Jenny, A. Planar cell polarity signaling in the Drosophila eye. Curr Top Dev Biol. 93, 189-189 (2010).
- Tomlinson, A., Ready, D. F. Cell fate in the Drosophila Ommatidium. Dev. Biol. 123, 264-264 (1987).
- Tomlinson, A., Ready, D. F. Neuronal differentiation in the Drosophila ommatidium. Dev. Biol. 120, 366-366 (1987).
- Jenny, A., Darken, R. S., Wilson, P. A., Mlodzik, M. Prickle and Strabismus form a functional complex to generate a correct axis during planar cell polarity signaling. Embo J. 22, 4409-4409 (2003).
- Zheng, L., Zhang, J., Carthew, R. W. frizzled regulates mirror-symmetric pattern formation in the Drosophila eye. Development. 121, 3045-3045 (1995).
- Reinke, R., Zipursky, S. L. Cell-cell interaction in the Drosophila Retina: The bride of sevenless Gene is required in photoreceptor cell R8 for R7 cell development. Cell. 55, 321-321 (1988).
- Wolff, T., Rubin, G. M. strabismus, a novel gene that regulates tissue polarity and cell fate decisions in Drosophila. Development. 125, 1149-1149 (1998).
- Winter, C. G. Drosophila Rho-associated kinase (Drok) links Frizzled-mediated planar cell polarity signaling to the actin cytoskeleton. Cell. 105, 81-81 (2001).
- Xu, T., Rubin, G. M. Analysis of genetic mosaics in developing and adult Drosophila tissues. Development. 117, 1223-1223 (1993).
- Stocker, H., Gallant, P. Methods Mol Biol. Dahmann, C. 420, Springer. 27-27 (2008).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved