このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
超音波標的マイクロバブル破壊テクニック入門
要約
マイクロバブル破壊(UTMD)ターゲット超音波検査は、心臓や肝臓などの超音波にアクセス可能な臓器を標的とする治療用遺伝子を含む生理活性分子の部位特異的送達を、、、指示するために使用することができます。 1月6日。
要約
そのような目的の遺伝子をコードして負に荷電したプラスミドDNAベクターとしてUTMD、生理活性分子、で、脂質マイクロバブル造影剤7-9のカチオン性シェルに追加されます。マウスではこれらのベクトルを媒介するマイクロバブルは、心臓の左心室に静脈内投与、または直接投与することができます。大型動物ではそれらはまた冠動脈内カテーテルを通して注入することができます。循環から標的臓器へのその後の送達は、マイクロバブルの共振周波数で音響キャビテーションが発生します。それは力学的エネルギーがでたり、標的領域10の微小血管の内皮細胞との間の一時的な細孔形成におけるマイクロバブルの破壊の結果によって生成される可能性が高いようです。このソノポレーションの効果の結果として、内皮細胞へと全体のトランスフェクション効率が強化され、導入遺伝子をコードするベクターは、周囲の組織に堆積される。循環に残っているプラスミドDNAは、さらに、非超音波組織への配信の可能性を低減し、非常に特異的な標的器官のトランスフェクションにつながる血、でヌクレアーゼによる急速に分解される。
プロトコル
1。マイクロバブル株式の準備
- 10にPBSのMLSは、1gのグルコースと200 mgの1,2 - ジパルミトイル- sn -グリセロ-3 - ホスファチジルコリンと50mgの1,2 - ジパルミトイル- sn -グリセロ-3 - ホスファチジルエタノールアミンを混ぜる。
- 沸騰水浴中で混合物20〜30分、5分ごとに混合ピペットを加熱する。
- ソリューションは、最大6ヶ月までは4℃で保存することができます。
2。マイクロバブルの準備
- 40で準備したマイクロバブルストック溶液とインキュベート℃で15分間の250μlを取る。
- 予め温めておいたマイクロバブル溶液は、次いで、グリセロール50μlを含む1.5mlチューブに転送されます。
- 発現をコードするプラスミドDNAを精製1-2 mgのは、目的の遺伝子(4mg/mlの最適な濃度でキアゲンエンドトキシンフリーMegaPrepキット、キアゲン、メリーランド州ジャーマンタウン、で、この例で精製された)のために構築する。 2.4)リン酸緩衝生理食塩水は、500μlの最終容量に追加されます。エンドトキシンフリーキアゲンmaxiprepsは、無菌性を保証するために使用するだけでなく、滅菌PBSされています。
- マイクロチューブ内の空気は、オクタフルオロプロパンガスで置換されます。
- マイクロチューブを20秒間歯科融合する人で激しく振盪されています。
- マイクロバブルにバインドされていないsubnatant含む残存DNAとバッファを注意深く除去され、マイクロバブル層がアタッチされていないDNAを除去する滅菌PBSで3回洗浄し、各洗浄サイクルの間に氷の上に配置されます。我々は通常、30〜40%の結合効率を実現。すべての試薬は無菌であり、注意が汚染を最小限に抑えるために行われます。
- プラスミドDNA結合マイクロバブルは、次に使用するまで2時間のために氷の上に配置されます。
- ミキシングとPBS洗浄後のマイクロチューブから除去subnatantは、使用して260nmの波長で、このソリューションの光学密度を測定することによって、未結合のDNAの濃度、および同様に既知の初期濃度に基づいて結合量を決定するために使用することができます。分光光度計。
3。機器の校正
- 最初の使用に先立ち、1 MHzのキャビテーションのトランスデューサは、適切な機械的なインデックスとパルス繰り返しを確保するためにキャリブレーションする必要があります。 submergible 1 MHzの、13ミリメートル、焦点の合っていないトランスデューサーはパワーアンプを介して20MHzファンクション/任意波形発生器に接続されています。
- トランスデューサは、チャージアンプを経由して500 MHzのオシロスコープに接続されているハイドロフォン、で直接目的とした、水の完全なプラスチック容器に入れています。
- 波形、周波数、振幅、バーストサイクル、および電力増幅は、すべての適切なデューティサイクルとマイクロバブルの空洞を作るために最適な機械的なインデックスを取得するように変更することができます。この特定の実験では、我々は1 MHzで〜1.3と同等の機械的なインデックスにシステムをキャリブレーションしている。
4。マイクロバブルデリバリー&UTMD
- 前にマイクロバブル配信しUTMDに、C57BL / 6マウスでは、IP注射を通じてケタミン及び5mg/kgキシラジンを100mg/kgで麻酔した。
- マイクロバブルの配信は、心臓の左心室にまたは尾静脈にカテーテルを通して直接注入によって静脈内投与した。直接心臓注射の場合は、上のプラスミドDNAにロードされたマイクロバブル溶液100μlにボリュームが心臓の左心室に超音波可視化の下前歯4 番目の肋間腔に挿入された30ゲージの針を通して注入される。
- 左心室の注入に起因するマイクロバブル溶液のボーラスは、VEVO 2100イメージングシステムのVisual SonicsのVisualSonics使用して長軸像でマウスの胸部上の静止位置に配置された38 MHzの高い周波数の超音波トランスデューサー"を用いて可視化です。すべての注射器と注射針は、これらの注射のため、可能な限り無菌環境を保証する、無菌である。
- すぐに注射後、マイクロバブルの破壊は、この地域に破壊を標的に、目的の臓器の上に直接保持していた2番目の、より小さいサイズの低周波数1.0 MHzの振動子を用いて〜5分間行われます。この例では、超音波検査は、機械的に約1.3から1.5へのインデックスと同等、およびすべての20サイクルの100 msのパルス繰り返し周期で、1.0 MHzのパルス繰り返し周波数で肝臓に投与した。また、パルスは、超音波の3フレーム、すべての4から6の心臓周期のバーストにマウスのECG(この実験で示されていない)にゲートすることができます。我々は超音波のバーストの間に気泡を補給する毛細血管床を可能にするプロトコルとトランスフェクションの効率を得る。
5。代替配信方法
我々は、このようなマイクロバブルの長時間注入として、多くのインスタンスでの尾静脈を手続きの複雑さに起因する心室間注射を強調するために選択したが、jectionが好ましい方法である。マイクロバブル配信の尾静脈方式の場合、マウスは、同じ方法で麻酔です。プラスミドDNA結合マイクロバブルを含む注射器は、27ゲージの針/尾静脈カテーテルに接続されています。尾静脈カテーテルは、そのマウスの尾部に沿って右または左横静脈の遠位3分の1に挿入されます。マイクロバブルを含む注射器は、自動的に一定時間以上の解の一様なプリセットボリュームを管理する輸液ポンプに配置されます。我々は一般的に3ml/hourの速度で200 -300μlを注入する。
動物の使用
すべての動物は、関連する国内及び/またはローカルの動物福祉団体によって定義された適切な動物の習慣に従って処理され、そしてすべての動物の作品は(ハワイ動物実験用の委員会の大学、承認番号07から100に適切な委員会によって承認された-3)。適切な麻酔(ケタミン/ zylazine)を使用し、鎮痛薬(Bupivicaineとブプレノルフィンは)は、必須ではありません、利用可能であったれました。
6。代表的な結果:
UTMDを介したプラスミドDNAの配信の有効性は、構造、などでエンコードする遺伝子に応じて、さまざまな方法で評価したが、これらに限定されないが、in vivoイメージング、B - galをex vivoでの染色、及び/ またはルシフェラーゼ免疫組織学。特に、 生体内生物発光イメージングの一つをコードするプラスミド生物発光レポーター遺伝子(ルシフェラーゼ)をトランスフェクションしたマウスのシリアル遺伝子の発現の有無と持続時間を監視することができます。 in vivoイメージングシステム(IVIS)(キャリパーライフサイエンス、ホプキントン、マサチューセッツ州) では Xenogenは、生物発光イメージングに使用されます。画像は通常、すべてのマウスのUTMD媒介トランスフェクション後の最初の日を取られるし、生物発光遺伝子の発現は、システム(図1)によって、もはや視覚的に検出不可能になるまで、3〜4日に繰り返されます。生物発光イメージングのためのマウスを準備するには、マウスは、最初にルシフェラーゼレポータープローブD -ルシフェリン(キャリパーライフサイエンス)のIP注射を受信し、麻酔〜3分後。 D -ルシフェリン基質の生体内分布は、動物がIVISイメージングチャンバー内に設置され、フルボディイメージのスキャンが取られる前に〜10分間進行させる。買収時には、ホタルルシフェラーゼ/ D -ルシフェリン光化学反応から放出された光子が測定されます。図1は、またUTMD以下の肝臓の同様のIVIS生物発光イメージングを示し、そして図2は、抗ルシフェラーゼ一次抗体(Sigma - Aldrich社)とAlexFluor - 568標識二次抗体(Invitrogen)を用いてトランスフェクトされた肝臓の落射蛍光(100倍)の画像です。 。それはUTMDを介した肝トランスフェクションは、内皮細胞ではないだけに影響を与えていることを確認することは明らかですが、hepatocyes同様。
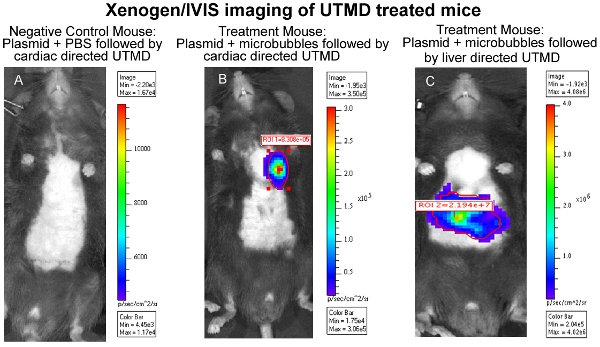
図1心臓のXenogen / IVISイメージングは、治療したマウスをUTMD(A)ネガティブコントロールマウス:。。プラスミド+ PBSは、心臓の指向性UTMD続いて、(B)治療のマウス:プラスミド+心臓が続くマイクロバブルはUTMD指示、および(C)治療のマウス:肝臓に続くプラスミド+のマイクロバブルはUTMD監督。
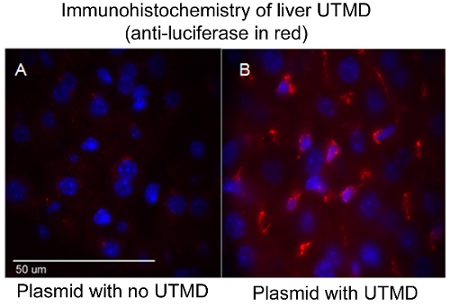
図せずUTMD 2。肝臓UTMDの免疫組織化学(赤の抗ルシフェラーゼ)。(A)プラスミド、及びUTMDと(B)プラスミド。共焦点画像(100X)、核はDAPI染色した青です。
ディスカッション
UTMDは、遺伝子デリバリーへの新しいアプローチを表しています。プラットフォーム技術としては、組織特異性の高度が望まれている生理活性分子の無数を提供するために、多くの潜在的な遺伝子治療の戦略のいずれかと組み合わせることができます。技法の主な生物学的限界は、トランスフェクションの効率が低いことです。もう一つの重要な考慮事項は、著しく骨や空気を介在すること?...
開示事項
謝辞
助成金は、NHLBI HL080532、NHLBI HL073449、NCRR RR16453、およびAHAナショナル費補助金援助賞(RVSに)含まれています。特別な感謝は、ビデオ制作ととDCDCを設立した教育グラント第P336C050047の米国務省への支援のため、距離のコースデザインとコンサルティング(DCDC)グループ、dcdcgroup.orgに拡張されます。
資料
| Name | Company | Catalog Number | Comments |
| 試薬/装置の名前 | 会社 | カタログ番号 | コメント |
|---|---|---|---|
| 1,2 - ジパルミトイル- sn -グリセロ-3 - ホスファチジルコリン | シグマアルドリッチ | P - 5911 | マイクロバブル脂質の殻の成分 |
| 1,2 - ジパルミトイル- sn -グリセロ-3 - ホスファチジルエタノールアミン | シグマアルドリッチ | P - 3275 | マイクロバブル脂質の殻の成分 |
| グルコース | シグマアルドリッチ | G5400 | マイクロバブルを安定化すると考えられて |
| リン酸緩衝食塩水 | シグマアルドリッチ | P5368 | |
| グリセロール | シグマアルドリッチ | G5516 | 合体からマイクロバブルを防止するためと考えられ |
| オクタフルオロプロパンガス | Airgasの | N / | 臨床アプリケーションで使用される不活性ガス |
| VialMix歯科融合する人 | ブリストルマイヤーズスクイブ | N / | |
| 1 MHzの、13ミリメートル、焦点の合っていない変換器 | オリンポス | A303S - SU | |
| 20MHzファンクション/任意波形発生器 | アジレント | 33220A | |
| パワーアンプ | クルーン-ハイト(株) | モデル7500 | |
| ハイドロフォン | ブリュエルケアーと | タイプ1803 | |
| チャージアンプ | ブリュエルケアーと | タイプ2634 | |
| 500 MHzのオシロスコープ | レクロイ | 9354L | |
| 34 MHzのトランスデューサとVisualSonics"VEVO 2100イメージングシステム | VisualSonics | 2100 | |
| 27G 1インチ尾静脈カテーテル | VisualSonics | N / | |
| 精霊プラス輸液ポンプ | ケントサイエンティフィック | GENIE |
参考文献
- Bekeredjian, R., Chen, S., Frenkel, P. A., Grayburn, P. A., Shohet, R. V. Ultrasound-targeted microbubble destruction can repeatedly direct highly specific plasmid expression to the heart. Circulation. 108, 1022-1026 (2003).
- Bekeredjian, R., Katus, H. A., Kuecherer, H. F. Therapeutic use of ultrasound targeted microbubble destruction: a review of non-cardiac applications. Ultraschall Med. 27, 134-140 (2006).
- Chen, S. Regeneration of pancreatic islets in vivo by ultrasound-targeted gene therapy. Gene Ther. 17, 1411-1420 (2010).
- Miao, C. H. Ultrasound enhances gene delivery of human factor IX plasmid. Hum Gene Ther. 16, 893-905 (2005).
- Shimoda, M., Chen, S., Noguchi, H., Matsumoto, S., Grayburn, P. A. In vivo non-viral gene delivery of human vascular endothelial growth factor improves revascularisation and restoration of euglycaemia after human islet transplantation into mouse liver. Diabetologia. 53, 1669-1679 (2010).
- Shohet, R. V. Echocardiographic destruction of albumin microbubbles directs gene delivery to the myocardium. Circulation. 101, 2554-2556 (2000).
- Sirsi, S., Borden, M. Microbubble Compositions, Properties and Biomedical Applications. Bubble Sci Eng Technol. 1, 3-17 (2009).
- Li, H. L. Ultrasound-targeted microbubble destruction enhances AAV-mediated gene transfection in human RPE cells in vitro and rat retina in vivo. Gene Ther. 16, 1146-1153 (2009).
- Lindner, J. R. Microbubbles in medical imaging: current applications and future directions. Nat Rev Drug Discov. 3, 527-532 (2004).
- Newman, C. M., Bettinger, T. Gene therapy progress and prospects: ultrasound for gene transfer. Gene Ther. 14, 465-475 (2007).
- Vancraeynest, D. Myocardial injury induced by ultrasound-targeted microbubble destruction: evidence for the contribution of myocardial ischemia. Ultrasound Med Biol. 35, 672-679 (2009).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved