このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
ヒト胚性幹細胞集団から肝細胞様細胞の堅牢な生成
要約
この記事では、ヒト胚性幹細胞集団からヒト肝内胚葉の発生に焦点を当てます。
要約
モデリング人間の薬物毒性の進歩にもかかわらず、多くの化合物は、予期せぬ副作用のために臨床試験中に失敗する。臨床試験の費用はかなりのもの、従ってそれはより多くの予測毒性学スクリーンを開発し、薬剤開発(Greenhoughら2010)で早い段階で展開されていることが不可欠です。ヒト肝細胞は、薬物の毒性を評価するための現在のゴールドスタンダードモデルを表していますが、変数機能を発揮する限られたリソースです。そのため、不死化細胞株や動物の組織モデルの使用が日常的に多量のために採用されている。両方のソースが有益であるが、彼らは貧しい機能、種の変動および/または培養における不安定性(ダルゲティら2009)によって制限されています。多能性幹細胞(PSCは)細胞などのヒト肝細胞の魅力的な代替ソース(HLCs)(Medineら2010)です。 PSCは自己再生し、成人で見つかったすべての体細胞型へ分化することが可能であり、それによって表しています分化した細胞の潜在的に無尽蔵の源。我々は、自動化と収量機能性ヒトHLCs(;フレッチャーら2008; Hannounら2010; Payne氏ら2011年とヘイら2011ヘイら2008)の影響を受けやすい、高効率、簡単な手続きを開発した。私たちは、私たちの技術が創薬、疾病のモデリング、体外装置の建設とおそらく細胞ベースの移植療法のためのHLCsのスケーラブルな生産につながると信じています。
プロトコル
1。すべての化学物質の株式や文化プラスチック容器のコーティングの初期準備
すべてのステップは、無菌条件下で組織培養フード内で行われる。
- 人間の塩基性線維芽細胞増殖因子の調製(hbFGF)
- 0.22μmフィルターを通してPBSとフィルタで10%BSA溶液を調製します。
- 10%BSA溶液からの0.2%BSA溶液を調製。
- 10 mLの0.2%BSA solution/100μgのhbFGFを追加。
- プリウェット0.22μmのフィルターを通して5mLの10%BSA溶液をフィルタリングすることにより、フィルタ。 10 mLのBSA洗浄を捨てる。
- あらかじめ洗浄フィルターを通してhbFGFをフィルタリングする。
- 分注し-20℃で滅菌eppendorfsとストア内のhbFGF
- 人間のアクチビンストック溶液の調製
- シリンジとフィルタープレウェットに0.2%BSAを1mLを追加。
- アクチビン100μg/ mLの原液濃度〜0.2%のBSAを希釈する。
- 活動をフィルタリング滅菌eppendorfsのnソリューションと注し、-20℃で保存
- マウスのWnt3aストック溶液の調製
- 10μg/ mLの原液濃度へのWnt3aの2μgのバイアルにPBS 200μlを加え。
- -20℃で滅菌eppendorfsとストア内の一定分量
- ヒトHGFストック溶液の調製(1000X)
- 10μg/ mLの原液濃度にPBSでHGFを希釈する。
- 滅菌eppendorfsでHGFのソリューションと注し、-20℃で保存をフィルタリング
- オンコスタチンMのストック溶液の調製(1000X)
- 20μg/ mLの原液濃度にPBSでOSMを希釈する。
- 滅菌eppendorfsのOSMソリューションと注し、-20℃で保存をフィルタリング
- マトリゲルで培養プラスチック容器のコーティング
- 4℃で一晩マトリゲルの10mLのストックボトルを融解氷の上でCしてから、KO - DMEM 10mLを加える。冷やしたピペットと店舗1を使用して、よく混ぜる-20℃で1mlのアリコート
- 4のマトリゲルの分量℃で少なくとも2時間またはゲルの形成を回避するために一晩を解凍。
- マトリゲルにコールドKO - DMEM 5 mLを加え、ピペットでよく混ぜる。
- コールドKO - DMEMとピペットを使ってミックスを15 mLに構成しています。
- (表(I))コーティングするプレートまたはフラスコにマトリゲルを追加
| プレート/フラスコ | ボリューム/ウェルまたはフラスコ |
| 12ウェルプレート | ウェル当たり0.5mLの |
| 6ウェルプレート | ウェル当たり1 mLの |
| 25センチメートル2フラスコ | フラスコあたり2 mLの |
ヒトES細胞培養用コーティング標準的なプラスチック容器のためのマトリゲルの表は1推奨量。
- 4℃一晩コーティングしたプレートまたはフラスコをインキュベート° Cまたは部屋を使用前に1時間tempature。
- マトリゲルでコーティングされたプレートまたはフラスコは、最大1週間は4℃で保存することができます。彼らは明らかに彼らがコーティングされた日付とラベルする必要があります。一週間以内に使用していないプレートまたはフラスコを破棄する。
- 使用前にコーティングされた培養容器は、組織培養フードの内部に室温に出てくることができます。
- マトリゲルを吸引し、ウェルまたはフラスコに細胞懸濁液を追加使用する直前に。
2。ヒトES細胞の培養と特性評価の定期的なメンテナンス
- ヒトES細胞株の蘇生
- 液体窒素貯蔵からヒトESを削除するとすぐに37℃の水浴で解凍。
- 暖かい培地の数mLを含有する滅菌チューブに慎重に細胞懸濁液を移す。
- ペレット遠心分離により細胞を5分間の@低速(1000 RPM)。
- 上清と非常に軽くresusをオフに吸引する暖かいES培地およびMEFフィーダー層上にプレートアウトに細胞を保留。
- 新鮮なES培地とし、subconfluence時に毎日再供給する細胞、細胞、細胞は継代が必要です。
- ルーチンhESCのメンテナンス
ES細胞をマトリゲルをコートしたプレートまたはフラスコで栽培されています。細胞は日々検討し、供給する必要があります。- 汚染、細胞の形態と合流するための顕微鏡下で調べます。
- 使用済み培地を吸引除去する。
- 新鮮なマウス胚線維芽細胞条件培地(MEF - CM)+ヒトbFGF(最終濃度4 ng / mL)をまたは他の無血清培地6の適切なボリュームを追加します。
- コラゲナーゼとの継代細胞
hESCの線は(H1、H9とRCM - 1)1時03分割比で継代以下のすべての5〜7日間コンフルエントに到達します。間質の存在下で初期継代ヒトESが遅く成長するとマトリゲル上で時間が重要な要素になることができます。人間のES細胞は、長い14よりも状態のままにしないでくださいマトリックス分解による同マトリゲル上に日と細胞がサブコンフルエントな場合は、このインスタンスでは、1:1または1:2の分割比での細胞継代する必要があります。
酵素のインキュベーション- すべてのステップは、無菌条件下で組織培養フード内で行われる。
- 1.6節あたりのように調製された新しいマトリゲルコートしたディッシュまたはフラスコがあることを確認してください。
- 細胞のために必要なスプリット比を決定します。多くの要因は、スプリット比を決定に関与している。
- コロニーの数が少ないと間質の高いレベルは:小さいだけでなくサイズに戻す継代することができますまたはいくつかの基質を取り除くため、ヒトES細胞の成長を促進する、間質比に植民地を増加させる1:1で継代することができます。
- 十分な大きさのヒトES細胞のコロニーが存在する場合、大規模なコロニーと間質の高いレベルは、コロニーの数に応じて、1:1または1:2を継代することができます。
- 少しSTRを持つ典型的な成長ヒトES細胞omaやない間質および/またはいくつかの分化は、1:2または3を継代することができます。
- よくまたはフラスコから培地を吸引除去する。
- 2 MLS PBS( -のMgCl 2、- CaCl 2で )で1回洗浄する。
- コラゲナーゼの適切な量を(200 U / mLのKO - DMEM中に希釈)を加え、37℃で2〜5分間のためのC。 2分から以降は、顕微鏡(1分間隔)で定期的に調べる。時点で、分化した細胞は、離陸を開始し、コロニーは、細胞は継代する準備ができているエッジで持ち上げ始める。
- コラゲナーゼを吸引除去する。
- 2 MLS PBS( -のMgCl 2、- CaCl 2で )で1回洗浄する。
- スプリット比に応じて、MEF - CMの適切な量を追加し、そして物理的によくまたはフラスコの表面から細胞を除去するセルスクレーパーを使用して、その後、genをひいて粉にするtly 10 mLのピペットを使用して2〜3回上下にピペッティングにより。ヒトES細胞は、細胞の塊に保持され、単一細胞に分割されていないことが重要です。
- 新しいマトリゲルコートフラスコまたは井戸の上に得られた細胞懸濁液をReplate。
- 最大で6ウェルプレートのウェルに4 mLのMEF - CMの音量を行います。
- ときに細胞をインキュベーターに配置すると、コロニーは、細胞の再播種し、分化に影響を及ぼす組織培養プレート/フラスコの中心地に定住する傾向があるので、できる限りであってもコロニーの分布を確保するために組織培養容器を振とうする。
- フローサイトメトリーによるヒトES細胞の集団のルーチン特性評価
- ヒトES細胞の集団は、10月3日/ 4、テリグマン1から60およびSSEA - 4のような幹細胞マーカーのための月に一度、フローサイトメトリーを介して調べられます。
- ヒトES細胞集団はトリプシン/ EDTA(Invitrogen社)で5分間処理後の単細胞懸濁液として、その基板から削除されます。
- 0.1%BSAおよび0.1%アジ化ナトリウムを添加したPBSで1 × 10 6細胞/ mLでの単一細胞を再懸濁します。
- 40分のための適切な抗体で4℃で細胞調製物をインキュベートする。
- PBSは、未結合抗体を除去し、100μLの最終容量に再懸濁し、フローサイトメトリーで分析するために0.1%BSAおよび0.1%アジ化ナトリウムを添加した細胞を2回洗浄する。
- 30000〜40000"ライブ"イベントのデータは、FACSキャリバーサイトメーター488 nmのレーザーを装備し、CellQuestソフトウェア(Becton Dickinson社、サンノゼ、CA)を用いて分析を用いて各サンプルのために取得されます。未染色細胞をコントロールとして含まれています。破片と一緒に死んだとアポトーシス細胞は、前方散乱と側方散乱パラメータの電子のライブゲートを使用して分析から除外した。
3。差別肝内胚葉へのヒトESの評価作業を容易に
- 肝内胚葉へのヒトESの分化のためのメディアの準備。すべてのメディアの準備は、無菌条件下で組織培養フード内で行ってください。
- RPMIの準備:内胚葉分化のためのB27プライミング媒体
- RPMI - B27培地、ミックスRPMI 1640(500mL)およびB27(50倍、10mL)を用
- 成分を混合する渦巻。
- 真空下でのフィルタユニットとフィルター、4℃で保存するすべてのコンポーネントを追加します。
- 肝細胞分化のためのSR - DMSOの培地の調製
- SR - DMSOの培地の場合は、KO - DMEM、20%KO - SR、0.5%L -グルタミン、1%非必須アミノ酸、0.1mmのβ-メルカプトエタノール、1%DMSO 80%をミックス。
- 必要に応じて-20℃でvacum、4℃で保存し、分注してストアの下にあるソリューションをフィルタリングする。
- 4mLのウェルあたりの6ウェルプレート、およびT25フラスコあたり6 mLを使用してください。
- HEPA用L15成熟培地の調製tocyte成熟
- のためのL - 15培地、ミックス500 mLのリーボビッツL - 15培地、トリプトースリン酸培養液(最終濃度8.3%)、熱不活性化ウシ胎児血清(最終濃度8.3%)、10μMのヒドロコルチゾン21 -ヘミスクシネート、1μMのインスリン(ウシ膵臓)、1%L -グルタミン、0.2%アスコルビン酸。
- 必要に応じて-20℃でvacum、4℃で保存し、分注してストアの下にあるソリューションをフィルタリングする。
- 最後のRPMIの準備:B27プライミング媒体
- 実験(6ウェルプレートのウェルあたり1mL、およびT25フラスコあたり2 mLの)のためにプライミング液の必要量を分注する。
- は100 ng / mlの最終濃度にアクチビン追加。
- 50 ng / mLの最終濃度に組換えのWnt3aを追加。
- よく混和して、メディアが使用できるようになりました。
- この最終的なメディアは、毎日新鮮で構成する必要があります。
- 最終的なL - 15成熟培地の調製
- 必要なディスペンス実験(6ウェルプレートのウェルあたり4 mLを加え、T25フラスコあたり6 mL)にするためのL - 15培地の容積。
- は10 ng / mlの最終濃度にHGFを追加。
- 20 ng / mLの最終濃度にOSMを追加。
- よく混和して、メディアが使用できるようになりました。
- この最終的なメディアは、毎日新鮮で構成する必要があります。
- RPMIの準備:内胚葉分化のためのB27プライミング媒体
- 内胚葉へのプライミングヒトES
- 文化ヒトES細胞(H1、H9とRCM - 1)とbFGFを添加したマウス胚性線維芽細胞MEF - CMでマトリゲルコートしたプレートに伝播する。
- 100 ng / mLのアクチビンおよび50 ng / mLのを補充したヒトES細胞のプライミングの培地でMEF - CMを置き換えることにより、約30%-60%(hESCのラインに応じて)のコンフルエントレベルに達すると肝分化を開始する(RPMI 1640 - B27 Wnt3aは。
- 細胞は、(24時間ごとに培地を変える)3日間プライミングの培地で培養され、アクチビンとのWnt3aによる最終的なプライミングの培地は毎日新鮮で構成されています。 プライミングの培地で72時間後、5日間(48時間毎に培地を変更)するための第2分化培地(SR - DMSO)に培地を変更してください。
- 8日目文化9日間は10 ng / mLのhHGFと20 ng / mLにOSMを添加した成熟と維持培地中の細胞(L - 15)(48時間ごとに培地を変えること)で。 hHGFとOSMと成熟と維持培地は毎日新鮮で構成されています。
- 細胞は徐々に先端のとがった/三角形の形状からポリゴン外観(図2A)を表示する特徴的な肝臓の形態に形態変化を示す。
- 肝細胞分化のための回路図:

4。ヒトES細胞由来の肝内胚葉のキャラクタリゼーション
- 免疫染色
- 各洗浄、PBSで2回1分のhESC由来HLCsを洗ってください。
- (セル、室温で20分間、4%PFAでHLCsを修正sは、4℃でPBS中で保存され、)後日染色することができます。細胞はまた、-20℃で10分間氷冷メタノールで固定することができます
- PBS、各洗浄5分で細胞を2回洗浄する。
- 核染色(メタノール固定を使用する場合は、このステップは不要です)の100%エタノールで室温で2分間細胞をインキュベートする。
- PBS、各洗浄5分で細胞を2回洗浄する。
- 室温で1時間PBS / T(0.1%のTween)/ 10%BSAで細胞をブロックする。
- ブロッキングバッファーを削除し、室温で2時間PBS / T(0.1%のTween)/ 1%BSAとインキュベートで希釈したそれぞれの一次抗体を加える、または一晩4℃で撹拌しながらC。
- 細胞をPBS / T(0.1%のTween)/室温で1%BSA、5分ごとに洗浄と3回洗浄する。
- 攪拌しながら、暗所で室温で1時間細胞をインキュベートするためにPBSで希釈した適切な二次のAlexa Fluor ®抗体(1:400)を追加します。
- 細胞をPBSで3回、5分間ずつ洗浄を洗う。
- MOWIOL 4から88とDAPI(1:1000)で各ウェルをマウントします。すべての気泡が4で削除され、ストアされることを保証するために軽くカバーを押して° Cの暗所で、カバースリップをうまくカバーしています。
- RNAの分離と抽出
- PBSと吸引によるヒトES細胞由来のHLCsを洗ってください。
- TRIZOL試薬1 mLを加え、5分間室温でインキュベートする。
- 1.5mlエッペンドルフ(-80℃で保存、必要に応じて後で使用するため)で、細胞と場所をこすり落とす。
- エッペンドルフして転倒混和するクロロホルム0.5 mLを加え、これはドラフト内で行われていることを確認します。
- 4℃で15分間13,000 rpmで解決策を遠心℃に
- きれいなエッペンドルフに水層と場所を収集、インターフェースからの汚染がないことを確認してください。
- 析出に室温で10分間のまま、反転により1イソプロパノールの添加及び混合を追加します。テートRNA。
- 4℃で10分間13,000 rpmで遠心する℃、
- 上清を吸引除去し、RNAペレットを妨害しないことを確認してください。 70%エタノール0.5 mLで洗い、室温で5分間おきます。
- 4℃で5分間8000回転で遠心分離℃に
- エタノールを吸引除去し、5〜10分間室温で乾燥させるままに。
- 一度、すべてのエタノールが蒸発して、脱イオン水30μlにペレットを再懸濁します。 ° C、後で使用するために-80 RNAを保管してください。
- 光度計を用いてRNA濃度を定量化する。
- 逆転写PCR
- 以前に単離されたRNA(200 ng)を、ランダムヘキサマー、ヌクレオチド(10mMの)逆転写酵素と薄肉0.5mLのエッペンドルフにそれぞれのバッファを使用して反応をセットアップします。
- 負のRT、逆転写酵素なしで上記の反応を設定します。
- サーモサイクラー、PCR機にチューブをセットし、次のpを設定するrogram:
- 37℃ - 5分(1サイクル)
- 42 ° C - 1時間(1サイクル)
- 95℃ - 5分(1サイクル)
- 必要に応じて後で使用するために-20℃でのcDNAを保管してください。
- 分化プロトコルを通じて異なる時点でのTaqMan定量的逆転写ポリメラーゼ連鎖反応の収穫は、細胞。 RNAを抽出し、オンデマンドで以下のプライマーおよびアッセイ、(アプライドバイオシステムズ社)プロトコルを用いた逆転写定量PCRを行う。
- 10月4日Hs03005111_g1
- NanogのHs02387400_g1
- アルブミンHs00910225_m1
- α-フェトプロテインHs00173490_m1
RNAの分離と抽出のためにセクション3.3.2を参照してください
- 逆転写およびTaqMan定量PCR
- RNA1μgを取るとInvitrogenの上付きIII逆転写を用いてcDNAに転写するの逆キット、メーカーの指示に従って。
- アプライドバイオシステムズ、18SリボソームコントロールプライマーおよびROXとInvitrogenの2倍プラチナ定量PCRスーパーミックスUDGから適切なプライマーと水の適切なボリュームで構成された25μlののTaqMan反応で使用されているcDNAを1μlの。
- よく混和して、いずれかの96または384ウェル定量PCRプレートの2つのウェルに各サンプル10μlを置きます。
- すべてのサンプルは)ロードされ、加えて適切なコントロールがされると、プレートをシールし、アプライドバイオシステムズ社7900HTのTaqManマシン上で分析する。
- 結果は、対照試料上の相対的な式として表されます。
- -ヒトES細胞由来肝内胚葉の機能解析は、P450アッセイシトクロムhttp://www.promega.com/tbs/tb325/tb325.pdfを
- HEで、37で5時間、特定の基質を用いて、派生17日目のhESC ° C(N = 3)インキュベートする。として組織培養培地を使用して、37ネガティブコントロールとインキュベート℃で5時間。
- 上清を収集し、メーカーの指示に従ってアッセイを行う。
- 基礎活性の相対的なレベルを測定し、BCAアッセイ(http://www.piercenet.com/products/browse.cfm?fldID=02020101)によって決定されるあたりのmgのタンパク質に正規化する。
ノート
- すべてのボリュームを6ウェルプレートフォーマットに基づいています。必要なプレートまたはフラスコのためにそれに応じてボリュームを調整します。
- すべてのプライミング、分化と成熟培地は使用前に真空下で濾過される。
- プライミング、分化と成熟培地は4℃で保存されています℃で2週間以上、もはや用。培地は、将来の使用のために-20℃での実験と注し、残りのメディアや店舗に必要とされるどの程度評価する。
- マトリゲルは、メーカーの指示に従って構成され、1mlのアリコートは、使用時まで-20℃で保存することができます。
- グロ一度作ら及び小分けWTHの要因は、-20℃で保存することができますし、解凍したときには、4℃で保存することができます℃で2週間以上、もはや用のC。
- 通常、ヒトES細胞由来のHLCsを特徴付けるために使用される一次抗体(1:250、Sigma - Aldrich社、セントルイス、MO)アルブミンです。
5。代表的な結果:
肝分化する前に維持するヒトES細胞のキャラクタリゼーション
本研究で使用されているH9ヒトES細胞の幹細胞の状態を特徴付けるために我々は、パラメータの数を調べた。細胞はヒトES細胞の形態、定義されたコロニー(図1A)に成長している小さな、すし詰め状態の細胞を示し、多能性幹細胞の遺伝子マーカー、10月- 3 / 4とNanogを(図1B)表明した。我々は、H7のhESCのライン陽性対照と比較してこれらの遺伝子の発現に有意差を見つけることができませんでした。さらに、ヒトES細胞の人口の90.1%が幹細胞のマーカーSSEA - 4(図1C)のための陽性であった。
氏肝内胚葉へのSCの分化
ヒト胚性幹細胞を効率的にin vitroでの肝内胚葉(ヘイら2008)に分化させることができる。分化の9日目では、細胞を採取しHLCsへのヒトES細胞の分化を評価した。既報の通りヒトES細胞は、深遠な形態学的変化のシリーズを展示し、9日目で、多角形の外観(図2A)を開発する早期の肝細胞形態を示した。また、9日の時間の経過とともに月から3 / 4のダウンレギュレーションは、(図2B)が観察された。対照的に、肝臓の転写産物AFPとアルブミンは、7日目以降からアップレギュレート(図2C)であった。
肝内胚葉の体外成熟
肝内胚葉は、確立された手順(ヘイら2008)を用いてin vitroで成熟された。分化培養の最終日に人間の肝臓のマーカーアルブミン、AFPおよびE -カドヘリンのために免疫染色を行った。私たちを使用してHLCsの収量手順は、通常、90%(;アヌーンら2010; Payne氏ら2011ヘイら2008)です。 HLCsはアルブミン、α-フェトプロテインおよびE -カドヘリン(図3)に対して陽性に染色。
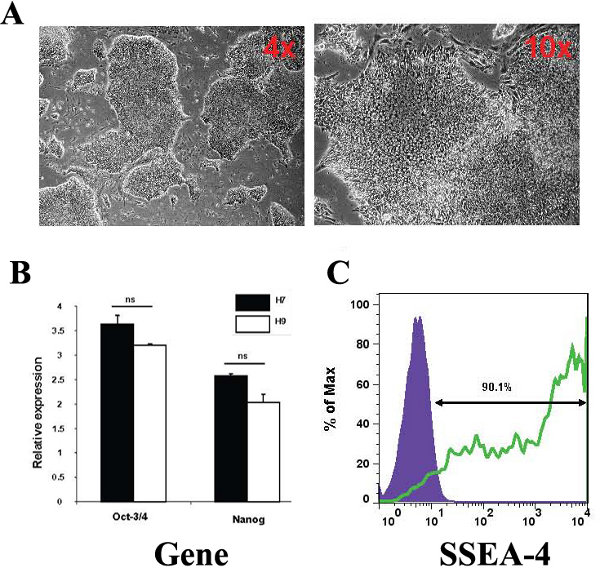
図1。本研究で使用されるヒトES細胞のキャラクタリゼーション。 (A)ヒトES細胞の形態の位相差顕微鏡画像の代表は、4倍と10倍の倍率で文化の中で観察された。画像はニコンTE3000 / U倒立顕微鏡を用いて捕獲された(B)培養したヒトES細胞は、正八量体(10 - 3 / 4)正とNanogです。 H7ヒトES細胞は多能性遺伝子の発現レベルのコントロールとして使用した。相対的な発現は、β- 2ミクログロブリン、内因性遺伝子の制御と比較して誘導のひだを指します。(C)FACSプロットはステージの特定胚性抗原SSEA 4を含む、ヒトES細胞の表面マーカーの発現レベルを示す。
69/2969fig2.jpg"/>
図2。 (A)× 4と× 10の倍率での培養で観察される分化の9日目でヒトES細胞由来の肝内胚葉の形態、の位相差顕微鏡の代表的なイメージを。遺伝子発現の変化(B)キャラ。プログレッシブ未分化細胞の遺伝子発現のダウンレギュレーション(10 - 3 / 4)と肝細胞の遺伝子発現の(C)アップレギュレーションを(アルブミンとα-フェトプロテイン)を示す、定量的ポリメラーゼ連鎖反応によってRNAを抽出し、cDNAを解析した。相対的な発現は、内在性遺伝子制御、分化の0日目β- 2ミクログロブリンと比較して誘導のひだを指します。 P <0.05は、*と表記されており、P <0.001は0日目でヒトES細胞に比べて生徒のt検定により測定された***が示されます。エラーバーは1標準偏差を表しています。
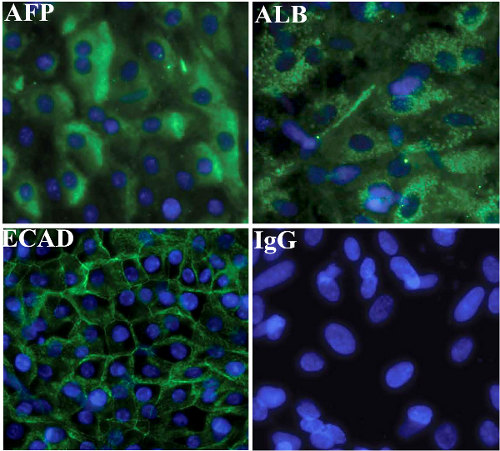
図3。 CHヒトES細胞由来の肝内胚葉のaracterisation
肝細胞マーカー、アルブミン、AFPとヒトES細胞におけるE -カドヘリン(H9)由来の肝内胚葉の発現を示す免疫細胞化学。ネガティブコントロールは、対応する免疫グロブリンG(IgG)と画像が表示されている代表者で行われた。
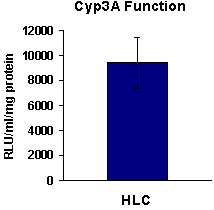
図4ヒトES細胞(H9)由来HLCsは、代謝活性を示す。 17日目で、HLCsに分化H9は、CYP3A代謝活性(N = 6)を示した。
ディスカッション
私たちは、人間のHLCsのスケーラブルなレベルを生成するために、単純な均質およびin vitroで再現性の高いモデルを開発した。我々のモデルは、外部の協力研究室の数によって検証されています。我々は日常的に発達マーカーと肝特異的機能アッセイ(これのほとんどが市販されている)の私達の家のツールボックスを使用して幹細胞由来のHLCsを特徴付ける。私たちのプロセスの重要な...
開示事項
利害の衝突は宣言されません。
謝辞
博士ヘイは博士西、RCUKフェローシップによってサポートされていました外科でサポートされていた、博士MedineはBHFコア基金からの助成金によって支えられて、氏バルタザルLucendo - VillarinはMRC博士Studenshipによってサポートされていました。博士周は、中国政府からの奨学金によって支えられている。
資料
マトリゲルコーティングプレートとフラスコ
- マトリゲル(10 mLを、BD Biosciences社、英国)、-20℃で保存
- KO - DMEM(500mLの、ギブコ、Invitrogen社、英国)、4℃で保存します。
- 組織培養プレート(ウェル6、ウェル12、コーニング、英国)
- 組織培養フラスコ(ベント25平方センチメートル、コーニング、英国)
hESCのメンテナンス
- マウス胚性線維芽細胞条件培地(MEF - CM)(100mLの、R&Dシステムズ社、米国)、-20℃で保存します。
- BSA溶液(50mL、シグマアルドリッチ、英国)、4℃で保存します。
- 人間の塩基性線維芽細胞増殖因子(100μgを、Peprotech社製、米国)、-20℃で保存
コラゲナーゼで継代ヒトES細胞
- ヒトES細胞のコンフルエントよくまたはフラスコ。
- 必要に応じて、マトリゲル被覆ウェルまたはフラスコ。
- Phospate緩衝生理食塩水(- MgCl 2の 、 -のCaCl 2)(500mLの、ギブコ、Invitrogen社、英国)、室温で保管。
- コラゲナーゼIV(1グラム、ギブコ、Invitrogen、英国)、4℃で保存します。
- マウス胚性線維芽細胞条件培地(MEF - CM)(100mLの、R&Dシステムズ社、米国)。
- 人間の塩基性線維芽細胞増殖因子(100μgを、Peprotech社製、米国)。
肝内胚葉へのヒトESの分化
- RPMI 1640(500 mLを、ギブコ、Invitrogen社、英国)、4℃で保存します。
- B27サプリメント(10 mLを、ギブコ、Invitrogen社、英国)、-20℃で保存
- アクチビンA(2μgを、Peprotech社製、米国)、-20℃で保存します。
- 組換えマウスのWnt3a(2μgを、R&Dシステムズ社、米国)、-20℃で保存
- KO - DMEM(500mLの、ギブコ、Invitrogen社、英国)、4℃で保存します。
- KO - SR(500mLの、ギブコ、Invitrogen社、英国)、-20℃で保存
- 非必須アミノ酸(100mLの、ギブコ、Invitrogen社、英国)、4℃で保存します。
- β-メルカプトエタノール(10 mLを、ギブコ、Invitrogen社、英国)、4℃で保存します。
- DMSO(シグマアルドリッチ、英国)、室温で保管
- リーボビッツL - 15培地(500mLの、SIGMアルドリッチ、英国)、4℃で保存します。
- トリプトースリン酸塩ブロス(100mLの、シグマアルドリッチ、英国)、4℃で保存します。
- 胎児ウシ血清、不活化熱(500mLの、ギブコ、Invitrogen社、英国)、-20℃で保存
- ヒドロコルチゾン21 -ヘミサクシネート(100mgを、シグマアルドリッチ、英国)、-20℃で保存
- インスリン(ウシ膵臓)(100 mgの、シグマアルドリッチ、英国)、-20℃で保存
- L -グルタミン(100mLの、ギブコ、Invitrogen社、英国)、-20℃で保存
- アスコルビン酸(25グラム、シグマアルドリッチ、英国)、-20℃で保存します。
- ヒトHGF(10μgを、Peprotech社製、米国)、-20℃で保存
- 組換えヒトオンコスタチンM(OSM)(50μgの、R&Dシステムズ社、米国)、-20℃で保存します。
- シリンジは、フィルタユニット0.22μmの(ミリポア、英国)を駆動
ヒトES細胞由来の肝内胚葉のキャラクタリゼーション
免疫染色
- リン酸緩衝生理食塩水(- MgCl 2の 、 -のCaCl 2)(500mLの、ギブコ、Invitrogen社、英国)、STO室温で再。
- PBST、PBS、0.1%Tween 20(Sigma - Aldrich社、英国)で構成さ。
- パラホルムアルデヒド(PFA)(Sigma - Aldrich社、英国)をPBSで構成され、店舗-20℃
- グリセロール(Sigma - Aldrich社、英国)、室温で保管。
- トリスベース(Sigma - Aldrich社、英国)、室温で保管。
- エタノール
- 血清(ABD Serotech、英国)、-20℃で保存
- 二次抗体、Alexaのフルオロフォア(Molecular Probes社、Invitrogen社、英国)。
- MOWIOL 4から88は(Polysciences社、米国)あたりの製造業者の指示としてトリスHCLとグリセロールで構成されています。 DAPI(ピアース、サーモフィッシャーサイエンティフィック、英国)は、1:1000希釈でMOWIOL溶液に添加される。
| Name | Company | Catalog Number | Comments |
| 一次抗体 | |||
| 抗原* | タイプ | サプライヤー | 希釈 |
| ALB | モノクローナルマウス | シグマアルドリッチ | 1月5日00 |
| E -カドヘリン | モノクローナルマウス | ミリポア | 100分の1 |
| α-フェトプロテイン | モノクローナルマウス | シグマ | 500分の1 |
| SSEA - 4 FITC | モノクローナルマウス | Biolegend | 100分の1 |
| IgG抗体 | モノクローナルマウス | DAKO | 500分の1 |
| 二次抗体 | |||
| 抗マウスFITC共役 | モノクローナルヤギ | インビトロジェン | 400分の1 |
表2ヒトES細胞由来の肝内胚葉の免疫染色に用いる抗体を、使用される濃度は、種はで開発され、企業はそれらがから購入されています。
肝内胚葉とNormalisationの機能解析(mgタンパク質当たり)
シトクロムP450アッセイ
- P4 - GLO CYP3A4、CYP1A2、キットおよびルミノメーター(Promega社製、米国)。
- 白色平底96ウェルアッセイプレート(BD Biosciences社、英国)。
- BCAアッセイキット(Pierce社、サーモフィッシャーサイエンティフィック、英国)。
- 透明な96ウェルアッセイプレート(IWAKI、英国)
参考文献
- Asgari, S., Pournasr, B., Salekdeh, G. H., Ghodsizadeh, A., Ott, M., Baharvand, H. Induced pluripotent stem cells: a new era for hepatology. J. Hepatol. 53, 738-751 (2010).
- Hay, D. C., Pernagallo, S., Diaz-Mochon, J. J., Medine, C. N., Greenhough, S., Hannoun, Z., Schrader, J., Black, J. R., Fletcher, J., Dalgetty, D. Unbiased Screening of Polymer Libraries to Define Novel Substrates for Functional Hepatocytes with Inducible Drug Metabolism. Stem Cell Research. 6, 92-101 (2011).
- Payne, C. M., Samuel, K., Pryde, A., King, J., Brownstein, D., Schrader, J., Medine, C. N., Forbes, S. J., Iredale, J. P., Newsome, P. N. Persistence of Functional Hepatocyte Like Cells in Immune Compromised Mice. Liver International. 31, 254-262 (2011).
- Greenhough, S., Medine, C., Hay, D. C. Pluripotent Stem Cell Derived Hepatocyte Like Cells and their Potential in Toxicity Screening. Toxicology. 278, 250-255 (2010).
- Medine, C. N., Greenhough, S., Hay, D. C. The Role of Stem Cell Derived Hepatic Endoderm in Human Drug Discovery. Biochemical Society Transactions. 38, 1033-1036 (2010).
- Hannoun, Z., Fletcher, J., Greenhough, S., Medine, C. N., Samuel, K., Sharma, R., Pryde, A., Black, J. R., Ross, J. A., Wilmut, I., Iredale, J. P., Hay, D. C. The Comparison between Conditioned Media and Serum Free Media in Human Embryonic Stem Cell Culture and Differentiation. Cellular Reprogramming. 12, 133-140 (2010).
- Dalgetty, D. M., Medine, C., Iredale, J. P., Hay, D. C. Progress and Future Challenges in Stem Cell-Derived Liver Technologies. American Journal of Physiology - Gastrointestinal and Liver Physiology. 297, 241-248 (2009).
- Hay, D. C., Fletcher, J., Payne, C., Terrace, J. D., Gallagher, R. C. J., Snoeys, J., Black, J., Wojtacha, D., Samuel, K., Hannoun, Z., Pryde, A. Highly Efficient Differentiation of hESCs to Functional Hepatic Endoderm Requires ActivinA and Wnt3a Signalling. Proceedings of the National Academy of Sciences. 105, 12301-12306 (2008).
- Fletcher, J., Cui, W., Samuels, K., Black, J. R., Currie, I. S., Terrace, J. D., Payne, C., Filippi, C., Newsome, P., Forbes, S. J., Ross, J. A., Iredale, J. P., Hay, D. C. The Inhibitory Role of Stromal Cell Mesenchyme on Human Embryonic Stem Cell Hepatocyte Differentiation is Overcome by Wnt3a Treatment. Cloning and Stem Cells. 10, 331-340 (2008).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved